扩展功能
文章信息
- 刘阳, 张韶华, 梁焯南, 秦彦珉
- LIU Yang, ZHANG Shao-hua, LIANG Zhuo-nan, QIN Yan-min
- 相邻场所白纹伊蚊抗药性差异研究
- Study on insecticide resistance difference of Aedes albopictus between adjacent sites
- 中国媒介生物学及控制杂志, 2020, 31(4): 490-493
- Chin J Vector Biol & Control, 2020, 31(4): 490-493
- 10.11853/j.issn.1003.8280.2020.04.024
-
文章历史
- 收稿日期: 2020-03-17
白纹伊蚊(Aedes albopictus)是我国最重要的登革热传播媒介[1],对其防控是登革热疫情控制的关键环节。化学防治是目前控制白纹伊蚊的重要手段[2],而大量杀虫剂的使用可导致其抗药性出现[3]。近年来随着我国登革热疫情持续增长,各地化学控制力度不断加大,致使许多地区的白纹伊蚊产生较高抗性[4-7],合理用药、减缓抗药性发展是我国当前亟需重视的问题[2]。目前蚊虫的抗药性监测工作主要由疾病预防控制部门开展[8],如何利用抗药性监测结果指导防制用药,使防控人员合理选择杀虫剂,对有效控制蚊虫密度意义重大。目前许多地市在做抗药性监测时,一般以行政区划分监测点,但其采集点设置并不明了,有时可能使用1个采集点的结果代表 1个区(县)的抗药性水平。为明确白纹伊蚊抗药性发生的范围有多大,某个采集点的蚊虫抗药性能否代表周边区域的整体水平,1个采集点的抗药性监测结果能否指导整个范围的防控用药等问题,笔者于2018年8-10月开展相邻场所白纹伊蚊抗药性差异研究,现将结果报告如下。
1 材料与方法 1.1 供试药物使用3种杀虫剂母液:1%氯菊酯,1%高效氯氰菊酯,1%倍硫磷,由广东省疾病预防控制中心(CDC)消毒与病媒生物预防控制所提供,使用东莞市东江化学试剂有限公司生产的丙酮(批号:20130501)稀释。
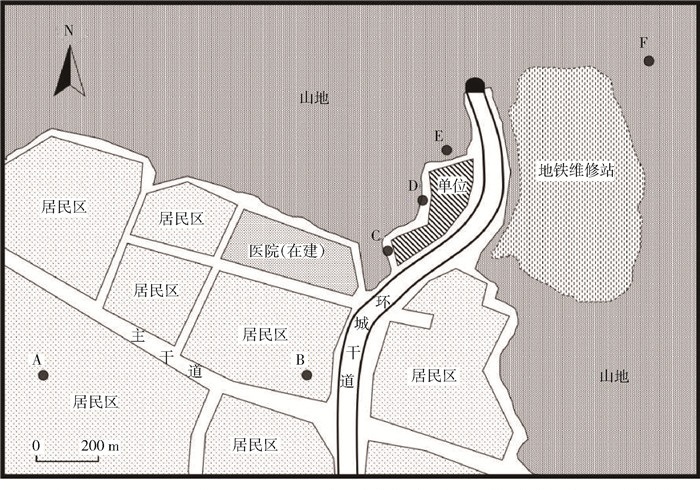
1.2 试虫采集在深圳市某地2 km范围内选择6个采集点,采集点分布与环境见图 1,幼蚊使用勺舀法、积水诱集法,成蚊采用人诱法收集;敏感性试虫来自广东省CDC。
|
| 注:A、B.居民小区; C、D.同一单位中的2个采集点; E.简易工棚; F.山中荔枝林。相邻采集点间直线距离: AB=728 m, BC=462 m, CD=214 m, DE=198 m, EF=648 m。 图 1 广东省深圳市某地蚊虫采样点分布与环境 Figure 1 Surroundings and distribution of mosquito sampling sites in Shenzhen, Guangdong province |
| |
将采集的蚊虫饲养繁殖1~2代,选择3龄末或4龄初幼虫供试。使用幼虫浸渍法[9]进行试验,将母液用丙酮稀释到合适浓度,使用移液枪吸取5~320 μl药液分别加到盛有200 ml去氯自来水的烧杯中,等比配制成5~7个浓度梯度,每个烧杯放入20条幼蚊,每组实验重复3次,同时设丙酮对照组;加入食物静置24 h后,检查并记录幼蚊的死亡情况。幼蚊死亡判断标准:用镊子轻触幼蚊,以不能逃避刺激判定为死亡。实验条件:室温(25 ±1)℃,相对湿度(60~80)%。
1.4 统计学分析使用SPSS19.0软件计算各浓度组蚊虫半数致死浓度(LC50)及其95%可信区间(CI)并建立毒力回归方程。
1.5 判定标准抗性倍数(resistance ratio,RR)=野外种群LC50/敏感品系LC50;抗性级别判定:RR<3为敏感;3≤RR<10为低抗;10≤RR<40为中抗;RR≥40为高抗[10]。LC50差异判定:以95%CI无重叠为差异有统计学意义[11],反之则无。
2 结果白纹伊蚊对2种菊酯类药物抗药性产生情况差异较大,高效氯氰菊酯在A、E点为高抗,C点为低抗,B、D、F点为敏感;氯菊酯在E点为高抗,A、C、D点为中抗,B、F点为敏感。倍硫磷在各个监测点抗性差异较小,均为低抗或敏感;除氯菊酯的C、D两点,倍硫磷的D、E两点外,其余相同药物相邻两点之间抗药性差异均有统计学意义(LC50的95%CI无重叠)(表 1)。

|
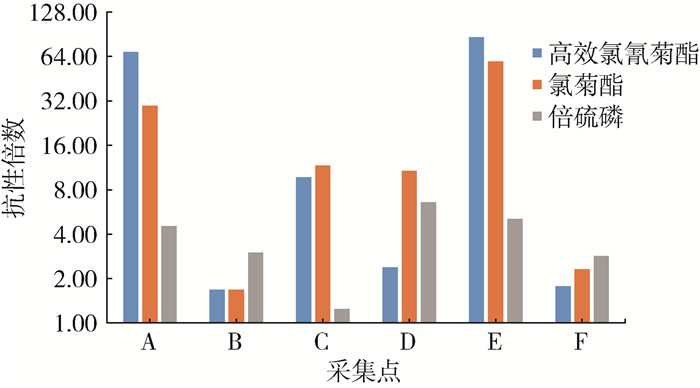
如图 2所示,A、E两点的2种菊酯类药物抗性倍数远高于其他点,B、F两点的菊酯类药物抗药性最低;倍硫磷抗药性C点最低、D点最高。按顺序各点的抗药性呈不规律波浪形分布。
|
| 图 2 广东省深圳市不同采集点白纹伊蚊抗性倍数分布 Figure 2 Distributions of resistance ratios of Aedes albopictus in different sampling sites of Shenzhen, Guangdong province |
| |
实验结果显示,2 km范围内的6个监测点抗药性产生情况差异较大。A、B两点属于相临近的2个小区,但其菊酯类抗药性却差异极大(A中、高抗,B敏感),可能的原因是A小区较老旧,蚊虫密度高,经常开展消杀,同时居民楼下自种花草多,为防虫居民自己也经常喷施杀虫剂,因此导致抗药性极高;B小区较新,占地面积和绿化面积均不大,伊蚊密度很低,蚊虫相对较少,消杀频次也很低,而且只在绿化带边缘采用象征性的滞留喷药,这可能是该小区抗药性较低的原因。C、D两点为同一单位内的绿化带,其氯菊酯抗药性较为接近,但高效氯氰菊酯与倍硫磷LC50差异较大,同一单位中的施药类型与频次均相同,造成此差异的原因可能是由于C点在前面门口,D点在后面人活动较少的地方,喷药人员关注程度不同,并且D点有一条长的排水沟,本单位消杀人员经常在此沟渠投放有机磷灭蚊幼药物进行幼蚊控制,可能导致倍硫磷抗药性在所有点中为最高。E点为D单位的物业宿舍,为在林地边缘建的临时板房棚区,与D单位直线距离虽近但并不相邻(之间有6 m高边坡和荔枝林阻隔),E工棚四周都为荔枝林,棚区内人员住宿密集,蚊虫密度高,物业工人经常自己喷药杀虫,由于范围小施药多,可能因此导致E工棚的抗药性极高;F点为距离城市较远的山中气象站,周边为大片的荔枝林,属于野外环境,据了解除了荔枝林承包者在荔枝结果前施药灭虫外,其余时间均不施药,因此蚊虫相对较为敏感。
不同地点抗药性高低与药物使用情况密切相关,杀虫剂使用频次高、量大的场所更容易产生较高抗性;由于白纹伊蚊活动半径一般为50~150 m[12-14],相邻的不同场所蚊虫种群之间交流可能相对较少,并且还会出现人为阻隔(如道路、楼宇、截断式的环境变化),因此可能导致蚊虫抗药性形成局限于较小区域范围而不易受周边环境的影响,同时由于不同场所各自独立施药,药物的种类、施药方法和频次都可能完全不同,这可能导致相邻场所抗药性产生极大差异;因此针对某一特定小范围场所,其抗药性监测结果对现场用药指导性更强,范围越大,抗药性就越反映为一个整体趋势,需要合理的抽样方法和充足的样本量,以防止由于监测点选择不当导致结果偏差。
研究表明,不同抗药性种群的蚊虫混合培养繁殖后,其抗药性会达到一个比较平均的水平[15],在中国CDC发布的《全国病媒生物抗药性监测(试行)方案》中规定,采集时需在东、西、南、北、中5个方向各设置1个采集点,再等比例混合饲养后实验,此方法一定程度上保证了结果的客观性,但实际应用中还需考虑监测涉及范围,若要了解一个较大行政区域的抗药性产生情况,仅仅靠1个或者几个采集点的结果,较难反映整个区域的抗药性状况,可以将大的区域划分为若干小区域,每个小区域内再按多个方位进行采集分别开展抗药性实验;但由于抗药性实验工作量大,周期长,加之疾病预防控制部门人力物力的限制,过多的监测点开展大量实验较难实现,因此在人力物力紧张或者时效性较为紧迫的情况下,可以在尽可能多而分散的地点采集,混合饲养传代后进行一次性抗药性监测实验,亦可以反映整体的趋势,如2015年潮州市在城区近20个点采集开展伊蚊抗药性监测[16],及时指导登革热疫情防控;同时建议在选择蚊虫采集点时,尽可能甄选有代表性的场所,尽量选择人口密度高,用药强度大的区域,选择场所类型也应多样化,如居民区、工地、公园、单位等,从而更准确反映抗药性产生趋势,科学指导消杀部门合理选择杀虫药物。
| [1] |
刘起勇. 媒介伊蚊可持续控制策略及关键技术[J]. 新发传染病电子杂志, 2018, 3(2): 75-79. Liu QY. The sustainable control strategy and key technology of Aedes vector[J]. Electr J Emerg Infect Dis, 2018, 3(2): 75-79. DOI:10.3877/j.issn.2096-2738.2018.02.005 |
| [2] |
孟凤霞, 王义冠, 冯磊, 等. 我国登革热疫情防控与媒介伊蚊的综合治理[J]. 中国媒介生物学及控制杂志, 2015, 26(1): 4-10. Meng FX, Wang YG, Feng L, et al. Review on dengue prevention and control and integrated mosquito management in China[J]. Chin J Vector Biol Control, 2015, 26(1): 4-10. DOI:10.11853/j.issn.1003.4692.2015.01.002 |
| [3] |
Cui F, Raymond M, Qiao CL. Insecticide resistance in vector mosquitoes in China[J]. Pest Manag Sci, 2006, 62(11): 1013-1022. DOI:10.1002/ps.1288 |
| [4] |
段金花, 蔡松武, 吴军, 等. 2014年广东省登革热疫情应急控制后期白纹伊蚊抗药性水平调查[J]. 中国媒介生物学及控制杂志, 2017, 28(2): 141-143. Duan JH, Cai SW, Wu J, et al. Resistance of Aedes albopictus to insecticides in the late stage of emergency control of dengue fever of Guangdong province in 2014[J]. Chin J Vector Biol Control, 2017, 28(2): 141-143. DOI:10.11853/j.issn.1003.8280.2017.02.011 |
| [5] |
刘洪霞, 朱江, 刘曜, 等. 上海地区2015-2016年白纹伊蚊幼虫监测及抗药性调查[J]. 中国媒介生物学及控制杂志, 2017, 28(4): 305-307. Liu HX, Zhu J, Liu Y, et al. Study on the seasonal dynamics and insecticides resistance of Aedes albopictus larvae, in Shanghai, 2015-2016[J]. Chin J Vector Biol Control, 2017, 28(4): 305-307. DOI:10.11853/j.issn.1003.8280.2017.04.001 |
| [6] |
彭丽兰, 解锐历, 言慧, 等. 2017年广州市白纹伊蚊对5种杀虫剂的抗药性调查[J]. 寄生虫与医学昆虫学报, 2018, 25(4): 206-211. Peng LL, Xie RL, Yan H, et al. A survey for Aedes albopictus resistance to five insecticides in Guangzhou areas in 2017[J]. Acta Parasitol Med Entomol Sin, 2018, 25(4): 206-211. DOI:10.3969/j.issn.1005-0507.2018.04.003 |
| [7] |
梁秋果, 文赛, 杨茜, 等. 贵阳市致倦库蚊和白纹伊蚊对4种常用杀虫剂抗药性调查[J]. 中国媒介生物学及控制杂志, 2018, 29(1): 30-33. Liang QG, Wen S, Yang X, et al. Resistance of Culex pipiens quinquefasciatus and Aedes albopictus to four insecticides in Guiyang, China[J]. Chin J Vector Biol Control, 2018, 29(1): 30-33. DOI:10.11853/j.issn.1003.8280.2018.01.008 |
| [8] |
孟凤霞, 靳建超, 陈云, 等. 我国淡色库蚊/致倦库蚊对常用化学杀虫剂的抗药性[J]. 中国媒介生物学及控制杂志, 2011, 22(6): 517-520, 528. Meng FX, Jin JC, Chen Y, et al. Resistance of Culex pipiens pallens/Cx. pipiens quinquefasciatus to commonly used insecticides in China[J]. Chin J Vector Biol Control, 2011, 22(6): 517-520, 528. |
| [9] |
中华人民共和国卫生部. GB/T 26347-2010蚊虫抗药性检测方法生物测定法[S].北京: 中国标准出版社, 2011. Ministry of Health of the People's Republic of China. GB/T 26347-2010 Test methods of mosquito resistance to insecticides-Bioassay methods[S]. Beijing: Standards Press of China, 2011. |
| [10] |
Zhang K, Zhang W, Zhang S, et al. Susceptibility of Sogatella furcifera and Laodelphax striatellus (Hemiptera:Delphacidae) to six insecticides in China[J]. J Econ Entomol, 2014, 107(5): 1916-1922. DOI:10.1603/EC14156 |
| [11] |
林国松, 张晓越, 刘欣, 等. 淡色库蚊抗药性测定中不同容器对测定结果的影响研究[J]. 中国媒介生物学及控制杂志, 2014, 25(5): 385-387. Lin GS, Zhang XY, Liu X, et al. Influence of containers on insecticide resistance bioassay in Culex pipiens pallens larvae[J]. Chin J Vector Biol Control, 2014, 25(5): 385-387. DOI:10.11853/j.issn.1003.4692.2014.05.001 |
| [12] |
Iyaloo DP, Damiens D, Facknath S, et al. Dispersal and survival of radio-sterilised male Aedes albopictus Skuse (Diptera:Culicidae) and estimation of the wild populations in view of an sterile insect technique programme in Pointe des Lascars, Mauritius[J]. Int J Trop Insect Sci, 2019, 39(1): 63-72. DOI:10.1007/s42690-019-00017-6 |
| [13] |
Marini F, Caputo B, Pombi M, et al. Study of Aedes albopictus dispersal in Rome, Italy, using sticky traps in mark-release-recapture experiments[J]. Med Vet Entomol, 2010, 24(4): 361-368. DOI:10.1111/j.1365-2915.2010.00898.x |
| [14] |
Medeiros MCI, Boothe EC, Roark EB, et al. Dispersal of male and female Culex quinquefasciatus and Aedes albopictus mosquitoes using stable isotope enrichment[J]. PLoS Negl Trop Dis, 2017, 11(1): e0005347. DOI:10.1371/journal.pntd.0005347 |
| [15] |
郭凤英, 吴厚永, 李承毅. 白纹伊蚊对高效氯氰菊酯的抗药性及其遗传方式[J]. 寄生虫与医学昆虫学报, 2001, 8(2): 103-108. Guo FY, Wu HY, Li CY. Genetic form and resistance of beta-cypermethrin of Aedes albopictus skuse[J]. Acta Parasitol Med Entomol Sin, 2001, 8(2): 103-108. DOI:10.3969/j.issn.1005-0507.2001.02.008 |
| [16] |
王义冠, 师灿南, 林国松, 等. 广东省潮州市白纹伊蚊对常用杀虫剂的抗药性[J]. 中国媒介生物学及控制杂志, 2016, 27(3): 228-231. Wang YG, Shi CN, Lin GS, et al. Resistance of Aedes albopictus in Chaozhou city, China to commonly used insecticides[J]. Chin J Vector Biol Control, 2016, 27(3): 228-231. DOI:10.11853/j.issn.1003.8280.2016.03.004 |
 2020, Vol. 31
2020, Vol. 31


