服务
文章信息
- 林国松, 张晓越, 刘欣, 孟凤霞
- LIN Guo-song, ZHANG Xiao-yue, LIU Xin, MENG Feng-xia
- 淡色库蚊抗药性测定中不同容器对测定结果的影响研究
- Influence of containers on insecticide resistance bioassay in Culex pipiens pallens larvae
- 中国媒介生物学及控制杂志, 2014, 25(5): 385-387,392
- Chines Journal of Vector Biology and Control, 2014, 25(5): 385-387,392
- 10.11853/j.issn.1003.4692.2014.05.001
-
文章历史
- 收稿日期:2014-4-30
2 泰山医学院公共卫生学院,山东泰安271016
2 College of Public Health,Taishan Medical University,Tai’an271016,Shandong Province, China
蚊虫是我国重要的传染病传播媒介,能引起登革 热、疟疾、流行性乙型脑炎(乙脑)的暴发流行;同时也 是重要的骚扰性害虫,为控制其危害,全国每年都生产 和使用大量的化学杀虫剂[1]。而长期大量地使用杀虫 剂,使很多区域的蚊虫对多数杀虫剂已产生不同程度 的抗药性[2, 3, 4]。为了评价蚊虫的抗药性以便指导杀虫 剂的合理使用,全国各地每年都会进行大量的蚊虫抗 药性实验。而实验方法也从针对蚊幼虫的幼虫浸渍 法、成虫的接触筒法和点滴法发展到蚊虫的分子生物 学检测和生化检测[5]。然而实验过程费时费力,为了 尽可能地提高实验效率,需要从可行的步骤中节省时 间。由于国内外尚无能否用一次性杯子代替玻璃烧杯 进行实验的理论依据的相关报道,但地方省(市)疾控 人员为了节省时间有的在用一次性杯子进行实验,因 此为了保证抗药性监测数据的可比性,展开玻璃烧杯 能否被市售一次性杯子替代的相关研究尤其重要。
淡色库蚊(Culex pipiens pallens)广泛分布于北纬 32°以北的各省,常孳生于污水沟、污水坑、水塘、容器 积水等处,为我国北方和南方班氏丝虫病的主要传播 媒介。此外,淡色库蚊还被认为是乙脑病毒的可能传 播媒介[6]。本研究以淡色库蚊为例,分别测定在3种容 器类型下其对3类常用杀虫剂的敏感性,期望得出玻 璃烧杯在何种情况下可以进行替代的理论依据,现将 结果报告如下。
1 材料与方法 1.1 供试药剂94.62%溴氰菊酯、94.18%仲丁威、95.10%双硫磷,均由中国疾病预防控制中心传染病预防控制所媒介生物室提供。
1.2 测定容器博美BOMEX牌250 ml玻璃烧杯(北京玻璃仪器厂生产)、妙洁牌320 ml一次性塑料杯(苏州市苏容塑料制品厂生产,材质为聚丙烯)、绿奥牌250 ml一次性纸杯(北京绿奥纸杯厂生产,内表面材质为聚乙烯,外层材质为纸浆)。
1.3 试虫采集点位于昌平区百善镇(40°11.097′N,116°18.165′E)一水沟内。采集大龄幼虫约10 000只,带回实验室饲养。控制饲养温度为(26±1)℃,相对湿度为(60±10)%,选取3龄末4龄初幼虫进行实验。
1.4 幼虫对杀虫剂的敏感性测定方法以丙酮为溶剂将原药稀释成5~7个浓度梯度。在250 ml烧杯中,分别加入0.1 ml待测药液和隔夜自来水(脱氯水),充分混匀的200 ml药液,加入20条健康幼虫,在温度为26 ℃,相对湿度为70%,光周期(L∶D=16∶8)的培养箱中饲养24 h,记录死亡数,剔除化蛹数,计算死亡率;对照组加入相应量的丙酮,实验重复3 次。若化蛹率>10%,对照组死亡率>20%,实验无效,需重做。然后再分别用容积为320 ml的一次性塑料杯和250 ml的一次性纸杯重复上述实验过程。
幼虫死亡判定标准[7]:用利器轻触幼虫呼吸管,不能运动或仅对刺激做微小反应(抽搐),并且不能主动逃逸避免刺激的持续发生,即为死亡。
1.5 统计与计算用SPSS 16.0软件进行数据统计,记录处理试虫数。通过分析得出半数致死浓度(LC50)值及其95%可信区间(95%CI),并比)、毒力回归线的斜率b 值及sx、χ2值、自由度。若5%<对照组死亡率<20%,用Abbott公式校正处理死亡率。以LC50的95%CI),并比 是否重叠和重叠程度的大小判断不同容器类型对实验结果的影响差异是否有统计学意义,并以此作为玻璃烧杯能否被替代的参考依据。
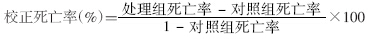
在玻璃烧杯、一次性塑料杯和一次性纸杯分别作 为盛药容器下,应用浸渍法测得的淡色库蚊对溴氰菊 酯的LC50 及其95%CI),并比 分别为0.002 009(0.001 654~ 0.002 449)、0.003 858(0.003 062~0.005 224)和 0.005 459(0.004 051~0.008 757)mg/L,玻璃烧杯与一 次性杯子的95%CI),并比 没有重叠,由此可见玻璃烧杯与一 次性塑料杯和纸杯差异有统计学意义,故可作为一次 性塑料杯或纸杯不能代替玻璃烧杯的依据;对仲丁威 的LC50 及其95%CI),并比 分别为0.3470(0.3059~0.3821)、 0.2575(0.2118~0.3095)和0.4844(0.4460~0.5232)mg/L, 玻璃烧杯与一次性塑料杯的95%CI),并比 有重叠而与一次 性纸杯的95%CI),并比 没有重叠,由此可见玻璃烧杯与一次 性塑料杯差异无统计学意义,而玻璃烧杯与一次性纸 杯差异有统计学意义,故可以作为一次性塑料杯可替 代玻璃烧杯的参考依据;对双硫磷的LC50及其95%CI),并比分别为0.000 955(0.000 816~0.001 094)、0.003 007 (0.002 661~0.003 407)和0.003 830(0.003 450~ 0.004 256)mg/L,玻璃烧杯与一次性塑料杯和纸杯的 95%CI),并比 均无重叠,可见玻璃烧杯与一次性塑料杯和纸 杯差异均有统计学意义,故不可用一次性塑料杯或者 纸杯代替玻璃烧杯(表 1)。
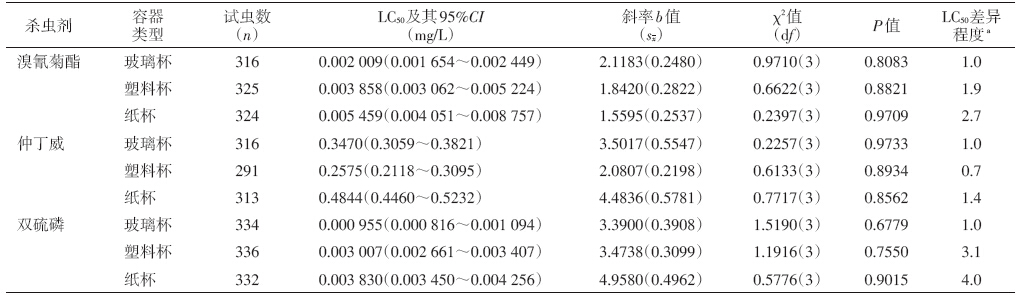 | |||||||
| 注:a. LC50差异程度=测定组的LC50/玻璃杯组的LC50。 | |||||||
由图 1可以看出,在相同浓度时蚊虫的死亡率由 高到低均为玻璃杯>一次性塑料杯>一次性纸杯,而 且玻璃杯蚊虫死亡率与一次性杯子蚊虫死亡率之比有 一个先增加后减少最后趋于1.0的趋势,随着药液浓度 的升高,玻璃杯蚊虫死亡率与一次性塑料杯蚊虫死亡 率之比依次为1.0、1.5、1.8、1.5和1.2,而与一次性纸杯 蚊虫死亡率之比依次为1.5、2.2、1.9、1.9和1.5。即玻 璃杯与一次性杯子对实验结果影响的差异随实验浓度 的增加先增大后减小。

|
| 图 1 不同浓度溴氰菊酯测定淡色库蚊幼虫在3种容器中的死亡率 Figure 1 The mortality of Cx. pipiens pallens larvae exposed to different concentrations of deltamethrin measured using three types of containers |
玻璃烧杯、一次性塑料杯和一次性纸杯分别作为盛药容器时,淡色库蚊对双硫磷的药液浓度与死亡率关系见图 2。与图 1不同之处在于玻璃杯蚊虫死亡率与一 次性杯子蚊虫死亡率之比是一个逐渐减小的趋势,随着药液浓度的升高,玻璃杯蚊虫死亡率与一次性塑料 杯蚊虫死亡率之比依次为19.1、6.0、2.8、1.2 和1.0,而 与一次性纸杯蚊虫死亡率之比依次为42.9、5.1、1.4和 1.0。从死亡率之比可见,玻璃杯与一次性杯子对结果 影响的差异随实验浓度的倍增而急剧减小。

|
| 图 2 不同浓度双硫磷测定淡色库蚊幼虫在3种容器中的死亡率 Figure 2 The mortality of Cx. pipiens pallens larvae exposed to different concentrations of temephos measured using three types of containers |
蚊传疾病的控制是传染病预防控制的重要内容, 每年进行及时有效的蚊虫抗药性评价,可通过合理选 择杀虫剂以减缓蚊虫抗药性的发展;亦可以在传染病 发生时通过正确使用杀虫剂控制疾病的发展与蔓延。 因此,对蚊虫的抗药性进行检测甚为重要。
本实验以玻璃烧杯作为盛药容器能否被市售一次 性杯子替代为出发点而进行,实验发现:在不同杯子类 型和不同药液浓度下,淡色库蚊幼虫对不同种类的杀的血淋巴,是96孔酶标板法使用血淋巴量的7倍。② 简单快速。分光光度计法每次只能检测1个样品,而 96孔酶标板法1次可以同时检测多个样品。③稳定灵 敏。分光光度计法每次检测需要人工调试,获得的重 复数据间误差较大,96孔酶标板法只需将每个样品定 容,完全自动检测,数据稳定。总之,96孔酶标板法比 分光光度计法用于检测家蝇血淋巴的黑化反应更加方 便快捷。
| [1] | Cerenius L,Lee BL,Soderhall K. The proPO-system:pros and cons for its role in invertebrate immunity[J]. Trends Immunol,2008,29:263-271. |
| [2] | Tang H. Regulation and function of the melanization reaction in Drosophila[J]. Fly(Austin),2009,3(1):105-111. |
| [3] | Binggeli O,Neyen C,Poidevin M,et al. Prophenoloxidase activation is required for survival to microbial nfections in Drosophila[J]. PLoS Pathog,2014,10(5):e1004067. |
| [4] | An C,Zhang M,Chu Y,et al. Serine protease MP2 activates prophenoloxidase in the melanization immune response of Drosophila melanogaster[J]. PLoS One,2013,8(11):e79533. |
| [5] | Nappi A,Poirie M,Carton Y. The role of melanization and cytotoxic by-products in the cellular immune responses of Drosophila against parasitic wasps[J]. Adv Parasitol,2009,70:99-121. |
| [6] | Cerenius L,Kawabata S,Lee BL,et al. Proteolytic cascades and their involvement in invertebrate immunity[J]. Trends Biochem Sci,2010,35(10):575-583. |
| [7] | Chen K,Liu C,He Y,et al. A short-type peptidoglycan recognition protein from the silkworm: expression, characterization and involvement in the prophenoloxidase activation pathway[J]. Dev Comp Immunol,2014,45(1):1-9. |
| [8] | Cao X,Zhou M,Wang C,et al. Musca domestica pupae Lectin improves the immunomodulatory activity of macrophages by activating nuclear factor-κ B[J]. J Med Food,2012,15(2):145-151. |
| [9] | Sun SG,Liu WG,Wang JG,et al. Endonuclease activity of phenol oxidase from Musca domestica larvae[J]. Biol Bull,2008,215(1):108-114. |
| [10] | 李殿香,刘晖,王军,等. 家蝇对病原入侵黑化反应的研究[J]. 中华卫生杀虫药械,2013,19(3):193-196. |
| [11] | 王秀华,雷质文,黄倢,等. 96孔酶标板法测定对虾血淋巴的过氧化物酶相对活性的初步研究[J]. 海洋科学,2001,25(11):55-58. |
 2014, Vol. 25
2014, Vol. 25


