2. 中国科学院 苏州纳米技术与纳米仿生研究所, 江苏 苏州 215123
2. Suzhou Institute of Nano-tech and Nano-bionics, Chinese Academy of Sciences, Suzhou 215123, China
近年来,人源脐带间充质干细胞(hMSCs)凭借其分化潜能和无排异反应的优点,在膝关节损伤修复、心血管堵塞、神经系统损伤等疾病治疗方面受到广泛关注[1, 2].而干细胞再生医疗应用的前提是精准掌握移植干细胞在活体中的存活、迁移、归巢等行为.为此,X-射线检测、计算机断层扫描(CT)、正电子发射体层成像(PET)、磁共振成像(MRI)等技术均被应用于干细胞的示踪研究[3].
MRI具有高的空间分辨率和无电离辐射等优点,使得其在干细胞示踪研究中脱颖而出.为了将移植干细胞与周围组织清晰的区别开来,人们设计并开发了不同的标记方法和成像策略.超顺磁性的Fe3O4纳米粒子常用来标记干细胞以获得T2加权磁共振图像[4-10].Fe3O4纳米粒子具有较高的磁化率,横向弛豫率(r2)一般在100~200 mmol–1·L·s–1,用它标记细胞的MRI检测灵敏度可达到单细胞水平[8–10].然而由于Fe3O4纳米粒子偶联修饰等方面面临技术上的局限性,一定程度上限制了这类分子影像探针的应用[11].Gd的络合物一般用作T1型造影剂,虽然在结构精确控制方面有明显优势,但是其纵向弛豫率(r1)远远小于商业的Fe3O4纳米粒子的r2,如在临床上使用的多它灵(Gd-DOTA)的r1一般在3~5 mmol–1·L·s–1,比Fe3O4纳米粒子的r2低了1~2个数量级,因此限制了Gd-DOTA标记细胞的MRI检测灵敏度[4, 12].因而,发展一种结构精确可控、毒副作用小、成像灵敏度高的MRI探针标记示踪干细胞显得尤为重要.本文设计合成了结构为TPP-Lys(Acp-DOTA-Gd)-COOH(简称Gd-DOTA-TPP)的小分子磁共振探针标记hMSCs,为研究移植干细胞在活体的存活、迁移、归巢等行为提供了有力的技术支持.
1 实验部分 1.1 仪器与试剂1, 4, 7, 10-四氮杂环十二烷盐酸盐购自安耐吉化学公司(中国),Wang树脂[Fmoc-Lys(Mtt)-Wang Resin]、四甲基脲六氟磷酸酯(HATU)、1-羟基苯并三唑(HOBT)、N, N-二异丙基碳二亚胺(DIC)购自吉尔生化有限公司(中国),N, N-二甲基甲酰胺(DMF)、N, N-二异丙基乙胺(DIEA)、三氟乙酸(TFA)等其它化学和生化试剂购自国药集团化学试剂有限公司(中国).血清、培养基DMEM/F12、双抗、胰酶购自Gibco公司(美国).
11.7 T磁共振微成像系统(Bruker,德国),电转染仪(壹达,中国),多功能酶标仪(PerkinElmer Victor X,新加坡),Forma CO2细胞培养箱(Thermo,美国),2535/2707高效液相色谱(HPLC)仪(Waters,美国),1200/6220飞行时间质谱(TOF-MS)仪(Agilent,美国),X series 2电感耦合等离子体发射质谱仪(Thermo,美国).
1.2 磁共振探针Gd-DOTA-TPP的制备参照文献[13]由1, 4, 7, 10-四氮杂环十二烷盐酸盐经多步反应得到1, 4, 7-三(叔丁氧羰甲基)-10-(乙酸)-1, 4, 7, 10-四氮杂环十二烷[DOTA(OtBu)3];参照文献[14]由5-溴戊酸和三苯基膦经一步反应合成5-羧戊基三苯基鏻(TPPC4H8COOH).
DOTA(OtBu)3和TPPC4H8COOH的偶联过程如图 1所示,具体说明如下:称取2.0 g Fmoc-Lys(Mtt)-Wang Resin(0.5 mmol/g)在20 mL无水DMF中充分溶胀2 h,用20%的哌啶常温(25℃)常压下(下同)洗脱芴甲氧羰基(Fmoc)30 min,然后用DMF洗6次,得NH2-Lys(Mtt)-Wang Resin;投料按摩尔比NH2-Lys(Mtt)-Wang Resin:TPPC4H8COOH:HATU:DIEA = 1:3:3:3的比例依次加入各反应物进行反应,用茚三酮显色法检测氨基充分反应,得Lys带侧链保护的偶联产物TPP-Lys(Mtt)-Wang Resin;用1%的TFA洗脱3次去除侧链保护基Mtt,每次10 min,用DMF洗脱6次,去除侧链得产物TPP-Lys-Wang Resin.按对树脂的摩尔比1:3:3:3的比例在上述产物中依次加入Fmoc-Acp-OH、HATU、DIEA进行反应,用茚三酮显色法判断反应终点,得TPP-Lys(-Acp-Fmoc)-Wang Resin;用20%的哌啶洗脱Fmoc 3 h,用DMF洗脱6次,按对树脂的摩尔比1:1.5:3:3:3加入DOTA(OtBu)3、HOBT、DIC和DIEA,用茚三酮显色法检测氨基充分反应,得到TPP-Lys{Acp-DOTA(OtBu)3}-Wang Resin.加入5mL TFA脱保护和树脂,然后加入约30 mL乙醚洗涤3次并沉淀产物,过滤洗涤后真空干燥,得到粗产物TPP-Lys(Acp-DOTA)-COOH;将上述粗产物通过Pre-HPLC纯化,收集纯度 > 95%的洗脱液,常温浓缩后低温(约-50℃)冷冻干燥,得产物TPP-Lys(Acp-DOTA)-COOH(简称DOTA-TPP),纯度 > 95%.
依据文献[15]对DOTA-TPP进行螯合Gd3+和产物纯化,得目标产物Gd-DOTA-TPP(结构如图 1所示).

|
图 1 Gd-DOTA-TPP固相合成示意图 Figure 1 Schematic illustration of solid phase synthesis procedure of Gd-DOTA-TPP |
用超纯水将探针Gd-DOTA和Gd-DOTA-TPP配制成一定浓度系列(0~1 mmol/L)的水溶液,转移至直径为1 mm样品玻璃管中.在11.7 T磁共振微成像系统中测定探针的纵向弛豫时间(T1)和横向弛豫时间(T2),将1/T1和1/T2与水溶液中Gd浓度进行线性拟合,得到探针的r1和r2.测定MRI后的样品回收硝解,使用X series 2电感耦合等离子体发射质谱仪测量水溶液中探针的实际浓度.
11.7 T磁共振微成像系统体外实验具体实验参数如下:
T1测量使用MSME序列:成像视野(FOV)= 12 mm×12 mm,回波时间(TE)= 7 ms,重复时间(TR)= 40、70、100、180、300、500、750、1 000、1 500、3 000、5 000 ms,矩阵(Matrix)= 96×96,累加次数为2,片厚/间隔(Slice Thickness/Gap)= 0.8 mm/0.2 mm.T1加权图像采集时,成像视野(FOV)= 12 mm×12 mm,TE/TR= 5.2 ms/500 ms,矩阵(Matrix)= 96×96,累加次数为2,片厚/间隔(Slice Thickness/Gap)= 0.8 mm/0.2 mm.
T2测量使用MSME序列:FOV= 12 mm×12 mm,TE= 8~480 ms,TR= 3 000 ms,Matrix = 96×96,累加次数为2,Slice Thickness/Gap= 0.8 mm/0.2 mm.TE= 40 ms的图片为文中使用的T2加权图像.
1.4 磁共振探针Gd-DOTA-TPP细胞安全性测试采用电转染的方式用探针Gd-DOTA或Gd-DOTA-TPP标记hMSCs,电转染标记的具体实验操作为:将消化离心好的细胞沉淀重悬于200 mL含有一定探针浓度的电转染液中,转移至96孔板,在电压为120 V、脉宽为100 ms、间隔为1 000 μs、重复次数为6的电转染条件下标记细胞;将标记好的细胞转移至15 mL无菌离心管,用磷酸盐缓冲液(PBS)洗涤3次并计数,以去除未进入细胞的探针.
采用上述电转染的方式,用一定浓度系列(0、0.5、1、2 mmol/L)的Gd-DOTA-TPP标记hMSCs,用PBS洗涤3次后重悬于完全培养基中,按10 000个细胞/孔的密度接种于96孔板中,设置5个复孔.未经任何处理的hMSCs以同样的密度接种于同一个96孔板中作为对照组.在CO2细胞培养箱培养12 h后用MTT和二甲亚砜(DMSO)进行处理,在酶标仪490 nm处测定吸光度,以检测探针Gd-DOTA-TPP对hMSCs的毒性.
用上述方法标记hMSCs后,按2 000个细胞/孔的密度将Gd-DOTA-TPP标记的hMSCs接种于96孔板中,设置3个复孔.未经任何处理的hMSCs以同样的密度接种于同一个96孔板中,接种两列,分别作为阳性对照和阴性对照组.于CO2细胞培养箱培养12 h,阳性对照组加入1%的Triton-X-100继续培养30 min.阳性对照处理结束后,每孔加入150 mL乳酸脱氢酶(LDH)释放液,避光室温孵育1 h后,加入检测工作液继续室温避光孵育30 min,经离心取上清液,于多功能酶标仪490 nm处测定吸光度,以检测细胞膜的完整性.
1.5 体外MRI实验采用1.4所述的电转染方式,用一定浓度系列(0~2 mmol/L)的磁共振探针Gd-DOTA或Gd-DOTA-TPP标记hMSCs,用PBS洗涤3次后转移至直径为1 mm样品玻璃管中,未用探针标记的hMSCs作为对照组.在11.7 T磁共振微成像系统中按1.3节所述实验参数测定探针标记的hMSCs的T1、T2、T1加权信号强度、T2加权信号强度,并采集T1加权图像及T2加权图像.细胞样品测定MRI后回收硝解,使用X series 2电感耦合等离子体发射质谱仪测量细胞中Gd的实际含量.由此获得细胞内Gd含量与T1、T2、T1加权信号强度、T2加权信号强度之间的定量关系.
1.6 体内MRI检测灵敏度实验采用1.4所述的电转染方式,用浓度为2 mmol/L的Gd-DOTA-TPP标记hMSCs.将Gd-DOTA-TPP标记的一定数目的hMSCs以头颅注射的方式移植入小鼠脑室,在11.7 T MRI系统中采集小鼠头颅T2加权像.逐渐减少移植的干细胞数目,于11.7 T MRI系统多次采集小鼠头颅T2加权像,至外源移植干细胞无法清晰可辨为止.
11.7 T MRI系统体内实验具体实验参数如下:T2加权像采集使用RARE序列:FOV= 2.0 cm× 2.0 cm,TR/TE= 3 000 ms/22 ms,Matrix = 128×128,累加次数为8,Slice Thickness=0.5 mm,单位像素对应采集对象的体积为156×156×500 mm3.
2 结果与讨论 2.1 Gd-DOTA-TPP的MS表征最终产物Gd-DOTA-TPP的分子结构由1200/6220飞行时间质谱仪测定.Gd-DOTA-TPP(C51H70GdN7O11P+)理论分子质量为1 145.410 6,由图 2可得质荷比(m/z)为1 145.410 3是分子离子峰(M+),m/z为573.220 0是[M++H]2+的峰.MS解析结果说明了最终产物结构的正确性.

|
图 2 Gd-DOTA-TPP质谱图 Figure 2 The mass spectrum of Gd-DOTA-TPP |
Gd-DOTA-TPP的弛豫性能以Gd-DOTA作为对照,在水溶液中测定.利用11.7 T磁共振微成像系统测量探针的T1和T2值,经线性拟合得Gd-DOTA、Gd-DOTA-TPP在水溶液中的r1值分别为3.87 mmol–1·L·s–1、5.49 mmol–1·L·s–1[图 3(a)],r2值分别为4.86 mmol–1·L·s–1、8.00 mmol–1·L·s–1[图 3(b)].

|
图 3 Gd-DOTA-TPP与Gd-DOTA在水溶液中的(a)纵向弛豫率r1和(b)横向弛豫率r2 Figure 3 (a) Longitudinal relaxivity r1 and (b) transverse relaxivity r2 of Gd-DOTA-TPP and Gd-DOTA in aqueous solution |
MTT毒性实验结果验证,Gd-DOTA-TPP在实验浓度范围内(0~2 mmol/L)对标记的hMSCs无明显毒性.将未标记的对照组hMSCs的存活率设为100%,Gd-DOTA-TPP标记的hMSCs存活率均在100%左右,与未标记的对照组hMSCs无显著性差异[图 4(a)].

|
图 4 Gd-DOTA-TPP标记的细胞毒性测试. (a)细胞存活率;(b)乳酸脱氢酶(LDH)释放 Figure 4 Cytotoxicity assays of Gd-DOTA-TPP to hMSCs. (a) Cell viability; (b) LDH leakage |
LDH实验结果表明,Gd-DOTA-TPP电转标记hMSCs对其细胞膜的破坏性很小.将用1%的Triton-X-100处理的阳性对照组LDH的释放量设为100%,阴性对照组和各实验组LDH的释放量均在25%左右,无显著性差异,且均仅为阳性对照组LDH释放量的25%[图 4(b)],呈现较好的细胞完整性和低的细胞毒性.
2.4 体外MRI实验细胞中的水环境跟水溶液中的差异很大,因而用细胞中而不是水溶液中的弛豫率来评价造影剂更准确,而本文采用了细胞密堆积的形式,这样比文献[16]中把标记的细胞分散在琼脂中更接近活体组织.将11.7 T MRI系统采集的Gd-DOTA和Gd-DOTA-TPP标记hMSCs的T1加权像和T2加权像对比可得:Gd-DOTA标记的hMSCsT1加权像在较大的细胞Gd含量范围内(8.0~59.3×109Gd/cell)T1加权信号强度均明显高于对照组,呈现较强亮信号;Gd-DOTA-TPP标记的hMSCs在0.2~21.2×109Gd/cell的细胞Gd含量范围内,T1加权信号强度均小于等于对照组[图 5(a)].Gd-DOTA-TPP标记的hMSCs的T2加权信号强度在细胞Gd含量为9×109 Gd/cell时已低至背景信号强度,呈现很强暗信号[图 5(b)].体外MRI实验证明,Gd-DOTA-TPP在较低的细胞Gd含量下即可呈现很强的暗信号,有效提高MRI成像对比度,可作为一种新型的T2型小分子造影剂.

|
图 5 Gd-DOTA与Gd-DOTA-TPP标记hMSCs的(a) T1加权图像和(b) T2加权图像 Figure 5 (a) T1-weighted and (b) T2-weighted images of hMSCs labeled with Gd-DOTA-TPP and Gd-DOTA |
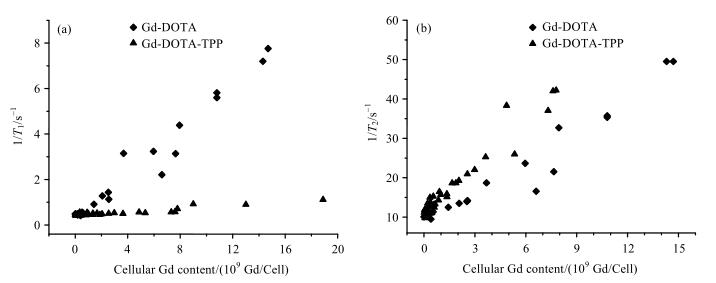
偶联蛋白或多肽的Gd基造影剂通常用作T1型造影剂,除了具有靶向性之外,偶联上大分子会降低分子的旋转速率从而提高r1[17, 18].Xue[19]报道的检测肝癌的ProCA32可作为T1和T2双模造影剂,是因为ProCA32偶联了蛋白之后提高了造影剂的r1的同时,也提高了r2.而在细胞影像方面,需要对用分子探针所标记的细胞进行综合评价.对Gd-DOTA-TPP经电转染的方式标记hMSCs呈现暗信号的实验现象进一步探究发现:虽然在水溶液中两种MRI探针的弛豫率相差较小,差距在同一数量级范围内,但在细胞中,Gd-DOTA和Gd-DOTA-TPP的1/T1相对于胞内Gd含量的变化率相差很大. Gd-DOTA和Gd-DOTA-TPP的1/T1相对于胞内Gd含量的变化率分别为0.366×10–9 Gd–1×cell·s–1和0.033×10–9 Gd–1×cell·s–1,即Gd-DOTA-TPP的1/T1相对于胞内Gd含量的变化率仅约为Gd-DOTA的1/10[图 6(a)].Gd-DOTA-TPP的1/T2相对于胞内Gd含量的变化率约为Gd-DOTA的2倍[图 6(b)].结合(1) 式[11],Gd-DOTA-TPP的1/T1相对于胞内Gd含量变化率的减小,1/T2相对于胞内Gd含量变化率的增大,导致其在MRIT1加权像和T2加权像上信号强度的减小.因而在较低(9×109Gd/cell)的细胞Gd含量下,T2加权像上即可呈现很强的暗信号(T2加权信号强度低至背景信号强度).
| ${F_{sc}} \propto (1 - {{\rm{e}}^{ - {T_R}/{T_1}}}){{\rm{e}}^{ - {T_E}/{T_2}}}$ | (1) |
|
图 6 Gd-DOTA-TPP与Gd-DOTA在hMSCs中的(a) 1/T1和(b) 1/T2相对于细胞Gd含量的变化率 Figure 6 Cellular (a) T1-and (b) T2-relaxation rate as a function of cellular Gd content of Gd-DOTA-TPP and Gd-DOTA in hMSCs |
其中Fse是自旋回波信号强度,T1和T2分别是纵向和横向弛豫时间,TR和TE分别是实验的重复时间和回波时间.
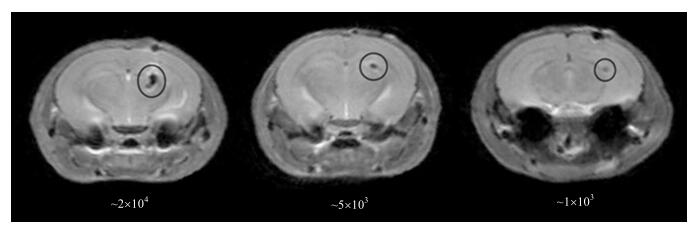
2.5 体内MRI移植干细胞检测灵敏度体外MRI实验证明,Gd-DOTA-TPP可作为一种新型的T2型小分子造影剂.将Gd-DOTA-TPP电转染标记的hMSCs以头颅注射的方式移植入小鼠脑室,对其在体内MRI分辨率的影响进行探究.实验结果明:Gd-DOTA-TPP电转染标记的hMSCs移植入小鼠脑室后,T2加权像上呈现暗信号,灵敏度可达约1×103个细胞(图 7).而一般当Gd的络合物作为T1型造影剂标记细胞时,需要约5×104个以上的细胞才可以被MRI检测[4].利用Gd-DOTA-TPP电转标记的hMSCs做干细胞移植示踪,可显著提高移植干细胞在MRI系统的成像分辨率,为利用MRI系统研究移植干细胞在体内的存活、迁移、归巢等行为提供有力的技术支持.
|
图 7 注射有一定数量Gd-DOTA-TPP标记的hMSCs的小鼠头颅T2加权像 Figure 7 T2-weighted MR images of a mouse brain receiving injection of defined number of hMSCs labeled with Gd-DOTA-TPP |
本文利用固相合成的方法合成了一种新型Gd基小分子磁共振造影剂Gd-DOTA-TPP.经该探针标记的hMSCs在11.7 T MRI系统上呈现很强的暗信号;经该探针标记的hMSCs移植入小鼠脑室,在11.7 T MRI系统上可达到103个细胞的检测灵敏度.MRI扫描结果表明,Gd-DOTA-TPP作为一种新型T2造影剂,可显著提高移植干细胞在体内的MRI检测灵敏度,为研究干细胞在活体中的存活、迁移、归巢等行为提供很好的技术保障.
| [1] | TACHIBANA Y, ENMI J, AGUDELO C A, et al. Long-term/bioinert labeling of rat mesenchymal stem cells with pva-gd conjugates and mri monitoring of the labeled cell survival after intramuscular transplantation[J]. Bioconjugate Chem, 2014, 25(7): 1243-1251. DOI: 10.1021/bc400463t. |
| [2] | IWASE T, NAGAYA N, FUJⅡ T, et al. Comparison of angiogenic potency between mesenchymal stem cells and mononuclear cells in a rat model of hindlimb ischemia[J]. Cardiovasc Res, 2005, 66(3): 543-551. DOI: 10.1016/j.cardiores.2005.02.006. |
| [3] | ZHENG Q, SHI X Y. Dendrimer-based molecular imaging contrast agents[J]. Prog Polym Sci, 2015, 44: 1-27. DOI: 10.1016/j.progpolymsci.2014.08.002. |
| [4] | MAHMOUDI M, HOSSEINKHANI H, HOSSEINKHANI M, et al. Magnetic resonance imaging tracking of stem cells in vivo using iron oxide nanoparticles as a tool for the advancement of clinical regenerative medicine[J]. Chem Rev, 2011, 111(2): 253-280. DOI: 10.1021/cr1001832. |
| [5] | KHURANA A, NEJADNIK H, GAWANDE R, et al. Intravenous ferumoxytol allows noninvasive MR imaging monitoring of macrophage migration into stem cell transplants[J]. Radiology, 2012, 264(3): 803-811. DOI: 10.1148/radiol.12112393. |
| [6] | ARBAB A S, YOCUM G T, KALISH H, et al. Efficient magnetic cell labeling with protamine sulfate complexed to ferumoxides for cellular MRI[J]. Blood, 2004, 104(4): 1217-1223. DOI: 10.1182/blood-2004-02-0655. |
| [7] | SHAPIRO E M, SKRTIC S, SHARER K, et al. MRI detection of single particles for cellular imaging[J]. P Nat Acad Sci USA, 2004, 101(30): 10901-10906. DOI: 10.1073/pnas.0403918101. |
| [8] | SHAPIRO E M, SHARER K, SKRTIC S, et al. In vivo detection of single cells by MRI[J]. Magn Reson Med, 2006, 55(2): 242-249. DOI: 10.1002/(ISSN)1522-2594. |
| [9] | YI P W, CHEN G C, ZHANG H L, et al. Magnetic resonance imaging of Fe3O4@SiO2-labeled human mesenchymal stem cells in mice at 11.7[J]. Biomaterials, 2013, 34(2): 3010-3019. |
| [10] |
WANG Q Y, ZENG X X, ZHU Q, et al. Research progress in magnetic resonance contrast agents[J].
Prog Mod Biomed, 2013, 13(16): 3186-3189.
王巧英, 曾晓霞, 祝青, 等. 磁共振造影剂的研究进展[J]. 现代生物医学进展, 2013, 13(16): 3186-3189. |
| [11] | LI C, JR W P, BHUJWALLA Z M. Facile synthesis of 1-(acetic acid)-4, 7, 10-tris(tert-butoxycarbonylmethyl)-1, 4, 7, 10-tetraazacyclododecane:A reactive precursor chelating agent[J]. Tetrahedron Lett, 2009, 50(24): 2929-2931. DOI: 10.1016/j.tetlet.2009.03.198. |
| [12] |
XIAO Y, ZHAN Y Y, XUE R, et al. A biocompatible gadolinium (iii)-poly (aspartic acid-co-phenylalanine) for liver magnetic resonance imaging contrast agent[J].
Chinese J Magn Reson, 2015, 32(2): 273-282.
肖研, 湛游洋, 薛蓉, 等. 一种肝脏类生物相容性氨基酸共聚物磁共振成像造影剂[J]. 波谱学杂志,, 2015, 32(2): 273-282. |
| [13] |
ZHANG H Y, LI C L, YING X F, et al. A gadolinium-based T1 MRI probe for detection of lung cancer stem cells[J].
Chinese J Magn Reson, 2016, 33(4): 628-634.
张宏岩, 李春林, 英晓芳, 等. 靶向肺癌干细胞的多肽Gd基T1型MRI探针的研究[J]. 波谱学杂志, 2016, 33(4): 628-634. |
| [14] | ZHANG Q Q, CAO R, FEI H, et al. Mitochondria-targeting phosphorescent iridium(Ⅲ) complexes for living cell imaging[J]. Dalton Transactions, 2014, 43(44): 16872-16879. DOI: 10.1039/C4DT00823E. |
| [15] | MCROBBIE D W, MOORE E A, GRAVES M J, et al. MRI from Picture to Proton, 2nd Ed[M]. New York: Cambridge University Press, 2006. |
| [16] | GUENOUN J, RUGGIERO A, DOESWIJK G, et al. In vivoquantitative assessment of cell viability of gadolinium or iron-labeled cells using MRI and bioluminescence imaging[J]. Contrast Media Mol Imaging, 2013, 8(2): 165-174. DOI: 10.1002/cmmi.1513. |
| [17] | CAO L M, LI B B, YI P W. The interplay of T1 -and T2-relaxation on T1 -weighted MRI of hMSCs induced by Gd-DOTA-peptides[J]. Biomaterials, 2014, 35(13): 4168-4174. DOI: 10.1016/j.biomaterials.2014.01.073. |
| [18] |
ZHAN Y Y, XUE R, ZHU Y L, et al. A biocompatible gadolinium-based amino acid copolymer contrast agent for magnetic resonance imaging[J].
Chinese J Magn Reson, 2016, 33(4): 635-645.
湛游洋, 薛蓉, 祝云龙, 等. 氨基酸共聚物修饰的生物相容性MRI造影剂[J]. 波谱学杂志, 2016, 33(4): 635-645. DOI: 10.11938/cjmr20160413. |
| [19] | XUE S H, YANG H, QIAO J J, et al. Protein MRI contrast agent with unprecedented metal selectivity and sensitivity for liver cancer imaging[J]. P Nat Acad Sci USA, 2015, 112(21): 6607-6612. DOI: 10.1073/pnas.1423021112. |
 2017, Vol. 34
2017, Vol. 34 
