文章信息
- 湛游洋, 薛蓉, 祝云龙, 李晓晶, 裴奉奎, 冯江华
- ZHAN You-yang, XUE Rong, ZHU Yun-long, LI Xiao-jing, PEI Feng-kui, FENG Jiang-hua
- 氨基酸共聚物修饰的生物相容性MRI造影剂
- A Biocompatible Gadolinium-Based Amino Acid Copolymer Contrast Agent for Magnetic Resonance Imaging
- 波谱学杂志, 2016, 33(4): 635-645
- Chinese Journal of Magnetic Resonance, 2016, 33(4): 635-645
- http://dx.doi.org/10.11938/cjmr20160413
-
文章历史
收稿日期: 2016-02-29
收修改稿日期: 2016-10-24


DOI:10.11938/cjmr20160413
2. 中国科学院大学, 北京 100049;
3. 厦门大学 电子科学系, 福建 厦门 361005
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Department of Electronic Science, Xiamen University, Xiamen 361005, China
近年来,磁共振成像(MRI)在临床诊断中得到了广泛的应用.但是,一些早期的病变并不能被精确地诊断出来.为了提高病变部位与正常组织信号间的对比度,大约40%的诊断需要使用MRI造影剂[1].目前,临床应用的MRI造影剂主要是小分子金属配合物,如Magnevist、Dotarem、Omniscan、Gadovist等.然而这些小分子MRI造影剂具有弛豫效率低、成像窗口时间短、用药量大等缺点[2].将小分子造影剂大分子化,可以有效的克服以上缺点,并且可以提高造影剂的相关性能.现阶段研究的大分子MRI造影剂大多是将小分子造影剂引入高分子主链或共价偶联到大分子载体上,如Gd-DOTA-BSA、Gd-DTPA-Dextran等[3, 4].尽管如此,这类大分子造影剂仍有水溶性低、选择性分布较差、生物降解性不强等缺点[5].
聚天门冬氨酸(Asp)具有良好的生物相容性,并可以通过体内水解或酶解反应降解为小分子氨基酸,易于被机体吸收或代谢,对生物体无毒、无害,是一种具有广泛应用前景的大分子药物载体[6].同时,将含有亲脂基团的异亮氨酸(Ile)引入造影剂,可以提高造影剂与肝脏组织的特异性结合能力[5, 7].
本文选择了以Asp-Ile共聚物(AI)作为大分子载体,乙二胺(EDA)作为桥连剂与Gd3+-1, 4, 7, 10-四氮杂环十二烷-1, 4, 7, 10-四羧酸(Gd-DOTA)相连接,制备了大分子MRI造影剂——AI-EDA-DOTA-Gd,在提高其分子量、增大弛豫效率的同时,增强了其对肝脏的靶向性,并延长了成像窗口时间.此外,我们还对所合成的大分子MRI造影剂的化学结构、体外弛豫性能、生物相容性及动物体内成像等进行了研究.
1 实验部分 1.1 仪器及试剂Bruker AV-600型核磁共振(NMR)谱仪(Bruker公司)、Bruker Vertex70型红外光谱仪(Bruker公司);FD-2冻干机(北京博医康实验仪器有限公司);HT-MRSI65-35A 1.5 T NMR谱仪(上海寰彤科教设备有限公司);Varian 7.0 T小动物成像仪(Varian公司);TJA POEMS型等离子光谱仪(ICP-OES Thermol公司);CX22光学显微镜(奥林巴斯公司).
Asp、Ile、乙醚、乙醇、硝酸、磷酸、甲醛、EDA、氢氧化钠、N, N-二甲基甲酰胺(DMF)购自国药集团化学试剂有限公司;DOTA购于Sigma公司;家兔红细胞购自吉林大学动物实验中心.
1.2 AI-EDA-DOTA-Gd的合成[8]AI-EDA-DOTA-Gd的合成路线如图 1所示.70 mmol Asp、30 mmol Ile与5 mL 85%磷酸均匀混合,在165 ℃、3 190 Pa条件下反应5 h.反应结束后,产物在DMF中溶解,并用去离子水沉淀、过滤洗涤,真空干燥,得到AI.将1.0g AI溶解到12 mL DMF中,在冰水浴中,将12 mL EDA滴加到AI溶液中,反应2.5 h后升温至室温并继续反应2 h.反应物在乙醚-乙醇(体积比为乙醚:乙醇=1:2)混合溶液中沉淀、过滤,透析后冻干,得到AI-EDA.AI-EDA(1 g溶于10 mL去离子水中)与DOTA活化酯(DOTA活化酯反应按参考文献[9]制备)室温下反应24 h,反应液透析后冻干,得到AI-EDA-DOTA.将得到的AI-EDA-DOTA与GdCl3溶液按照Gd3+:AI-EDA-DOTA = 1.2:1(摩尔比)混合,在室温下反应过夜,透析冻干,得到AI-EDA-DOTA-Gd.
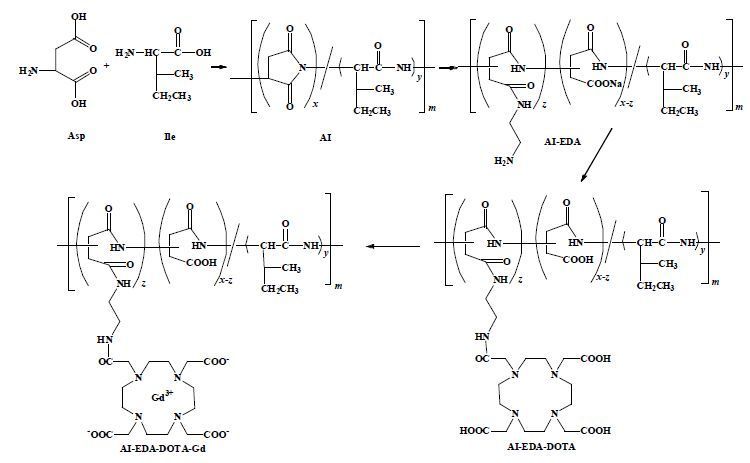
|
| 图 1 AI-EDA-DOTA-Gd的合成路线. x:y = 7:3 Fig. 1 Synthesis route of AI-EDA-DOTA-Gd. x:y = 7:3 |
AI-EDA-DOTA-Gd的T1在1.5 T NMR谱仪测试.将AI-EDA-DOTA-Gd溶解在 1.5 mL 20%重水中,配制钆浓度为5 mmol/L的母液.分别取0.05、0.1、 0.2、0.35、0.5 mL母液放入直径为5 mm的NMR样品管中,加入20%重水使其体积均达到0.5 mL,则AI-EDA-DOTA-Gd的终浓度分别为0.5、1、2、3.5和5 mmol/L.采用反转恢复法测试各浓度样品的T1.
1.4 溶血性实验配制浓度为2%的红细胞生理盐水混悬液置于7支试管中.在第1~5支试管中加入不同体积的0.5 mmol/L的AI-EDA-DOTA-Gd溶液.第6支试管不加入AI-EDA- DOTA-Gd溶液,作为空白对照.第7支试管不加AI-EDA-DOTA-Gd溶液,并以蒸馏水代替生理盐水,作为完全溶血对照.将1~7支试管轻轻摇匀后,置于37 ℃恒温水浴槽中保温1 h.
1.5 组织切片制备将9只雄性Sprague Dawley(SD)大鼠分为三组,每组3只.其中一组通过尾静脉注射生理盐水7 d后处死;另外两组分别通过尾静脉注射AI-EDA-DOTA-Gd(浓度为0.1 mmol/kg.bw,用生理盐水配制)1 d和7 d后处死.分别取肝、肾组织于4%甲醛溶液中固定,并进行包埋、切片(片厚为4 mm),用苏木素-伊红(HE)进行染色,在光学显微镜下观察结果.
1.6 MRI实验6只SD大鼠随机分为两组,每组3只.将20%的氨基甲酸乙酯(注射剂量为 10 mL/kg. bw)麻醉剂腹腔注射使大鼠麻醉,然后分别注射造影剂AI-EDA-DOTA-Gd [注射剂量为(0.093±0.008)mmol/kg. bw]和商用造影剂Gd-DOTA [注射剂量为 (0.098±0.010)mmol/kg. bw],每隔10 min采集磁共振图像,连续观测120 min.
MRI实验在Varian 7.0 T小动物MRI系统上进行.采用脉冲序列为Spin Echo Multi Slice,重复时间(TR)为300 ms,回波时间(TE)为20 ms,片厚(TH)为2 mm,视野(FOV)为100×60 mm2,数据矩阵大小为256×256.
2 结果与讨论 2.1 AI-EDA-DOTA-Gd的结构表征 2.1.1 NMR表征图 2(a)、2(b)分别为AI和AI-EDA-DOTA的13C NMR谱图.由图 2(a)中可以看出,δC 173.5、δC 172.3为天冬酰胺环中羰基碳信号,δC 169.2为Ile中羰基碳信号,这证明了Asp与Ile热缩聚反应的发生.在图 2(b)中,δC 169.1~172.4为AI-EDA羰基碳信号,δC 34.2~39.3、δC 14.3~25.7为AI-EDA非羰基碳信号,δC 45.5~63.2为AI-EDA-DOTA中DOTA的13C NMR信号[5, 6],以上结果说明了AI-EDA-DOTA的成功合成.
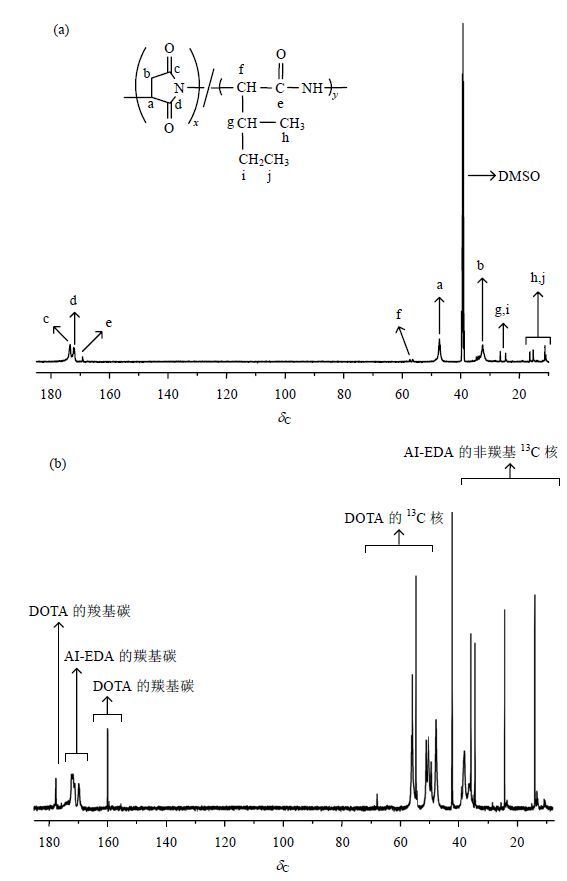
|
| 图 2 (a) AI和(b) AI-EDA-DOTA的13C NMR谱图 Fig. 2 13C NMR spectra of (a) AI and (b) AI-EDA-DOTA |
图 3为AI、AI-EDA-DOTA、AI-EDA-DOTA-Gd的红外光谱图.由图 3(a)中可以看出,3 550 cm-1附近为OH的伸缩振动峰,1 788 cm-1、1 705 cm-1为酰胺基中C=O、C-N的强吸收峰.图 3(b)、图 3(c)中1 083 cm-1、1 037 cm-1附近出现DOTA的指纹区特征峰,证明了我们成功的合成了AI-EDA-DOTA-Gd[6, 7].通过ICP-OES测定,AI-EDA-DOTA-Gd中钆含量 为8.83%.
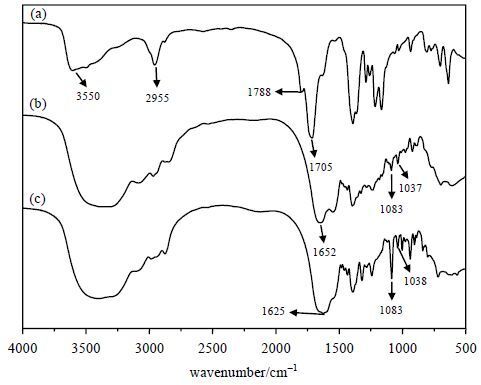
|
| 图 3 (a) AI、(b) AI-EDA-DOTA和(c) AI-EDA-DOTA-Gd红外光谱图 Fig. 3 Infrared spectra of (a) AI, (b) AI-EDA-DOTA and (c) AI-EDA-DOTA-Gd |
临床上通常采取测量计算得出纵向弛豫效率(r1)来作为评价造影剂体外弛豫性能的一个重要指标.
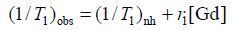
|
(1) |
由(1) 式可以计算得到AI-EDA-DOTA-Gd和Gd-DOTA的纵向弛豫效率(r1)分别为12.6 mmol-1×L×s-1和5.8 mmol-1×L×s-1,本文所合成的AI-EDA-DOTA-Gd的r1是临床应用的Gd-DOTA的2.2倍.这是由于将小分子的Gd-DOTA连接到大分子的氨基酸共聚物上增大了分子尺寸,从而使旋转相关时间得到延长,最终改善了弛豫性能[10, 11].
2.3 溶血性试验溶血性试验是用于观察测试药物是否会引起溶血和红细胞凝聚等反应,是注射类药物安全性检查的重要指标之一.
由表 1和图 4可以直观的看出,AI-EDA-DOTA-Gd的加入既无凝血现象也无溶血现象,说明它具有良好的血液相容性,是一种潜在的静脉注射制剂.这可能是因为AI-EDA-DOTA-Gd带有酸性基团,而红细胞表面带有负电荷,酸性基团阻碍了AI-EDA-DOTA-Gd与红细胞的作用[8, 12],使其具有良好的血液相容性.
| 溶液体积/mL | 试管1 | 试管2 | 试管3 | 试管4 | 试管5 | 试管6 | 试管7 |
| 0.5 mmol/L AI-EDA-DOTA-Gd | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0 | 0 |
| 生理盐水 | 2.4 | 2.3 | 2.2 | 2.1 | 2.0 | 2.5 | 0 |
| 蒸馏水 | 0 | 0 | 0 | 0 | 0 | 0 | 2.5 |
| 2%红细胞悬浊液 | 2.5 | 2.5 | 2.5 | 2.5 | 2.5 | 2.5 | 2.5 |
| 结果* | - | - | - | - | - | - | + |
| *“+”代表溶血,“-”代表既不溶血也不凝血. | |||||||

|
| 图 4 AI-EDA-DOTA-Gd溶血性试验结果.1~6号试管没出现溶血和凝血现象,7号试管出现溶血现象 Fig. 4 Hemolytic experiment result of AI-EDA-DOTA-Gd. No hemolysis and blood coagulation were observed in No. 1~6 except No.7 |
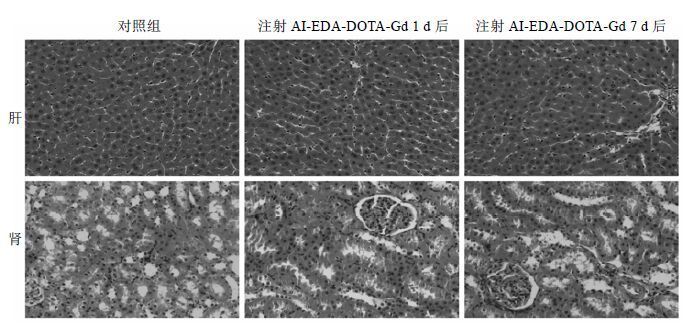
通常情况下,可以通过组织切片结果来反应药物在体内的急性毒性.由图 5中大鼠的肝、肾组织切片可以看出,大鼠的肝、肾组织均未发生明显病变.在注射造影剂后1 d和7 d的肝组织切片图中,肝细胞排列紧密、细胞核生长旺盛、无纤维性增生,
|
| 图 5 大鼠肝肾组织切片(H&E染色法) Fig. 5 H&E stained images for liver and kidney tissues of SD rats |
与对照组相比,没有出现组织病变症状.同样,在肾组织切片中,肾小管、肾小球等形态正常,整个组织没有显著的异常.综上所述,我们所合成的大分子MRI造影剂——AI-EDA-DOTA-Gd在动物体内有较低的毒性和良好的生物相容性[13].
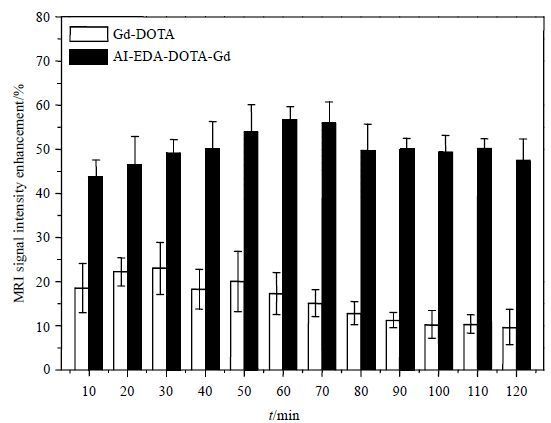
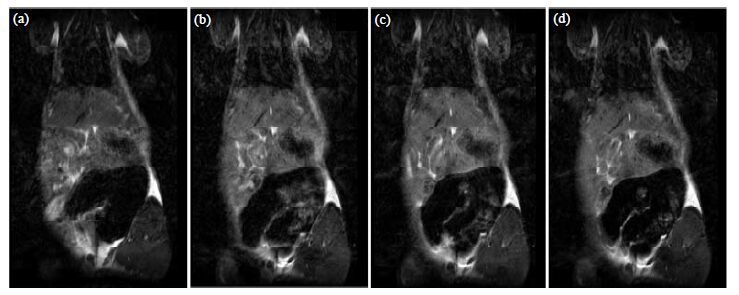
2.5 体内成像实验图 6为大鼠肝脏信号增强程度[信号增强程度= (注射造影后剂信号强度-注射前信号强度)/注射前信号强度]效果随时间变化趋势,图 7为尾静脉注射AI-EDA-DOTA-Gd前和注射30 min、60 min、90min后大鼠肝脏部位T1加权像.由图中可以看出,AI-EDA-DOTA-Gd对肝脏的最佳成像时间为30~70 min,信号增强约(55.1±5.7)%.与Gd-DOTA[最佳成像时间为10~30 min,信号增强约(23.6±3.7)%]相比,具有更长的成像窗口时间,对肝脏部位的信号增强程度也明显提高.良好的成像效果原因可能是:(1)由于AI-EDA-DOTA-Gd中引入了大量疏水性的甲基,增强了对肝脏部位的靶向性[7, 14];(2)由于肝脏为血液灌注器官,可以引起血液T1变化的因素都可以影响到肝脏的MRI信号[15].AI-EDA-DOTA-Gd具有较长的成像窗口时间,可以延长信号采集时间,提高图像清晰度.同时,其对肝脏有着明显的成像增强效果,在相同的信号采集时间内,可以有效的提高图像质量,对临床上早期的、微小的病变检测有着重要意义.
|
| 图 6 注射Gd-DOTA和AI-EDA-DOTA-Gd后大鼠肝脏MRI信号增强程度随时间变化趋势 Fig. 6 The mean enhancement percentage of rat liver at different time after injection of Gd-DOTA and AI-EDA-DOTA-Gd |
|
| 图 7 注射AI-EDA-DOTA-Gd (a)前、(b) 30 min后、(c) 60 min后和(d) 90 min后大鼠肝脏的T1加权图像 Fig. 7 Axial T1-weighted images of rat liver (a) pre-injection, (b) 30 min post-injection, (c) 60 min post-injection and (d) 90 min post-injection of AI-EDA-DOTA-Gd |
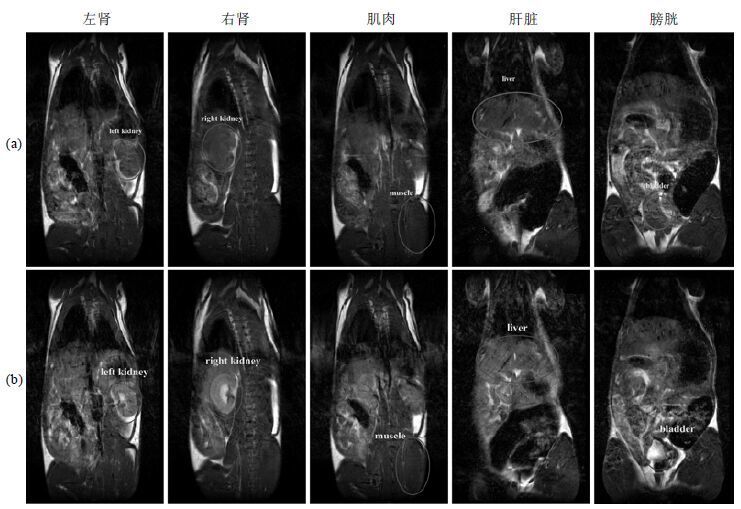
图 8为尾静脉注射AI-EDA-DOTA-Gd前和80 min后,大鼠部分组织的磁共振图像.由图中可以观察到,在注射AI-EDA-DOTA-Gd 80 min后,不仅肝脏部位MRI信号增强,双肾和肌肉部位的磁共振图像亮度也有所增加.这可能是由于AI-EDA-DOTA-Gd随着血液循环,分布到全身各个部位,从而引起了其它组织MRI信号的变化[16].在图 8(b)中,膀胱位置图像明显变亮,并且轮廓清晰边界明显.这种现象的主要原因可能是AI-EDA-DOTA-Gd主要通过肾脏进行代谢,并通过尿液排出体外[16, 17].
|
| 图 8 尾静脉注射AI-EDA-DOTA-Gd (a)前和(b)注射80 min后大鼠肾脏、肝脏、肌肉、膀胱部位T1加权图像 Fig. 8 Coronal T1-weighted images of rat in kidney, liver, muscle and bladder (a) pre-injection and (b) 80 min post-injection of AI-EDA-DOTA-Gd |
采用热缩聚的方法制备了AI,并通过EDA与小分子的Gd-DOTA连接,制备了大分子的MRI造影剂——AI-EDA-DOTA-Gd.溶血性实验、动物组织生理切片结果表明AI-EDA-DOTA-Gd具有良好的生物相容性和较低的毒性,体外弛豫速率测定和动物体内成像说明其对肝脏具有较好的选择性.由于氨基酸共聚物为载体的大分子造影剂具有比其他大分子造影剂更为优异的生物相容性和生物降解性能,因此,其在MRI应用方面具有良好前景.
| [1] | Yang Bao-lian(杨保联) . Future of ultra high field MRI in basic research and clinical applications(超高场磁共振人体成像应用研究和医学前景)[J]. Chinese J Magn Reson(波谱学杂志) , 2015, 32 (4) : 707-714 |
| [2] | Yu Kai-chao(俞开潮), Wang Guo-ping(王国平), Ding Shang-wu(丁尚武) et al . Recent progresses in the development of contrast agents used in magnetic resonance imaging(用于磁共振成像对比增强的造影剂研发进展)[J]. Chinese J Magn Reson(波谱学杂志) , 2004, 21 (4) : 505-525 |
| [3] | Chen Y Y, Zhu Q, Hu A G et al . Preparation of highly efficient MRI contrast agents through complexation of cationic GdⅢ-containing metallosurfactant with biocompatible polyelectrolytes[J]. Chem Eur J , 2014, 20 (39) : 12477-12482 DOI:10.1002/chem.v20.39 |
| [4] | Pierre V C, Allen M J, Caravan P . Contrast agents for MRI:30+years and where are we going?[J]. J Biol Inorg Chem , 2014, 19 (2) : 127-131 DOI:10.1007/s00775-013-1074-5 |
| [5] | Gaetano G, Gennara C, Laura M . Synthesis and characterization of novel chemical conjugates based on α, β-polyaspartylhydrazide and β-cyclodextrins[J]. Eur Polym J , 2006, 42 (10) : 2715-2729 DOI:10.1016/j.eurpolymj.2006.05.005 |
| [6] | Yang H M, Park C W, Ahn T et al . A direct surface modification of iron oxide nanoparticles with various poly(amino acid)s for use as magnetic resonance probes[J]. J Colloid Interf Sci , 2013, 391 : 158-167 DOI:10.1016/j.jcis.2012.09.044 |
| [7] | Adel B, Graaf L M, Que I et al . Contrast enhancement by lipid-based MRI contrast agents in mouse atherosclerotic plaques; a longitudinal study[J]. Contrast Media Mol I , 2013, 8 (1) : 63-71 DOI:10.1002/cmmi.v8.1 |
| [8] | Xiao Yan(肖研), Zhan You-yang(湛游洋), Xue Rong(薛蓉) et al . A biocompatible gadolinium (Ⅲ)-poly (aspartic acid-co-phenylalanine) for liver magnetic resonance imaging contrast agent(一种肝脏类生物相容性氨基酸共聚物磁共振成像造影剂)[J]. Chinese J Magn Reson(波谱学杂志) , 2015, 32 (2) : 273-282 |
| [9] | Chen X, Park R, Tohme M et al . Micro PET and autoradiographic imaging of breast cancer alpha(v)-integrin expression using F-18-and Cu-64-labeled RGD peptide[J]. Bioconjugate Chem , 2004, 15 (1) : 41-49 DOI:10.1021/bc0300403 |
| [10] | Werner E J, Datta A, Jocher C I et al . High-relaxivity MRI contrast agents:where coordination chemistry meets medical imaging[J]. Angew Chem Int Ed Engl , 2008, 47 (45) : 8569-8580 |
| [11] | Yu Kai-chao(俞开潮), Lv Zhi-yong(吕志勇), Yao Yao(姚瑶) et al . Recent progress in development of bio-active MRI contrast agents(生物激活磁共振成像造影剂的研究进展)[J]. Chinese J Magn Reson(波谱学杂志) , 2010, 27 (3) : 355-368 |
| [12] | Dekie L, Toncheva V, Dubruel P et al . Poly-L-glutamic acid derivatives as vectors for gene therapy[J]. J Control Release , 2000, 65 (1, 2) : 187-202 |
| [13] | Dai L L, Liu Y K, Wang Z Q et al . One-pot facile synthesis of PEGylated superparamagnetic iron oxide nanoparticles for MRI contrast enhancement[J]. Mater Sci Eng C Mater Biol Appl , 2014, 41 : 161-167 DOI:10.1016/j.msec.2014.04.041 |
| [14] | Xiao Y, Xue R, Li X J et al . Gadolinium-1, 4, 7, 10-tetraazacyclododecane-1, 4, 7, 10-tetraacetic acid conjugate of arabinogalactan as a potential liver-targeting magnetic resonance imaging contras tagent[J]. Carbohydr Res , 2014, 395 : 9-14 DOI:10.1016/j.carres.2014.05.022 |
| [15] | Sun G Y, Feng J H, Pei F K et al . Synthesis and evaluation of novel polysaccharide-Gd-DTPA compounds as contrast agent for MRI[J]. J Magn Magn Mater , 2003, 265 (2) : 123-129 DOI:10.1016/S0304-8853(03)00239-7 |
| [16] | Xiao Y, Xue R, Li X J et al . A new biodegradable and biocompatible gadolinium(Ⅲ)-polymer for liver magnetic resonance imaging contrast agent[J]. Magn Reson Imaging , 2015, 33 (6) : 822-828 DOI:10.1016/j.mri.2015.03.002 |
| [17] | Zhang G D, Zhang R, Melancon M P et al . The degradation and clearance of Poly (N-hydroxypropy-L-glutamine)-DTPA-Gd as a blood pool MRI contrast agent[J]. Biomaterials , 2012, 33 (2) : 5376-5383 |

本作品采用知识共享署名 4.0 国际许可协议进行许可。
 2016, Vol. 33
2016, Vol. 33



