文章信息
- 张宏岩, 李春林, 英晓芳, 魏建东, 张海禄, 邓宗武, 朱毅敏, 谭波
- ZHANG Hong-yan, LI Chun-lin, YING Xiao-fang, WEI Jian-dong, ZHANG Hai-lu, DENG Zong-wu, ZHU Yi-min, TAN Bo
- 靶向肺癌干细胞的多肽Gd基T1型MRI探针的研究
- A Gadolinium-Based T1 MRI Probe for Detection of Lung Cancer Stem Cells
- 波谱学杂志, 2016, 33(4): 627-634
- Chinese Journal of Magnetic Resonance, 2016, 33(4): 627-634
- http://dx.doi.org/10.11938/cjmr20160412
-
文章历史
收稿日期: 2016-03-03
收修改稿日期: 2016-10-25


DOI:10.11938/cjmr20160412
2. 中国科学院 苏州纳米技术与纳米仿生研究所, 江苏 苏州 215123


2. Suzhou Institute of Nano-tech and Nano-bionics, Chinese Academy of Sciences, Suzhou 215123, China
癌症严重威胁着人类生命和健康, 是全球性的公共卫生问题.癌症的预防、诊断及治疗尤其重要.对于肿瘤发生发展的过程,目前主要偏向于肿瘤干细胞学说[1, 2].肿瘤干细胞是肿瘤起始、生长、复发、转移以及耐药性产生的根源[3].肿瘤干细胞学说的提出为早期诊断与彻底治愈癌症带来新的希望.
磁共振成像(MRI)因其具有无创、快速、高解析率、高对比度等特点,在临床上广泛使用.特别是在肿瘤的诊断中,该技术利用病变组织和正常组织物理特性的不同而获得的结构和功能影像,已经成为原发肿瘤和肿瘤转移早期诊断中不可或缺的重要依据[4].一般来说,MRI因其较低的灵敏度而不能满足肿瘤早期诊断的要求,这是因为早期肿瘤和正常组织在物理特性(例如T1和T2)上差异较小.当这种微小差异不足以产生肿瘤和正常组织的影像对比时,人们应用核磁共振造影剂来增强肿瘤和正常组织影像的对比度以利于肿瘤的早期诊断[5, 6].
Gd络合物造影剂容易与各种生物标记物结合,可以通过精确的化学结构修饰设计可靠的MRI分子探针来增强信号.同时生物标记物的结合也可大幅度提高Gd络合物的纵向弛豫效率(r1).该技术的核心是需要偶联有细胞靶向功能的不同种类和大小的功能单元,包括蛋白、抗体、多肽和化学小分子等.其中,靶向多肽分子近年来越来越引起人们的重视,特别是在肿瘤的靶向诊断和治疗中得到了广泛深入的研究[7]. 本文使用我们筛选出的HCBP-1特异性多肽[8],合成特异性靶向H460肺癌干细胞的T1型MRI探针——Gd-DOTA-HCBP-1,希望通过这种分子探针实现对肺癌干细胞的检测,为临床上早期检测与治疗肺癌提供有效的工具.
1 实验部分 1.1 试剂及仪器1, 4, 7, 10-四氮杂环十二烷盐酸盐购自安耐吉化学公司;二甲基甲酰胺(DMF)、N, N-二异丙基碳二亚胺(DIC)、1-羟基苯并三唑(HOBT)、1, 2-乙二硫醇(EDT)购自国药集团化学试剂有限公司;Fmoc-Trp (Boc)-Wang树脂、四甲基脲六氟磷酸酯(HATU)、甲基吗啉(NMM)以及各种氨基酸(AA)购自吉尔生化(上海)有限公司.化学和生化试剂均为AR级,直接使用.培养基DMEM/F12、双抗、胰酶购自Hyclone公司;重组人表皮生长因子(EGF)、重组人碱性成纤维细胞生长因子(bFGF)购自Pepro Tech公司;B27无血清培养添加剂购自Gibco公司;H460肺癌干细胞克隆球是实验室自行培养[8].
2535/2707高效液相色谱(HPLC)仪(Waters);1200/6220飞行时间质谱(MS)仪(Agilent);11.7 T磁共振微成像系统(Bruker);TS100倒置显微镜(Nikon);X series 2电感耦合等离子体发射质谱仪(Thermo)、Forma CO2细胞培养箱(Thermo).
1.2 材料合成按文献[9]由1, 4, 7, 10-四氮杂环十二烷盐酸盐经多步反应得到1, 4, 7-三(叔丁氧羰甲基)-10-(乙酸)-1, 4, 7, 10-四氮杂环十二烷[DOTA(OtBu)3]以备用;称取2.0 g Fmoc-Trp(Boc)-Wang树脂(0.5 mmol/g)在DMF中充分溶胀2 h;20%哌啶/DMF作用30 min脱除保护基团Fmoc;用DMF洗6次,按目标产物的氨基酸序列依次与下一个氨基酸缩合,缩合后脱去Fmoc.每步投料比为AA:DIC:HOBT:树脂=3:3:3:1;最后与DOTA(OtBu)3缩合,缩合剂为NMM和HATU,比例为DOTA(OtBu)3:HATU:NMM = 2:1.9:4,茚三酮显色法检测缩合反应的终点.最终逐步得到线性多肽DOTA(OtBu)3-PEG2-Leu-Gly-Cys(Trt)-Phe-Pro-Glu-Gly-Glu-Met-Ala-Cys(Trt)-Trp(Boc)-Trp(Boc)-Wang树脂.
将上述线性多肽树脂分散在TFA的混合溶液(TFA:EDT:苯硫基甲烷:H2O = 90:5: 2.5:2.5)中,室温搅拌3 h;过滤去除树脂,将滤液加入到10倍体积的冷却乙醚中,析出固体,离心分离后真空干燥得粗产品1.2 g.
将所得到的多肽粗产品以2 mg/mL的浓度溶解在水中,室温搅拌;将1 mol/L I2/MeOH溶液逐滴加入,至液体颜色变为棕黄色;继续搅拌10 min,随后逐滴加入 0.1 mol/L Na2S2O3至无色透明;用HPLC提纯,纯度达到95%以上;将提纯后的样品于-20℃冷冻干燥48 h,得到白色粉状DOTA-HCBP-1(结构如图 1所示)约101 mg,产率约为5%(以树脂计).取DOTA-HCBP-1,用MS确认样品分子量及元素组成.

|
| 图 1 DOTA-HCBP-1的结构式 Fig. 1 Chemical structure of DOTA-HCBP-1 |
取90 mg DOTA-HCBP-1于10 mL离心管中,加入4 mL超纯水溶解;用氨水调节pH至5~6之间;极缓慢地加入5.556 mg/mL的GdCl3水溶液(DOTA-HCBP-1:GdCl3 = 1:1)2.64 mL;室温反应6 h后,再使用1 mol/L 氨水溶液调节pH值至7~8之间;继续室温反应6 h;冷冻干燥后用HPLC对所得粗产品进行纯化.取2 mg制备好的探针样品(Gd-DOTA-HCBP-1),利用HPLC分析样品的络合效率.
1.3 探针样品的纵向弛豫效率(r1)表征使用电感耦合等离子体发射质谱仪测量制备的Gd-DOTA-HCBP-1的钆含量.将探针Gd-DOTA-HCBP-1配制成浓度为1.0、0.5、0.2、0.1、0.05、0.025 mmol/L的溶液系列,置于直径为5 mm样品管中.
使用11.7 T磁共振微成像系统采用RARE(Rapid Acquisition with Refocused Echoes)序列获得T1,将1/T1与其溶液钆浓度进行线性拟合,得到探针的r1.具体实验参数如下:成像视野(FOV)= 12 mm×12 mm,回波时间(TE)= 7 ms,重复时间(TR)= 40、70、100、180、300、500、750、1 000、1 500、3 000、5 000 ms,矩阵(Matrix)= 96×96,累加次数为2,片厚/间隔(Slice Thickness/Gap)= 0.8 mm/0.2 mm.
使用MSME(Multi-Slice Multi Echo)序列收集加权像,具体实验参数如下:FOV = 12 mm×12 mm,TE = 5.2 ms,TR = 500 ms,Matrix = 96×96,累加次数为2,Slice Thickness/Gap = 0.8 mm/ 0.2 mm.
1.4 H460肺癌干细胞克隆球的培养本文采用克隆球形成实验来富集H460肺癌干细胞.在无血清的培养基体系中,只有干细胞才能持续地分裂、传代,而已经分化的细胞由于不能进行自我更新和持续分裂,在多次传代后就消失了,从而得到富集了H460肺癌干细胞的克隆球[10].而H460肺癌细胞是一种普通贴壁细胞,需要在有血清的培养基体系中培养.
取直径约为100 μm的肺癌干细胞克隆球,300 rpm离心1 min;收集克隆球,加入1 mL 0.25% 胰酶和0.02% EDTA的消化液进行重悬,37℃消化2 min;用移液枪反复吹打,约60次后可见克隆球被消化成单细胞或多聚体;加入10 mL 磷酸缓冲盐溶液(PBS)进行稀释,1 000 rpm离心5 min,弃上清液以除去残留的胰酶;10 mL PBS清洗2遍后,进行细胞计数;以104个/mL的密度接种到DMEM-F12(1:1)培养基;添加20 ng/mL的EGF、20 ng/mL的bFGF以及2% B27;每隔1 d进行半量换液,干细胞克隆球培养到10~14 d时直径约达到200 μm.用含有10%胎牛血清(FBS)的RPMI-1640培养基培养H460肺癌细胞.图 2(a)是显微镜下观测到的贴壁H460肺癌细胞,图 2(b)是H460肺癌干细胞克隆球的形态.

|
| 图 2 H460肺癌(a)贴壁细胞与(b)干细胞克隆球显微镜图 Fig. 2 Microscopic images of H460 (a) parental cells and (b) tumor spheres |
取2 mL含有约70个干细胞克隆球的培养基溶液,加入11 mg Gd-DOTA-HCBP-1(2 mmol/L),在37℃/5% CO2的培养箱中孵育17 h;500 rpm离心2 min;弃培养基,用1 mL PBS清洗4遍;加入100 μL PBS,用1 mL浓度为1%的琼脂糖重悬克隆球,吸入1 mL注射器.另外,将相同数目的未标记的干细胞克隆球用同样方法分散在1%的琼脂糖中以及1%的琼脂糖凝胶作为阴性对照.在11.7 T磁共振微成像系统上采用与溶液加权成像相同的序列获得T1加权图像.
2 结果与讨论 2.1 材料的表征结果分析我们用筛选的可以特异性结合H460肺癌干细胞的多肽HCBP-1作为靶向分子,其序列为LGCFPEGEMACWW[8].为了检测其特异性,使用终浓度为0.5 μmol/L N端FITC标记的HCBP-1多肽与H460肺癌干细胞克隆球以及H460肺癌贴壁细胞孵育后经流式细胞仪检测结合率情况.结果显示HCBP-1多肽与H460肺癌贴壁细胞的结合率只有0.8% [如图 3(a)所示],而与H460肺癌干细胞克隆球的结合率高达34.0% [如图 3(b)所示],说明HCBP-1多肽与H460肺癌干细胞结合具有高特异性.

|
| 图 3 HCBP-1多肽与H460肺癌(a)贴壁细胞和(b)干细胞克隆球的结合率 Fig. 3 Binding capacity of HCBP-1 peptide to H460 (a) parental cells and (b) tumor spheres |
固相合成中,氨基酸的加入顺序可确保多肽序列的正确;得到目标产物后,用MS检测其分子量可确保分子结构的正确.DOTA-HCBP-1分子量的理论值为2 058.33,MS测得结合两个质子带双电荷的分子离子的质荷比(m/z)为1 030.77 [如图 4(a)所示],与理论分子量一致,证实了目标分子正确.进行Gd络合后,用HPLC分析Gd-DOTA-HCBP-1的络合率[如图 4(b)所示],保留时间(Rt)为9.1 min的是Gd-DOTA-HCBP-1,Rt为8.6 min的是未络合的DOTA-HCBP-1,结果显示络合率为90.2%.

|
| 图 4 (a) DOTA-HCBP-1的质谱图和(b) Gd-DOTA-HCBP-1液相色谱图 Fig. 4 (a) The mass spectrum of DOTA-HCBP-1 and (b) HPLC chromatogram of Gd-DOTA-HCBP-1 |
为了评价Gd-DOTA-HCBP-1的弛豫性能,我们选用了临床使用的商用T1造影剂Dotarem作为实验对照.在11.7 T MRI系统上,测得了不同浓度(C)Gd-DOTA-HCBP-1水溶液与Dotarem的T1,对1/T1与其钆浓度进行线性拟合得到r1 [如图 5(b)所示].结果显示,Gd-DOTA-HCBP-1探针的r1为6.15 mmol-1·L·s-1,是临床使用的Dotarem(r1 = 3.85 mmol-1·L·s-1)的1.6倍.这是因为当Gd-DOTA与大分子结合后,由于分子转动变得缓慢,导致水质子T1缩短,表现出较高的r1[11].T1加权像显示Gd-DOTA-HCBP-1在0.7 mmol/L浓度的影像对比度与Dotarem 1 mmol/L的影像相当[如图 5(a)所示].
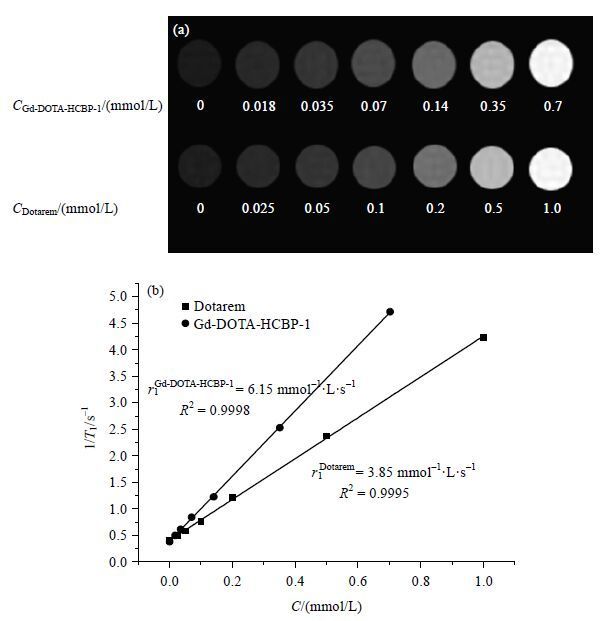
|
| 图 5 不同浓度Gd-DOTA-HCBP-1与Dotarem水溶液的(a) T1加权像和(b)纵向弛豫效率r1 (11.7 T) Fig. 5 (a) T1-weighted spin-echo MR images and (b) longitudinal relaxation rate r1 of Gd-DOTA-HCBP-1 and Dotarem in aqueous solution at 11.7 T MRI spectrometer |
浓度为20 mmol/L的Gd-DOTA-HCBP-1多肽MRI探针标记H460肺癌干细胞克隆球后,在11.7 T下的T1加权像如图 6所示.结果显示未标记细胞无法与基底材料形成对比[图 6(b)].使用Gd-DOTA-HCBP-1探针后,干细胞克隆球显示明显的亮信号[图 6(c)~(e)].由干细胞克隆球的密度以及影像所量尺寸可知图 6(c)中的亮点为一个克隆球,其直径约为200 μm,如果将干细胞克隆球和单个细胞简化为球体,单个细胞直径约为15 μm,那么一个克隆球里的细胞个数为2003/153 ≈ 2 000,由于克隆球里的细胞比单个细胞小,所以一个克隆球大约包含2 000~4 000个肺癌干细胞.图 6(d)和图 6(e)呈现的是2~3和4~6个球聚集在一起的状况,肺癌干细胞个数分别约为4 000~12 000和8 000~24 000.

|
| 图 6 探针Gd-DOTA-HCBP-1标记的H460肺癌干细胞克隆球分散在1%琼脂糖凝胶中的T1加权像. (a) 1%琼脂糖凝胶;(b) H460肺癌干细胞克隆球分散于1%琼脂糖凝肢中;(c)~(e)由Gd-DOTA-HCBP-1探针孵育的不同数目的H460肺癌干细胞克隆球 Fig. 6 T1 weighted images of H460 tumor spheres incubated with Gd-DOTA-HCBP-1 distributed in 1% agarose gel. (a) 1% agarose gel, (b) H460 tumor spheres distributed in 1% agarose gel, (c)~(e) Different numbers of H460 tumor spheres incubated with Gd-DOTA-HCBP-1 |
本文制备了靶向肺癌干细胞的T1型MRI探针——Gd-DOTA-HCBP-1,能够靶向结合H460肺癌干细胞.弛豫时间测试表明,该探针的r1约为临床上使用的Dotarem的1.6倍.探 针标记的肺癌干细胞克隆球的T1加权磁共振图像显示这一种探针具有很好的T1造影效果,能够使标记细胞与周围环境很明显地区分开;该探针成像灵敏度可达到小于等于单个克隆球尺寸.综上所述,此种新型的靶向多肽分子探针可以作为潜在的T1型MRI造影剂应用于肺癌的检测与治疗上,为接下来进一步对肺癌干细胞在体内的成像及肺癌的起始、生长、复发转移以及耐药性的研究提供有效的工具.
| [1] | Reya T, Morrison S J, Clarke M F et al . Stem cells, cancer, and cancer stem cells[J]. Nature , 2001, 414 (6859) : 105-111 DOI:10.1038/35102167 |
| [2] | Alent P, Bonnet D, De Maria R et al . Cancer stem cell definitions and terminology:the devil is in the details[J]. Nat Rev Cancer , 2012, 12 (11) : 767-775 DOI:10.1038/nrc3368 |
| [3] | Visvader J E, Lindeman G J . Cancer stem cells in solid tumours:Accumulating evidence and unresolved questions[J]. Nat Rev Cancer , 2008, 8 (10) : 755-768 DOI:10.1038/nrc2499 |
| [4] | Gillies R J, Bhujwalla Z M, Evelhoch J et al . Applications of magnetic resonance in model systems:Tumor biology and physiology[J]. Neoplasia , 2000, 2 (1, 2) : 139-151 |
| [5] | Pautler R G . Mouse MRI:Concepts and applications inphysiology[J]. Physiol , 2004, 19 (4) : 168-175 DOI:10.1152/physiol.00016.2004 |
| [6] | Persigehl T, Heindel W, Bremer C . MR and optical approaches to molecular imaging[J]. Abdom Imaging , 2005, 30 (3) : 342-354 |
| [7] | Fani M, Maeche H R, Okarvi S M . Radiolabeled peptides:Valuable tools for the detection and treatment of cancer[J]. Theranostics , 2012, 2 (5) : 481-501 DOI:10.7150/thno.4024 |
| [8] | Wang A, Chen L, Pu K et al . Identification of stem-like cells in non-small cell lung cancer cells using specific peptides[J]. Cancer Lett , 2014, 351 (1) : 100-107 DOI:10.1016/j.canlet.2014.05.004 |
| [9] | Li C, Winnard P, Bhujwalla Z M . Facile synthesis of 1-(acetic acid)-4, 7, 10-tris(tert-butoxycarbonylmethyl)-1, 4, 7, 10-tetraazacyclododecane:A reactive precursor chelating agent[J]. Tetrahedron Lett , 2009, 50 (24) : 2929-2931 DOI:10.1016/j.tetlet.2009.03.198 |
| [10] | Visvader J E, Lindeman G J . Cancer stem cells in solid tumours:Accumulating evidence and unresolved questions[J]. Nat Rev Cancer , 2008, 8 (10) : 755-768 DOI:10.1038/nrc2499 |
| [11] | Arbab A S, Liu W, Frank J A . Cellular magnetic resonance imaging:Current status and future prospects[J]. Expert Rev Med Devic , 2006, 3 (4) : 427-439 DOI:10.1586/17434440.3.4.427 |

本作品采用知识共享署名 4.0 国际许可协议进行许可。
 2016, Vol. 33
2016, Vol. 33

