近年来,交通事故、自然灾害、疾病等多种原因造成的人体组织和器官损伤日益增多,人体组织和器官修复的需求正日益突出。因此,生物材料作为一种新型医疗功能材料越来越受到研究者的关注。在对人体组织或血液无不良影响的前提下,生物材料可以用于治疗、修复或暂时替代损伤的人体组织和器官。生物材料有天然来源和人工合成两大类,其中天然来源的材料又分为天然高分子和天然无机物2种[1]。
羟基磷灰石(hydroxyapatite,HA)具有与人骨骼中的无机盐极为相似的晶体结构[2, 3],主要用于人骨修复[4, 5],如牙槽脊增高、口腔种植、骨替换等方面。该材料本身安全、无毒,耐腐蚀强度高,具有良好生物相容性,在临床上被广泛应用。羟基磷灰石具有传导骨生长的特性[6],即新骨可以从HA与原骨结合处沿着表面或贯通孔隙继续生长,这种特性是其与骨组织的成分结构相似性的表现。因此,临床上的HA材料与人骨中磷灰石晶体越相似,医疗效果越好。然而,材料本身较低的强度和韧性限制了其应用范围,目前主要应用于牙科和整形外科等临床上的低负荷承载力材料[7]。对HA材料进行覆层[8-10]增强其强度和韧性是该材料的重要发展方向。
胶原是一种常用的覆层材料,具有良好的生物相容性和组织结合力[11-13],可以促进细胞生长,引导组织分化。Langmuir-Blodgett(LB)膜技术是一种新型覆层技术[14-16],在气液界面上将两亲性分子有序排列,形成单分子薄膜,再将其转移到固体表面,可根据需要通过多次转移得到多层覆层材料,制备的材料覆层均匀可控。通过LB膜技术将胶原覆层到羟基磷灰石材料上,可以改善材料的性能,研制新型覆层材料。
本研究拟制备分子量均一的胶原蛋白肽,通过LB膜技术制备单分子层,并将其覆层在羟基磷灰石表面,对制备的覆层材料进行AFM表征,研究覆层稳定性,分析其力学性能变化,考察生物培养性能,为研发新型医用生物覆层材料提供理论基础。
1 材料与方法 1.1 材料与仪器胶原蛋白、胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶、木瓜蛋白酶、菠萝蛋白酶和碱性蛋白酶购自美国SIGMA公司,羟基磷灰石片由中国科学院过程工程研究所提供,其他试剂均为市售分析纯。
LB膜分析仪KN2002,原子力显微镜(AFM),高效液相色谱仪(Agilent 1100),万能材料试验机300DX。
1.2 实验方法 1.2.1 胶原蛋白肽制备将1 g胶原蛋白加入到50 ml水中,加热搅拌使其全部溶解,然后加入碱性蛋白酶50 mg,胰蛋白酶20 mg,保持温度为37 ℃,pH值为8.0,搅拌反应1 h后,将pH值调为7.0,煮沸灭酶10 min,离心取上清,冷冻干燥,得到胶原蛋白肽备用。
1.2.2 胶原蛋白肽分子量分析使用凝胶过滤色谱法(HPSEC)分析,色谱柱:TSK3000SW(300 mm×7.5 mm I.D., 10 μm);流动相:磷酸缓冲液(0.02 mol/L,pH 7.0);流速:0.4 mL/min;检测波长:280 nm;进样量:10 mL。
1.2.3 LB膜制备将胶原蛋白肽溶于氯仿,配置成0.5 mg/mL溶液。在LB膜分析仪中加入超纯水作为亚相,滴加500 μL胶原蛋白肽溶液,挥发30 min,压膜速率为5 mm/min。
1.2.4 羟基磷灰石覆层维持表面压23 mN/m,将羟基磷灰石片浸入亚相中,采用垂直提拉法,使胶原蛋白肽覆层在羟基磷灰石表面,提拉速度为7.5 mm/min,根据实验需求控制覆层次数。
1.2.5 原子力显微镜用原子力显微镜对羟基磷灰石片上的覆层胶原蛋白肽进行观察,采用间接接触模式,扫描范围由大到小,通过NanoScope Analysis软件处理图像。
1.2.6 稳定性分析为检测覆层材料的稳定性,将材料浸泡在50倍体积的生理盐水中24 h,收集浸泡液备用。继续用10倍体积生理盐水反冲洗材料,冲洗10次后收集冲洗液,更换生理盐水冲洗20次、30次、50次,收集冲洗液。将浸泡液、各次冲洗液浓缩,检测其中蛋白含量。
1.2.7 杨氏模量测定将胶原覆层羟基磷灰石材料置于万能材料试验机上,以2 mm/min的速度测试材料的压缩应力,根据力与位移的关系绘制应力-应变曲线,计算材料杨氏模量,每个样品测试5次,取平均值。
1.2.8 生物性能测试用MC3T3-E1细胞对覆层材料的细胞增殖活性进行评价,通过CCK-8法,分为覆层材料组和空白材料对照组,细胞培养周期为5天,每天取样5个复孔,每孔分别加入50 μL CCK-8试剂,37 ℃恒温培养箱中(5% CO2)孵育4 h,每孔吸取100 μL样品,检测其450 nm处的吸光度,每组取平均值,绘制细胞增殖曲线。
2 结果与讨论 2.1 胶原蛋白肽的制备完整的胶原是具有三螺旋结构的原胶原分子,形成独特的纤维结构,交织成坚固的网络,提供结缔组织的承受力。这样的胶原是难以溶解的,也无法覆层至羟基磷灰石材料表面,因此必须对其进行降解,为覆层提供材料。
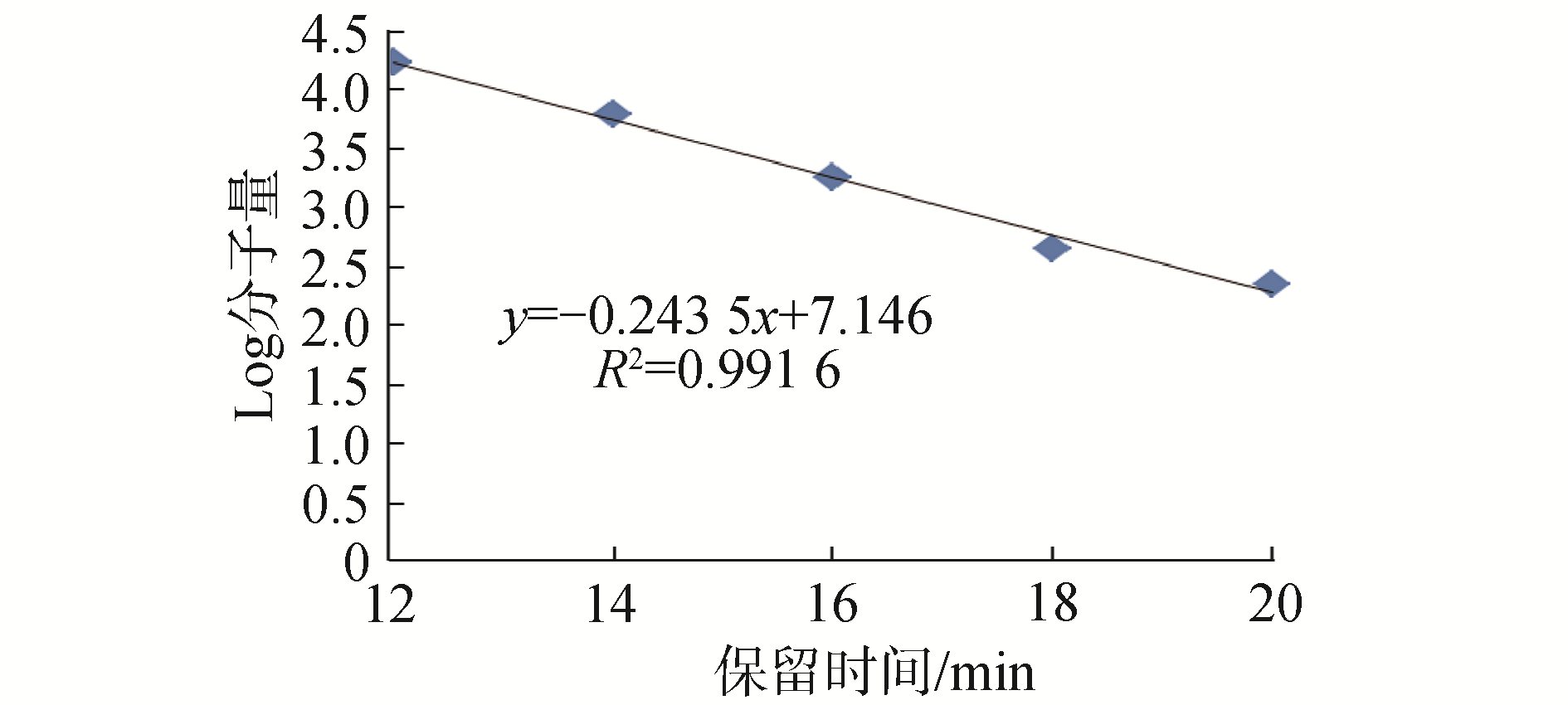
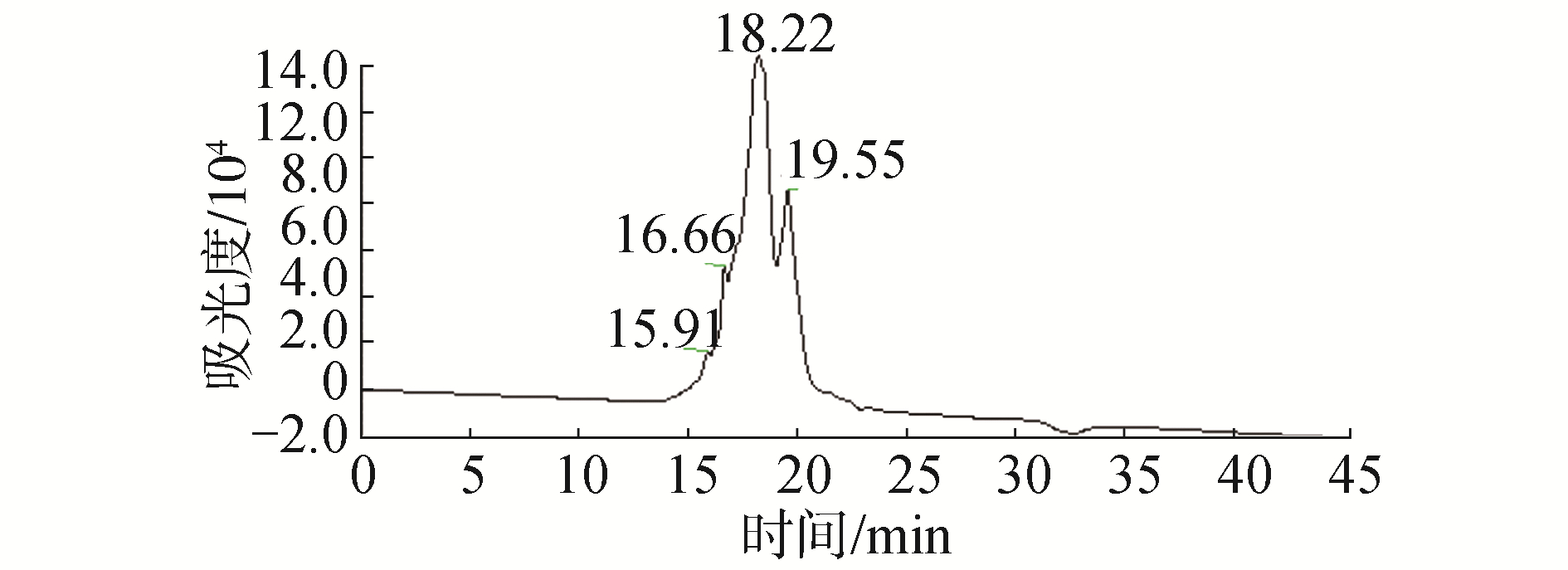
为实现胶原蛋白肽分子量可控均一,分别比较了胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶、木瓜蛋白酶、菠萝蛋白酶、碱性蛋白酶的酶解效果,在酶本身最适pH条件下,酶解至分子量不发生明显变化,检测其酶解后分子量分布(分子量计算依据图 1中的标准曲线),结果见表 1。从表中结果可以看出不同的酶对胶原蛋白的酶解效果不尽相同,然而均未能达到控制其分子量在200~5 000 Da的预期效果。胰蛋白酶酶解速度最快,1 h酶解结束,而碱性蛋白酶是这几种蛋白酶中酶解后分子量最小的。因此,将这2种最适pH为8.0的蛋白酶混合,经条件优化发现胰蛋白酶。碱性蛋白酶为2:5时,2种酶同时作用可以在1 h内将胶原蛋白酶解至200~5 000 Da(凝胶过滤色谱检测结果见图 2)。碱性蛋白酶酶切位点为Ala、Leu、Val、Tyr、Phe、Try,胰蛋白酶酶切位点为Arg、Lys,这2种酶的酶切位点无重叠,从而在酶解过程中协同作用,实现了快速高效酶解。
|
Download:
|
| 图 1 多肽分子量计算标准曲线 Fig. 1 The standard curve of peptide molecular weight | |
|
Download:
|
| 图 2 胶原蛋白肽凝胶过滤色谱分析 Fig. 2 The Gel Filtration Chromatogram of collagen peptide | |
| 表 1 酶解效果表 Table 1 Enzymolysis effect table |
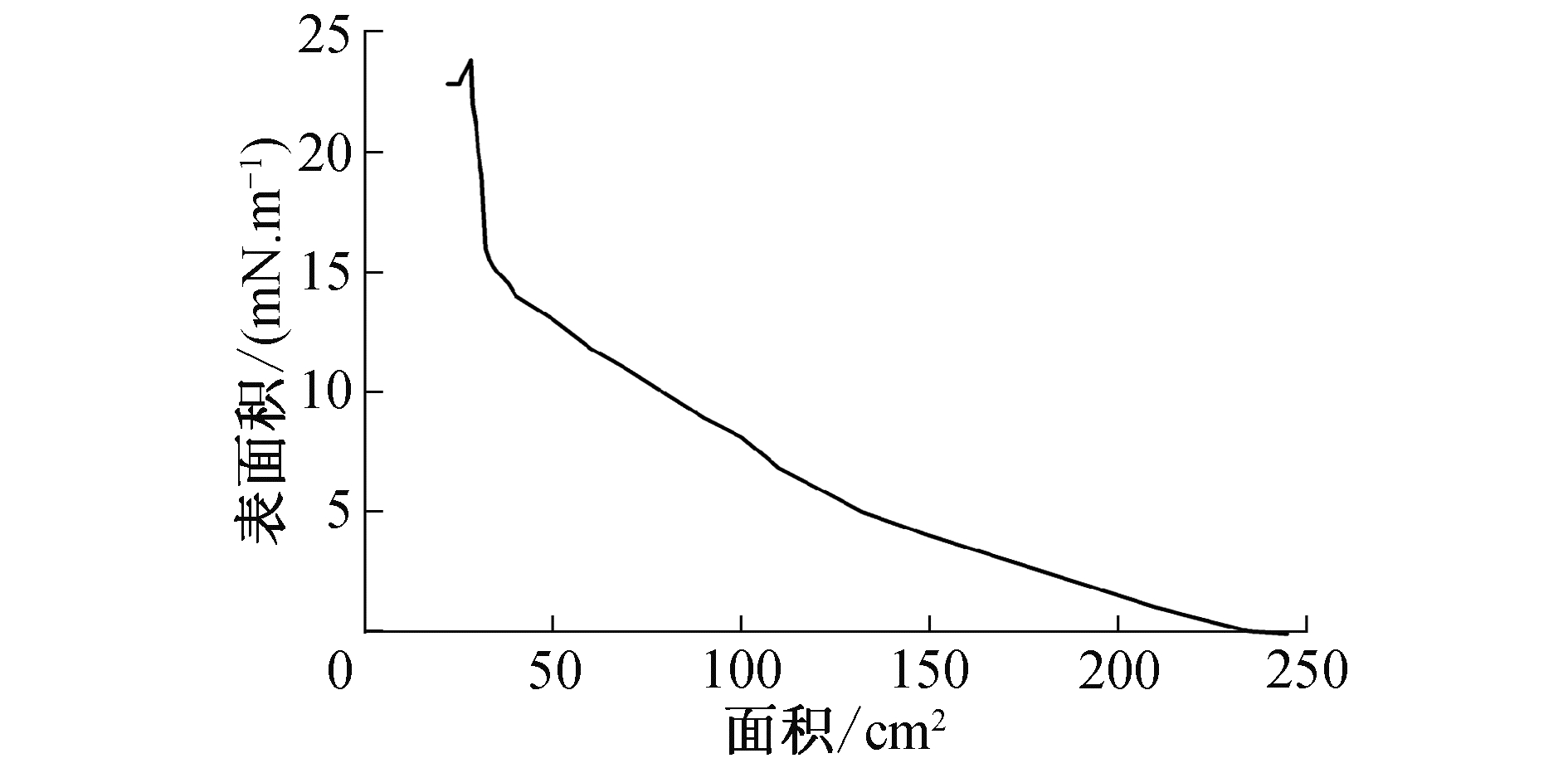
用LB膜分析仪研究了胶原蛋白肽LB膜的表面压-面积曲线,如图 3所示。当胶原蛋白肽氯仿溶液被滴加在亚相表面上,随着氯仿在亚相表面的铺散,胶原蛋白肽呈分散状态,分子间距较远,单分子所占面积大,呈现出LB膜制备过程中气相状态特点,表面压几乎为零。在氯仿溶剂挥发干净后,随着滑障的压缩胶原蛋白肽分子互相靠近,单分子所占面积变小,当分子间距离缩短至液相状态,可以检测到表面压开始缓缓上升。继续压缩,亚相表面上的胶原蛋白分子由液态向固态转变,分子间距快速减小,表面压快速上升,此时形成固相状态的单分子膜,分子之间排列紧密。继续压缩,可以使分子间距到达最小值,表面压升至最高,即为其崩溃压力,再压缩则形成的单分子层会瞬间崩溃。经图 3结果中可以看出,胶原蛋白肽的成膜过程符合标准朗格缪尔膜成膜过程的相关特性,其崩溃压力为23.8 mN/m,维持表面压为23 mN/m,可以得到稳定的胶原蛋白肽单分子层,实现LB膜的固相转移,制备胶原蛋白肽覆层羟基磷灰石材料。
|
Download:
|
| 图 3 面积-表面压图像 Fig. 3 Surface pressure/area isotherm graph | |
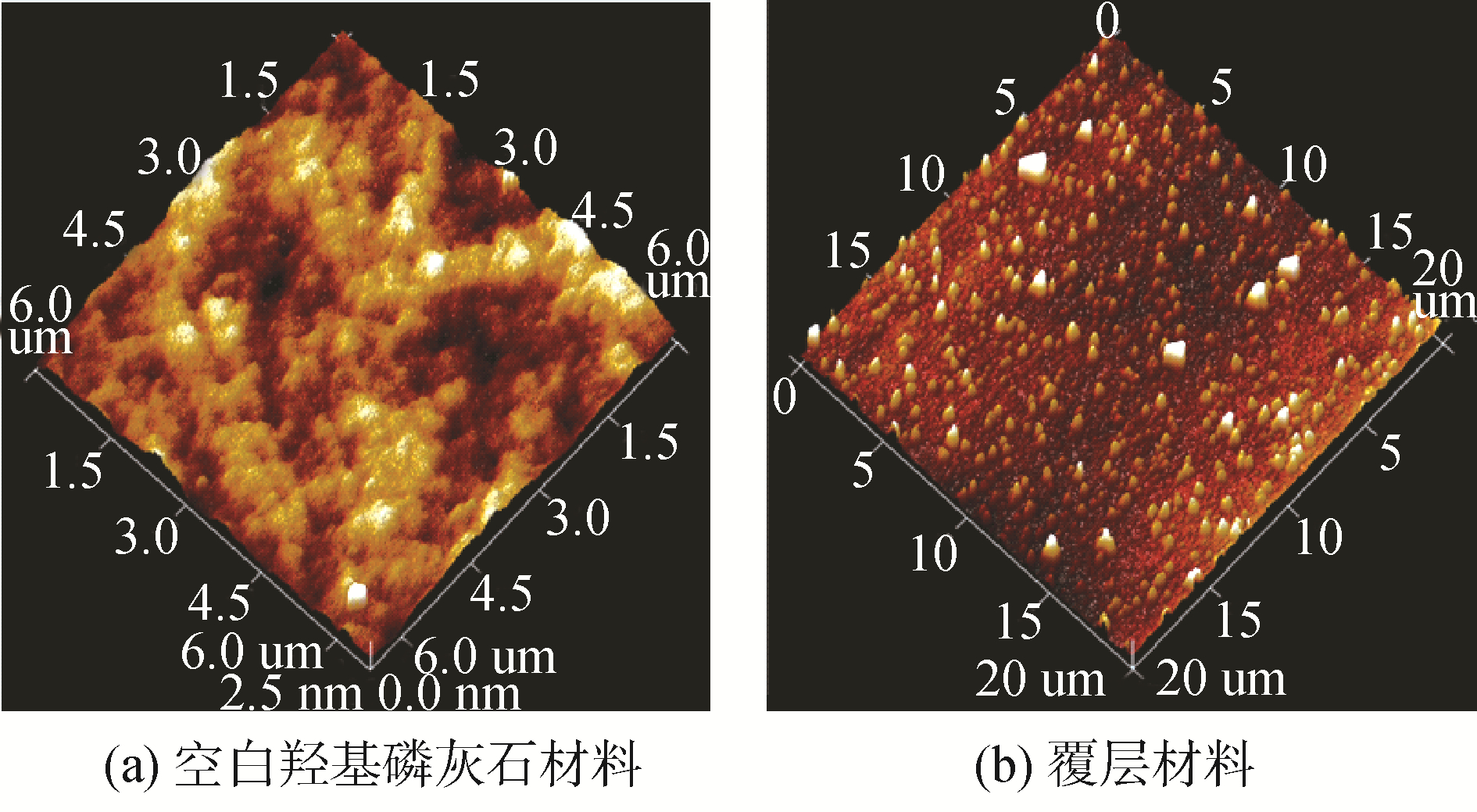
利用AFM对胶原蛋白肽覆层羟基磷灰石材料性质进行研究(结果见图 4)。从图 4中的AFM 3D图像中可以看出转移至羟基磷灰石表面上的胶原蛋白肽LB膜性质良好,形成的单分子层呈平铺状态,分子分散均匀,厚度相对均匀,经估算单层厚度约为3.1 nm,2层厚度为5.7 nm,3层为8.9 nm,4层为11.7 nm。通过软件测得单层胶原蛋白肽LB膜表面粗糙度Ra(轮廓算术平均偏差)为0.9 nm,表明膜的表虽不完全平坦,但相对均匀。这表明通过LB膜技术可以制备出胶原蛋白肽覆层的羟基磷灰石材料,并且可以根据需求制备单层、双层、多层的覆层材料,满足不同应用需求。
|
Download:
|
| 图 4 空白羟基磷灰石材料与覆层材料AFM 3D图像 Fig. 4 AFM 3D image (Blank HA and Collagen peptide HA) | |
通过用生理盐水对材料进行浸泡、多次冲洗,检测覆层4层羟基磷灰石材料中胶原蛋白肽的泄露,来评价生物覆层材料的稳定性。对收集的浸泡液、冲洗液浓缩100倍,通过微量Lowry法检测其蛋白浓度,在浸泡液中未检出胶原蛋白肽,冲洗液检测结果见表 2。从表中结果可以看出随着冲洗次数增多,泄露的胶原蛋白肽呈现先增加后减少的趋势,说明覆层的胶原蛋白肽会有一定的脱落,但不会一直脱落,经折算,脱落胶原蛋白肽总量仅占覆层总量的0.01%,因此制备的覆层材料是稳定可靠的。
| 表 2 冲洗液检测结果表 Table 2 The test result of washing fluid |
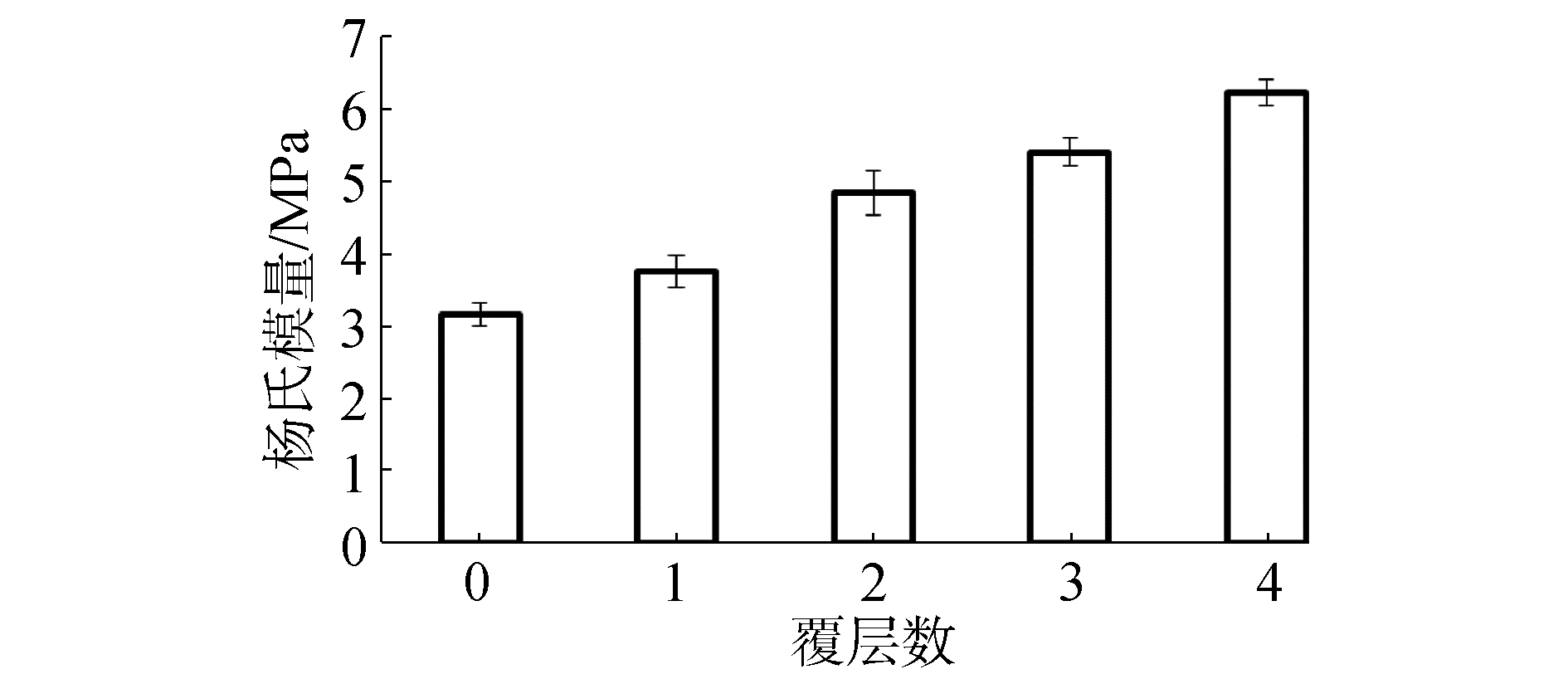
对羟基磷灰石和覆层材料的杨氏模量进行了测量,结果如图 5所示。空白的羟基磷灰石材料的杨氏模量为3.14±0.16 MPa,随着覆层层数的增加杨氏模量逐渐增加,最高可达6.21±0.18 MPa,说明胶原蛋白肽的覆层能够有效地改善羟基磷灰石材料的力学性能,提高其杨氏模量。
|
Download:
|
| 图 5 不同材料的杨氏模量 Fig. 5 Young's modulus of different materials | |
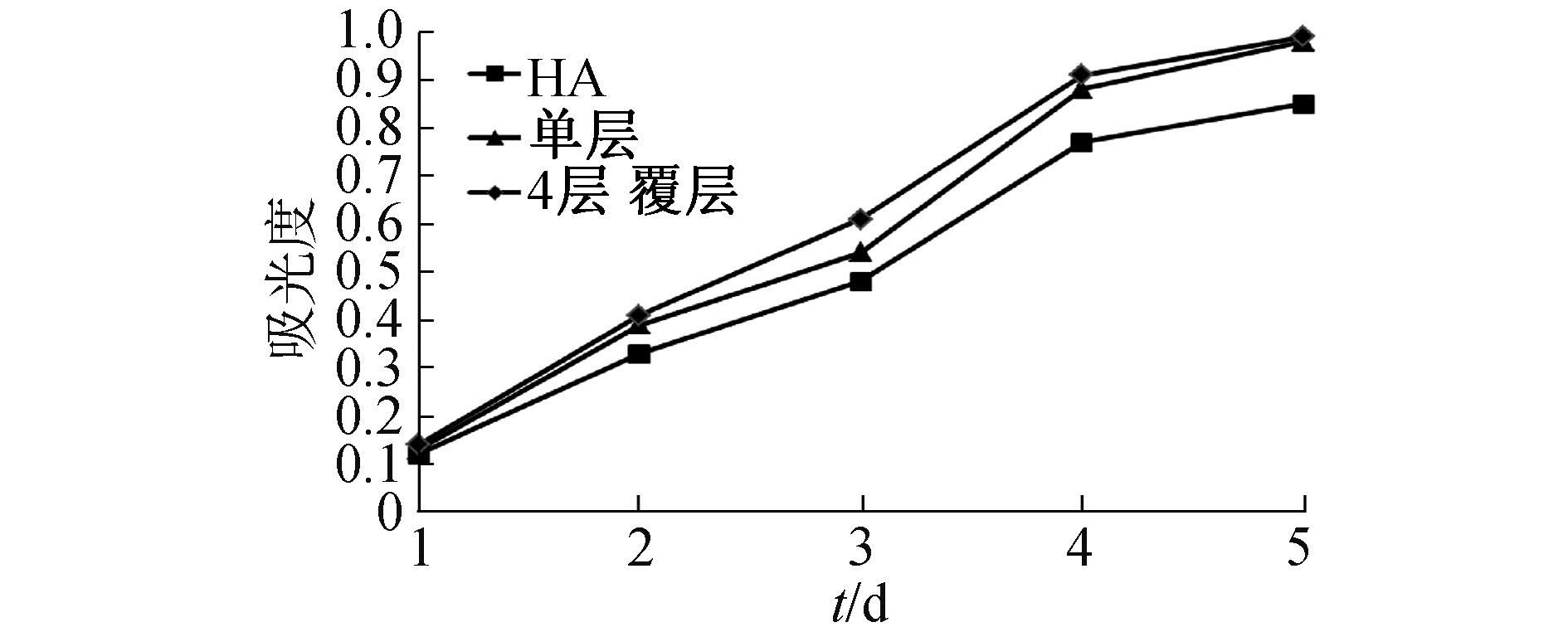
MC3T3-E1细胞在羟基磷灰石和覆层材料上培养5天的增殖情况见图 6。因结果类似,图中仅列出了单层和4层覆层材料的增殖结果,可以看出在覆层材料上MC3T3-E1细胞增殖要优于空白羟基磷灰石材料,表明所制覆层材料不仅无细胞毒性,而且因胶原蛋白肽的优良生物相容性,能一定程度上促进细胞增殖。所用的羟基磷灰石和胶原蛋白肽都是经过实践证明的生物相容性良好的材料,其对材料生物性能的提升作用是由其本身的生物相容性良好引起的,因此覆层层数对生物性能提升作用不明显。
|
Download:
|
| 图 6 不同材料细胞培养情况 Fig. 6 Cell proliferation rasults of different materials | |
1) 本文建立了一种制备胶原蛋白肽覆层材料的新方法,利用LB膜技术将胶原蛋白肽覆层至羟基磷灰石上,制备了一种新型覆层生物材料。
2) 通过碱性蛋白酶和胰蛋白酶复合作用实现了均一分子量胶原蛋白肽的制备。将胶原蛋白肽覆层至羟基磷灰石片上,通过AFM表征发现膜的表面平整,单层厚度约为3.1 nm。
3) 制备的材料性能稳定,能有效提高羟基磷灰石材料的力学性能,生物相容性良好,能促进细胞增殖。进一步可以通过化学交联提高覆层的稳定性,为新型医用生物材料开发提供借鉴。
| [1] |
胡堃, 刘斌. 骨移植材料发展趋势[J]. 生物骨科材料与临床研究, 2010, 7(3): 32-38. HU Kun, LIU Bin. Tendency of bone grafting materials development[J]. Orthopaedic biomechanics materials and clinical study, 2010, 7(3): 32-38. DOI:10.3969/j.issn.1672-5972.2010.03.010 (  0) 0)
|
| [2] |
年利伟, 赵建民, 刘瑞. 纳米羟基磷灰石复合人工骨的研究进展[J]. 内蒙古医科大学学报, 2015, 37(3): 274-277. NIAN Liwei, ZHAO Jianmin, LIU Rui. Exploratory development of nano-hydroxyapatite composite artificial bone[J]. Journal of Inner Mongolia Medical University, 2015, 37(3): 274-277. (  0) 0)
|
| [3] |
VON BURKERSRODA F, SCHEDL L, GÖPFERICH A. Why degradable polymers undergo surface erosion or bulk erosion[J]. Biomaterials, 2002, 23(21): 4221-4231. DOI:10.1016/S0142-9612(02)00170-9 (  0) 0)
|
| [4] |
SUCHANEK W, YOSHIMURA M. Processing and properties of hydroxyapatite-based biomaterials for use as hard tissue replacement implants[J]. Journal of materials research, 1998, 13(1): 94-117. DOI:10.1557/JMR.1998.0015 (  0) 0)
|
| [5] |
MURRAY M G S, WANG J, PONTON C B, et al. An improvement in processing of hydroxyapatite ceramics[J]. Journal of materials science, 1995, 30(12): 3061-3074. DOI:10.1007/BF01209218 (  0) 0)
|
| [6] |
牛宗伟, 张建华, 任升峰, 等. 羟基磷灰石人工骨研究进展与展望[J]. 硅酸盐通报, 2004, 23(6): 71-74. NIU Zongwei, ZHANG Jianhua, REN Shengfeng, et al. Research progress and prospect of hydroxyapatite artificial bone[J]. Bulletin of the Chinese ceramic society, 2004, 23(6): 71-74. DOI:10.3969/j.issn.1001-1625.2004.06.019 (  0) 0)
|
| [7] |
OOI C Y, HAMDI M, RAMESH S. Properties of hydroxyapatite produced by annealing of bovine bone[J]. Ceramics international, 2007, 33(7): 1171-1177. DOI:10.1016/j.ceramint.2006.04.001 (  0) 0)
|
| [8] |
WAHL D A, CZERNUSZKA J T. Collagen-hydroxyapatite composites for hard tissue repair[J]. European cells and materials, 2006, 11: 43-56. DOI:10.22203/eCM.v011a06 (  0) 0)
|
| [9] |
ZHU Xiaolong, EIBL O, SCHEIDELER L, et al. Characterization of nano hydroxyapatite/collagen surfaces and cellular behaviors[J]. Journal of biomedical materials research part A, 2006, 79(1): 114-127. (  0) 0)
|
| [10] |
雷雄心, 李赛娜, 康跻耀, 等. 牛煅烧骨/I型胶原复合骨修复材料制备及评价[J]. 过程工程学报, 2017, 17(2): 389-394. LEI Xiongxin, LI Saina, KANG Jiyao, et al. Preparation and evaluation of true bone ceramic/type I collagen composite bone repair materials[J]. The Chinese journal of process engineering, 2017, 17(2): 389-394. (  0) 0)
|
| [11] |
LI Qing, WANG Tong, ZHANG Guifeng, et al. A comparative evaluation of the mechanical properties of two calcium phosphate/collagen composite materials and their osteogenic effects on adipose-derived stem cells[J]. Stem cells international, 2016, 2016: 6409546. (  0) 0)
|
| [12] |
李赛娜, 康跻耀, 高建萍, 等. 胶原涂层对3D打印种植体表面生物相容性的影响[J]. 中国组织工程研究, 2017, 21(10): 1558-1564. LI Saina, KANG Jiyao, GAO Jianping, et al. Influence of collagen coating on the biocompatibility of three-dimensional printed implants[J]. Chinese journal of tissue engineering research, 2017, 21(10): 1558-1564. DOI:10.3969/j.issn.2095-4344.2017.10.014 (  0) 0)
|
| [13] |
LI Xiaoming, FENG Qingling, CUI Fuzhai. In vitro degradation of porous nano-hydroxyapatite/collagen/PLLA scaffold reinforced by chitin fibres[J]. Materials science and engineering:C, 2006, 26(4): 716-720. DOI:10.1016/j.msec.2005.06.062 (  0) 0)
|
| [14] |
GURFIDAN L, OZMEN M, ATACAN K, et al. Preparation and characterization of calix[6] arene Langmuir-Blodgett thin film[J]. Thin solid films, 2012, 520(19): 6238-6242. DOI:10.1016/j.tsf.2012.05.080 (  0) 0)
|
| [15] |
CHEN Qibin, XU Shouhong, LI Rong, et al. Network structure of collagen layers absorbed on LB film[J]. Journal of colloid and interface science, 2007, 316(1): 1-9. DOI:10.1016/j.jcis.2007.07.059 (  0) 0)
|
| [16] |
李雯露, 孔英俊, 康跻耀, 等. DEAE-琼脂糖LB膜的制备与表征[J]. 生物学杂志, 2017, 34(1): 89-93. LI Wenlu, KONG Yingjun, KANG Jiyao, et al. Preparation and characterization of DEAE-agarose Langmuir-Blodgett films[J]. Journal of biology, 2017, 34(1): 89-93. DOI:10.3969/j.issn.2095-1736.2017.01.089 (  0) 0)
|
 2019, Vol. 40
2019, Vol. 40


