文章信息
- 袁颂东, 杨灿星, 江国栋, 熊剑, 艾青, 黄仁忠
- YUAN Song-dong, YANG Can-xing, JIANG Guo-dong, XIONG Jian, AI Qing, HUANG Ren-zhong
- 锂离子电池高镍三元材料的研究进展
- Research progress in nickel-rich ternary materials for lithium-ion batteries
- 材料工程, 2019, 47(10): 1-9
- Journal of Materials Engineering, 2019, 47(10): 1-9.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2018.001301
-
文章历史
- 收稿日期: 2018-11-05
- 修订日期: 2019-03-18
2. 催化材料湖北省协同创新中心, 武汉 430068
2. Synergistic Innovation Center of Catalysis of Hubei Province, Wuhan 430068, China
随着煤、石油等不可再生能源过度开采导致的资源匮乏,以及这些资源的使用给我们的生存环境带来的巨大污染,人们逐渐关注具有可持续发展和环境友好性的新能源[1]。电能是目前广泛应用的清洁能源。随着城镇化的发展,人们对交通工具环境友好性的要求会越来越高,环保型新能源车如电动车将成为人们出行的首要选择。锂离子电池因为成本低廉、环保低毒、无记忆效应和能量密度高等优势逐渐受到了广大学者的关注。但是,作为动力电池而言,锂离子电池正极材料必须拥有高比容量。现在的锂离子电池所用正极材料主要包括磷酸铁锂及三元材料,磷酸铁锂具有安全性高、循环寿命长等特点,但导电性差,实际比容量低,仅为140mAh/g,无法完全满足动力电池对能量密度提出的高要求。现在大多数厂家采用的主要是333, 523型三元材料,少量厂家采用622型,相比于高镍三元材料,它们的主要优点是循环稳定性好,但实际比容量相对较低,能量密度在230Wh/kg以下,由于电动汽车要求的里程更长,333,523及622型三元正极材料还达不到电动汽车对相应能量密度的要求,因此国内外厂家纷纷开发具有更高比容量的高镍三元作为锂离子正极材料,并辅以硅碳为对应负极,使能量密度有望突破300Wh/kg。高镍三元材料不但具有工作电压高(≈3.8V vs Li/Li+)[2]、成本低[3]、环保低毒等特性,其能量密度也比传统的正极材料如LiCoO2,Li2Mn2O4和LiFePO4等高。目前,制备三元材料的主流方法是共沉淀-高温固相法,虽然镍含量的提高将导致高镍三元材料的热稳定性和循环性比低镍三元材料差,但通过对高镍三元材料进行简单的掺杂修饰和表面包覆改性,可改善上述缺陷,使高镍三元正极材料满足高能量密度要求的同时更适于锂离子电池的广泛应用。
1 高镍三元材料的特性 1.1 高镍三元材料的晶体结构特性高镍三元材料的结构式为LiNixCoyMzO2(x≥0.6, M为Mn或Al),其中含Mn的高镍三元材料在本文中根据Ni,Co,Mn的比例简称NCMXYZ,如LiNi0.6Co0.2Mn0.2O2简称NCM622,LiNi0.8Co0.1Mn0.1O2简称NCM811,含铝的LiNi0.85Co0.10Al0.05O2在本文中简称NCA。高镍三元材料属于六方层状结构,其空间点群类似于α-NaFeO2的R3m。Li+和过渡金属离子分别占据3a(0 0 0)和3b(0 0 1/2)位置,而O2-在6c(0 0 z)位置。其中6c位置上的O为立方紧密堆积,3b位置的过渡金属离子和3a位置的Li+分别交替占据其八面体空隙,在(1 1 1)晶面上呈层状排列[4-5]。在高镍三元材料中,Co和Al为+3价,Mn为+4价,而Ni既有+2价,也有+3价。过渡金属元素具有三元协同作用即过渡金属元素相互协调的作用,其中,Ni是主要的电化学活性物质,有助于提高材料的容量;Co的作用是提高材料的倍率性能,减少阳离子混排,降低阻抗值,提高电导率;Mn是非电化学活性物质,主要起骨架支撑作用,能够使锂离子嵌入和脱嵌时保持晶体结构不变[6-8]。但是,过多的Ni2+会使材料的循环性能恶化,也会使阳离子混排加剧;过多的Co会使可逆嵌锂容量下降,成本增加;Mn含量太高容易出现尖晶石相而破坏材料的层状结构[9]。
1.2 高镍三元材料的电化学特性高镍三元材料是由LiCoO2掺杂演变而来的,理论比容量约为280mAh/g。由于三元材料在充放电过程中,锂离子从正极材料中脱出会使结构塌陷,得失电子数一般在0.5~0.7之间,这样使高镍三元材料的实际放电容量低于理论比容量,只有180~220mAh/g,目前高镍三元材料最高实际放电容量接近240mAh/g[10]。当然,高镍三元材料的实际容量与充放电的截止电压有关,通常电压范围越宽,实际放电容量越高,一般高镍三元材料的截止电压在2.5~4.8V之间取值。在充电过程中,Ni2+先氧化生成Ni3+,Ni3+又优先于Co3+生成+4价,所以镍含量越高,三元材料的实际放电比容量越高,其工作电压就越低[11-12]。但由于Ni3+/4+和Co3+/4+与O有能带重叠,所以在高脱锂状态下,晶格中的O会从晶格中脱出,造成高氧化态的过渡金属离子趋于形成+3价而导致循环稳定性变差。高镍三元材料的电化学性能也与阳离子(Li+/Ni2+)混排及两组劈裂峰有关,阳离子混排可以用c/a值和I003/104表征,当c/a>4.9以及I003/104>1.2时,表明阳离子混排程度越低[13]。而006/102和108/110两组劈裂峰的劈裂程度越大,表明α-NaFeO2型层状结构越完整,锂离子越容易嵌入和脱出,材料的可逆容量也就越高[14]。因此,在制备NCM和NCA材料时,保持较低的Li+/Ni2+的混排程度和较完整的层状结构有利于提高高镍材料的电化学性能。
相对于低镍材料而言,高镍材料在充放电过程容易出现相变的问题。NCM和NCA在脱嵌锂的过程中会发生相变,通常相变峰在4.2V左右[15-16],采用包覆的方法即可有效抑制相变。一般通过循环伏安能明显看出包覆有效抑制高镍三元相变,从而提高了电池的循环性能,尤其是高电压下的循环性能。
2 高镍三元材料的制备 2.1 高温固相法高温固相合成是指在高温下,固体界面间经过接触、反应、成核、晶体生长而生成一大批复合氧化物,如含氧酸盐类、二元或多元陶瓷化合物等的方法。高温固相法是一种传统的制粉工艺,虽然有其固有的缺点,如能耗大、效率低、粉体不够细、易混入杂质等,由于该法制备的粉体颗粒无团聚、填充性好、成本低、产量大、制备工艺简单等优点,迄今仍是常用的方法。高温固相法制备三元材料主要是将镍钴锰的化合物(主要为氧化物、硫酸盐、硝酸盐和醋酸盐)与锂盐(主要为氢氧化锂、碳酸锂和硝酸锂)按照一定比例混合后高温煅烧得到高镍材料。Xiao等[17]采用高温固相法,将Ni(CH3COO)2,Co(CH3COO)2和Mn(CH3COO)2作为原料探究预烧、锂源种类(CH3COO Li·2H2O,Li2CO3,LiOH·H2O和LiNO3)、锂源的加入方式和煅烧温度对制备NCM811的电化学性能的影响。结果发现在550℃空气中预烧8h,研磨后加碳酸锂作为锂源在O2中800℃煅烧24h制备的NCM811电化学性能最好。在0.2C倍率下,首次放电容量为200.8mAh/g,20次循环后放电容量还有188.1mAh/g。
2.2 水热法水热法是指在一个封闭的体系(通常为高压反应釜)中,采用水溶液或其他溶剂作为反应体系,通过对反应体系加热、加压(或自生蒸汽压)创造一个相对高温、高压的反应环境,使得通常难溶或不溶的物质溶解并且重结晶而进行无机合成与材料处理的一种有效方法。水热法克服了高温制备不可避免的硬团聚,制备的产品具有粉末(纳米级)、纯度高、分散性好、均匀、分布窄、无团聚、晶型好、形状可控和利于环境净化等特点。Wang等[18]将Ni(CH3COO)2·4H2O,Co(CH3COO)2·4H2O,Mn(CH3COO)2·4H2O,CTAB和草酸溶于乙二醇水溶液,置于高压反应釜中于200℃反应10h,过滤干燥后与LiNO3混合并在850℃及O2氛围下煅烧12h,制备出单晶颗粒800nm的LiNi0.6Co0.2Mn0.2O2。在2.8~4.3V,0.2C倍率条件下进行电化学储能测试,首次放电容量为183.7mAh/g,在10C倍率条件下,首次放电容量依旧有153.6mAh/g。
2.3 溶胶凝胶法溶胶凝胶法是一种软化学方法,所制备的材料具有均匀性高、合成温度低等特点,解决了高温固相法的反应物扩散慢,组成均匀性不好等问题。Lu等[19]将锂、镍、钴、锰的硝酸盐与柠檬酸按照1.05:0.8:0.1:0.1:1的比例溶于水中,用氨水调节溶液pH值为7,于80℃蒸发形成湿凝胶,干燥后于480℃预烧5h,于750℃煅烧15h得到LiNi0.8Co0.1Mn0.1O2。该材料在2.5~4.3V的电压和0.5C倍率下,首次放电容量高达200.1mAh/g,50次循环后容量保持率为82.2%。作者认为其较优异的电化学性能主要因为采用该法制备的材料中Li+/Ni2+混排程度(2.44%)小于共沉淀法制备的材料(4.02%)。
2.4 共沉淀法共沉淀法一般是向原料溶液中添加适当的沉淀剂,使溶液中已经混合均匀的各组分按化学计量比共同沉淀出来,或者在溶液中先沉淀反应生成前驱体,再将前驱体煅烧分解制备出目标产物。采用该工艺可以通过调整实验条件来对产物的粒度、形貌进行调控,产物中有效组分可达到原子、分子级别的均匀混合,设备简单,操作容易。共沉淀法根据沉淀剂不同,又可以分为氢氧化物共沉淀法[20]、碳酸盐共沉淀法[21]和草酸盐共沉淀法[22]。共沉淀法是制备三元材料的主流方法,不但重现性好,而且制备出来的材料振实密度高。Liang等[20]以MSO4(M为Ni,Co和Mn)为金属盐,NaOH为沉淀剂,NH3·H2O为络合剂获得了共沉淀法合成三元材料的最佳条件,即pH值为11.2,氨水浓度为0.6mol/L,转速为800r/min,水浴温度为55℃,820℃高温煅烧,该条件下制备出来的Ni0.6Co0.2Mn0.2(OH)2振实密度为1.94g/cm3,LiNi0.6Co0.2Mn0.2O2振实密度为2.59g/cm3。相比于氢氧化物共沉淀,碳酸盐和草酸盐共沉淀制备方法比较少见,Mezaal等[21]用NiSO4,CoSO4和MnSO4作为过渡金属盐溶液,Na2CO3作为沉淀剂,控制反应温度和pH值分别为60℃和11,陈化1h后逐滴加入MnSO4(浓度分别为0.1,0.2mol/L和0.3mol/L)溶液,陈化18h,整个反应在N2保护下进行。前驱体与Li2CO3及Na2CO3按化学计量比混合并在空气氛围下煅烧,煅烧程序为450℃/5h,850℃/12h。XRD,XPS和TEM表征结果证明最后产物是以NCM811(空间点群R3m)为核,Li2MnO3(空间点群C2/m)为壳的高镍三元材料Li1.15Na0.05(Ni0.8Co0.1Mn0.1)core(Mn0.1)shellO2。由于壳Li2MnO3的热稳定性较好,该材料的充电截止电压(4.7V)远高于一般的三元材料(4.3V),在20mA/g电流密度下放电容量高达255mAh/g。Wu等[22]先将H2C2O4溶液在强烈搅拌下缓慢加入CoSO4溶液中形成分散液,接着将Ni,Co和Al的混合硫酸盐溶液逐滴加入上述溶液中,再搅拌2h过滤干燥得到MC2O4微米棒前驱体,最后前驱体与LiOH混合在550℃预烧5h,780℃煅烧15h可得到NCA微米棒。与传统的共沉淀法制备的NCA微米球相比,在2.7~4.3V,0.1C时NCA微米棒的首次放电容量高达218mAh/g,库仑效率为92%;而NCA微米球的首次放电容量仅为195mAh/g,库仑效率也只有86%。
2.5 其他方法除了上述几种常见的制备方法外,对于高镍三元材料的制备,还有燃烧法[23]、红外辅助合成法[24]和喷雾热解[25]等方法。Ahn等[23]采用燃烧法制备出了NCM622,将LiCH3COO·2H2O,Ni(CH3COO)2·4H2O,Ni(NO3)3·6H2O,Co(CH3COO)2·4H2O,Mn(CH3COO)2·4H2O和尿素溶于水中,在80℃干燥24h,随后在130,350℃和700~1000℃区间于空气中分别煅烧1,5h和12h。发现最后的煅烧温度为800℃时,产物NCM622中的Ni3+含量(0.69)与理论值(0.67)比较一致,具有较好的层状结构以及低的阳离子混排。Li等[25]采用喷雾热解法制备出了Ni0.8Co0.1Mn0.1O1.1,再混锂煅烧得到NCM811。喷雾热解法具体如下:先将Ni,Co,Mn的二价氯化物按8:1:1的摩尔比配成0.5mol/L的溶液,使用1.75MHz超声雾化器对溶液进行雾化,液滴流通过氧气运送到垂直反应器中,流速为5L/min,喷雾热解的温度为750℃,产品在反应器出口收集。制备的NCM811具有优异的循环性能,在2.8~4.3V和1C的条件下,100次循环后容量保持率高达95.6%。
3 高镍三元材料的改性 3.1 离子掺杂高镍三元材料的离子掺杂一般选择离子半径相近的离子掺杂,通过引入离子可以稳定层状结构[26],改善材料的电化学性能,尤其是热稳定性。根据掺杂元素的种类可以分为单元素掺杂和多元素掺杂,单元素掺杂根据掺杂离子所带电荷的不同又可以分为阳离子掺杂和阴离子掺杂。
3.1.1 阳离子掺杂阳离子掺杂主要有Mg[27],Na[28]等,不同元素的掺杂,作用也有所不同。Huang等[27]将NCA前驱体、MgNO3·6H2O和LiOH·H2O混合高温煅烧制备了Mg掺杂的NCA。通过XRD分析可知,Mg掺杂NCA的空间点群依然是六方层状结构,并且没有其他杂相的出现。由(003)和(110)两个峰可以看出,随着Mg掺杂量的增大,NCA的(003)和(110)峰所在位置往低角度偏移,表明c和a值随着Mg掺杂量的增大而增大。分析还发现随着Mg掺杂量的增大,Li+的迁移具有更高的活化能,而且Mg的掺杂可以抑制相变,从而减少掉粉和容量衰减。Xie等[28]用少量的Na2CO3替代一小部分LiOH与NCA前驱体混合煅烧得到Na掺杂的NCA。研究发现在2.8~4.3V,1C的倍率下,Na掺杂的NCA首次放电容量为170.1mAh/g,虽然较原料(175.6mAh/g)有所下降,但是Li0.99Na0.01Ni0.85Co0.10Al0.05O2的循环性能较好,200次循环后容量保持率有90.71%,而原料只有80.46%。电化学性能的提高得益于Na的掺杂,Na掺杂增大了Li层的层间距,降低了Li+的迁移活化能,降低了Li+/Ni2+混排以及增强了结构稳定性。
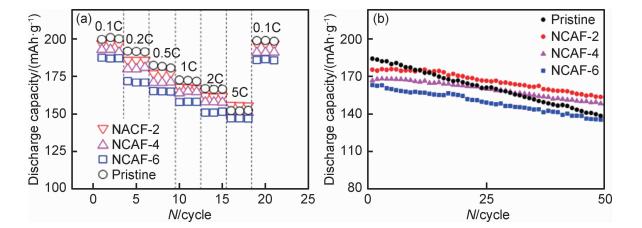
3.1.2 阴离子掺杂阴离子掺杂主要有F[29-30],还有比较少见的B[31]。由于F的电负性远大于O,M—F的键能强于M—O,所以抑制了过渡金属的溶解。F掺杂高镍材料的结构稳定性较原料有所提高,热稳定性也随之提高。Li等[29]将NCA乙醇分散液和NH4F乙醇溶液混合后持续搅拌5h,干燥研磨后于420℃在空气氛围中煅烧5h,得到F掺杂的NCA。图 1为F掺杂NCA和原料的倍率性能和循环性能。由图 1可以看出,在55℃高温下,虽然F掺杂NCA的倍率性能较原料差,但是F掺杂NCA循环稳定性优于原料,尤其是4%摩尔分数F掺杂NCA,在2.8~4.3V,2C下,50次循环后容量保持率为92.1%,而原料仅为77.2%。电化学性能的提升得益于F掺杂可以抑制循环过程中的阻抗上升以及正极材料的溶解。Zhu等[30]也对NCA进行了F掺杂,不同的是Zhu等只是对NCA表面进行F掺杂,将NH4F和商业NCA按原子比1:100混合研磨30min后高温煅烧2h,即可得到表面F掺杂NCA。2.8~4.3V,0.1C倍率条件下,表面F掺杂NCA的可逆容量高达220.5mAh/g,80次循环后容量保持率为93.6%。不但电化学性能得到提升,材料的储存性能也得到较大提升,在10%,40%和60%湿度的空气中放置12h后,原料表面的残锂化合物分别为4.269×10-4(质量分数,下同),7.145×10-4和1.555×10-3,而F掺杂的NCA表面残锂量仅仅只有2.446×10-4,2.746×10-4和8.245×10-4。表面F掺杂可以使NCA表面M—O键转变为M—F键,不但避免HF破坏M—O键,而且抑制了NCA与空气中的H2O和CO2的副反应,从而提高电化学储能性能。Chen等[31]对NCA材料进行了B掺杂处理,先将NCA前驱体和H3BO3的混合水溶液80℃搅拌蒸干,之后再230r/min的转速下球磨2h,最后高温煅烧可得到B掺杂NCA。在55℃,2.8~4.3V,2C条件下,原料首次放电容量有196.8mAh/g,最高可逆容量达到了199.6mAh/g,100次循环后容量仅有146.4mAh/g;而B掺杂NCA虽然首次放电容量较原料略低,只有182.2mAh/g,最高可逆容量达到了195.2mAh/g,但是100次循环后容量为181.4mAh/g,容量基本没有衰减。B掺杂NCA后,材料高温性能得到极大改善,主要由于B掺杂抑制了SEI层增厚和裂纹产生。
多元素掺杂一般为两种或三种元素共同掺杂,有Mg-F共掺杂[32],Al-Fe共掺杂[33]。Chen等[32]采用共沉淀法制备出了Ni0.6Co0.2Mn0.11Mg0.09(OH)2,随后与Li2CO3和LiF混合高温煅烧制备出了LiNi0.6Co0.2Mn0.11Mg0.09O1.96F0.04。在0.2C充放电倍率和2.8~4.4V条件下,该材料的首次充放电比容量为189.7mAh/g,库仑效率高达98.6%,100次循环后容量保持率为96.3%。EIS测试表明,Mg-F共掺杂降低了电荷传输电阻,提高了反应动力学,这是材料有高倍率性能的主要原因。EL mofid等[33]以LiNO3,Ni(NO3)2,Co(NO3)2,Mn(NO3)2,Al(NO3)3和Fe(NO3)3为原料,以蔗糖为燃料,采用自燃烧法合成了LiNi0.6Mn0.2Co0.15Al0.025Fe0.025O2。材料在2.5~ 4.4V和0.05C的条件下,首次放电容量为189mAh/g,而原料仅为155mAh/g。该材料在高倍率下的循环性能较为优异,0.2C100次循环后容量保持为75.4%,1C100次循环后容量保持率为61.4%。
3.2 表面包覆当高镍三元材料暴露于潮湿环境中时,材料表面容易吸收空气中的H2O和CO2,生成LiOH和Li2CO3等杂质,严重影响其电化学性能。对于高镍三元材料而言,表面包覆是最常用的一种改性方法。表面包覆不但能将HF与NCM隔绝开来,防止HF对NCM的腐蚀,而且避免电解液与主体材料的直接接触进而发生一系列反应,防止过渡金属的溶解。此外,表面包覆有降低阳离子混排和抑制相变的作用。常用的表面包覆剂有氧化物[34-36]、磷酸盐[38-39]、氟化物[40-42]、锂盐[43-45]和导电材料[46-49]。此外,还有一些不常见的包覆材料,如MoS2和聚乙烯吡咯烷酮等[50-53]。
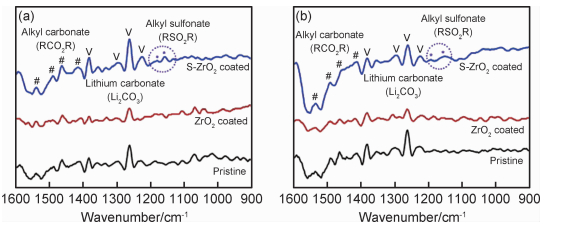
3.2.1 氧化物氧化物包覆三元材料是最常见的一种包覆方法,常用的有金属氧化物Co3O4[34],ZrO2[35]和非金属氧化物SiO2[36]。Woo等[35]合成了硫酸化ZrO2(S-ZrO2)包覆NCM811材料。该材料在60℃高温下、1C倍率条件下50次循环后容量保持率为88.9%,ZrO2包覆NCM811为79.2%,而原料仅为64.9%。通过红外光谱(图 2)检测发现,60℃循环1次和50次后,S-ZrO2包覆NCM811电极材料在1180cm-1和1157cm-1处出现了RSO2R官能团。S-ZrO2包覆NCM811高温循环稳定性优异的原因不仅仅由于S-ZrO2隔绝了主体材料和电解液从而避免两者的副反应,而且由于S-ZrO2在活性材料表面形成了更加稳定的SEI膜。Tao等[34]采用聚乙烯吡咯烷酮(PVP)辅助法合成出了Co3O4包覆NCM622。材料的储存性能极为优异,空气中储存90d后,在2.8~4.6V,0.1C的放电容量由209.5mAh/g仅降到198.6mAh/g,原料则由206.4mAh/g降到177.8mAh/g。储存性能的提高主要由于Co3O4包覆层防止NCM622表面形成非电化学活性的残锂化合物Li2CO3和LiOH。
包覆三元材料的磷酸盐一般为Li3PO4[37]和CoPO4[38]。磷酸盐的包覆方法比较单一,主要将磷酸盐(通常为(NH4)2HPO4和NH4H2PO4)和金属盐混合制备成溶胶后,接着加入高镍三元材料,在搅拌条件下蒸干溶剂或者过滤,最后于700℃高温煅烧即可得到磷酸盐包覆的高镍三元材料。Park等[38]探究了不同磷酸盐及其含量对Li1.0Ni0.91Co0.06Mn0.03O2的电化学性能的影响。结果发现,Al/P(1:0.5)包覆的材料表面残锂化合物的量最少,为2.037×10-3;虽然Co/P(1:1)包覆在降低残锂化合物的效果上不如Al/P(1:0.5)包覆,残锂化合物的量为2.151×10-3,但是材料的电化学性能比Al/P和Fe/P包覆要优异,在1C倍率下,首次放电容量比原料高12mAh/g,50次循环后,容量保持率为86.3%,而原料仅为65.4%。与上述团队不同,Tang等[37]巧妙地利用高镍三元材料表面固有的残锂化合物与NH4H2PO4反应制备出了Li3PO4包覆LiNi0.815Co0.15Al0.035O2材料。研究发现,不管在10min还是一星期后测试pH值,随着NH4H2PO4量的增加,材料的pH值逐渐降低,这也间接地说明高镍三元材料表面的残锂化合物的量在逐渐减少。作者认为高温循环性能的提高得益于NH4H2PO4和残锂化合物反应生成Li3PO4不但降低残锂量,而且多孔Li3PO4抑制HF与高镍三元的副反应以及提高了Li+传输速率。
3.2.3 氟化物氟化物包覆三元材料一般用得比较少,通常有FeF3[39],AlF3[40]和LiF[41]。Lee等[40]将AlF3和NCA在3400r/min下混合5min后得到了AlF3包覆的NCA,AlF3涂层厚度为50nm。该材料在中间相碳微球作为负极材料的全电池中表现出优异的循环性能,在25℃及3.0~4.2V和1C充放电条件下,1000次超长循环后容量保持率为86.2%,而原料为66.5%,在55℃,500次长循环下,容量保持率为55.9%,而原料仅为11.7%。Liu等[39]采用重结晶的方法在NCA表面包覆了10~20nm厚的FeF3。FeF3涂层可以提高NCA的热稳定,差示扫描量热法(DSC)分析结果显示原料在229.3℃有放热峰,放热量为536.8J/g,而FeF3包覆后的NCA在236.7℃有放热峰,放热量为454.3J/g。放热峰和放热量与阴极材料分解的氧和电解液的副反应有关,FeF3涂层阻止NCA与电解液直接接触,从而抑制Ni4+的反应和氧的释放。Xiong等[41]通过搅拌和超声的方式将NCM811分散于NH4F的水溶液中,干燥后在300℃空气中退火3h得LiF包覆的NCM811。在电压2.8~4.3V,2C倍率下,原料在200次循环后,容量损失28.2%,而包覆了LiF的NCM811在200次循环后容量仅损失17.8%。LiF涂层可以提高Li+传输速率,随着循环次数的增加,LiF包覆的NCM811可以降低阻抗。LiF可以减缓高脱锂Li1-xNi0.8Co0.1Mn0.1O2与电解液的反应,进而抑制了LixPOFy等阻碍Li+迁移的化合物生成,提高材料的Li+传输速率。
3.2.4 锂盐包覆三元材料的锂盐根据作用可以分为两类:第一类为电化学活性材料,主要作用在不降低容量的同时抑制高镍三元材料与HF的副反应,如NCM111[42],此外,现在研究较活跃的浓度梯度材料也属于电化学活性材料[43];第二类为快离子导体,主要作用是提高Li+的传输速率,如常用的锂盐有Li1.3Al0.3Ti1.7(PO4)3[44]。Yang等[42]在NCA表面包覆了电化学活性物质NCM111,不但没有降低原料的放电容量,而且提高了材料的电化学性能。图 3(a)为NCM111包覆NCA前后在0.5C和1C倍率的循环性能,在2.8~4.25V以及分别在0.5C和1C倍率放电条件下,200次循环后NCM111包覆的NCA容量保持率为88.5%,而原料的容量保持率为84.7%;NCM111包覆的NCA在每周循环过程中库仑效率基本为100%,而原料在60次循环后库仑效率逐渐下降,最后仅为90%左右。Choi等[44]采用溶胶凝胶法将NASICON型Li+导体Li1.3Al0.3Ti1.7(PO4)3(LATP)包覆在NCM622表面,提高了材料的倍率性能。图 3(b)为LATP包覆NCM622的Li+扩散系数,恒电流间歇滴定技术(GITT)发现,不管放电深度如何,LATP包覆的NCM622材料中Li+化学扩散系数总体比原料要高,尤其是0.5%质量分数LATP包覆的NCM622,在放电深度20%以后,化学扩散系数总是高于原料一个数量级。

|
图 3 NCM111包覆NCA前后在2.8~4.25V和0.5C,1C倍率条件下的循环性能图[42](a)和由GITT数据得出LATP包覆NCM622的Li+化学扩散系数[44](b) Fig. 3 Cycle performance diagram of NCM111 coated-NCA before and after 2.8-4.25V under charging at 0.5C and discharging at 1C[42](a) and the Li+ chemical diffusion coefficient of LATP coated-NCM622 obtained from GITT data[44](b) |
最近几年,人们逐渐将包覆材料由无机盐过渡到导电材料,发现导电材料包覆对电极材料的电化学性能有较大影响。本团队为了解决LiFePO4和红磷的导电性问题,通过包覆还原氧化石墨烯(rGO),极大提高了材料的导电性[54-55],同时也开展了rGO包覆高镍三元的研究。导电材料可以根据其导电功能分为3类:第一类,离子电导材料,如聚(丙烯腈-丁二烯)共聚合物(PAB)[45];第二类,电子电导材料,如rGO[46],不定形碳-烷基碳酸锂-碳酸锂[47]和石墨烯-氧化硅复合物(石墨烯球)[48];第三类,离子-电子双电导材料,如Li3PO4-PPy[49]。Wang等[45]报道了用PAB作为NCM622正极材料的包覆层,用于解决固态电池中正极材料与固体电解质之间的界面问题。结果发现,PAB有机包覆层不但可以改善循环过程中正极与固体电解质间的物理接触,而且抑制了正极/电解质界面处的副反应和相互扩散。通过不同扫描速率下CV测试发现,包覆PAB后,锂离子表观迁移速率可增加30%左右,而且在5C倍率下比容量保持率大大高于未包覆的NCM622,且循环400周后仍可保持75%的比容量。Shim等[46]为了提高NCM622的电子导电性,在材料表面包覆2nm左右厚的rGO。NCM622粉末分散于3-氨丙基三乙氧基硅烷(APTES)的甲苯溶液中,搅拌6h后过滤,将滤渣分散于GO分散液中,80℃下搅拌2h后过滤干燥,在300℃下用H2还原4h即可得到rGO-NCM622。拉曼光谱分析证明rGO成功包覆在NCM622表面。导电性原子力显微镜(C-AFM)测试结果表明随着电压的增加,rGO-NCM622的电子电导率相较于原料变得更加显著,证明了rGO包覆有助于提高NCM622的电子电导率。来自韩国三星先进技术研究院的Son等采用CVD在NCM613上分别包覆了不定形碳-烷基碳酸锂-碳酸锂[47]和石墨烯球[48],两种复合材料对NCM613的电子电导都有较大提高,尤其石墨烯球的包覆,极大地提高了NCM613的快充能力,在2.5~4.3V及0.1,0.2,0.5,1,2,5C和10C倍率下,石墨烯球包覆的NCM613材料的放电容量分别为191.6,188.4,183.5,175.3,161.6,131.2mAh/g和81.6mAh/g,而原料则为187.2,178.3,160.5,133.4,101.8,54.2mAh/g和1.3mAh/g。
4 结束语近年来,广大学者就高镍三元材料的制备、元素掺杂和表面包覆等方面做了大量的研究,推动了高镍三元在动力汽车上的应用。今后该材料的主要研究方向集中在以下方面:
(1) 高镍三元电解液的适配问题,三元材料的截止电压为4.3V及以上,有的甚至达到了4.7V,而现有的锂电电解液的适用电压为4.2V,通过高压电解液的研究,可以提高高镍三元电池的能量密度。
(2) 动力电池的安全性问题,现有的电解液一般为碳酸酯类有机物,属于易燃物质,通过在动力电池电解液中添加适量阻燃剂,将有效降低安全事故的发生概率。此外,将固态电解质应用到高镍三元锂电中也能提高动力电池的安全性。
(3) 高镍三元的压实问题,在现有的工艺技术下,高镍三元的压实密度大部分为3.5~3.6g/cm3,远低于LiCoO2的压实密度(3.6~4.2g/cm3),通过优化粒度分布即将不同粒度的高镍三元混合提高材料的压实密度,从而提高电池的质量能量密度。
(4) 高镍三元的循环寿命问题,高镍三元材料的循环次数一般在800~2000次,而政府规定动力电池等关键零部件质保不低于8年,因此,通过包覆导电材料,提高材料导电性,进而优化材料的循环稳定性,延长使用寿命。
虽然高镍三元材料刚刚起步,但其成本低,能量密度高,明显优于传统正极材料。在动力电池正极材料领域中,三元材料已经逐步取代LiFePO4,成为电动汽车的主流正极材料。在未来几十年,动力汽车也将成为人们出行的首选,高镍三元电池作为动力汽车的新型能源载体必将得到广泛应用。
| [1] |
袁琦, 邹正光, 韩世昌, 等. 锂离子电池正极材料铁掺杂V6O13的制备及电化学性能[J].
材料工程, 2018, 46 (1): 106–113.
YUAN Q, ZOU Z G, HAN S C, et al. Synthesis and electr-ochemical properties of Fe-doped V6O13 as cathode material for lithium-ion battery[J]. Journal of Materials Engineering, 2018, 46 (1): 106–113. |
| [2] | MANTHIRAM A, SONG B, LI W. A perspective on nickel-rich layered oxide cathodes for lithium-ion batteries[J]. Energy Storage Materials, 2017 (6): 125–139. |
| [3] |
董鹏, 张英杰, 李雪, 等. 纳米磷酸铁包覆锂离子电池正极材料LiNi0.5Co0.2Mn0.3O2的制备及其电化学性能[J].
材料工程, 2017, 45 (11): 49–57.
DONG P, ZHANG Y J, LI X, et al. Fabrication and electr-ochemical performance of LiNi0.5Co0.2Mn0.3O2 coated with nano FePO4 as cathode material for lithium-ion batteries[J]. Journal of Materials Engineering, 2017, 45 (11): 49–57. DOI: 10.11868/j.issn.1001-4381.2015.001257 |
| [4] | RIEKEHR L, LIU J, SCHWARZ B, et al. Effect of pristine nanostructure on first cycle electrochemical characteristics of lithium-rich lithium-nickel-cobalt-manganese-oxide cathode ceram-ics for lithium ion batteries[J]. Journal of Power Sources, 2016, 306 : 135–137. DOI: 10.1016/j.jpowsour.2015.11.082 |
| [5] | DING Y, WANG R, WANG L, et al. A short review on layered LiNi0.8Co0.1Mn0.1O2 positive electrode material for lithium-ion batteries[J]. Energy Procedia, 2017, 105 : 2941–2952. DOI: 10.1016/j.egypro.2017.03.672 |
| [6] | ZHENG J, KAN W H, MANTHIRAM A. Role of Mn content on the electrochemical properties of nickel-rich layered LiNi0.8-xCo0.1Mn0.1+xO2(0.0≤ x ≤ 0.08) cathodes for lithium-ion batteries[J]. ACS Appl Mater Interfaces, 2015, 7 (12): 6926–6934. DOI: 10.1021/acsami.5b00788 |
| [7] | SUN H H, CHOI W, LEE J K, et al. Control of electrochemical properties of nickel-rich layered cathode materials for lithium ion batteries by variation of the manganese to cobalt ratio[J]. Journal of Power Sources, 2015, 275 : 877–833. DOI: 10.1016/j.jpowsour.2014.11.075 |
| [8] | GONG J, WANG Q, SUN J. Thermal analysis of nickel cobalt lithium manganese with varying nickel content used for lithium ion batteries[J]. Thermochimica Acta, 2017, 655 : 176–180. DOI: 10.1016/j.tca.2017.06.022 |
| [9] | PAN C C, ZHU Y R, YANG Y C, et al. Influences of transition metal on structural and electrochemical properties of Li[NixCoyMnz]O2 (0.6≤ x ≤ 0.8) cathode materials for lithium-ion batteries[J]. Transactions of Nonferrous Metals Society of China, 2016, 26 (5): 1396–1402. DOI: 10.1016/S1003-6326(16)64244-9 |
| [10] | ZHOU P, ZHANG Z, MENG H, et al. SiO2-coated LiNi0.915Co0.075Al0.01O2 cathode material for rechargeable Li-ion batteries[J]. Nanoscale, 2016, 8 (46): 19263–19269. DOI: 10.1039/C6NR07438C |
| [11] | DE B L, KONDRAKOV A O, GEßWEIN H, et al. Between scylla and charybdis:balancing among structural stability and energy density of layered NCM cathode materials for advanced lithium-ion batteries[J]. The Journal of Physical Chemistry C, 2017, 121 (47): 26163–26171. DOI: 10.1021/acs.jpcc.7b06363 |
| [12] | ISHIDZU K, OKA Y, NAKAMURA T. Lattice volume change during charge/discharge reaction and cycle performance of Li[NixCoyMnz]O2[J]. Solid State Ionics, 2016, 288 : 176–179. DOI: 10.1016/j.ssi.2016.01.009 |
| [13] | ZHANG Q, SU Y, CHEN L, et al. Pre-oxidizing the precu-rsors of Nickel-rich cathode materials to regulate their Li+/Ni2+ cation ordering towards cyclability improvements[J]. Journal of Power Sources, 2018, 396 : 734–741. DOI: 10.1016/j.jpowsour.2018.06.091 |
| [14] | WU F, TIAN J, SU Y, et al. Effect of Ni2+ content on lith-ium/nickel disorder for Ni-rich cathode materials[J]. ACS Appl Mater Interfaces, 2015, 7 (14): 7702–7708. DOI: 10.1021/acsami.5b00645 |
| [15] | MENG K, WANG Z, GUO H, et al. Enhanced cycling stability of LiNi0.8Co0.1Mn0.1O2 by reducing surface oxygen defects[J]. Electrochimica Acta, 2017, 234 : 99–107. DOI: 10.1016/j.electacta.2017.03.054 |
| [16] | SUN H H, MANTHIRAM A. Impact of microcrack generation and surface degradation on a Nickel-rich layered Li[Ni0.9Co0.05Mn0.05]O2 cathode for lithium-ion batteries[J]. Chemistry of Materials, 2017, 29 (19): 8486–8493. DOI: 10.1021/acs.chemmater.7b03268 |
| [17] | XIAO Z, ZHANG Y, WANG Y. Synthesis of high-capacity LiNi0.8Co0.1Mn0.1O2 cathode by transition metal acetates[J]. Transactions of Nonferrous Metals Society of China, 2015, 25 (5): 1568–1574. DOI: 10.1016/S1003-6326(15)63759-1 |
| [18] | WANG L, WU B, MU D, et al. Single-crystal LiNi0.6Co0.2Mn0.2O2 as high performance cathode materials for Li-ion batteries[J]. Journal of Alloys and Compounds, 2016, 674 : 360–367. DOI: 10.1016/j.jallcom.2016.03.061 |
| [19] | LU H, ZHOU H, SVENSSON A M, et al. High capacity Li[Ni0.8Co0.1Mn0.1]O2 synthesized by sol-gel and co-precipitation methods as cathode materials for lithium-ion batteries[J]. Solid State Ionics, 2013, 249/250 : 105–111. DOI: 10.1016/j.ssi.2013.07.023 |
| [20] | LIANG L, DU K, PENG Z, et al. Co-precipitation synthesis of Ni0.6Co0.2Mn0.2(OH)2 precursor and characterization of LiNi0.6Co0.2Mn0.2O2 cathode material for secondary lithium batteries[J]. Electrochimica Acta, 2014, 130 : 82–89. DOI: 10.1016/j.electacta.2014.02.100 |
| [21] | MEZAAL M A, QU L, LI G, et al. High energy density and lofty thermal stability nickel-rich materials for positive electrode of lithium ion batteries[J]. Journal of Solid State Electro-chemistry, 2017, 21 (8): 2219–2229. DOI: 10.1007/s10008-017-3564-9 |
| [22] | WU N, WU H, YUAN W, et al. Facile synthesis of one-dimen-sional LiNi0.8Co0.15Al0.05O2 microrods as advanced cathode materials for lithium ion batteries[J]. Journal of Materials Chemistry A, 2015, 3 (26): 13648–13652. DOI: 10.1039/C5TA02767E |
| [23] | AHN W, LIM S N, JUNG K N, et al. Combustion-synthesized LiNi0.6Mn0.2Co0.2O2 as cathode material for lithium ion batteries[J]. Journal of Alloys and Compounds, 2014, 609 : 143–149. DOI: 10.1016/j.jallcom.2014.03.123 |
| [24] | HSIEH C T, HSU H H, HSU J P, et al. Infrared-assisted synthesis of lithium nickel cobalt alumina oxide powders as elect-rode material for lithium-ion batteries[J]. Electrochimica Acta, 2016, 206 : 207–216. DOI: 10.1016/j.electacta.2016.04.146 |
| [25] | LI T, LI X, WANG Z, et al. A short process for the efficient utilization of transition-metal chlorides in lithium-ion batteries:A case of Ni0.8Co0.1Mn0.1O2[J]. Journal of Power Sources, 2017, 342 : 495–503. DOI: 10.1016/j.jpowsour.2016.12.095 |
| [26] |
李高锋, 李智敏, 向黔新, 等. 锂离子电池正极材料表面包覆改性研究进展[J].
材料工程, 2018, 46 (9): 23–30.
LI G F, LI Z M, XIANG Q X, et al. Research progress of cathode materials modified by surface coating for lithium ion batteries[J]. Journal of Materials Engineering, 2018, 46 (9): 23–30. |
| [27] | HUANG B, LI X, WANG Z, et al. Synthesis of Mg-doped LiNi0.8Co0.15Al0.05O2 oxide and its electrochemical behavior in high-voltage lithium-ion batteries[J]. Ceramics International, 2014, 40 (8): 13223–13230. DOI: 10.1016/j.ceramint.2014.05.029 |
| [28] | XIE H, DU K, HU G, et al. The role of sodium in LiNi0.8Co0.15Al0.05O2 cathode material and its electrochemical behaviors[J]. The Journal of Physical Chemistry C, 2016, 120 (6): 3235–3241. DOI: 10.1021/acs.jpcc.5b12407 |
| [29] | LI X, XIE Z, LIU W, et al. Effects of fluorine doping on structure, surface chemistry, and electrochemical performance of LiNi0.8Co0.15Al0.05O2[J]. Electrochimica Acta, 2015, 174 : 1122–1130. DOI: 10.1016/j.electacta.2015.06.099 |
| [30] | ZHU L, LIU Y, WU W, et al. Surface fluorinated LiNi0.8Co0.15Al0.05O2 as a positive electrode material for lithium ion batteries[J]. Journal of Materials Chemistry A, 2015, 3 (29): 15156–15162. DOI: 10.1039/C5TA02529J |
| [31] | CHEN T, LI X, WANG H, et al. The effect of gradient boracic polyanion-doping on structure, morphology, and cycling perfor-mance of Ni-rich LiNi0.8Co0.15Al0.05O2 cathode material[J]. Journal of Power Sources, 2018, 374 : 1–11. DOI: 10.1016/j.jpowsour.2017.11.020 |
| [32] | CHEN Q C, YAN G J, LUO L M, et al. Enhanced cycling stability of Mg-F co-modified LiNi0.6Co0.2Mn0.2-yMgyO2-zFz for lithium-ion batteries[J]. Transactions of Nonferrous Metals Society of China, 2018, 28 (7): 1397–1403. DOI: 10.1016/S1003-6326(18)64778-8 |
| [33] | EL MOFID W, IVANOV S, KONKIN A, et al. A high perfor-mance layered transition metal oxide cathode material obtained by simultaneous aluminum and iron cationic substitution[J]. Journal of Power Sources, 2014, 268 : 414–422. DOI: 10.1016/j.jpowsour.2014.06.048 |
| [34] | TAO F, YAN X X, LIU J J, et al. Effects of PVP-assisted Co3O4 coating on the electrochemical and storage properties of LiNi0.6Co0.2Mn0.2O2 at high cut-off voltage[J]. Electrochimica Acta, 2016, 210 : 548–556. DOI: 10.1016/j.electacta.2016.05.060 |
| [35] | WOO S G, HAN J H, KIM K J, et al. Surface modification by sulfated zirconia on high-capacity nickel-based cathode materials for Li-ion batteries[J]. Electrochimica Acta, 2015, 153 : 115–121. DOI: 10.1016/j.electacta.2014.12.001 |
| [36] | LIANG L W, HU G R, CAO Y B, et al. Electrochemical behaviours of SiO2-coated LiNi0.8Co0.1Mn0.1O2 cathode mate-rials by a novel modification method[J]. Journal of Alloys and Compounds, 2016, 657 : 570–581. DOI: 10.1016/j.jallcom.2015.10.177 |
| [37] | TANG Z F, WU R, HUANG P F, et al. Improving the electro-chemical performance of Ni-rich cathode material LiNi0.815Co0.15Al0.035O2 by removing the lithium residues and forming Li3PO4 coating layer[J]. Journal of Alloys and Compounds, 2017, 693 : 1157–1163. DOI: 10.1016/j.jallcom.2016.10.099 |
| [38] | PARK K, PARK J H, CHOI B, et al. Metal phosphate-coated Ni-rich layered oxide positive electrode materials for Li-ion batteries:improved electrochemical performance and decreased Li residuals content[J]. Electrochimica Acta, 2017, 257 : 217–223. DOI: 10.1016/j.electacta.2017.10.101 |
| [39] | LIU W, TANG X, QIN M, et al. FeF3-coated LiNi0.8Co0.15Al0.05O2 cathode materials with improved electrochemical prop-erties[J]. Materials Letters, 2016, 185 (96): 99. |
| [40] | LEE S H, YOON C S, AMINE K, et al. Improvement of long-term cycling performance of Li[Ni0.8Co0.15Al0.05] O2 by AlF3 coating[J]. Journal of Power Sources, 2013, 234 : 201–207. DOI: 10.1016/j.jpowsour.2013.01.045 |
| [41] | XIONG X, WANG Z, YIN X, et al. A modified LiF coating process to enhance the electrochemical performance charact-eristics of LiNi0.8Co0.1Mn0.1O2 cathode materials[J]. Materials Letters, 2013, 110 : 4–9. DOI: 10.1016/j.matlet.2013.07.098 |
| [42] | YANG C, SHAO R, MI Y, et al. Stable interstitial layer to alleviate fatigue fracture of high nickel cathode for lithium-ion batteries[J]. Journal of Power Sources, 2018, 376 : 200–206. DOI: 10.1016/j.jpowsour.2017.11.085 |
| [43] | LIAO J Y, OH S M, MANTHIRAM A. Core/double-shell type gradient Ni-rich LiNi0.76Co0.10Mn0.14O2 with high capacity and long cycle life for lithium-ion B batteries[J]. ACS Appl Mater Interfaces, 2016, 8 (37): 24543–24549. DOI: 10.1021/acsami.6b06172 |
| [44] | CHOI J W, LEE J W. Improved electrochemical properties of Li(Ni0.6Mn0.2Co0.2)O2 by surface coating with Li1.3Al0.3Ti1.7(PO4)3[J]. Journal of Power Sources, 2016, 307 : 63–68. DOI: 10.1016/j.jpowsour.2015.12.055 |
| [45] | WANG L P, ZHANG X D, WANG T S, et al. Ameliorating the interfacial problems of cathode and solid-state electrolytes by interface modification of functional polymers[J]. Advanced Energy Materials, 2018, 8 (24): 1801528–1801535. DOI: 10.1002/aenm.201801528 |
| [46] | SHIM J H, KIM Y M, PARK M, et al. Reduced graphene oxide-wrapped nickel-rich cathode materials for lithium ion batteries[J]. ACS Appl Mater Interfaces, 2017, 9 (22): 18720–18729. DOI: 10.1021/acsami.7b02654 |
| [47] | HYUK S I, PARK K, HWAN P J. Improvement in high-voltage and high rate cycling performance of nickel-rich layered cathode materials via facile chemical vapor deposition with methane[J]. Electrochimica Acta, 2017, 230 : 308–315. DOI: 10.1016/j.electacta.2017.01.198 |
| [48] | SON I H, PARK J H, PARK S, et al. Graphene balls for lithium rechargeable batteries with fast charging and high volumetric energy densities[J]. Nature Communications, 2017, 8 (1): 1561–1571. DOI: 10.1038/s41467-017-01823-7 |
| [49] | CHEN S, HE T, SU Y, et al. Ni-rich LiNi0.8Co0.1Mn0.1O2 oxide coated by dual-conductive layers as high performance cathode material for lithium-ion batteries[J]. ACS Appl Mater Interfaces, 2017, 9 (35): 29732–29734. DOI: 10.1021/acsami.7b08006 |
| [50] | QI X, XUE Z, DU K, et al. Graphene-analogous structural MoS2 modification to improve electrochemical properties of Ni-rich layered oxide cathode material for lithium-ion batteries[J]. Journal of Power Sources, 2018, 397 : 288–295. DOI: 10.1016/j.jpowsour.2018.07.037 |
| [51] | KIM H S, KIM J, KIM S, et al. Post surface treatment of LiNi0.6Co0.1Mn0.3O2 electrode with poly(4-vinylphenol) for lithium ion batteries[J]. Electrochimica Acta, 2017, 246 : 51–58. DOI: 10.1016/j.electacta.2017.05.148 |
| [52] | KIM H, KIM M G, JEONG H Y, et al. A new coating method for alleviating surface degradation of LiNi0.6Co0.2Mn0.2O2 cathode material:nanoscale surface treatment of primary particles[J]. Nano Lett, 2015, 3 : 2111–2119. |
| [53] | LEE Y S, SHIN W K, KANNAN A G, et al. Improvement of the cycling performance and thermal stability of lithium-ion cells by double-layer coating of cathode materials with Al2O3 nanoparticles and conductive polymer[J]. ACS Appl Mater Interfaces, 2015, 7 (25): 13944–13951. DOI: 10.1021/acsami.5b02690 |
| [54] | JIANG G D, HU Z H, YUAN S D, et al. Enhanced perfor-mance of LiFePO4 originating from the synergistic effect of graphene modification and carbon coating[J]. Journal of Alloys and Compounds, 2018, 767 : 528–537. DOI: 10.1016/j.jallcom.2018.07.078 |
| [55] | ZHU X, YUAN Z W, YUAN S D, et al. Hydrothermal synth-esis of red phosphorus@reduced graphene oxide nanohybrid with enhanced electrochemical performance as anode material of lithium-ion battery[J]. Applied Surface Science, 2018, 433 : 125–132. DOI: 10.1016/j.apsusc.2017.09.256 |
 2019, Vol. 47
2019, Vol. 47