开发具有高选择性和高灵敏度的金属离子探针一直都倍受人们关注[1-4]。铁是人体中存在最多的过渡金属,平均每个成年人含有3-5 g这种微量元素,细胞内的铁元素总浓素大约是50-100 μM[5]。铁是组成生命体的基本元素之一,并在生命过程中有重要作用。铁元素参与细胞内新陈代谢的各种过程如电子传递、DNA合成;铁是构建肌红蛋白和血红蛋白的重要元素,亚铁离子与亚铁血红素的结合是人体内运输氧的重要环节[6-7];铁是酶反应的重要辅助因子,在顺乌头酸酶、亚铁血红素酶、核苷酸还原酶、细胞色素中都有铁元素[8-9]。生物体中铁元素主要以亚铁离子和铁离子[Fe(III)]存在,破坏了Fe(III)平衡就会引起相应的失调症状,如贫血、血色沉着症、阿兹海默症、帕金森症、癫痫、肝肾损伤、心力衰竭和糖尿病[10-16]。Fe(III)也是常见的环境污染物之一[17],因此需要建立一种有效的方法来检测自然水系、工业废水和生物体内的Fe(III)浓度。
许多Fe(III)荧光探针已见文献报道,包括杯芳烃、氮杂冠醚、希夫碱衍生物等[18-21],然而它们普遍都有合成路线太长、产率低、检测时间长等缺点。要开发出一种便捷、高选择性、高灵敏度的Fe(III)荧光探针仍然是一项挑战。香豆素类衍生物具有较高的摩尔消光系数、较长的荧光激发与发射波长和高荧光量子产率等优点,已经被大量应用于荧光探针的构建,是优秀的备选荧光团[22-29]。香豆素即2-氢-苯并吡喃-2-酮,其本身无荧光,通过引入推−拉电子体系发出强荧光。香豆素的化学结构是杂环体系,通过适当识别基团的引入来改变探针的电子排布,就能够构建络合型金属离子探针。
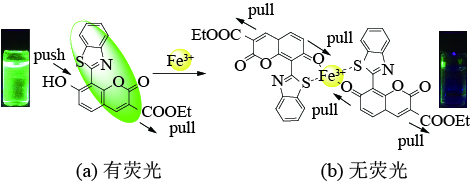
本文设计合成了一种用于快速检测Fe(III)的新型荧光探针BC-1。通过香豆素醛与邻氨基苯硫酚直接缩合成环,将苯并噻唑杂环引入了香豆素环的8位。这样设计的目的首先是改善了荧光团的性质,香豆素与苯并噻唑环的共轭导致共轭体系加大、发射波长红移、Stokes位移增大。探针BC-1的荧光发射波长在510 nm处,比起常见的香豆素发射峰红移了60 nm,发出绿色荧光。其次,杂原子可以作为络合基团引入用以选择性识别Fe(III)。香豆素7位酚羟基和苯并噻唑环的硫原子可以与Fe(III)络合,继而导致荧光团电子排布的改变,推−拉电子体系被破坏,荧光性质改变,同时由于Fe(III)具有顺磁性,就会导致荧光的猝灭,从而达到识别目的。
1 实验部分本文设计的探针BC-1合成路线简单(图1)、产率高、水溶性好,能够在水溶液中快速识别Fe(III),可以达到对Fe(III)的实时检测。

|
Download:
|
| 图 1 探针BC-1的合成路线 | |

|
Download:
|
| 图 1 探针BC-1的合成路线 | |
实验中使用的仪器有:Brucker EQUIOX-55 红外光谱仪(KBr压片),美国Varian INOVA-400型超导核磁共振仪(内标TMS),德国道尔顿Bruker microTOF-Q II高分辨质谱仪,XT-4B型显微熔点仪(温度未校正),Hitachi F-4500荧光分光光度计,Shimadzu UV-1700紫外可见分光光度计。全部化合物的紫外可见吸收光谱和荧光发射光谱均在室温下进行测定,TLC监测在自制硅胶板上进行,柱色谱分离使用的是硅胶(200-300目)。所有的试剂都来自于试剂供应商,且未经纯化直接投入使用。所有的光谱实验都使用蒸馏水。
实验中使用的试剂有2,4-二羟基苯甲醛、乙二酸二乙酯、六氢吡啶、醋酸、乙醇、乌洛托品、三氟乙酸、盐酸、双氧水、邻氨基苯硫酚等,均为分析纯试剂。
1.2 7-羟基香豆素-3-甲酸乙酯(1)的合成向50 mL圆底烧瓶中,加入2,4-二羟基苯甲醛0.91 g (6.6 mmol)、丙二酸二乙酯0.6 mL (4 mmol),无水乙醇10 mL、六氢吡啶0.1 mL和2滴冰醋酸。保持85 ℃搅拌回流4~6 h,TLC监控反应。冷至室温,有淡黄色晶体析出,抽滤收集滤饼,无水乙醇洗涤,得淡黄色晶体,即为7-羟基香豆素-3-甲酸乙酯[30],产量为1.14 g,产率为74%。1H NMR (DMSO-d6, 400 MHz): δ ppm 1.29 (t, J=7.2 Hz, 3H), 4.26 (q, J=7.2 Hz, 2H), 6.73 (s, 1H), 6.84 (d, J=8.4 Hz, 1H), 7.76 (d, J=8.6 Hz, 1H), 8.68 (s, 1H), 11.10 (s, 1H).
1.3 7-羟基-8-甲酰基香豆素-3-甲酸乙酯(2)的合成向25 mL圆底烧瓶中,加入7-羟基香豆素-3-羧酸乙酯1.64 g (7 mmol)、乌洛托品1.5 g (10.7 mmol)和三氟乙酸10 mL。升温至85 ℃搅拌回流24 h。冷至室温后,加入10 mL H2SO4(20%)搅拌1 h。将反应液倾入25 mL冰水中,静置,有黄色固体析出,抽滤收集滤饼,得到黄色固体,过柱提纯(洗脱剂:v(CH2Cl2):v(CH3OH) =300:1),得到浅黄色固体,即为7-羟基-8-甲酰基香豆素-3-羧酸乙酯[30],产量为1.4 g,产率为76%。1H NMR (DMSO-d6, 400 MHz): δ ppm 1.29 (t, J=6.8 Hz, 3H), 4.28 (q, J=6.8 Hz, 2H), 7.01 (d, J=9.2 Hz, 1H), 8.06 (d, J=8.4 Hz, 1H), 8.75 (s,1H), 10.40 (s, 1H); FT-IR (KBr, cm-1): 3 431,3 045,1 742,1 700,1 659,1 595,1 480,1 445,1 304,1 236.
1.4 探针BC-1的合成向25 mL圆底烧瓶中加入7-羟基-8-甲酰基香豆素-3-甲酸乙酯0.262 2 g (1 mmol)、邻氨基苯硫酚0.1502 g (1.2 mmol)、乙醇10 mL、30%双氧水0.8 mL、37%盐酸0.5 mL,室温下搅拌,TLC监测反应,1 h后停止搅拌,抽滤得橘红色固体,过柱提纯 (洗脱剂:v(CH2Cl2):v(CH3OH)=500:1)得浅黄色固体,即为产物,产量0.38 g,产率91%。1H NMR (CDCl3, 400 MHz): δ ppm 1.43 (t, J=8.0 Hz, 3H), 4.43 (q, J=8.0 Hz, 2H), 7.11 (d, J=8.0 Hz, 1H), 7.50 (d, J=8.0 Hz, 1H), 7.59 (m, 2H), 8.06 (m, 2H), 8.58 (s, 1H), 15.23 (s, 1H); FT-IR (KBr, cm-1): 3 432, 3 045, 2 921, 2 863, 1 770, 1 691, 1 598, 1 565, 1 474, 1 438, 1 290, 1 027, 860, 825, 761; ESI-HRMS: [M+1]+m/z 368.085 3, calcd for C19H14NO5S 368.085 7.
2 结果与讨论 2.1 探针BC-1的合成本实验以2,4-二羟基苯甲醛为原料,先经过两步反应合成探针BC-1的荧光母环,也就是3位乙酰基7位羟基香豆素。通过向香豆素结构中引入推−拉电子体系,构建了优秀的荧光母环,为接下来的检测提供了很好的荧光基础。在母环合成之后,经过一步反应合成了香豆素−苯并噻唑共轭衍生物。该反应时间短、条件温和、产率高。在本文所述条件下,2-氨基苯硫酚和含醛基的芳香系化合物可以在双氧水/盐酸体系中快速、高产率的生成苯并噻唑衍生物。其机理为先生成苯并噻唑啉中间产物,然后再脱氢生成相应的苯并噻唑。
2.2 探针BC-1的检测机理本文设计合成了一种用于快速检测Fe(III)的新型荧光探针BC-1。通过香豆素醛与邻氨基苯硫酚直接缩合成环,将苯并噻唑杂环引入了香豆素环的8位。这样设计的目的首先是改善了荧光团的性质,香豆素与苯并噻唑环的共轭导致共轭体系加大,发射波长红移,Stokes位移增大。探针BC-1的荧光发射波长在510 nm处,比起常见的香豆素发射峰红移了60 nm,发出绿色荧光。其次,杂原子可以作为络合基团引入用以选择性识别Fe(III)。香豆素7位酚羟基和苯并噻唑环的硫原子可以与Fe(III)络合,继而导致荧光团电子排布的改变,推−拉电子体系被破坏,荧光性质改变,同时由于Fe(III)具有顺磁性,就会导致荧光的猝灭,从而达到识别目的(图2)。
|
Download:
|
| 图 2 探针BC-1的检测机理 | |
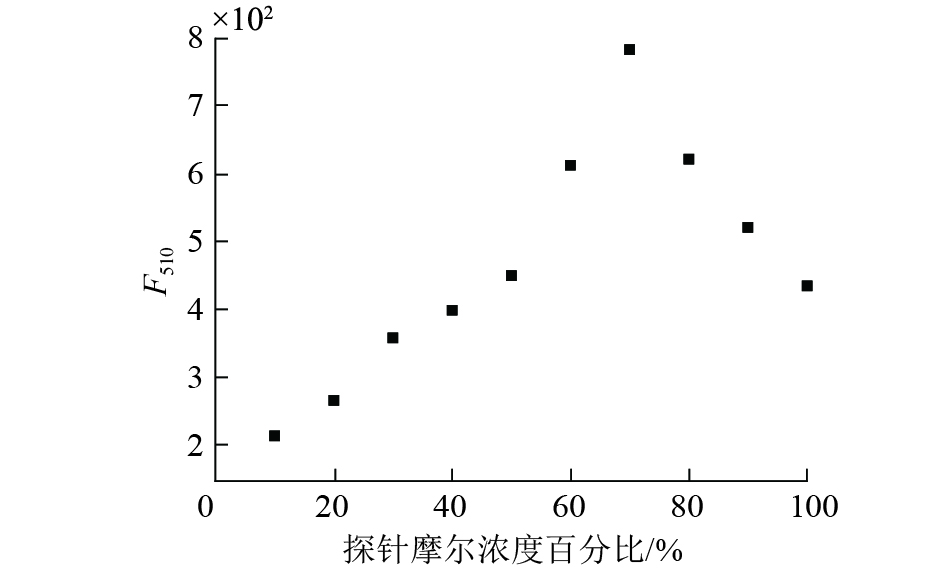
由于香豆素3位吸电子基团和7位给电子基团的引入能够形成推−拉电子体系,7-羟基香豆素-3-甲酸乙酯荧光团在450 nm处发出强荧光,与苯并噻唑杂环共轭后,共轭体系增大,发射波长红移了60 nm。而杂环上的氮原子和硫原子可以络合Fe(III),为了络合Fe(III)、香豆素环上的酚羟基转化为酮式结构,破坏了香豆素环的共轭结构和推−拉电子体系,加之Fe(III)具有顺磁性,使荧光猝灭。本文通过1H NMR和Job曲线证明了这一机理。如图3所示,在核磁滴定谱图中,探针BC-1的酚羟基原本在15.23 ppm处出峰,加入Fe(III)后,该质子峰消失,说明了酚羟基结构转化成了酮式结构。由于Fe(III)对探针BC-1的络合作用,探针BC-1的芳基氢表现出向低场位移。同时Job曲线也证明了探针BC-1与Fe(III)是以2:1为比例络合的,如图4所示。

|
Download:
|
| 图 3 探针BC-1的核磁滴定图谱(CDCl3) | |
|
Download:
|
| 图 4 探针BC-1的JOB曲线([BC-1+Fe(III)]: 10 μM;狭缝宽度:2.5 nm,5 nm) | |
香豆素本身无荧光,通过在香豆素的3位、7位构建推-拉电子体系,化合物1在450 nm处有荧光发射峰。在香豆素8位引入苯并噻唑杂环后,共轭体系扩大,发射波长红移。探针BC-1的发射波长红移至510 nm,同时荧光量子产率增加,Stokes位移增大(表1)。比起化合物1的荧光性质,探针BC-1具有更好的光学性质。
|
|
表 1 化合物1和探针BC-1的荧光数据 |
探针BC-1的杂原子能够络合Fe(III),香豆素的酚羟基转化为酮式结构,破坏了荧光团的推−拉电子体系及共轭结构,从而引起荧光猝灭(图5)。

|
Download:
|
| 图 5 探针BC-1对Fe(III)的荧光猝灭照片(紫外灯365 nm激发) | |
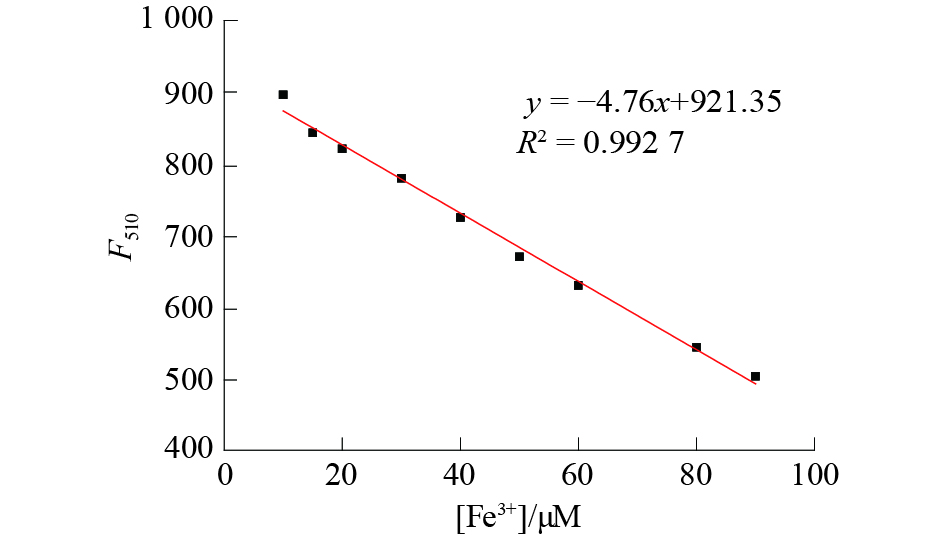
如图6所示,随着Fe(III)浓度增大,探针BC-1在510 nm处的荧光发射强度逐渐降低,与预测机理完全一致。紫外可见吸收光谱也表现出相似的性质,探针BC-1的吸收峰在370 nm处,Fe(III)浓度逐渐增大时,紫外吸收峰逐渐降低,与荧光光谱表现一致(图7)。光谱滴定实验也验证了预测的检测机理的正确性。以荧光滴定光谱为基础可以测得探针BC-1对Fe(III)的工作曲线,线性方程可以记作F = a + b × [Fe(III)] (图8)。结果表明,探针BC-1都能够在0~100 μM范围内定量检测Fe(III)。根据线性方程还能计算出探针BC-1的检出限为0.83 μM,表示探针BC-1有很好的灵敏度。

|
Download:
|
| 图 6 探针BC-1(10 μM)对不同浓度Fe(III)的荧光谱图 | |

|
Download:
|
| 图 7 探针BC-1(10 μM)对不同浓度Fe(III)的紫外可见吸收谱图 | |
|
Download:
|
| 图 8 探针BC-1的工作曲线 | |
由于pH值对反应进行程度有重要影响,本文检测了pH值3~9反应进行的程度。如图9所示,探针BC-1在较宽pH值范围内都对Fe(III)有较好的响应,中性条件下检测效果最佳。因此,选择pH值为7.0作为检测条件。

|
Download:
|
| 图 9 pH值对Fe(III)检测的影响曲线([探针BC-1]10 μM) | |
接下来研究了反应时间对Fe(III)检测效果的影响。如图10所示,向探针BC-1中分别加入0.1 μM、1 μM、10 μM Fe(III)后,荧光强度均有下降,且Fe(III)浓度越大,荧光下降的速度也越快,但即使在浓度只有0.1 μM的情况下,反应也可以在4 min内进行完全。说明探针BC-1可用于快速、实时检测痕量Fe(III)。

|
Download:
|
| 图 10 时间对Fe(III)检测的影响曲线([探针BC-1]10 μM) | |
探针BC-1在510 nm有很强的荧光发射峰,并发出绿色荧光,加入Fe(III)后,荧光强度下降,发生猝灭现象。为了研究探针的选择性,其他金属离子包括K+、Na+、Ca2+、Mg2+、Al3+、Zn2+、Co2+、Cu2+、Cr3+、Cd2+、Ni2+、Pb2+、Hg2+、Sn2+、Ba2+、Mn2+、Ag+都被加入溶液,如图11所示。

|
Download:
|
| 图 11 探针BC-1(10 μM)对不同种类金属离子(1 000 μM)的选择性光谱 | |
探针BC-1只对Fe(III)表现出明显的荧光猝灭,而其他金属离子没有引起明显的光谱变化,说明了探针BC-1对Fe(III)有良好的选择性。不仅如此,在其他干扰离子的存在下,探针BC-1对Fe(III)的检测也不受干扰,说明探针还具有很好的抗干扰性(图12)。

|
Download:
|
| 图 12 探针对不同种类金属离子的抗干扰性柱状图 | |
本文通过香豆素醛与邻氨基苯硫酚直接缩合成环,将苯并噻唑杂环引入了香豆素环的8位,合成了用于检测Fe(III)的荧光探针BC-1。探针BC-1具有以下特点:1) 香豆素与苯并噻唑环的共轭导致共轭体系加大,荧光发射波长红移,荧光量子产率增大,Stocks位移增大,改善了探针的荧光性质;2)再通过与Fe(III)形成络合物,破坏了香豆素的电子排布,进而导致荧光猝灭,达到检测效果;3)探针BC-1的合成路线反应时间短、条件温和、产率高、成本低,这为探针BC-1的市场化提供了很大的潜力。该探针可以在中性水溶液中快速、高选择性、高灵敏度地检测Fe(III),为便捷地在生物体、自然水系和工业废水中实时检测痕量Fe(III)提供了一种有效且易于推广的手段。在以后的研究中,可以将探针BC-1制成荧光试纸,以达到快速检测Fe(III)的目的。
| [1] |
KANG Wenjing, PEI Xing, RUSINEK C A, et al. Determination of lead with a copper-based electrochemical sensor[J]. Analytical chemistry, 2017, 89(6): 3345-3352. DOI:10.1021/acs.analchem.6b03894 ( 0) 0)
|
| [2] |
ZHANG Bibo, LIU Haiyang, WU Fengxu, et al. A dual-response quinoline-based fluorescent sensor for the detection of Copper (II) and Iron(III) ions in aqueous medium[J]. Sensors and actuators B: chemical, 2017, 243: 765-774. DOI:10.1016/j.snb.2016.12.067 ( 0) 0)
|
| [3] |
NAMGUNG H, KIM J, GWON Y, et al. Synthesis of poly(p-phenylene) containing a rhodamine 6G derivative for the detection of Fe(III) in organic and aqueous media
[J]. RSC advances, 2017, 7(63): 39852-39858. DOI:10.1039/C7RA07853F ( 0) 0)
|
| [4] |
TANG Yongjuan, CUI Shiqiang, PU Shouzhi. A dual-channel sensor for Hg2+ based on a diarylethene with a rhodamine B unit
[J]. Journal of fluorescence, 2016, 26(4): 1421-1429. DOI:10.1007/s10895-016-1834-z ( 0) 0)
|
| [5] |
EPSZTEJN S, GLICKSTEIN H, PICARD V, et al. H-ferritin subunit overexpression in erythroid cells reduces the oxidative stress response and induces multidrug resistance properties[J]. Blood, 1999, 94(10): 3593-3603. ( 0) 0)
|
| [6] |
HENTZE M W, MUCKENTHALER M U, GALY B, et al. Two to tango: regulation of mammalian iron metabolism[J]. Cell, 2010, 142(1): 24-38. DOI:10.1016/j.cell.2010.06.028 ( 0) 0)
|
| [7] |
CHEN Weihua, XING Yu, PANG Yi. A highly selective pyrophosphate sensor based on ESIPT turn-on in water[J]. Organic letters, 2011, 13(6): 1362-1365. DOI:10.1021/ol200054w ( 0) 0)
|
| [8] |
ZHANG Ansheng, YANG Fan, MEYER K, et al. Neogenin-mediated hemojuvelin shedding occurs after hemojuvelin traffics to the plasma membrane[J]. Journal of biological chemistry, 2008, 283(25): 17494-17502. DOI:10.1074/jbc.M710527200 ( 0) 0)
|
| [9] |
KREBS C, HENSHAW T F, CHEEK J, et al. Conversion of 3Fe-4S to 4Fe-4S clusters in native pyruvate formate-lyase activating enzyme: mössbauer characterization and implications for mechanism[J]. Journal of the American chemical society, 2016, 122(50): 12497-12506. ( 0) 0)
|
| [10] |
BARNHAM K J, MASTERS C L, BUSH A I. Neurodegenerative diseases and oxidative stress[J]. Nature reviews drug discovery, 2004, 3(3): 205-214. DOI:10.1038/nrd1330 ( 0) 0)
|
| [11] |
KELL D B. Iron behaving badly: inappropriate iron chelation as a major contributor to the aetiology of vascular and other progressive inflammatory and degenerative diseases[J]. BMC medical genomics, 2009, 2: 2. DOI:10.1186/1755-8794-2-2 ( 0) 0)
|
| [12] |
BRUGNARA C. Iron deficiency and erythropoiesis: new diagnostic approaches[J]. Clinical chemistry, 2003, 49(10): 1573-1578. DOI:10.1373/49.10.1573 ( 0) 0)
|
| [13] |
BEUTLER E, FELITTI V, GELBART T, et al. Genetics of iron storage and hemochromatosis[J]. Drug metabolism and disposition: the biological fate of chemicals, 2001, 29(4 Pt 2): 495-499. ( 0) 0)
|
| [14] |
CAIRO G, PIETRANGELO A. Iron regulatory proteins in pathobiology[J]. Biochemical journal, 2000, 352(Pt 2): 241-250. ( 0) 0)
|
| [15] |
PAPANIKOLAOU G, PANTOPOULOS K. Iron metabolism and toxicity[J]. Toxicology and applied pharmacology, 2005, 202(2): 199-211. DOI:10.1016/j.taap.2004.06.021 ( 0) 0)
|
| [16] |
KALINOWSKI D S, RICHARDSON D R. The evolution of iron chelators for the treatment of iron overload disease and cancer[J]. Pharmacological reviews, 2005, 57(4): 547-583. ( 0) 0)
|
| [17] |
LI Zhanxian, ZHANG Lifeng, LI Xiaoya, et al. A fluorescent color/intensity changed chemosensor for Fe3+ by photo-induced electron transfer (PET) inhibition of fluoranthene derivative
[J]. Dyes and pigments, 2012, 94(1): 60-65. DOI:10.1016/j.dyepig.2011.11.007 ( 0) 0)
|
| [18] |
YANG Min, SUN Mingtai, ZHANG Zhongping, et al. A novel dansyl-based fluorescent probe for highly selective detection of ferric ions[J]. Talanta, 2013, 105: 34-39. DOI:10.1016/j.talanta.2012.11.066 ( 0) 0)
|
| [19] |
MARENCO M J C, FOWLEY C, HYLAND B W, et al. A new use for an old molecule: N-phenyl-2-(2-hydroxynaphthalen-1-ylmethylene)hydrazinecarbothioamide as a ratiometric ‘Off-On’ fluorescent probe for iron
[J]. Tetrahedron letters, 2012, 53(6): 670-673. DOI:10.1016/j.tetlet.2011.11.126 ( 0) 0)
|
| [20] |
XU Meiyun, WU Shuizhu, ZENG Fang, et al. Cyclodextrin supramolecular complex as a water-soluble ratiometric sensor for ferric ion sensing[J]. Langmuir, 2010, 26(6): 4529-4534. DOI:10.1021/la9033244 ( 0) 0)
|
| [21] |
ZHOU Quanying, LIU Weizhou, CHANG Lin, et al. Spectral study of the interaction between 2-pyridinecarbaldehyde-p-phenyldihydrazone and ferric iron and its analytical application
[J]. Spectrochimica acta part A: molecular and biomolecular spectroscopy, 2012, 92: 78-83. DOI:10.1016/j.saa.2012.02.049 ( 0) 0)
|
| [22] |
HUANG Xiaobo, DONG Yu, HUANG Qianwen, et al. Hydrogen bond induced fluorescence recovery of coumarin-based sensor system[J]. Tetrahedron letters, 2013, 54(29): 3822-3825. DOI:10.1016/j.tetlet.2013.05.034 ( 0) 0)
|
| [23] |
LI Guangyue, SONG Ping, HE Guozhong. TDDFT study on different sensing mechanisms of similar cyanide sensors based on Michael addition reaction[J]. Chinese journal of chemical physics, 2011, 24(3): 305-310. DOI:10.1088/1674-0068/24/03/305-310 ( 0) 0)
|
| [24] |
KO K C, WU Jiasheng, KIM H J, et al. Rationally designed fluorescence ‘turn-on’ sensor for Cu2+[J]. Chemical communications, 2011, 47(11): 3165-3167. DOI:10.1039/c0cc05421f ( 0) 0)
|
| [25] |
RAZI S S, SRIVASTAVA P, ALI R, et al. A coumarin-derived useful scaffold exhibiting Cu2+ induced fluorescence quenching and fluoride sensing (On-Off-On) via copper displacement approach
[J]. Sensors and actuators B: chemical, 2015, 209: 162-171. DOI:10.1016/j.snb.2014.11.082 ( 0) 0)
|
| [26] |
PAL S, MUKHERJEE M, SEN B, et al. A new fluorogenic probe for the selective detection of carbon monoxide in aqueous medium based on Pd(0) mediated reaction[J]. Chemical communications, 2015, 51(21): 4410-4413. DOI:10.1039/C5CC00902B ( 0) 0)
|
| [27] |
SARKAR D, PRAMANIK A K, MONDAL T K. A novel coumarin based molecular switch for dual sensing of Zn(II) and Cu(II)[J]. RSC advances, 2015, 5(10): 7647-7653. DOI:10.1039/C4RA12920B ( 0) 0)
|
| [28] |
DUAN Yuwei, YANG Xiaofeng, ZHONG Yaogang, et al. A ratiometric fluorescent probe for gasotransmitter hydrogen sulfide based on a coumarin-benzopyrylium platform[J]. Analytica chimica acta, 2015, 859: 59-65. DOI:10.1016/j.aca.2014.12.054 ( 0) 0)
|
| [29] |
ROUBINET B, CHEVALIER A, RENARD P Y, et al. A synthetic route to 3-(heteroaryl)-7-hydroxycoumarins designed for biosensing applications[J]. European journal of organic chemistry, 2015, 2015(1): 166-182. DOI:10.1002/ejoc.v2015.1 ( 0) 0)
|
| [30] |
CHEN Kangyu, GUO Yuan, LU Zhenhuan, et al. Novel coumarin-based fluorescent probe for selective detection of bisulfite anion in water[J]. Chinese journal of chemistry, 2010, 28(1): 55-60. DOI:10.1002/cjoc.v28:1 ( 0) 0)
|
 2018, Vol. 45
2018, Vol. 45


