


2. 新疆维吾尔自治区药物研究所,新疆 乌鲁木齐 830004
2. Xinjiang Uygur Autonomous Region Institute of Materia Medica, Urumqi 830004,China
肝纤维化是慢性肝病发展为晚期肝硬化的中间环节,由细胞外基质(extracellular matrix,ECM)合成与降解失衡所致,已成为肝病死亡的主要原因[1]。纤维化ECM产生于肌成纤维细胞(myofibroblast,MFB),MFB主要来源于活化的肝星状细胞(hepatic stellate cells,HSC)[2-3];因此,抑制HSC的激活,减少其增殖、活化是有效阻断肝纤维化发生、发展进程的重要途径,对预防肝硬化[4]、逆转肝纤维化的病程[5]具有重要的意义。肉苁蓉(Cistanche)是列当科肉苁蓉属,一种在沙漠树木梭梭根部的寄生植物,中国传统的名贵中药材,其主要成分中苯乙醇总苷(phenylethanol glycosides from cistanche tubulosa,CPhGs)[6]系发挥药效的主要物质,具有抗肿瘤、抗氧化、抗炎等多种生物活性。前期研究显示,CPhGs对牛血清白蛋白(bovine serum albumin,BSA)所致肝纤维化大鼠具有一定的防治作用[7-8],血小板衍生生长因子(PDGF)-BB已被证实在刺激HSC生长和相关细胞间信号传递方面较为重要,本研究旨在观察CPhGs在rrPDGF-BB诱导的HSC细胞增殖中的作用及其对ERK信号转导通路的影响。
1 材料与方法 1.1 试剂与仪器肉苁蓉苯乙醇总苷:管花肉苁蓉取自新疆吐鲁番地区,物种标本凭证存放于新疆省中药研究所,CPhGs由新疆维吾尔自治区药物研究所植物化学室提取纯化,纯度为70%,以含10%胎牛血清的DMEM(高糖)培养液配成不同浓度的混悬液,经0.22 μm滤器过滤后使用;大鼠HSC购自武汉Procell生物科技有限公司;Recombinant rat PDGF-BB购自 Peprotech公司;ERK1/2、α-SMA、β-actin引物委托上海生工生物工程服务有限公司设计,经Genbank核实后合成;cDNA反转录试剂盒购自Thermo scientific公司;荧光定量PCR(real-time PCR,RT-PCR)试剂盒购自QIAGEN GmbH公司;β-actin单克隆抗体购自武汉Proteintech公司;p44/42 MAPK(ERK1/2) Antibody和Phospho-p44/42 MAPK(ERK1/2) Antibody购自Cell signaling technology公司;Collagen Ⅰ(ab34710)抗体购自Abcam公司;碱性磷酸酶标记的二抗购自于美国Invitrogen公司;RIPA裂解液购自于Thermo Fisher Scientific公司。
1.2 HSC的培养和传代和半数抑制率(IC50)HSC常规复苏后,用含10%的胎牛血清的DMEM(高糖)完全培养液,在37℃、5% CO2及饱和湿度下培养;当细胞呈单层致密状时,常规胰蛋白酶消化传代,24 h换液,72 h再传代;实验选用对数生长期 细胞,以5×104·L-1接种于96孔板,24 h后换液,加入不同浓度组(0、3.91、7.81、15.63、31.25、62.50、125.00、250.00和500.00 mg·L-1)的CPhGs,每组4个复孔,作用48 h,MTT法于酶标仪490 nm测定吸光度A值并取均数,计算IC50。
1.3 MTT法检测CPhGs对rrPDGF-BB刺激HSC增殖影响实验分组为空白对照组、rrPDGF-BB刺激组、PDGF-BB+不同终浓度(25、50、75、100 mg·L-1)CPhGs给药组。另设与试验平行不加细胞只加DMEM培养液的空白组。rrPDGF-BB的终浓度为10 ng·L-1,每组4个复孔,分别在加药后24、48、72 h后进行MTT法检测HSC的增殖抑制作用。抑制率/%=[(A模型组-A空白组)-(A用药组-A空白组)]/(A模型组-A空白组)×100%。
1.4 CPhGs对rrPDGF-BB刺激的HSCERK1/2、α-SMA、c-fos、c-jun 和Collagen Ⅰ mRNA表达的影响收集各组细胞,提取细胞总RNA,cDNA合成参照公司的逆转录试剂盒合成。引物的设计及合成:由上海生工生物有限公司采用引物设计软件Batch Primer 3设计,经Genbank核实后合成。引物序列见Tab 1。
| Target gene(rat) | Primer sequence(Forward/Reverse) | Gen bank | Annealing temperature | |
| ERK1/2 | F:GGCTGTTCCCAAATGCTGAC | R: AACTTGAATGGTGCTTCGGC | NM_138957.3 | 55℃ |
| α-SMA | F:TGCTGACAGAGGCACCACTGAA | R:CACTTGTACGTCCAGAGGCATA | NM_007392.3 | 53℃ |
| c-fos | F:CAGACTACGAGGCGTCATCC | R:CGTGGGAATGAAGTTGGCAC | NM_005252.3 | 58℃ |
| c-jun | F:CCGGCTGGAGGAAAAAGTGA | R:GCGTTAGCATGAGTTGGCAC | NM_002228.3 | 55℃ |
| Collagen Ⅰ | F:GGAGAGAGCATGACCGATGG | R:GGGACTTCTTGAGGTTGCCA | NM_053304.1 | 57℃ |
| β-actin | F:TAAGGCCAACCGTGAAAAGATG | R:AGAGGCATACAGGGACAACACA | NM_031144.3 | 55℃ |
反应条件:94℃变性3 min,变性94℃ 30 s,退火30 s,延伸72℃ 45 s,循环30次,终末延伸72℃ 10 min,其他步骤按说明书进行操作。以β-actin为内参,以目的基因与β-actin的比值表示目的基因mRNA的相对表达量(2-ΔΔCt)。
1.5 CPhGs对rrPDGF-BB刺激的HSCp44/42 MAPK(ERK1/2)、Phospho-p44/42 MAPK(P-ERK1/2)和Collagen Ⅰ蛋白表达的影响细胞分组同上。RIPA裂解液裂解细胞,4℃ 12 000×g离心收集上清液,BCA法测定蛋白含量,加4×loading buffer煮沸蛋白,上样蛋白量30 μg,制备10%的SDS-PAGE凝胶进行电泳。100 V恒压转膜70~100 min,用10%脱脂奶粉封闭1 h。一抗为兔抗p44/42 MAPK(ERK1/2) antibody和Phospho-p44/42 MAPK(ERK1/2) antibody(1 ∶1 000)及β-actin(1 ∶5 000)单克隆抗体,二抗为碱性磷酸酶标记的抗兔抗体(InvitrogenTM),显色剂显影,GEL DOC XR凝胶成像系统分析结果。
1.6 统计学方法应用SPSS 16.0统计软件分析数据。结果以x±s表示,组间比较用单因素方差分析及Tukey’s法;Probit 进行HSC IC50分析。
2 结果 2.1 CPhGs对HSC的IC50由Fig 1可知,随着CPhGs药物浓度的增加,HSC的抑制率逐渐增加,CPhGs在500 mg·L-1浓度时,抑制率达到73.4%,采用Probit分析,计算CPhGs药物的IC50为119.125 mg·L-1。
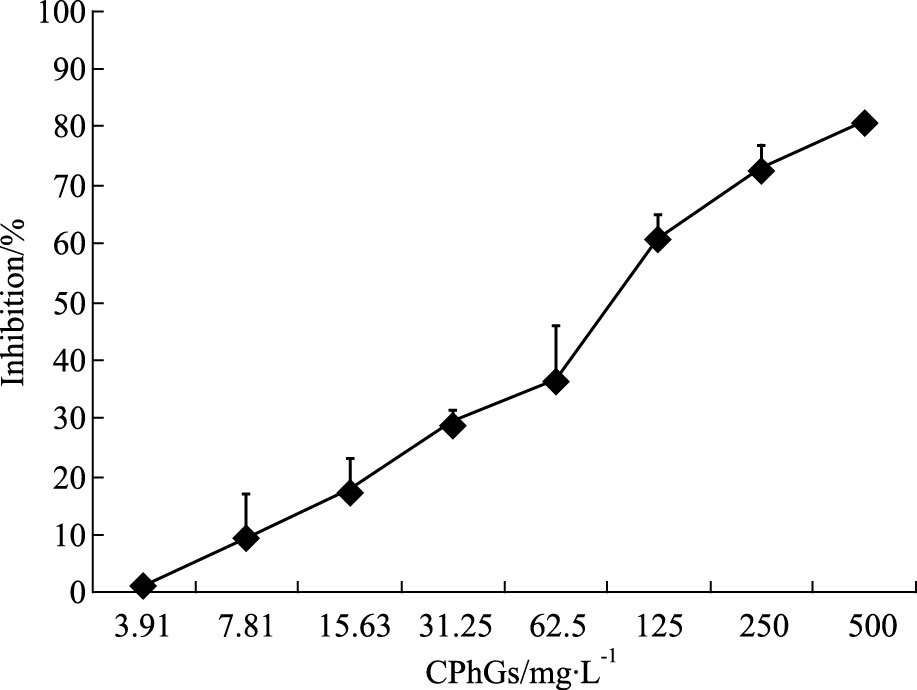
|
| 图 1 Effects of different concentrations of CPhGs on proliferative activity of HSC cells in 48 h |
与正常对照组比较,rrPDGF-BB(10 ng·L-1)组的HSC细胞明显增加,其中以48 h增殖最为明显(P<0.01),提示模型构建成功;与rrPDGF-BB组比较,除25 mg·L-1的CPhGs对HSC的抑制作用在24 h及48 h作用不明显以外,余CPhGs组均能不同程度地抑制rrPDGF-BB诱导的HSC的增殖,差异有统计学意义(P<0.05),其中rrPDGF-BB+CPhGs 100 mg·L-1剂量组的抑制率最高达47.20%;以抑制率表现最佳的CPhGs 100 mg·L-1进行药物作用时间的考察,CPhGs作用于细胞48 h较24 h时抑制率明显增加,但48 h后抑制率增加逐渐平缓,72 h时抑制率最佳。说明CPhGs发挥作用的最佳时间为rrPDGF-BB 刺激 HSC细胞48 h,后续时间,CPhGs的抑制率增加趋于稳定,见Tab 2。
| Group | n | 24 h | 48 h | 72 h | |||
| Absorbance(A) | Inhibition/% | Absorbance(A) | Inhibition/% | Absorbance(A) | Inhibition/% | ||
| Normal | 4 | 0.62±0.000 | 0.98±0.130 | 1.27±0.002 | |||
| rrPDGF-BB | 4 | 0.89±0.002* | 1.42±0.069** | 1.83±0.040** | |||
| rrPDGF-BB+CPhGs 100 mg·L-1 | 4 | 0.67±0.010# | 18.49 | 1.22±0.089## | 46.45 | 1.40±0.001# | 47.20 |
| 75 mg·L-1 | 4 | 0.68±0.005# | 15.13 | 1.23±0.060## | 43.54 | 1.50±0.012# | 45.72 |
| 50 mg·L-1 | 4 | 0.73±0.007# | 10.52 | 1.23±0.090## | 42.49 | 1.55±0.011# | 43.07 |
| 25 mg·L-1 | 4 | 0.75±0.004 | 9.19 | 1.36±0.050 | 12.40 | 1.62±0.008# | 25.25 |
| *P<0.05,**P<0.01 vs normal group;#P<0.05,##P<0.01 vs PDGF-BB group | |||||||
RT-PCR检测ERK1/2、α-SMA、c-fos、c-jun、Collagen Ⅰ及β-actin基因表达,25~100 mg·L-1浓度的CPhGs均可不同程度地下调细胞ERK1/2、α-SMA、c-fos、c-jun、Collagen I的mRNA表达,结果显示:与正常对照组比较,在rrPDGF-BB组ERK1/2、α-SMA、c-fos、c-jun和Collagen Ⅰ mRNA的表达水平(P<0.05)明显增高;与rrPDGF-BB组比较,CPhGs不同浓度药物组的ERK1/2、α-SMA、c-fos、c-jun和Collagen Ⅰ mRNA表达强度均有所下降(P<0.05),差异有统计学意义(Fig 2)。
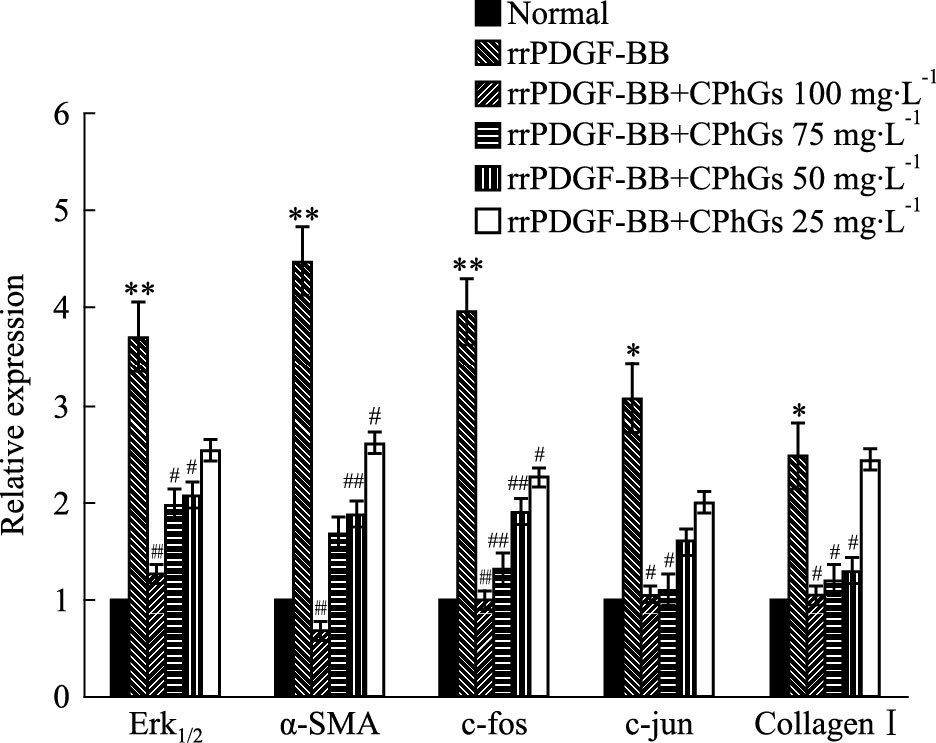
|
| 图 2 Effects of CPhGs on expressions of ERK1/2, α-SMA,c-fos,c-jun and Collagen Ⅰ in HSC(RT-PCR assay) *P<0.05,**P<0.01 vs normal group;#P<0.05,##P<0.01 vs rrPDGF-BB group |
如Fig 3所示,rrPDGF-BB刺激的HSC ERK1/2、p-ERK1/2和Collagen Ⅰ蛋白表达较正常组明显增加,CPhGs(25、50、75、100 mg·L-1)给药组均可不同程度地抑制rrPDGF-BB诱导的HSC ERK1/2、p-ERK1/2和Collagen Ⅰ蛋白表达,其中以CPhGs100 mg·L-1给药组作用效果最为明显。
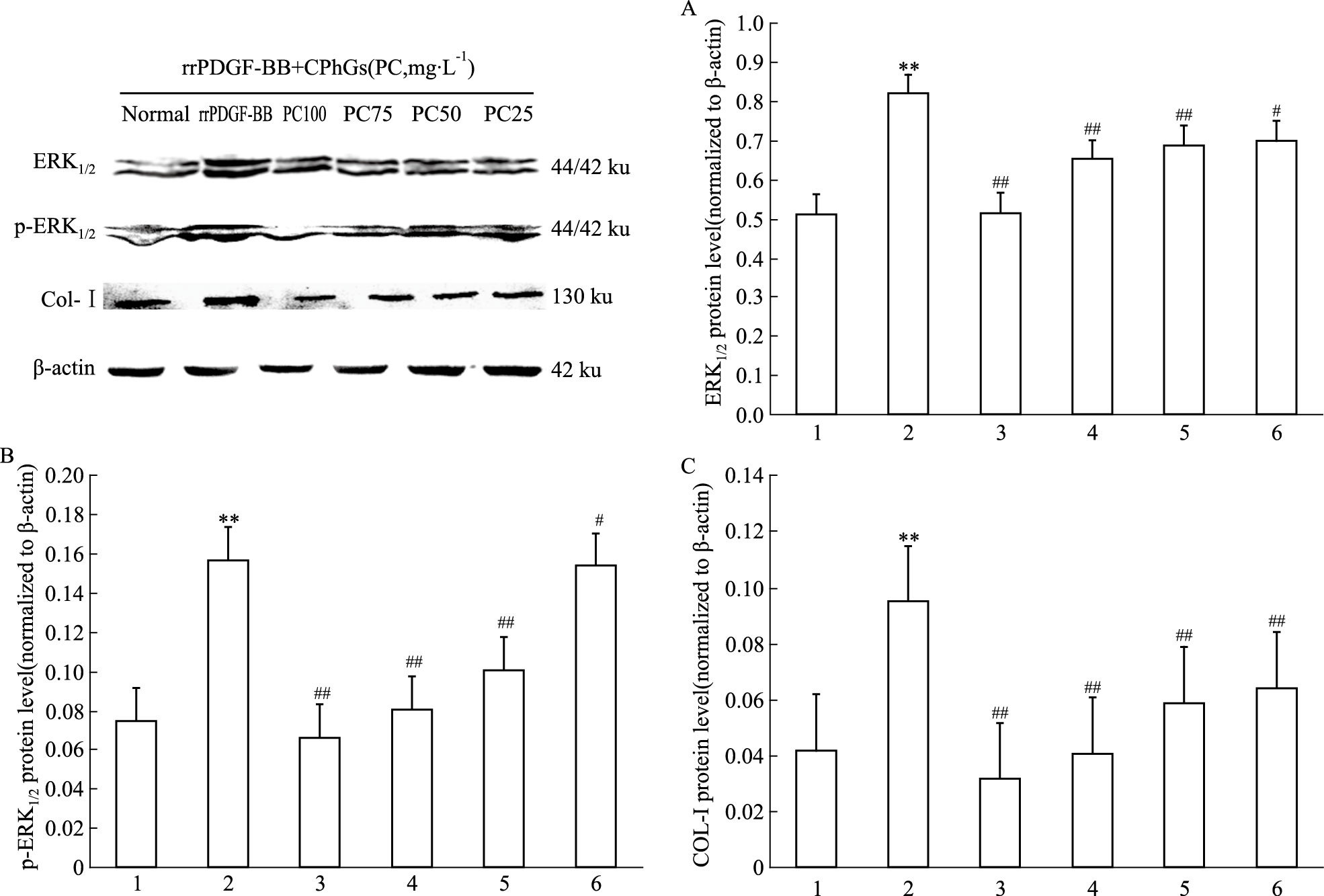
|
| 图 3 Effects of CPhGs on protein expression of ERK1/2,p-ERK1/2 and Collagen Ⅰ in HSC A:ERK1/2 protein level;B:p-ERK1/2 protein level;C:Collagen Ⅰ protein level.*P<0.05,**P<0.01 vs normal group;#P<0.05,##P<0.01 vs rrPDGF-BB group.1:Normal;2:rrPDGF-BB;3:PC 100 mg·L-1;4:PC 75 mg·L-1;5:PC 50 mg·L-1;6:PC 25 mg·L-1 |
PDGF主要源于血液中的血小板、肝窦内皮细胞、HSC、单核细胞、肝库普弗细胞等[9]。PDGF 包括-AA,-AB,-BB 3种亚型,其中PDGF-BB 主要位于肝脏,促HSC增殖的作用也最强,能促进HSC活化增殖、胶原分泌,是目前已知的促HSC增殖的细胞因子和促有丝分裂原;病理条件下静止的HSC表型会被激活,在肝纤维化进程中扮演着重要角色,能促使肝内的细胞-细胞、细胞-基质、基质-介质间相互作用,在复杂的网络系统中,促使细胞大量增殖;合成并分泌以胶原为主的ECM 和细胞因子、表达α-SMA、多种细胞因子及其受体、同时具有收缩功能。因此抑制rrPDGF-BB 对HSC的生物学作用对防治肝纤维化有重要的意义。
ERK1/2可被多种癌基因产物激活后向核内传递信号,磷酸化和活化核内的效应分子,调节下游核转录因子的表达,如c-myc、c-fos、c-jun、cyclin-D1、Bcl-2等,最终启动与调节细胞的生长、发育、分化、凋亡等多种生理过程相关的靶基因转录,发挥促进细胞的增殖、浸润、转移与恶性转化的功能[10]。c-fos和c-jun在成人正常组织中低表达,而在许多恶性肿瘤及其癌前病变中出现过度表达[11-12]。提示c-fos和c-jun的激活是细胞由正常状态向疾病状态转化的一个重要的生物学标志[13]。RT-PCR扩增检测ERK1/2、α-SMA、c-fos、c-jun、Collagen Ⅰ mRNA研究结果提示,PDGF/ERK1/2信号通路被激活,CPhGs可能通过阻断PDGF/ERK信号通路中ERK1/2、c-fos、c-jun、α-SMA、Collagen Ⅰ mRNA表达而起到治疗肝纤维化的作用。所以rrPDGF-BB作为一种损伤因素参与到肝纤维化的过程中,防治肝纤维化的重要途径之一是阻断rrPDGF-BB对HSC的生物学作用。
有研究[14-15]发现HSC中Ⅰ、Ⅲ型胶原的表达与ERK1/2有关,抑制HSC ERK1/2的活化或表达后,Ⅰ、Ⅲ型胶原的表达将被抑制,ERK1/2的表达随着肝纤维化的进展而明显增加,且与α-SMA的分布正相关[16]。因此以CPhGs作为干预药物,观察CPhGs对rrPDGF-BB 刺激的HSC增殖活性、Ⅰ型胶原、ERK1/2与α-SMA 表达的影响,可能成为CPhGs治疗肝纤维化的作用靶点。本研究结果显示,50~100 mg·L-1浓度的CPhGs,对rrPDGF-BB 刺激的HSC增殖活性具有明显的抑制作用,除25 mg·L-1浓度的CPhGs对rrPDGF-BB 刺激的HSC ERK1/2 mRNA的表达无明显差异外,其余浓度组的CPhGs ERK1/2及α-SMA mRNA的表达均有明显抑制作用,对rrPDGF-BB 刺激的HSC ERK1/2、p-ERK1/2和Collagen Ⅰ蛋白表达也具有抑制作用,随CPhGs浓度的增加抑制作用增强。
肉苁蓉作为一种名贵的中药材,在推动新疆特色沙漠产业的发展中具有重要地位;本研究对CPhGs药物的抗肝纤维化作用及机制进行研究,显示CPhGs能够阻断PDGF介导的HSC的活化及增殖作用,同时抑制胶原纤维蛋白的分泌,这可能是通过CPhGs药物干扰PDGF/ERK信号级联系统的相关信号分子及其磷酸化水平、抑制PDGF诱导的HSC活化和增殖来实现的。
( 致谢: 本实验主要在新疆医科大学第一临床医学院科技楼6楼细胞室及分子实验室完成,在此特别感谢实验室的负责老师及研究生同学的支持与帮助! )
| [1] | Kostadinova R, Montagner A, Gouranton E, et al. GW501516-activated PPARbeta/delta promotes liver fibrosis via p38-JNK MAPK-induced hepatic stellate cell proliferation[J]. Cell Bio Sci, 2012, 2 : 34-50 . |
| [2] | Mallat A, Lotersztajn S. Cellular mechanisms of tissue fibrosis.5. novel insights into liver fibrosis[J]. Am J Physiol, 2013, 305 : C789-99 doi:10.1152/ajpcell.00230.2013. |
| [3] | 彭龙希, 高思楠, 王媛, 等. 青蒿琥酯在大鼠体内外抗肝纤维化的作用[J]. 中国药理学通报, 2016, 32 (5) : 658-63 . Peng L X, Gao S N, Wang Y, et al. Effect of artesun ateonr atliver fibrogenesis invitroand in vivo[J]. Chin Pharmacol Bull, 2016, 32 (5) : 658-63 . |
| [4] | 陈小霞, 谢娟, 黄成, 等. EZH2对HSC-T6 细胞增殖活化的影响及其部分机制研究[J]. 中国药理学通报, 2015, 31 (8) : 1061-5 . Chen X X, Xie J, Huang C, et al. EZH2 plays a role in HSC-T6 cell proliferation and activationaffecting MAPK/ERK and PI3K/AKT pathway[J]. Chin Pharmacol Bull, 2015, 31 (8) : 1061-5 . |
| [5] | Sohrabpour A A, Mohamadnejad M, Malekzadeh R. Review article: the reversibility of cirrhosis[J]. Aliment Pharmacol Ther, 2012, 36 : 824-32 . |
| [6] | 李媛, 宋媛媛, 张洪泉. 肉苁蓉的化学成分及药理作用研究进展[J]. 中国野生植物资源, 2010, 29 (1) : 7-12 . Li Y, Song Y Y, Zhang H Q. Advancesin research of chemical constituents and medicinal activity of cistanche[J]. Chin Wild Plant Resour, 2010, 29 (1) : 7-12 . |
| [7] | 由淑萍, 赵军, 木克热木·吐地买提, 等. 肉苁蓉苯乙醇苷类成分对BSA诱导的肝纤维化大鼠转化生长因子β1表达的影响[J]. 癌变·畸变﹒突变, 2015, 27 (6) : 409-14 . You S P, Zhao J, Mukaram Tudimat, et al. The effects of Cistanche Phenylethanoid Glycosides on TGF-β1 expression of rats with hepatic fibrosis induced by BSA[J]. Carcinog Teratog Mutagen, 2015, 27 (6) : 409-14 . |
| [8] | You S P, Zhao J, Ma L, et al. Preventive effects of phenylethanol glycosides from Cistanche tubulosa on bovine serum albumin induced hepatic fibrosis in rats[J]. DARU J Pharm Sci, 2015, 23 : 52 doi:10.1186/s40199-015-0135-4. |
| [9] | Kwiecinski M, Elfimova N, Noetel A, et al. Expression of plate-let-derived growth factor-Cand insulin-like growth factor I in hepatic stellate cell is inhibited by miR-29[J]. Lab Invest, 2012, 92 (7) : 978-87 doi:10.1038/labinvest.2012.70. |
| [10] | Borkham-Kamphort E, Herrmann J, Stoll D, et al. Dominantnegative soluhle PDGF-beta receptorin hibitshepatics tellate cell activation attenuates liver fibrosis[J]. Lab Invest, 2004, 84 (6) : 766-77 doi:10.1038/labinvest.3700094. |
| [11] | Cheung T H, Leung J O. c-fos overexpression is associated with the pathoneogenesisof invasive cervicalcancer[J]. Gynecol ObstetInvest, 1997, 43 (3) : 200-3 . |
| [12] | Hartl M, Reiter F, Andreas G, et al. JAC, adirecttargetofoncogenic transcriptionfactorJun, is involved in cell transformation andtumorigenesis[J]. PNAS, 2001, 94 (24) : 13601-6 . |
| [13] | 陈建勇, 王聪, 王娟, 等. MAPK信号通路研究进展[J]. 中国医药科学, 2011, 1 (8) : 32-4 . Chen J Y, Wang C, Wang J, et al. Research progress of MAPK signal pathway[J]. Chin Med and Pharmacy, 2011, 1 (8) : 32-4 . |
| [14] | Svegliati-Baroni G, Ridolfi F, Di Sario A, et al. Intracellular signaling pathways involved in acetaldehyde-induced collagen and fibronectin gene expression in human hepatic stellate cells[J]. Hepatology, 2001, 33 (5) : 1130-40 doi:10.1053/jhep.2001.23788. |
| [15] | Qiang H, Lin Y, Zhong X, et al. Differential expression genes analyzed by cDNA array in the regulation of rat hepatic fibrogenesis[J]. Liver Int, 2006, 26 (9) : 1126-37 doi:10.1111/liv.2006.26.issue-9. |
| [16] | Zhang X L, Liu J M, Yang C C, et al. Dynamic expression of extracellular signal-regulated kinase in rat liver tissue during hepatic fibrogenesis[J]. World J Gastroenterol, 2006, 12 (39) : 6376-81 doi:10.3748/wjg.v12.i39.6376. |

