2. 中国科学院上海药物研究所, 上海 201203;
3. 中国科学院上海应用物理研究所, 上海 201204
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China;
3. Shanghai Institute of Applied Physics, Chinese Academy of Sciences, Shanghai 201204, China
固体制剂是临床上最为常用的剂型, 而缓控释制剂不但赋予了传统片剂、胶囊等剂型特殊的释药特征, 还蕴含着静态或动态的特殊单元结构/隔室的合理设计, 不同的结构设计具有截然不同的释药效果和临床疗效。药物研发除了原料药的创新外, 研制老药的新剂型、特别是通过制剂手段开发的给药系统, 在延长产品生命周期的同时能增强国际市场竞争力。目前, 制剂研发不仅强调创新, 而且仿制制剂的一致性评价亟待探究提高研发效率的评价技术和方法。
活性药物被加工成具有一定结构的剂型后, 制剂结构是影响其发挥疗效的基础因素。制剂的结构是特定处方与工艺技术的结果, 决定其递送药物的释放行为及其体内药代动力学行为。固体制剂的质量控制以释放度/溶出度为主, 但药物释放是药物、载体及释放环境三者相互作用的综合过程[1], 忽略给药系统制剂结构及其动态变化、仅用体外溶出/释放实验来预测和控制其在人体内的吸收, 做出是否一致的判断则有很大的风险。
同步辐射成像技术作为新一代的结构定量表征技术, 在揭示制剂内部精细结构方面展现了前所未有的能力, 能定量表征制剂的静态结构和动态结构, 剖析制剂工艺、甄别制剂间结构异同。本文从结构出发, 主要结合本课题组近年来基于同步辐射光源在原辅料粉体结构、颗粒单元结构、片剂结构、膜结构和动态结构和固体制剂工艺甄别等方面应用的研究经验, 将制剂的结构划分为剂型、制剂中间体、动态结构和分子结构等四级结构, 探讨其理论和方法问题, 提出基于制剂结构的药物一致性评价新策略。
1 制剂结构及其重要性 1.1 制剂的结构药物是用来预防、治疗疾病的活性物质, 但是原料药物不能直接用于患者, 必须制成具有一定结构特征的剂型 (溶液剂型也具有特定形式的结构特征), 并以合适的方式给药后才能发挥其临床疗效。依托上海光源, 中国科学院上海药物研究所张继稳课题组、上海应用物理研究所肖体乔组和英国Bradford大学Peter York等团队合作, 率先开展了药物制剂的定量结构研究, 提出结构药剂学理论和方法, 从宏观到微观将药物制剂的结构分类为四级结构, 即:一级结构:主要为剂型的形态与结构。临床上应用广泛的各种剂型及其内部结构, 如片剂、胶囊、颗粒剂等; 二级结构:制剂加工的中间体结构与药物原料的晶体结构。制备片剂时, 首先将药物粉体与辅料一起制粒, 其中间体就是制剂颗粒、药物的晶体等; 三级结构:制剂在溶出/释放过程中的动态结构。释药过程中剂型动态变化的内部结构与外部形态, 如片剂的崩解、分散; 颗粒与剂型的水化层、溶胀层和溶蚀前沿等; 四级结构:分子尺度的辅料与药物的分子结构。特别是药物分子与辅料在分子水平上的结构及其相互作用, 如环糊精包合物中的主客分子间的结构关系。
1.2 制剂结构的重要性在固体制剂中, 存在着不同的结构形式, 制剂的结构是研究多种剂型的核心要素之一。首先, 制剂结构决定着药物疗效的发挥, 相同的药物、剂型结构不同, 其疗效很可能不同。其次, 制剂结构决定和影响着制剂的释放特征, 制剂的固有结构决定药物制剂的释药机制, 即使具有类似的制剂宏观结构, 在溶出或释放过程中的动态结构的变化差异也会影响其释药行为。因此, 制剂结构决定和影响制剂的内在质量, 制剂的结构、尤其是缓控释制剂的结构, 是药物制剂设计和评价的关键因素, 共同决定了其体外释药速率与体内生物利用度等性质。
渗透泵类控释制剂主要由药物、半透膜材料、渗透压活性物质和助推剂组成, 具有丰富多彩的结构设计。其基本结构为片芯、包衣膜和释药孔。不同结构的渗透泵制剂, 其释药方式和释药速率不同。膨胀推动型结构的渗透泵, 主要以渗透压为推动力, 将药物推出渗透泵。单室单层结构的渗透泵制剂, 在片芯中加入吸水膨胀的高分子材料达到理想的零级释放[2]; 单室多层结构的三明治型/夹心型渗透泵制剂, 是将推进层置于两层药物中间, 两个药物层上均含释药孔, 避免含药层的识别, 适于两种不同药物, 尤其是有配伍禁忌药物的同步释放[3]; 为了实现药物的多脉冲释放, 在释药孔至药物层之间重复间隔填充空白层, 使药物滞后释放[4]。气压推动型结构的渗透泵, 以气压 (产气酸碱对) 为动力控制释药速率。将产气酸碱对与药物等直接混合、制备成泡腾型渗透泵制剂[5], 工艺简单但易突释, 不能达到理想的零级释放。可将药物层内置、产气物质外置包裹利用气压的推动作用, 使药物充分释放[6]。微孔型包衣膜的渗透泵制剂是以包衣膜内水溶性物质为致孔剂, 兼具了渗透压和扩散两种作用机制。不对称膜包衣的渗透泵制剂利用表层和基底层构成的不对称膜, 能提高药物的最终释放量, 且易于通过控制膜的结构和孔隙度来调节膜对水的通透性。渗透泵制剂膜上的释药孔也影响药物的释放, 因不同需要可调控内外释药孔的位置, 通过调节药物释放路径实现对释药曲线的调控[7]。
膜控型缓控释制剂是将一种或多种包衣材料对颗粒、片剂和小丸等进行包衣处理, 以控制药物的释放速率、释放时间或释放部位的制剂。将药物和辅料制粒, 压制成片, 用缓控膜材料包衣后通过控制包衣膜的材料和厚度达到不同的释药速率。膜控释小丸主要由丸芯和控释薄膜衣两部分组成, 选择不同的包衣膜材料达到不同的释药效果。布洛芬脂质微丸是依据阴阳离子的相互作用, 进行层层自组装包衣, 使其释放速率减慢, 具有一定的掩味效果[8]。
另外, 骨架型缓释制剂是药物和一种或多种骨架材料通过压制、融合等技术制成的片状、粒状或其他形式骨架的制剂。在水或生理体液中能维持或转变成整体式骨架结构, 药物以分子或结晶状态分布在骨架结构中, 起着贮库和控制药物释放的作用。亲水凝胶骨架片中药物的释放机制主要是在凝胶层中药物的扩散和凝胶层的溶蚀。药物的释放速率主要取决于药物的扩散速率与凝胶层的溶蚀速率[9]。溶解度大的药物, 释放机制主要表现为扩散; 溶解度小的药物, 释放机制主要表现为溶蚀; 不溶性的骨架片, 药物释放完骨架仍保持其形态。释药过程主要分为三步:消化液渗入骨架内、药物溶解和药物至骨架孔道扩散释放。孔道扩散是其释放的限速步骤, 释放符合Higuchi方程。溶蚀型骨架片中药物的释放机制以溶蚀为主, 释药过程中骨架的释药面积不断变化, 一般呈一级释药速率释药。以往的研究多以其释放结果为目标, 较少研究控制释放的制剂骨架精细结构及其动态变化。
2 以同步辐射X射线成像为主的制剂结构定量研究进展制剂的结构控制药物释放的速度、部位及制剂结构的动态变化影响药物作用与疗效。成像是研究药物制剂结构最直接的方法, 尤其是对制剂内部的精细结构进行成像, 能将制剂制备与使用过程中的静态与动态结构以可视化的方式直接呈现, 验证药物制剂结构的一致性。传统的光学显微镜、电子显微镜、原子力学显微镜等影像研究手段仅能给出二维和制剂表面特征, 不能有效地表征制剂的内部结构。核磁共振成像、太赫兹波成像、激光共聚焦成像、光学相干断层成像和X射线成像可用于制剂三维结构的表征, 但由于成像技术分辨率的不同, X射线成像具有较高的分辨率, 是最理想的三维成像技术。
同步辐射是在超高真空环境中, 电子在不同强度的电磁场的作用下, 以接近于光速的运动速度在弧形轨道上恒速、变方向运行时, 沿着运动方向的切线方向, 发射出的具有连续光谱的、性能优异的电磁辐射。以其高亮度、高准直性、高相干性及宽频谱范围的特点, 配合高性能的X射线探测器可实现高分辨率、高衬度的结构信息的快速、无损伤检测。计算机断层扫描 (computed tomography, CT) 通过利用X射线与探测器一同围绕被测物体进行快速连续的断面扫描, 得到被测物体的图像。相比于常规CT, 同步辐射X射线显微成像技术 (synchrotron radiation X-ray micro-computed tomography, SR-μCT) 的采集时间较短、分辨率高, 可以对结构及其动态演化进行定量研究, 在多层次、跨尺度结构研究中具有独特优势。药物制剂相关的结构基本介于亚微米至厘米尺度, 恰好处于SR-μCT技术最适合的分辨率水平内, 能实现原位在线检测、定量、精确表征不规则结构和多单元制剂的快速同步表征[10]。例如, SR-μCT可用于胶囊内的微丸、结晶、粉体和微球等单元结构的N-in-One方式结构测定。发展SR-μCT结构研究方法学, 为定量研究药物制剂的立体结构、发现和确证新型制剂结构以及探索释药机制提供了新的方向。
2.1 原辅料粉体结构制剂是由药物活性成分和辅料组成, 原辅料粉体中的药物晶型、粉体粒径及其分布、配比与规格直接影响药物制剂的质量。采用SR-μCT有效地区分不同结构的药物晶体, 实现制剂内药物晶型的辨识。Chen等[11]利用SR-μCT研究硫酸氢氯吡格雷的晶型, 以两种晶型硫酸氢氯吡格雷晶体与微晶纤维素丸芯的混合物为样本, 基于立体形态参数描述硫酸氢氯吡格雷晶体三维形态, 能有效地辨识晶型。Yin等[12]采用SR-μCT对氯吡格雷片剂内部的晶体形态进行原位检测, 定量表征氯吡格雷晶体在压片过程中的形变, 不同晶型的氯吡格雷在相同的压力下, 其形变行为差异反映了片剂内部压力场的分布情况。同时, 基于硫酸氢氯吡格雷与辅料的密度差异, 通过片剂进行CT, 得到其中的硫酸氢氯吡格雷微粒在片剂内的三维分布特征, 原位测定硫酸氢氯吡格雷微粒的粒径及其分布。此外, Yin等[13]采用SR-μCT研究多晶型混合物中硫酸氢氯吡格雷的晶型, 基于两种晶型颗粒表面的粗糙度差异, 有效地识别硫酸氢氯吡格雷的不同晶型 (图 1)。SR-μCT可以避免剂型中辅料的干扰, 准确识别药物的晶型, 且能无损伤、原位检测制剂内药物微粒的粒径及其分布。该方法解决了固体制剂内药物晶体的识别和药物粒径及其分布的测定难题, 具有重要应用价值, 为仿制药一致性评价中原辅料粉体结构的研究提供了新的视角和思路。
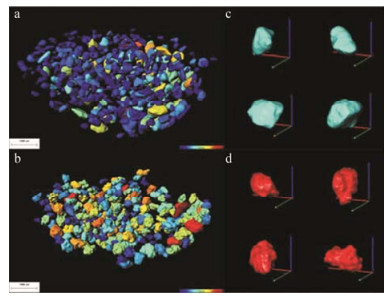
|
Figure 1 3D images of individual clopidogrel bisulphate crystal form Ⅰ and clopidogrel bisulphate crystal form Ⅱ microcrystalline particles in capsule after extraction and construction: (a) particles of clopidogrel bisulphate crystal form Ⅰ and (b) particles of clopidogrel bisulphate crystal form Ⅱ. Morphologies of randomly selected four particles: (c) particles of clopidogrel bisulphate crystal form Ⅰ and (d) particles of clopidogrel bisulphate crystal form Ⅱ[13] |
即使药物的活性成分、辅料的配比与规格都相同, 不同制备工艺获得的产品在制剂结构及其释放行为上可能不同。Lu等[14]采用SR-μCT技术对摇摆制粒、流化床制粒及高速搅拌制粒3种不同制备方法得到的健胃消食颗粒进行研究, 从颗粒的三维结构模型得到的定量数据准确地表征颗粒的不规则立体形态及内部精细结构, 可视化地揭示不同制粒方法对颗粒结构与形态的影响。Liu等[15, 16]采用SR-μCT研究不同制备工艺、处方所得的口腔崩解片的内部微观精细结构, 确定影响冻干口腔崩解片的崩解、脆碎差异的结构因素, 了解其力学基础和处方、制备工艺及宏观性质的关系 (图 2)。此外, Liu等[17]利用SR-μCT研究制粒过程中混合参数对均匀度的影响, 揭示容器旋转时间和振动时间对微晶纤维素丸芯和淀粉颗粒混合均匀度的影响, 首次建立了立体、可视化、定量测定二元颗粒系统混合均匀度的新方法, 有助于深入研究制剂过程的粉体结构及其分布特征 (图 3)。Wu等[18]通过SR-μCT测定卡托普利渗透泵片释药孔的三维结构参数, 研究激光功率和激光束的扫描速度与释药孔结构的关系, 为渗透泵控制药物释放的设计提供了新的视角。SR-μCT可用于定量研究固体制剂的制备工艺, 为药物一致性评价中制备工艺的研究提供新方法。
|
Figure 2 Structural models of orally disintegrating tablets made by molded freeze-drying (up), and freeze-dried orally disintegrating tablets made by freeze powders direct compression under low-temperature (down): 3D models (left), slides to show the structure subunits (right) |
|
Figure 3 Influence of the time of rotations (TR) for the mixed granular system at a rotation speed of 30 r·min−1. Each line corresponds to the same level of the cylindrical vessel. Images of each column correspond to the same time of rotation[17] |
微粒制剂是最重要的一大类剂型, 但缺少定量的结构研究方法。Lu等[14]采用SR-μCT针对颗粒结构的不规则性, 用盒维数方法计算获得颗粒的分形维度, 结果表明, 分形维度比常规的形态定量参数更为敏感, 实现对颗粒的特异性区分, 可以反映不规则结构颗粒在结构特征上的差异。Yang等[19, 20]采用SR-μCT对微米尺寸的单个微丸的内部精细结构进行了定量表征, 研究微丸内部结构与微丸释放的关系, 揭示了单微丸的释放与微丸的含药量、表面积和体积的相关性, 为预测影响微丸制备过程和释放行为的结构性质提供了可能性 (图 4)。此外, Guo等[21]用SR-μCT表征尤特奇微球释放过程中的精细结构变化, 将结构数据与释放行为进行定量关联, 从结构出发解释尤特奇E100的矫味机制。Wang等[22]采用同步辐射红外 (synchrotron radiation-based Fourier-transform infrared spectromicroscopy, SR-FTIR) 成像, 高灵敏、无损伤地检测单个微球中物质成分与功能性基团的分布。SR-μCT可定量地表征颗粒的单元结构, 为药物一致性评价中颗粒单元结构的研究提供了新的方法。
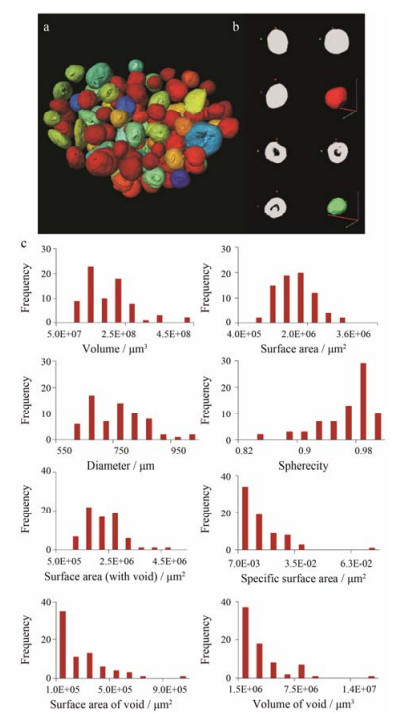
|
Figure 4 Characterization of the pellets. a: The reconstructed 3D model of pellets using SR-μCT showed the sphericity with the blue to red regions demonstrating incrementally higher sphericity; b: Typical pellets as solid or with a void; c: Frequency distribution for different parameters of the pellets[19] |
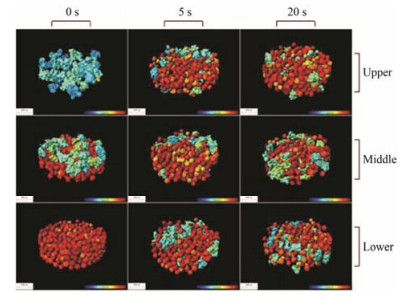
片剂的结构直接影响药物的释放。Yin等[23]通过研究非洛地平渗透泵片释放过程中片芯体积分维值和表面积分维值与片芯整体形状、内部孔道和表面结构变化的相关性, 表明分形维数是表征释药过程中片芯内部结构复杂变化的有效参数。此外, Yin等[9]采用SR-μCT研究获得了凝胶骨架片结构的立体参数, 定量分析了溶胀与溶蚀在难溶性药物控释中的相对重要性。Li等[24]通过SR-μCT对非洛地平渗透泵片在药物释放过程中的内部结构进行可视化研究。在药物释放的不同阶段, 将片剂的表面形态、水化效应、溶胀过程和结构变化以二维单色透视图像的形式完成可视化。同时, 发现释放过程中片剂的三维表面积几乎不变, 揭示了渗透给药系统实现零级释放的内部结构的作用 (图 5)。Liu等[16]以SR-μCT观察并定量分析不同制备工艺的口腔崩解片内部精细结构, 同时测定片剂的崩解性质和脆碎特征, 结果显示不同处方与工艺所得的口腔崩解片的精细结构存在显著的差异, 冰颗粒直压法片子内部呈松散聚集的颗粒态, 模制冻干法片子内部呈一体化致密网状结构。SR-μCT为定量研究片剂内部静态与动态结构提供了新方法。
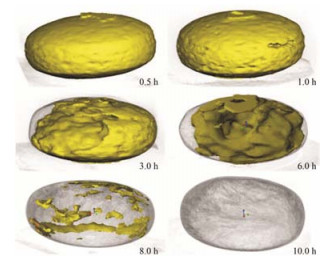
|
Figure 5 Reconstructed three dimensional images of felodipine monolithic osmotic tablet system at different sampling time (yellow represents the solid moiety of the tablet core, air appears grey)[24] |
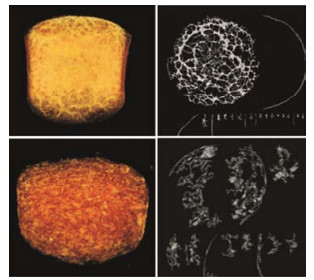
薄膜包衣技术常用于改善外观, 突出产品个性; 针对一些理化性质不稳定、成分复杂、吸湿性较强、吸湿后会发生变色、软化等现象的药物, 发挥物理隔离作用; 同时, 包衣膜也是控释制剂的基本结构单元。因此, 包衣膜的结构研究具有独特价值。研究报道SR-FTIR显微成像技术可用于包衣膜结构的研究, Feng等[8]采用SR-FTIR对包衣后微丸横切面及包衣膜的组成物质分布进行研究, 证实阴阳离子的静电吸附对包衣膜的形成具有重要作用, 建立了定量表征包衣膜内物质存在与分布的方法, 可用于药物输送系统中膜结构研究。Wu等[25]采用SR-FTIR研究渗透泵片的水化诱导渗透泵片膜材料的转移, 定量分析药物释放过程中水不溶性膜材料成分 (醋酸纤维素) 和水溶性膜材料成分 (聚乙二醇) 的含量变化。结果表明, 水化诱导渗透泵膜材料中水溶性物质的转移, 促进了药物的释放, 进一步揭示了渗透泵包衣膜制剂释放的机制 (图 6)。SR-FTIR能定量表征包衣膜内物质的分布, 为药物输送系统中膜的研究提供了一个新的有效工具。
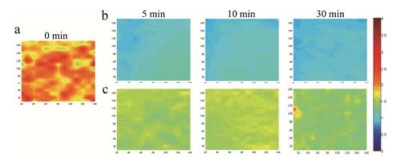
|
Figure 6 Chemical distribution of relative intensity ratios of polyethylene glycol to cellulose acetate for the in situ membrane after hydration for 0 min (a), the in situ membranes after hydra tion for 5, 10 and 30 min (b), and the isolated membranes after hydration for 5, 10 and 30 min (c)[25] |
渗透泵型给药系统中释药孔的大小、形状及深度均会影响片芯药物的释放, 是决定制剂质量的重要因素。对于释药孔的评价, 目前主要局限在二维结构上, 一般将含有释药孔的包衣膜剥离下来, 在显微镜或电镜下观察释药孔的大小, 不能评价真实三维结构。利用SR-μCT, 对渗透泵片进行CT扫描, 分离提取释药孔的三维结构 (图 7), 与包衣膜的厚度 (约50 μm) 相比, 释药孔的深度为575.6 μm, 表明释药孔远远穿透了包衣膜, 深入至片芯内部。分别考察不同激光扫描速度和功率所形成的释药孔的三维结构特征, 结果表明, 随着激光扫描速度的加快, 提取出来的释药孔的二维横截面积、表面积、体积和深度均逐渐减小。使用SR-μCT对释药孔三维结构的研究加深了对渗透泵型给药系统内部微细结构的认识, 为渗透泵控制药物释放的设计提供了新的视角[18]。
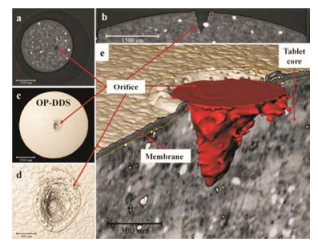
|
Figure 7 Visualization and 3D structure determination of laser drilled orifices. Slice of the orifice (a and b, from different perspectives), 3D visualization of the orifice (c and d, d is the magnification of c), and extraction of architectures (e) of the laser drilled orifices from the osmotic pump tablets[18] |
作者团队[24]率先采用SR-μCT成像技术, 研究渗透泵制剂的立体释药动力学。通过SR-μCT对非洛地平渗透泵片在药物释放过程中的内部结构进行原位动态测定和定量分析, 研究立体结构参数变化与药物释放的相关性。结果表明, 在药物释放过程中, 包衣型渗透泵片剂内部残留物的三维表面积几乎不变, 揭示了渗透给药系统的立体释药机制。另外, Yin等[9]采用SR-μCT成像技术研究难溶性药物非洛地平凝胶骨架片的释药动力学, 研究获得了凝胶骨架片片芯、水化层、溶蚀层相关的众多立体参数, 优选立体参数, 建立了基于立体参数定量刻画非洛地平凝胶型骨架片释放动力学的模型, 定量分析了溶胀与溶蚀在难溶性药物控释中的相对重要性 (图 8)。相比于测定片剂水化程度等传统方法, SR-μCT成像技术在研究固体制剂动态结构方面展现了前所未有的定量性和结构性。
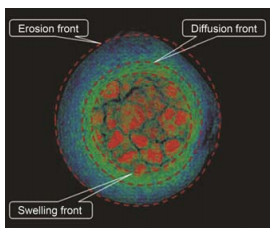
|
Figure 8 Schematic diagram of the swelling front, the diffusion front, and the erosion front of felodipine hydroxypropyl methyl cellulose tablet during drug dissolution[9] |
制剂结构一致性是指仿制药与原研药在药物制剂四级结构上的一致, 即剂型的形态与结构、制备该剂型所用颗粒的单元结构、制剂溶出/释放过程中的动态结构及分子水平上的辅料与药物分子结构的一致。具体地说, 是仿制制剂与原研制剂在一级结构的剂型种类、外观形态与内部结构上的一致; 是二级结构中用于加工制剂的颗粒等中间体结构、药物原料的晶体结构等的一致, 包括制剂加工过程中的颗粒单元结构、制备工艺及参数、原辅料的晶型、粒径分布、辅料的配比; 是三级结构中药物溶出/释放过程中剂型的动态变化的内部结构及外部形态的一致, 如片剂的崩解、分散, 骨架的形态, 颗粒与剂型的水化层、溶胀层和溶蚀前沿等; 是四级结构中分子尺度的辅料、药物分子结构的一致, 包括辅料的规格与型号、药物分子的结构、辅料与药物分子的相互作用等。
制剂结构一致性的定量评价策略:在定量测定原研制剂、仿制制剂的结构后, 计算机上重建其定量结构模型, 基于影像重叠, 计算图像的重合度; 或将结构转换为矩阵, 计算两者间的矢量夹角余弦相似性指数或均方根偏差, 用于定量评价制剂结构的一致性。作者团队正在以实例验证本策略。
3.2 原研制剂结构的剖析原研药是指境内外首个获批上市, 且具有完整和充分的安全性、有效性数据作为上市依据的药品。原研制剂中药物的晶型、粒径及其分布、辅料的型号与配比、制备工艺、包衣膜等影响药物的释放与疗效。因此, 评价仿制药是否具有结构一致性时, 不能仅依靠4条溶出曲线, 应对原研制剂的四级结构进行剖析, 通过对其内部精细结构与动态结构的解读, 分析制剂结构与制剂处方组成、制备工艺及药物释放机制的相关性, 将制剂释药行为的一致延伸至内部精细结构上的一致性, 从四级结构上对原研制剂的内部精细结构进行再认识, 有助于开发性能与质量优良的仿制产品。本文基于同步辐射光源成像技术在定量制剂结构方面的应用, 从制剂四级结构出发, 将各级制剂结构剖析的主要内容归纳为, 一级结构:剂型的种类及其外观形态、大小等形态因素, 内部精细结构特征; 二级结构:制剂加工过程中的中间体的结构与形态、药物晶型、粒径及其分布、药物颗粒的形貌、药物及关键辅料在剂型内的立体分布; 三级结构:溶出/释放过程中剂型或微粒的结构变化; 关键成分跨越包衣膜等制剂结构的动态物质转移现象; 四级结构:辅料的种类、规格与型号; 药物分子的结构; 辅料与药物分子的相互作用。
3.3 制剂结构一致性评价的研究内容药品一致性研究是追求仿制药和原研药高度一致的研发过程。药品的质量源于科学的设计, 因此, 仿制药与原研药的“一致性”不仅仅是指产品检验结果的一致性, 更是内在品质和功能等多方面的一致。高度一致的结构是保证仿制与原研制剂内在质量具有相同品质的前提。相同质量的制剂不仅仅在质量标准所设定的检验项目指标上的一致, 还包含影响产品质量的其他要素, 而结构性质则是最具有决定性价值、最难定量研究的因素。只有在剂型的结构设计时考虑到与原研制剂的一致性, 才能保证仿制制剂与原研制剂质量的一致, 才能有效实现药学等效。原辅料的来源、原料晶型的控制、处方及工艺参数的筛选、生产过程及最终产品的控制等均直接影响药品的质量和稳定性[26, 27]。因此, 研究仿制与原研制剂的一致性, 应从药物制剂的四级结构出发, 全面进行基于结构的制剂逆向工程设计和一致性研究 (图 9)。
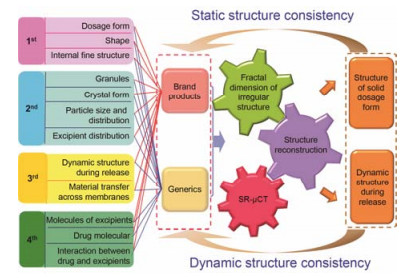
|
Figure 9 Road map for structure based strategy for consistency evaluation of dosage forms |
当前正在开展的仿制药质量一致性评价工作, 时间紧、研发投入大, 牵涉到用药质量和企业发展的重大利益, 从选择参比制剂, 到开展生物等效性试验, 最后获得一致性评价结果, 存在太多不确定因素。因此, 药品生产企业开展一致性评价的难度大、极具挑战性。从制剂定量结构出发, 同步辐射X射线成像技术与三维重建、图像处理、立体建模和定量分析技术相结合, 能从静态和动态两个角度, 实现制剂结构的可视化、定量化, 精准定量不同层次的药剂学精细结构, 确保仿制制剂与原研制剂从分子水平到剂型宏观结构等不同层次的一致性, 逆向工程精准开发仿制药, 为仿制制剂的一致性研究提供新的视角与思路。
| [1] | Yang S, Yin XZ, Li HY, et al. Research progress onarchitec & shy; ture of dosage forms using synchrotron radiation X-ray micro-tomography[J]. Chin Bull Life Sci (生命科学), 2013, 25: 794–802. |
| [2] | Shokri J, Ahmadi P, Rashidi P, et al. Swellable elementary osmotic pump (SEOP): an effective device for delivery of poorly water-soluble drugs[J]. Eur J Pharm Biopharm, 2008, 68: 289–297. DOI:10.1016/j.ejpb.2007.06.006 |
| [3] | Liu LX, Ku J, Khang G, et al. Nifedipine controlled delivery by sandwiched osmotic tablet system[J]. J Control Release, 2000, 68: 145–156. DOI:10.1016/S0168-3659(00)00243-1 |
| [4] | Wong PSL, Edgren DE, Dong LC, et al. Controlled release liquid active agent formulation dosage forms: US, 6596314 [P]. 2003-07-22. |
| [5] | Li XD, Pan WS, Nie SF, et al. Studies on controlled release effervescent osmotic pump tablets from Traditional Chinese Medicine Compound Recipe[J]. J Control Release, 2004, 96: 359–367. DOI:10.1016/j.jconrel.2004.01.026 |
| [6] | Khan ZA, Tripathi R, Mishra B. Floating elementary osmotic pump tablet (FEOPT) for controlled delivery of diethylcarbamazine citrate: a water-soluble drug[J]. AAPS PharmSciTech, 2011, 12: 1312–1323. DOI:10.1208/s12249-011-9699-6 |
| [7] | Faour J, Coppari MA. Osmotic device within an osmotic device: US, 6491949 [P].2002-12-10. |
| [8] | Feng J, Guo Z, Wu L, et al. Taste-masking mechanism of layer-by-layer self-assembly coating investigated by synchrotron radiation-based Fourier-transform infrared spectromicroscopy[J]. Acta Pharm Sin (药学学报), 2016, 51: 985–990. |
| [9] | Yin XZ, Li HY, Guo Z, et al. Quantification of swelling and erosion in the controlled release of a poorly water-soluble drug using synchrotron X-ray computed microtomography[J]. AAPS J, 2013, 15: 1025–1034. DOI:10.1208/s12248-013-9498-y |
| [10] | Du GH, Cheng RC, Xie HL, et al. The micro-tomography in synchrotron radiation[J]. Prog Biomed Eng (生物医学工程学进展), 2009, 30: 226–231. |
| [11] | Chen L, Wang LY, Yin XZ, et al. Identification of the poly-morphs of clopidogrel bisulfate based on the steric morphology parameters of crystals[J]. Acta Pharm Sin (药学学报), 2013, 48: 1459–1463. |
| [12] | Yin XZ, Wu L, Li Y, et al. Visualization and quantification of deformation behavior of clopidogrel bisulfate polymorphs during tableting[J]. Sci Rep, 2016, 6: 21770. DOI:10.1038/srep21770 |
| [13] | Yin XZ, Xiao TQ, Nangia A, et al. In situ 3D topographic and shape analysis by synchrotron radiation X-ray microtomo-graphy for crystal form identification in polymorphic mixtures[J]. Sci Rep, 2016, 6: 24763. DOI:10.1038/srep24763 |
| [14] | Lu XL, Zheng Q, Yin XZ, et al. Quantitative structure characteristics and fractal dimension of Chinese medicine granules measured by synchrotron radiation X-ray computed micro tomography[J]. Acta Pharm Sin (药学学报), 2015, 50: 767–774. |
| [15] | Zhang JW, Guo Z, Liu CB, et al. Low-temperature pressing method of rapidly disintegrating tablets: CN, 103191023A [P]. 2014-06-25. |
| [16] | Liu CB, Guo Z, Li B, et al. Investigation of microstructures of freeze-dried orally disintegrating tablets by synchrotron radiation X-ray computed microtomography[J]. J China Pharm Univ (中国药科大学学报), 2014, 45: 48–53. |
| [17] | Liu RH, Yin XZ, Li HY, et al. Visualization and quantitative profiling of mixing and segregation of granules using synchro-tron radiation X-ray microtomography and three dimensional reconstruction[J]. Int J Pharm, 2013, 445: 125–133. DOI:10.1016/j.ijpharm.2013.02.010 |
| [18] | Wu L, Wang LB, Wang SX, et al. Three dimensional structural insight of laser drilled orifices in osmotic pump tablets[J]. Eur J Pharm Sci, 2016, 93: 287–294. DOI:10.1016/j.ejps.2016.08.039 |
| [19] | Yang S, Yin XZ, Wang CF, et al. Release behavior of single pellets and internal fine 3D structural features co-define the in vitro drug release profile[J]. AAPS J, 2014, 16: 860–871. DOI:10.1208/s12248-014-9611-x |
| [20] | Yang S, Wang CF, Li X, et al. Release kinetics of single pellets and the multi-pellet system of tamsulosin hydrochloride sustained release pellets[J]. Acta Pharm Sin (药学学报), 2014, 49: 535–542. |
| [21] | Guo Z, Yin XZ, Liu CB, et al. Microstructural investigation using synchrotron radiation X-ray microtomography reveals taste-masking mechanism of acetaminophen microspheres[J]. Int J Pharm, 2016, 499: 47–57. DOI:10.1016/j.ijpharm.2015.12.045 |
| [22] | Wang ML, Lu XL, Yin XZ, et al. Synchrotron radiation-based Fourier-transform infrared spectromicroscopy for characterization of the protein/peptide distribution in single microspheres[J]. Acta Pharm Sin B, 2015, 5: 270–276. DOI:10.1016/j.apsb.2015.03.008 |
| [23] | Yin XZ, Li HY, Liu RH, et al. Fractal structure determines controlled release kinetics of monolithic osmotic pump tablets[J]. J Pharm Pharmacol, 2013, 65: 953–959. DOI:10.1111/jphp.12056 |
| [24] | Li HY, Yin XZ, Ji JQ, et al. Microstructural investigation to the controlled release kinetics of monolith osmotic pump tablets via synchrotron radiation X-ray microtomography[J]. Int J Pharm, 2012, 427: 270–275. DOI:10.1016/j.ijpharm.2012.02.017 |
| [25] | Wu L, Yin XZ, Gou Z, et al. Hydration induced material transfer in membranes of osmotic pump tablets measured by synchrotron radiation based FTIR[J]. Eur J Pharm Sci, 2016, 84: 132–138. DOI:10.1016/j.ejps.2016.01.020 |
| [26] | Yu SS, Zhang ZF, Li ZQ. Investigation and countermeasures to the current status of the generics quality consistency evalua-tion[J]. Chin J Clin Pharm Ther (中国临床药理学与治疗学), 2015, 20: 118–120. |
| [27] | Yu QH. Consistency evaluation of generic drugs and original drugs in China[J]. Shanghai Med Pharm J (上海医药), 2013, 34: 35–37. |
 2017, Vol. 52
2017, Vol. 52

