2. 中国科学院上海药物研究所, 上海 201210
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201210, China
药物制剂的口感是影响患者顺应性的重要因素,因此口感是药物制剂处方工艺的重要评价指标。《中国药典》收载的化学药物中,超过1/3有不同程度的苦味[1]。布洛芬是世界卫生组织、美国FDA唯一共同推荐的儿童退烧药,是公认的儿童首选抗炎药。其不良口感直接影响儿童用药的顺应性,结合布洛芬熔点低、不溶于水等特性,本文选用布洛芬作为模型药物。常用的矫味机制主要有: 加入矫味剂混淆味蕾、避免不良口感药物与味蕾直接接触、可逆和暂时地麻痹味蕾、通过与药物竞争苦味受体或阻断向大脑发送苦味信号等[2]。针对以上矫味机制,主要掩味技术有包衣、固体分散、离子交换树脂和甜味剂等[3]。其中,包衣是最有效和最常用的掩味技术之一[4,5]。通过包衣在制剂表面形成膜,可以掩盖药物不良口感、提高药物稳定性[4, 5, 6, 7, 8]。微丸等颗粒剂包衣辅料利用率低,较难形成完整包衣膜,往往颗粒增重较大。
基于聚电解质阴阳离子所带正负电荷之间的静电作用,采用层层自组装 (layer-by-layer self-assembly,LBL) 方法进行包衣成膜具有精确可控、性能可调的特点[9, 10, 11]。本文利用阴阳离子的静电作用,以壳聚糖 (≥ 95% 脱乙酰度、黏度为50~800 mPa·S、分子质量为100万以上) 为阳离子和明胶为阴离子在布洛芬脂质微丸的表面形成包衣膜。包衣膜的表征对包衣处方、工艺具有指导意义,常用的膜研究方法有一定的局限性,扫描电镜只能观察膜的形态及表观结构现象,对膜内部组成物质及分布无法探究[12,13]; 脉冲太赫兹波成像技术只反映包衣膜厚度的变化,无法对包衣膜内部进行分析[14,15]。同步辐射红外 (SR-FTIR) 具有宽光谱范围、高准直性和高亮度等[15, 16, 17, 18]特点,在整个红外波段的亮度是传统热光源亮度的2~3个数量级 以上[17],是对样品进行微区分析的一项新技术[16, 17, 18, 19]。采用SR-FTIR不仅可以获得样品的高质量单谱,而且还可以采用绘图模式 (mapping) 进行化学成像,从而获得特定组分的代表性化学官能团的平面分布。这些特性使其在生物细胞等研究领域获得广泛应 用[17,18],同时也适合于显微光谱成像对微球、丸剂的研究[19]。
本文应用SR-FTIR成像技术,研究壳聚糖与明胶在布洛芬脂质微丸表面形成的包衣膜,获得微丸及膜各组成物质高质量的单谱; 同时,通过扫描微丸的横切面获得mapping图,分析观察微丸膜组成物质的分布,探究SR-FTIR成像技术用于膜研究的方法。
材料与方法试剂与仪器 布洛芬 (20130307,湖北百科格莱制药有限公司); 壳聚糖 (YK110708148,浙江金壳生物化学有限公司); 明胶 (20100410)、切片石蜡 (20080911) (国药集团化学试剂有限公司); SR-FTIR 图像采集在中国科学院上海应用物理研究所上海光源BL01B实验站进行; 图像处理软件为Ominic software 9.2.86 (Thermo Fisher Scientific,Inc.); 统计分析软件为Matlab (R2012a版,美国Math Works公司)。
矫味脂质微丸制备 十八醇为蜡状白色晶体,有香味,具有熔点低 (59.4~59.8 ℃)、沸点高 (210.5 ℃) 和不溶于水的特性,可作为脂质微丸的基质。称取适量布洛芬与十八醇按照1:2 (w/w) 混合于烧杯中,水浴加热至60 ℃,直至布洛芬与十八醇完全熔融,搅拌使混合均匀。1 mL注射器经预热至60 ℃后,吸取熔融态的十八醇与布洛芬混合液,加载规格为4.5号针头,推动活塞,在空气中固化,收集,即得到粒径为500~1 500 μm的布洛芬矫味脂质微丸。
包衣溶液的配制 量取冰醋酸10 mL加入到含900 mL去离子水的1 L量瓶中,摇匀,再加去离子 水定容到刻度,得到1% (v/v) 冰醋酸溶液。称取壳聚糖10 g,置于另一个1 L量瓶中,加入1% 冰醋酸溶液900 mL,磁力搅拌 (200 r·min-1,40 ℃) 使完全溶解,剩余1% 冰醋酸溶液定容到刻度,即得到1% 壳聚糖溶液,备用。称取明胶10 g置于1 L量瓶中,加入去离子水900 mL,磁力搅拌 (200 r·min-1,40 ℃),使完全溶解,用去离子水定容至刻度,备用。
微丸包衣 在包衣过程中,先包裹壳聚糖再包裹明胶,并依次重复。将布洛芬的脂质微丸 (200 mg) 置于抽滤瓶中,先加入1% (w/v) 壳聚糖溶液20 mL,浸没微丸,5 min后真空抽出溶液,再加入1% 明胶溶液20 mL,5 min后抽滤。每包裹1次壳聚糖和1次明胶为1个循环,共交替包裹20、40、60和80个循环,记为交替包裹20、40、60和80层,口尝评价,交替包裹80层能达到满意矫味效果。同时只用1% 壳聚糖溶液或1% 明胶溶液对布洛芬的矫味脂质微丸分别包裹80次,作为对照。
微丸的释放 人的吞咽时间较短,前30 s药物的释放对药物的口感起关键性作用。分别取150 mg的未包裹矫味微丸、壳聚糖包裹80层微丸、明胶包裹80层微丸和明胶、壳聚糖交替包裹80层微丸,置于西林瓶中,加入37 ℃、pH 7.2磷酸盐缓冲液 (PBS) 15 mL作为释放介质。在摇床中振摇 (200 r·min-1,37 ℃),在15、30和60 s时取样0.5 mL并补充同体积37 ℃的PBS缓冲液。采用高效液相色谱法检测样品的释放度,每组微丸平行测定3次,计算获得其释放度。
HPLC检测条件 用十八烷基硅烷键合硅胶为填充剂,以醋酸钠缓冲液 (取醋酸钠6.13 g,加水750 mL,振摇使溶解,用冰醋酸调节pH至2.5) -乙 腈 (40:60) 为流动相; 检测波长为263 nm。理论塔板数按布洛芬计算不低于1 100。
SR-FTIR测定制样方法
粉末碎片 用刀片在交替包裹80层的微丸表面轻划,取细小粉末,置于氟化钡基片上进行红外扫描。
石蜡包埋切片 将切片石蜡 (熔点为48~50 ℃) 在水浴加热至50 ℃,完全熔融后,分为4份放于烧杯中; 分别将未包裹、壳聚糖包裹80层、明胶包裹80层和交替包裹80层的微丸样品倒入烧杯,搅拌使分散均匀,再倒入长方体模槽中,冷却。将含微丸样品的石蜡在切片机上进行切片处理,设置步长为10 μm,得到微丸的横切面。显微镜下操作,将获取的微丸的横切面样品置于氟化钡基片上,进行SR-FTIR单谱及mapping扫描绘图。
SR-FTIR显微成像
SR-FTIR谱扫描 分别将壳聚糖、明胶、布洛芬和十八醇等单组分物质、粉末碎片和微丸横切面放于无干扰物的氟化钡基片上,基片放置镜头下,在普通光显微镜下找到视野后,转换为红外显微成像镜头。设置扫描参数: 红外显微镜光栏为10 μm × 10 μm,光谱范围650~4 000 cm-1,分辨率4 cm-1,扫描累加次数128次,选择样品上的某一点进行扫描,每个样品选择5个不同区域的点。每个样品扫描前都必须进行背景扫描。对微丸横切面分别进行内部、微丸表面 (内表面、外表面) 及外部的单谱扫描,比较布洛芬、壳聚糖及明胶的吸收情况。
Mapping扫描 分别在壳聚糖包裹80层、明胶包裹80层和交替包裹80层样品的横切面上选择一块合适的区域进行mapping扫描,设置扫描参数进行微区放大,光谱范围650~4 000 cm-1,分辨率4 cm-1,步长10 μm,扫描累加次数64次。得到mapping谱图后,绘制积分分布图和比值谱图,进行分析。
结果与讨论 1 药物释放研究释放度测定结果表明,交替包裹后的微丸释放较慢,包衣能够抑制布洛芬的释放,交替包衣成膜后效果最佳 (图 1)。单独包裹壳聚糖样品由于本身具有黏性及在释放介质中溶胀,虽然有一定的阻止释放的作用,但壳聚糖与明胶通过阴阳离子静电作用协同包裹在布洛芬脂质微丸的表面,形成包衣膜,缓释效果更明显。布洛芬含1个羧基,在水环境下带少量负电,作为基质的十八醇含醇羟基也带有少量负电,因此,带少量负电的脂质微丸通过离子静电作用先包裹阳离子壳聚糖[20]并使微丸表面附着壳聚糖从而带正电; 再包裹带负电的阴离子明胶[21]。重复以上过程,以阴阳离子与带相反电荷的微丸之间的静电作用为驱动力,将包衣物质以分子形式一层一层地交替沉积在微丸表面,形成完整的包衣膜[22,23]。利用包衣膜控制药物在口腔中的释放及隔绝药物与味蕾接触,最终达到矫味目的。
 | Figure 1 The release profiles of pellets coated with different materials in phosphate buffer saline (PBS) 7.2. ◆: Gelatin; ■: Gelatin and chitosan; ▲: Chitosan; ×: Lipid pellets without coating. n = 3,x±s |
分别采集布洛芬、十八醇、壳聚糖和明胶等各单组分物质的红外图谱,并进行平滑处理和自动基线校准。结果显示,布洛芬在1 723 cm-1附近的强吸收是布洛芬结构中羧酸根碳氧双键的伸缩振动,为布洛芬的特征峰 (图 2a); 十八醇在1 462 cm-1附近的吸收可作为特征吸收峰 (图 2b); 壳聚糖的特征吸收峰在1 615 cm-1和1 653 cm-1附近 (图 2c); 明胶的红外波谱中1 643 cm-1附近的酰胺Ⅰ谱带、1 548 cm-1附近的酰胺II谱带作为明胶的特征吸收峰 (图 2d)。
 | Figure 2 Synchrotron radiation-based Fourier-transform infrared spectra (SR-FTIR) of ibuprofen (a),octadecanol (b),chitosan (c),gelatin (d),inside of pellets (e),inner surface of pellets (f),outer surface of pellets (g),fragment (h),outside of pellets (i),with dramatic differences at the bands of 1 800-1 500 cm-1 (right); synchrotron radiation-based Fourier-transform infrared light spot moved from internal pellets (j),inner surface of pellets (k) to outer surface of pellets (l) have been demonstrated in the schematic diagram (left) |
由交替包裹80层样品微丸表面剥离的粉末在酰胺谱带及壳聚糖的特征峰处均有明显吸收 (图 2h),证实在微丸的表面存在壳聚糖和明胶,并有可能形成包衣膜。同时,分别扫描交替包裹80层样品横切面的微丸内部 (图 2e)、微丸内表面 (图 2f)、微丸外表面 (图 2g) 及微丸外部 (图 2i)。布洛芬由微丸内部到微丸内表面吸收峰稍微减弱 (图 2f),但光斑向外移动到微丸外表面时,布洛芬的吸收明显减弱 (图 2g),直到光斑到达膜外不存在布洛芬的吸收 (图 2i),从而展示了布洛芬在微丸内到外的分布变化情况。在微丸内表面、外表面均可观察到明胶、壳聚糖的吸收特征峰 (图 2f,2g),证实微丸表面有壳聚糖和明胶。
2.2 SR-FTIR mapping线性提取扫描图由SR-FTIR mapping图谱中提取沿微丸横切面由内向外,即微 丸中心向微丸表面的吸收图谱 (图 3,从1到14),直观展示布洛芬和膜组成物质吸收强度的渐变过程。1 723 cm-1附近的布洛芬的特征吸收峰强度从内部向外部开始保持不变,当扫描到达微丸表面 (横切面边缘) 后吸收逐步减弱; 同时,明胶和壳聚糖在1 615 cm-1的共同吸收峰在微丸内表面突然出现,随后增强; 微丸外表面出现了明胶的特征双峰,进一步证实明胶与壳聚糖在微丸的表面存在并可能形成保护膜。在膜的吸收谱中同时观察到药物与电解质的吸收峰,这是由于光斑及扫描步长较大 (10 μm × 10 μm) 且膜的厚度有可能小于10 μm,导致在单次谱扫描中,既包括膜区域也涵盖内部含药区域,或部分药物在包衣过程中扩散进入膜内。
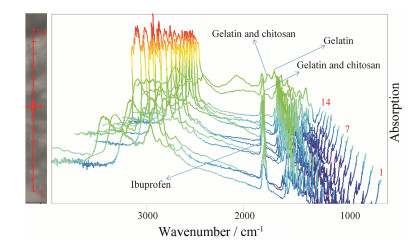 | Figure 3 Synchrotron radiation-based Fourier-transform infrared spectra of 14 scanning points (numbered from inter to outer of pellets,1 to 14) extracted from mapping image demonstrated that the absorptions of chitosan and gelatin existed on the surface of the coated pellets |
明胶与壳聚糖交替包裹样品的SR-FTIR mapping图,用Ominic软件进行平滑处理和基线自动校准后,分别对壳聚糖峰和明胶峰进行峰面积的积分,获得两种物质在微丸横切面的积分分布图(蓝色和红色代表强度,蓝色为弱,红色为强)。壳聚糖 (图 4a)积分分布图与明胶(图 4b) 积分分布图展示二者在微丸内部和微丸外部均无吸收,仅在微丸表面上有明显吸收且密集连续,证实壳聚糖与明胶在微丸表面形成膜。同时,该吸收沿着微丸表面呈带状,且分布不均匀。积分分布图表明,壳聚糖与明胶形成包衣膜,既能减缓药物释放,也能隔绝药物与味蕾接触,实现掩味目的。
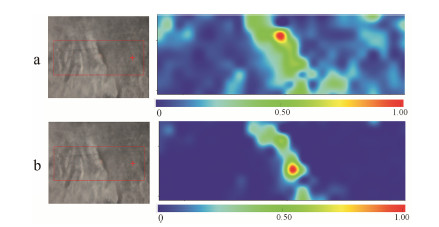 | Figure 4 Distributions of chitosan and gelatin determined by integral distribution map. a: The integral distribution map gained from the typical peak of chitosan in scanning area; b: The integral distribution map gained from the typical peak of gelatin in scanning area. The red boxes indicated the area imaged by synchrotron radiation-based Fourier-transform infrared spectromicroscopy (left); distributions of chitosan or gelatin (right) |
明胶与壳聚糖交替包裹样品的SR-FTIR mapping图,用Matlab软件经过平滑处理和自动基线校准后,再进行积分的比值谱图分析,分别考察壳聚糖相对十八醇和明胶相对十八醇的分布情况 (蓝色和红色代表强度,蓝色为弱,红色为强)。壳聚糖 (1 643~ 1 663 cm-1) 相对十八醇 (1 452~1 472 cm-1) 的谱图呈现沿着微丸边缘走向的连续吸收带,该吸收带为壳聚糖的吸收,证实壳聚糖已包裹在膜上 (图 5a); 明胶 (1 590~1 610 cm-1) 相对十八醇 (1 452~1 472 cm-1) 的谱图可观察到在微丸表面存在一条沿着微丸外延表面连续的吸收带,该吸收带为明胶的吸收,证实明胶存在于膜上 (图 5b)。在比值谱图中,明胶与壳聚糖均在微丸表面形成连续且密集的吸收带,进一步证实明胶与壳聚糖形成了包衣膜。
 | Figure 5 Chemical distributions by ratio analysis showed the formation of film only when the pellets coated with gelatin and chitosan. For the pellets coated with gelatin and chitosan,a: Distribution of chitosan obtained by ratio between chitosan and octadecanol; b: Distribution of gelatin obtained by ratio between gelatin and octadecanol. For the pellets coated with chitosan,c: Distribution of chitosan obtained by ratio between chitosan and octadecanol. For the pellets coated with gelatin,d: Distribution of chitosan obtained by gelatin and octadecanol. The red boxes indicated the area imaged by synchrotron radiation-based Fourier-transform infrared spectromicroscopy (left); distributions of chitosan or gelatin (right) |
单独包裹壳聚糖的样品SR-FTIR mapping图,用Matlab软件进行平滑处理与自动基线校正后,壳聚糖 (1 643~1 663 cm-1) 相对十八醇 (1 452~1 472 cm-1) 获得比值谱图,在图谱上只有极弱的壳聚糖吸收,这是壳聚糖黏度大、有少量附着在微丸表面的原因,单独包裹壳聚糖的包裹效果差且不能形成连续的密集吸收带,不可能形成包衣膜 (图 5c)。单独包裹明胶样品的SR-FTIR mapping图,用明胶 (1 590~1 610 cm-1) 相对十八醇 (1 452~1 472 cm-1) 得到比值谱图中未出现明胶的吸收,单独包裹明胶失败,也不能形成包衣膜 (图 5d)。通过对比单独包裹样品与交替包裹样品的比值图谱,证实只有壳聚糖与明胶同时存在、交替包裹并协同作用才能形成有阻止药物释放的包衣膜,单独包裹无法达到目的。
结论本文以布洛芬为模型药物,对具有部分掩味效果的脂质微丸进行壳聚糖与明胶阴阳离子层层自组装交互包衣处理,微丸的释放行为证实,包裹后的微丸比单独壳聚糖或明胶包衣及未包衣的样品在0~30 s释放明显变慢。基于SR-FTIR显微成像技术,通过单谱分析各物质的吸收及微丸表面膜组成物质的吸收,再对微丸横切面进行SR-FTIR mapping成像分析,证实单独包裹壳聚糖或明胶时,几乎无法在微丸表面形成包衣膜; 交替包裹壳聚糖与明胶时,明胶与壳聚糖均存在于膜上,通过静电作用吸附在微丸表面沉积形成包衣膜,延缓药物在口腔中的释放,掩盖药物的不良口感。本研究建立了包衣膜内物质存在与分布的SR-FTIR成像技术和方法,为药物输送系统中膜中物质传递研究提供一个新的有效工具。
| [1] | Tao T. The progress and applications of flavoring and taste masking technologies in new oral dosage forms[J]. Shanghai Med Pharm J (上海医药), 2011, 32:252-255. |
| [2] | Chen M, Cao F, Ping QN. The progress of taste masking techniques in oral solid dosage forms[J]. Prog Pharm Sci (药学进展), 2009, 33:212-217. |
| [3] | Kaushik D, Dureja H. Recent patents and patented technology platforms for pharmaceutical taste masking[J]. Recent Pat Drug Deliv Formul, 2014, 8:37-45. |
| [4] | Joshi S, Petereit HU. Film coatings for taste masking and moisture protection[J]. Int J Pharm, 2013, 457:395-406. |
| [5] | Li X, Guo Z, Hao JB, et al. Synergetic taste masking of lipid coating and β-cyclodextrin inclusion[J]. Acta Pharm Sin (药学学报), 2014, 49:392-398. |
| [6] | Paik DH, Jeong KY, Kim JH, et al. Edible HPMC films with indomethacin/HPMCP microparticles in oral delivery for taste-masking[J]. Macromol Res, 2014, 22:1156-1159. |
| [7] | Yang JL, Shan D, Wang YL, et al. Research progress in application of functional film coatings in the oral multiple-unit pulsatile delivery system[J]. Chin J New Drugs (中国新药杂志), 2015, 24:1610-1615. |
| [8] | Stange U, Führling C, Gieseler H. Taste masking of naproxen sodium granules by fluid-bed coating[J]. Pharm Dev Technol, 2014, 19:137-147. |
| [9] | Hernández-Montlongo J, Nascimento VF, Murillo D, et al. Nanofilms of hyaluronan/chitosan assembled layer-by-layer:an antibacterial surface for Xylella fastidiosa[J]. Carbohydr Polym, 2016, 136:1-11. |
| [10] | Xiang N, Lyu Y, Narsimhan G. Characterization of fish oil in water emulsion produced by layer by layer deposition of soy β-conglycinin and high methoxyl pectin[J]. Food Hydrocolloids, 2016, 52:678-689. |
| [11] | Yu FF, Zou H, Zhong YQ. Research progress of layer-bylayer self-assembly technique in drug delivery[J]. Acta Pharm Sin (药学学报), 2012, 47:332-338. |
| [12] | Wei X, Jie P, Zhang C, et al. Structure and properties of moisture-resistant konjac glucomannan films coated with shellac/stearic acid coating[J]. Carbohydr Polym, 2015, 118:119-125. |
| [13] | Malakauskaite M, Stankeviciute Z, Niaura G, et al. Synthesis and characterization of sol-gel derived calcium hydroxyapatite thin films spin-coated on silicon substrate[J]. Ceramics Int, 2015, 41:7421-7428. |
| [14] | Haaser M, Naelapää K, Gordon KC, et al. Evaluating the effect of coating equipment on tablet film quality using terahertz pulsed imaging[J]. Eur J Pharm Biopharm, 2013, 85:1095-1102. |
| [15] | Haaser M, Karrout Y, Velghe C, et al. Application of terahertz pulsed imaging to analyse film coating characteristics of sustained-release coated pellets[J]. Int J Pharm, 2013, 457:521-526. |
| [16] | Yu P. Application of advanced synchrotron radiation-based Fourier transform infrared (SR-FTIR) microspectroscopy to animal nutrition and feed science:a novel approach[J]. Br J Nutr, 2004, 92:869-885. |
| [17] | Zhu HC, Tong YJ, Ji T. Spatial resolution measurement of synchrotron radiation infrared microspectroscopy beam line[J]. Acta Opt Sin (光学学报), 2015, 35:21-24. |
| [18] | Hughes C, Brown MD, Clarke NW, et al. Investigating cellular responses to novel chemotherapeutics in renal cell carcinoma using SR-FTIR spectroscopy[J]. Analyst, 2012, 137:4720-4726. |
| [19] | Wang ML, Lu XL, Yin XZ, et al. Synchrotron radiationbased Fourier-transform infrared spectromicroscopy for characterization of the protein/peptide distribution in single microspheres[J]. Acta Pharm Sin B, 2015, 5:270-276. |
| [20] | Lin YP. Structural and character and application of chitosan[J]. Chem Eng (化学工程师), 1998, 5:33-35. |
| [21] | Guan LB, Dan WH, Zeng R, et al. Gelatin and its application in biomedical material[J]. Mater Rev (材料导报), 2006, 20:380-383. |
| [22] | Benbettaïeb N, Karbowiak T, Brachais CH, et al. Coupling tyrosol, quercetin or ferulic acid and electron beam irradiation to cross-link chitosan-gelatin films:a structure-function approach[J]. Eur Polym J, 2015, 67:113-127. |
| [23] | Prata AS, Grosso CR. Production of microparticles with gelatin and chitosan[J]. Carbohydr Polym, 2015, 116:292-299. |
 2016, Vol. 51
2016, Vol. 51


