|
收稿日期: 2017-11-08
基金项目: 国家重点研发计划(编号:2016YFA0600202);江苏省杰出青年基金(编号:BK20170018);国家自然科学基金(编号:41671421,41761134082)
第一作者简介: 章钊颖,1992年生,女,博士研究生,研究方向为植被定量遥感、全球变化遥感的理论和应用。E-mail:15048967116@163.com
通信作者简介: 张永光,1980年生,男,教授,研究方向为植被叶绿素荧光遥感和全球碳循环。E-mail:yongguang_zhang@nju.edu.cn
|
摘要
在植被遥感领域,遥感植被指数在过去30年极大地促进了从宏观尺度上来理解和认识地球生物圈,但是以“绿度”观测为主的植被指数仅表征植被“潜在光合作用”,而不能直接量化“实际光合作用”。植被叶绿素荧光在光合作用探测上具有优势,是“实际光合作用”的直接探测方法。日光诱导叶绿素荧光(SIF)遥感是近年快速发展起来的新型遥感技术,尤其是2011年实现全球尺度卫星反演以来,在反演算法、植被监测和碳循环应用等方面发展迅速,是近10年来植被遥感领域最具突破性的研究前沿。本文阐述了现阶段(2011年以来)SIF遥感反演及其在碳循环应用方面的进展。本文首先介绍了卫星SIF遥感的发展及其反演算法现状;然后重点剖析了其在陆地生态系统总初级生产力(GPP)估算、全球碳循环监测、物候和植被胁迫监测等方面的应用现状和特点;最后从卫星SIF反演算法优化、SIF-GPP关系机理、SIF多尺度综合观测和全球碳循环监测等方面对今后植被SIF遥感的发展前景进行了展望。
关键词
日光诱导叶绿素荧光, GPP模拟, 碳循环监测, 植被物候监测, 植被胁迫监测
Abstract
The emerging technique of remotely sensed sun-induced fluorescence (SIF) offers great advantages for estimating the gross primary photosynthetic (GPP) and investigating carbon cycles at regional and global scales. This novel satellite product is a state-of-the-art and booming avenue in recent years. Particularly, the flourishing progressions in retrieval techniques, vegetation monitoring, and applications in carbon cycle model have been accelerated to implement a satellite-based inversion at a global scale since 2011. During photosynthesis, part of solar radiation absorbed by chlorophyll is re-emitted at long wavelengths (fluorescence). Chlorophyll fluorescence is an electromagnetic emission in the 650–800 nm range originating at the core of the photosynthetic machinery. It been used in leaf-scale studies of photosynthesis in laboratory conditions for several decades. By using new, high-resolution spectrometers, chlorophyll fluorescence can be readily retrieved from satellite platforms. This scheme can be used to quantify the photosynthetic activity and efficiency globally. Satellite observations of chlorophyll fluorescence are important to reduce the uncertainties in research of global carbon cycle and climate change. In this review, we introduced the recent development in the remote sensing of SIF. First, recent instrumental and methodological developments in the field of spaceborne spectroscopy have rendered the measurement of SIF from space possible, which can alleviate the current limitations for the monitoring of terrestrial photosynthesis. Since 2011, the global data of SIF have been retrieved from a series of spaceborne instruments providing high-resolution spectra, such as the GOSAT’s Fourier transform spectrometer, ENVISAT/SCIAMACHY, MetOp-A/GOME-2, and OCO-2. The spatial coverage and resolution, wavelength, acquisition time, and amount of data available for analysis depend on the instrument from which they are derived. As a complement to reflectance-based vegetation indices, SIF offers new possibilities to monitor photosynthesis and GPP of terrestrial ecosystem from space. The potential of SIF, which is an indicator of large-scale GPP, has been demonstrated in a relatively short life time of global SIF data. Recent studies have shown that satellite observations of SIF are an excellent proxy for GPP at canopy and ecosystem scales. Meanwhile, spaceborne SIF data have also been used to monitor large-scale vegetation status in drought conditions, thereby suggesting that SIF provides unique, perhaps most direct, information from space for early warning and accurate monitoring of emerging drought. The potential of SIF as a constraint on regional and global carbon cycle variations has also been demonstrated together with the XCO2 data from GOSAT and OCO-2. Despite this experimental evidence of a direct and linear correlation between spatio-temporal aggregates of remotely sensed SIF data and large-scale GPP, the relationship between instantaneous photosynthesis and SIF is relatively complicated. Further study is necessary to investigate how the remotely sensed SIF signal can be used for plant photosynthesis monitoring, how we can interpret the SIF signal at various spatial and temporal scales, and how we link the active PAM measurements with canopy SIF at the seasonal scale. At the end of this review, we proposed a number of areas where further research can be conducted to better understand the mechanisms that govern the seasonality of canopy- and leaf-level SIF signal and its relation with photosynthesis. Several prospective areas for future work include improving the accuracy of retrievals with additional data, characterizing the mechanistic relationship between SIF and GPP across scales, measurements of near-surface continuous SIF along with eddy covariance flux system, data assimilation of SIF into land surface models, and development of new index for stress detection from SIF.
Key words
sun-induced Chlorophyll fluorescence, GPP modeling, global carbon cycle, phenology monitoring, stress monitoring
1 引 言
日光诱导叶绿素荧光SIF(Sun-Induced Chlorophyll Fluorescence)是植物在太阳光照条件下,由光合中心发射出的光谱信号(650—800 nm),具有红光(690 nm左右)和近红外(740 nm左右)两个波峰,能直接反映植物实际光合作用的动态变化。SIF遥感是近年迅速发展起来的植被遥感技术,可弥补当前植被遥感观测的不足,为陆地生态系统碳循环和植被监测等提供了新的思路和技术。以基于“绿度”观测的植被指数(如NDVI)为代表的植被遥感在过去30年极大地促进了从宏观尺度上来理解和认识地球生物圈,但其只能通过“绿度”来探测植物“潜在光合作用”。叶绿素荧光在植被光合生理探测方面具有独特的技术优势,是“实际光合作用”的直接探测方法。可以说植被叶绿素荧光遥感是近10年来植被遥感领域最具突破性的研究前沿。随着研究和技术的发展,SIF遥感最近10几年来得到了长足的进步。
尤其是在2011年,美国航天局(NASA)的科学家首次利用日本温室气体卫星GOSAT在全球尺度上实现了SIF的遥感反演(Frankenberg 等,2011;Joiner 等,2011)。之后,陆续在欧航局(ESA臭氧监测传感器)GOME-2、SCIAMACHY和NASA的OCO-2等传感器上实现了全球尺度的SIF反演(Joiner 等,2013;Frankenberg 等,2014;Köhler 等,2015;Wolanin 等,2015),这极大促进了植被叶绿素荧光遥感的发展。之后,卫星SIF反演及碳循环应用研究发展极其迅速,在Nature,Science,PNAS等期刊上多篇里程碑式的研究出现(Guanter 等,2014;Sun 等,2017)。因此,有必要对近几年SIF研究进行梳理和总结。
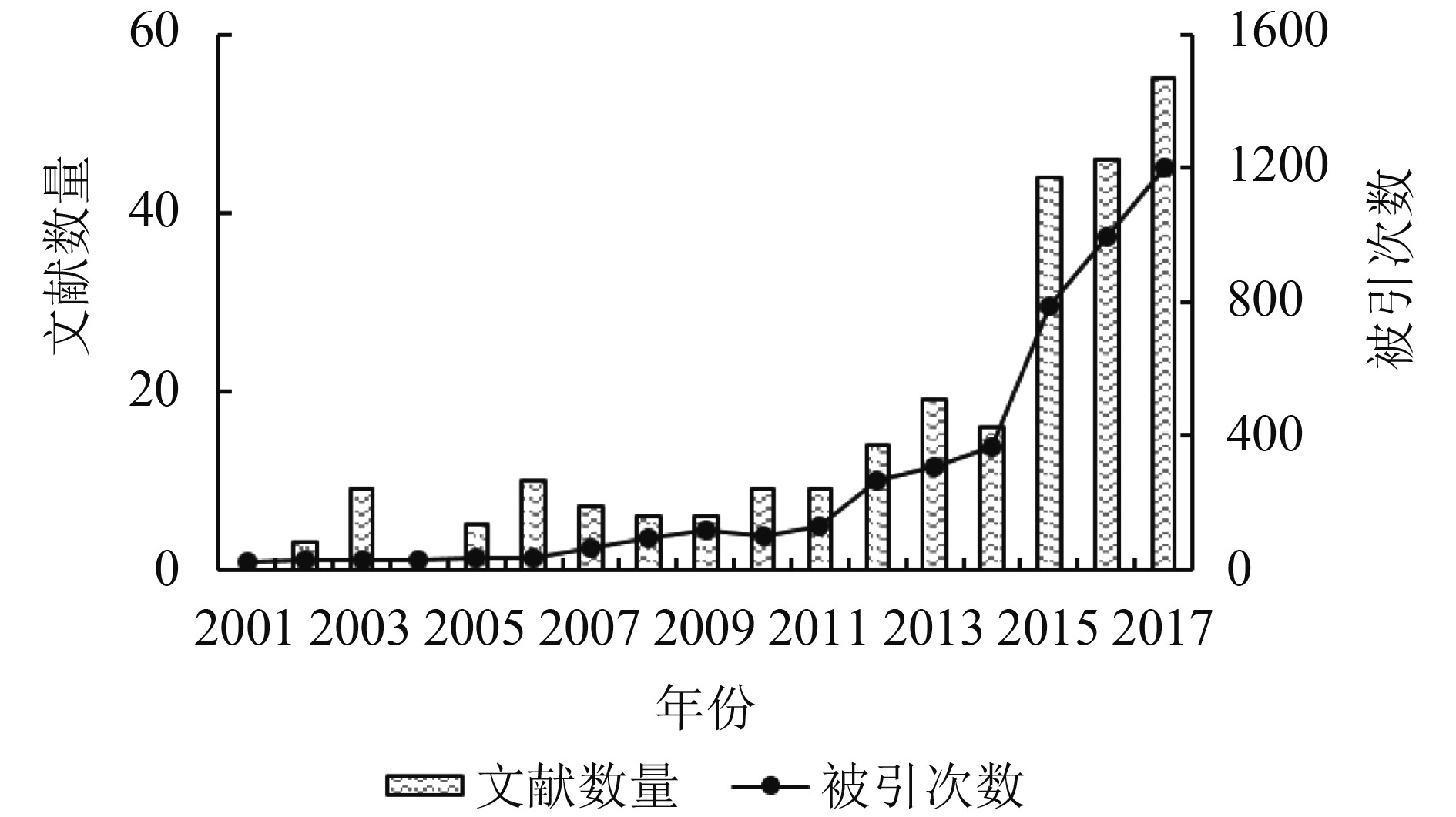
Meroni等人(2009)的综述文章对2009年前的植被SIF遥感原理、反演方法以及应用情况进行了介绍,其主要回顾了地基平台SIF的相关反演方法和应用研究。相应的中文综述文章(张永江 等,2009;王冉 等,2012)也多着重于反演算法总结,但对SIF在全球碳循环监测等应用方面还缺少相应述评。通过对2001年以来SIF在碳循环监测方面的文献进行了统计(图1),结果表明,SIF遥感近年来在监测全球碳循环方面的应用越来越受学者们的关注。本文针对2010年以来SIF在反演算法、陆地生态系统总初级生产力GPP(Gross Primary Productivity)模拟、物候和胁迫监测等方面的研究进展进行述评。
2 卫星日光诱导叶绿素荧光遥感反演发展
SIF最初由地面仪器测量得到,随着遥感技术的不断发展,从卫星高光谱数据中可以精确地反演叶绿素荧光信息,为全球植被叶绿素荧光的监测和应用提供了丰富的数据基础。下面将从数据和算法两方面对近年来SIF遥感反演的发展进行总结。
2.1 卫星SIF遥感数据发展
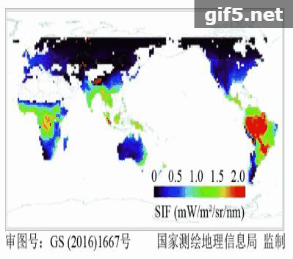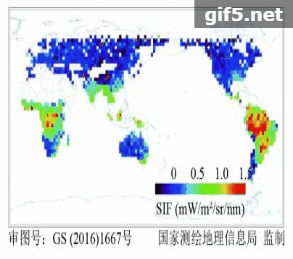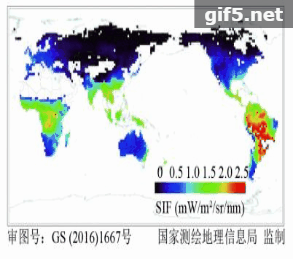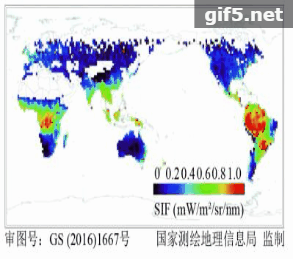
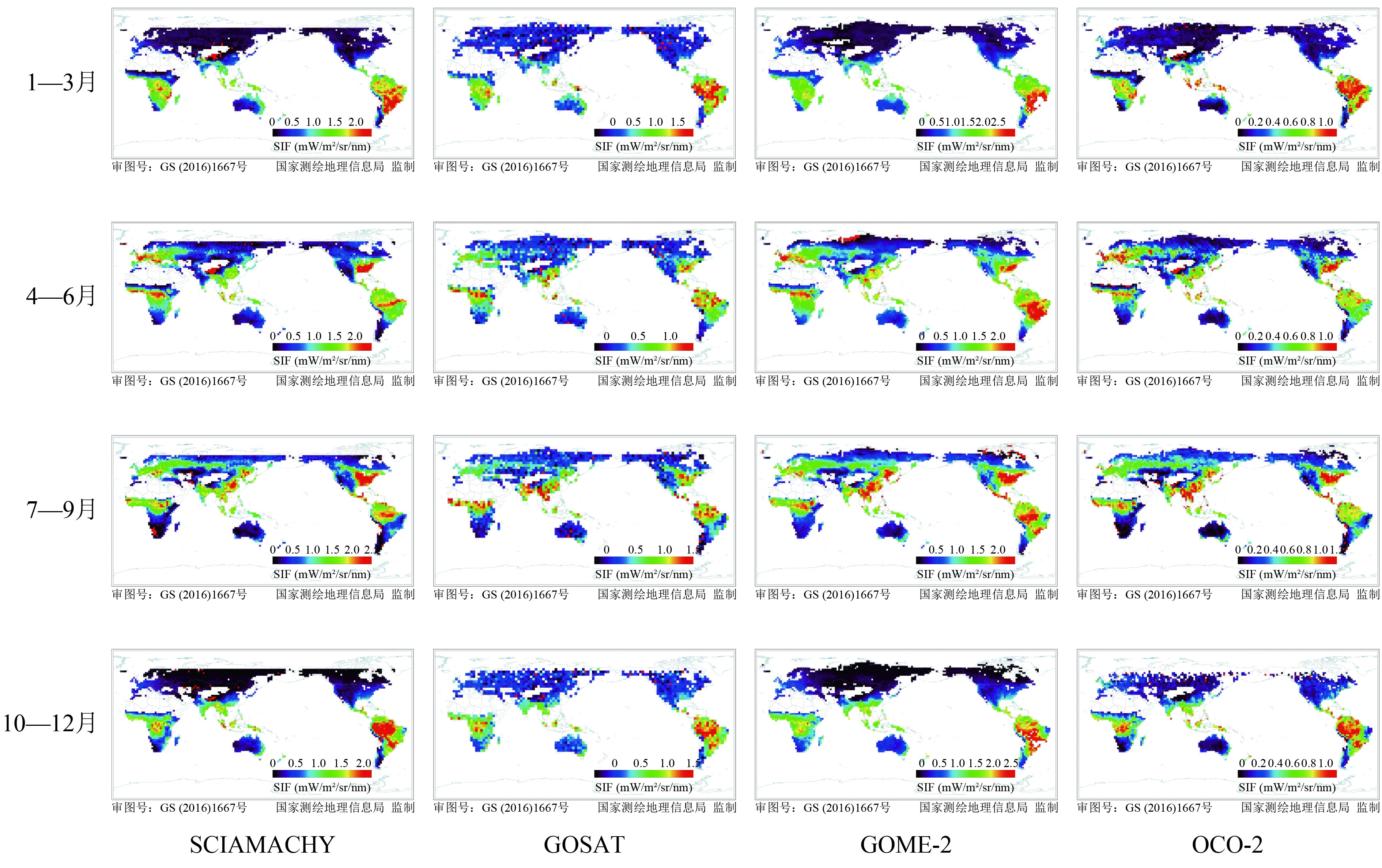
在卫星遥感反演叶绿素荧光方面,Guanter等人(2007)首次基于欧航局的MERIS卫星数据,在景观尺度上反演了SIF数据,并用机载CASI数据进行验证,证明了星载卫星数据提取SIF的可行性。如图2所示,2011年以来,利用GOSAT、GOME-2和SCIAMACHY、OCO-2等传感器,已经成功反演得到了全球性的SIF遥感数据(Frankenberg 等,2011;Joiner 等,2011;Guanter 等,2012;Joiner 等,2013;Köhler 等,2015)。
但是当前卫星传感器不是专门用来叶绿素荧光的探测,在分辨率和数据获取方面还有许多问题,GOSAT和GOME-2的空间分辨率都较低,GOSAT和OCO-2虽然空间分辨率有所提高,但是其采用了空间非连续的间断采样模式(表1)。美国宇航局2014年发射的OCO-2和欧航局2017年发射的Sentinel 5-P卫星(携带TROPOMI传感器)提供了更高空间分辨率与数据精度的遥感数据(Frankenberg 等,2014;Guanter 等,2015)。与其他植被相关的卫星产品(比如说MODIS NDVI)相比,卫星SIF产品受云和土壤背景的影响较小(Damm 等,2015a;Norton 等,2017)。云和土壤的反射信号会叠加到植被的反射信号中,所以基于混合反射信号构建的植被指数或多或少都会受到这些背景因素的影响,而SIF信号主要来源于植被叶绿素的荧光发射,土壤和云背景不会产生荧光信号,因此卫星SIF数据受土壤和云背景的影响要小于植被指数数据。
表 1 目前在轨和即将发射可用于SIF反演的卫星遥感传感器
Table 1 Satellite-based sensors used for the retrieval of SIF currently in orbit or are about to be launched
| 传感器 | 时段 | 过境时段 | 波段/nm | 空间连续性 | 像元大小/km2 | 重访周期/d |
| SCIAMACHY | 2003-01—2012-07 | 9:30 | 650—790 | 连续 | 30×240 | 约3 |
| GOSAT | 2009-12至今 | 13:30 | 757—775 | 间断 | 直径10 | 3 |
| GOME-2 | 2007-01至今 | 9:30 | 650—790 | 连续 | 40×80 (2013年以后40×40) | 约2 |
| OCO-2 | 2014-07至今 | 13:15 | 757—775 | 间断 | 1.3×2.3 | 16 |
| TanSat | 2016-12至今 | 13:30 | 758—778 | 间断 | 1.0×2.0 | 16 |
| TROPOMI | 2017-10至今 | 13:30 | 675—775 | 连续 | 7×3 | 约1 |
| FLEX | ~2022年 | 10:00 | 650—780 | 连续 | 0.3×0.3 | 约27 |
2.2 卫星SIF反演算法进展
在地表反射的光谱信号中,叶绿素荧光部分所占比重非常小(大约1%—2%)(Meroni 等,2009),因此从遥感数据中反演叶绿素荧光较为困难。遥感反演SIF算法多基于夫琅和费线提取算法FLD(Fraunhofer Line Discrimination)(Plascyk和Gabriel,1975)。由于大气的吸收作用,太阳光谱到达地表后有许多波段宽度为0.1—10 nm的暗线,即夫琅和费吸收暗线。在夫琅和费吸收暗线波段,植被的反射光相对较弱,荧光信号凸显,因此适合用于反演叶绿素荧光,其基本原理如下:
假设地表反射和荧光发射均符合朗伯定律,则植被在
| $L\left({\textit{λ}} \right)=\frac{{r\left({\textit{λ}} \right) \cdot E\left({\textit{λ}} \right)}}{\text{π}} + F\left({\textit{λ}} \right)$ | (1) |
式中,
目前,从卫星遥感数据中反演SIF的算法可以分为两类:基于大气辐射传输机理过程的反演算法和基于统计的反演算法。
2.2.1 基于大气辐射传输机理的反演算法
遥感反演SIF的算法均由夫琅和费线提取算法FLD(Fraunhofer Line Discrimination)发展而来(Plascyk和Gabriel,1975)。由于大气的吸收作用,太阳光谱到达地表后有许多波段宽度为0.1—10 nm的暗线,即夫琅和费吸收暗线。在可见光和近红外区域,由于氧气(O2)的吸收,太阳光谱分别在687.0 nm和760.6 nm附近呈现出暗带,即O2-B和O2-A波段。在夫琅和费吸收暗线波段,植被的反射光相对较弱,荧光作用凸显,因此适合用于反演叶绿素荧光。
最简单的FLD算法利用一个在夫琅和费线内的波段(
| $\left\{ \begin{gathered} L\left({{{\textit{λ}} _ {\rm{in}}}} \right)=\frac{{r \cdot E\left({{{\textit{λ}} _ {\rm{in}}}} \right)}}{\text{π}} + {F_ {\rm{s}}} \\ L\left({{{\textit{λ}} _{{\rm{out}}}}} \right)=\frac{{r \cdot E\left({{{\textit{λ}} _ {\rm{out}}}} \right)}}{\text{π}} + {F_ {\rm{s}}} \\ \end{gathered} \right.$ | (2) |
由上式可以推得
| ${F_ {\rm{s}}}=\frac{{E\left({{{\textit{λ}}_ {\rm{out}}}} \right) \cdot L\left({{{\textit{λ}}_ {\rm{in}}}} \right) - L\left({{{\textit{λ}} _ {\rm{out}}}} \right) \cdot E\left({{{\textit{λ}}_ {\rm{in}}}} \right)}}{{E\left({{{\textit{λ}} _ {\rm{out}}}} \right) - E\left({{{\textit{λ}} _ {\rm{in}}}} \right)}}$ | (3) |
式中,
FLD算法简单易行,在已知两个相邻波段的入射太阳辐照度和表观辐亮度时,根据上述公式即可以求得叶绿素荧光信息。由于两个相邻波段的反射率和荧光值并不是完全相同,利用FLD算法反演SIF会有一定的误差。因此在FLD算法的基础上发展了一系列的改进算法,例如3FLD(three bands FLD)、cFLD(correct FLD)、iFLD(improved FLD)、eFLD(extended FLD)和SFM(Spectral Fitting Model)等。
3FLD算法需要利用一个在夫琅和费线内的波段和两个分别在夫琅和费线两侧的波段,并假设反射率和荧光值线性变化;3FLD算法的精度较FLD算法有所提高,但是线性变化的假设依然与实际情况不符。cFLD和iFLD假设反射率和荧光值均变化,并通过校正系数对原始FLD算法进行修正。cFLD算法利用地面实测的叶片尺度荧光值来获得校正系数;iFLD算法适用于高光谱数据,通过三次样条插值的方法,对多个夫琅和费线外的波段和一个夫琅和费线内的波段进行拟合来确定校正系数。eFLD算法利用一个在夫琅和费线内的波段和两个分别在夫琅和费线两侧的波段,首先利用数学模型重建波段内反射率的波动信息,然后再反演叶绿素荧光值(Meroni 等,2009)。
Guanter等分别采用航天MERIS数据(7.5 nm/3.75 nm光谱分辨率)、航空CASI-1500数据(2.2 nm光谱分辨率),采用FLD算法在小区域范围内反演FLD数据,并通过实地测量数据验证了其反演精度(Guanter 等,2007)。Frankenberg等人(2011)基于GOSAT传感器的高光谱数据,利用769.9—770.25 nm的窄波段拟合窗口(包含夫琅和费KI暗线)首次反演了全球的叶绿素荧光信息。Joiner等人(2012)认为758.45—758.85 nm的窄波段窗口更加适合于反演SIF,因为该窗口更为接近荧光的一个发射峰值(740 nm)。除了窄波段窗口,Joiner等人(2011)利用两个相对较宽的拟合窗口(756—759 nm,770.5—774.5 nm),基于GOSAT数据获取了信噪比更高、噪音更小的SIF信号。Wolanin等人(2015)基于差分吸收光谱技术DOAS(Differential Optical Absorption Spectroscopy),利用681.8—685.5 nm的拟合窗口反演了红光波段的SIF信息。Köhler等人(2015)提出一种基于GOSAT数据的简化算法,该方法可以采用单一的拟合窗口和线性计算来反演SIF。Damm等人(2015b)采用3FLD算法从航空数据中反演了O2-A波段的荧光数据并进行了精度验证。
SFM算法利用夫琅和费线附近一定波段范围内(
| $\begin{aligned} L\left({\textit{λ}} \right)= & \frac{{{r_ {\rm{MOD}}}\left({\textit{λ}} \right) \cdot E\left({\textit{λ}} \right)}}{\text{π}}+ {F_ {\rm{MOD}}}\left({\textit{λ}} \right)+\varepsilon \left({\textit{λ}} \right) = \\ & {L_ {\rm{MOD}}}\left({\textit{λ}} \right)+\varepsilon \left({\textit{λ}} \right) \end{aligned} $ | (4) |
式中,
上述SFM的算法均是基于地面测量数据,Guanter等人(2010)首次将其引入到航天遥感数据中,通过模拟FLEX的高光谱数据对SFM算法的应用过程进行了详尽的推导和分析,发现传感器噪声、气溶胶光学厚度、气溶胶模式、地表气压等是影响反演精度的重要因素。由于大气校正存在误差,以及其他某些影响反演精度的因素未加考虑,利用SFM算法反演SIF需要利用临近无荧光地表的观测值进行修正。Mazzoni等人(2012)分别采用CRS(canopy radiance simulation)和GMB(ground-measurements-based method)作为构建临近无荧光地表对比值的方法,基于模拟数据和地表实测数据,利用SFM算法反演了叶绿素荧光值,结果表明即使在地表数据采集受限的情况下采用CRS作为对比值依然可以精确地反演荧光值。Liu等人(2015)则基于PCA算法分别对植被冠层表观反射率波谱和叶绿素荧光波谱进行重构,提出了一种全波段SFM算法(Full-spectrum Spectral Fitting Method),模拟数据和野外实测数据验证表明该算法精度较高且受仪器信噪比和波谱分辨率影响较小。Damm等人(2015b)分析了地表直射辐照度和散射辐照度变化对叶绿素荧光反演精度的影响。Cogliati等人(2015)在考虑了地表散射的前提下,对SFM算法进行了改进,利用基于FLEX-FLORIS传感器的模拟数据,实现了叶绿素荧光的全波段反演。
尽管仍有一系列的问题存在(需要精确的大气校正、需要无荧光地表观测值修正、散射影响等),SFM算法仍是目前基于大气传输模型算法中最精确的算法,也已经被欧空局选为FLEX计划的备选算法。
2.2.2 基于统计的反演算法
受限于大气校正精度的影响,SFM算法尚未应用于实际的卫星SIF遥感反演。为了应对大气校正对SIF反演的影响,近些年基于统计的反演算法得到了快速发展(Liu 等,2015)。考虑大气的因素,同样假设地表反射和荧光发射均符合朗伯定律
| ${L_ {\rm{TOA}}} = \frac{{{I_ {\rm{sol}}} \cdot {\mu _ {\rm{s}}}}}{{\text{π}} }{\rho _ {\rm{s}}}{T_{ \uparrow \downarrow }} + {F_ {\rm{s}}}{h_ {\rm{f}}}{T_ \uparrow }$ | (5) |
式中,
由式(5)可以看出,从遥感观测值中反演荧光值需要确定
| $\begin{split} {L_ {\rm{TOA}}}\left({\textit{λ}}\right) = & \frac{{{I_ {\rm{sol}}}\left({\textit{λ}} \right) \cdot {\mu _ {\rm{s}}}}}{{\text{π}} } \cdot \sum\limits_{i = 0}^m {\left({{\alpha _i} \cdot {\lambda ^i}} \right)} \cdot \sum\limits_{j = 1}^n {\left({{\beta _j} \cdot P{C_j}} \right)} + \\ & {F_{\rm{s}}}\left({\textit{λ}}\right) \cdot {h_ {\rm{f}}}\left({\textit{λ}} \right) \cdot {T_ \uparrow }\left(\lambda \right) \\ \end{split} $ | (6) |
| $\begin{split} {T_ \uparrow }\left({\textit{λ}} \right) = & \exp \left({\ln \left({{T_{ \uparrow \downarrow }}\left({\textit{λ}} \right)} \right) \frac{{\sec \left({{\theta _V}} \right)}}{{\sec \left({{\theta _V}} \right) + \sec \left({{\theta _0}} \right)}}} \right) = \\ & \exp \left({\ln \left({\sum\limits_{j = 1}^n {\left({{\beta _j} \cdot P{C_j}} \right)} } \right) \frac{{\sec \left({{\theta _V}} \right)}}{{\sec \left({{\theta _V}} \right) + \sec \left({{\theta _0}} \right)}}} \right) \end{split} $ | (7) |
式中,
在上述公式中,PC通常从无荧光地表的遥感数据中预先计算得到,例如地表为冰/雪、沙漠、厚云覆盖的海面等。在已知PC的前提下,上述公式的未知数仅有
Guanter等人(2012)首先提出了基于统计的SIF反演算法,验证了用主成分分量线性组合来表征高频变化的大气透射率信息的可行性,并将其用于GOSAT数据近红外波段的SIF反演中,其精度与基于大气辐射传模型的精度相当。Guanter等人(2013)利用地面光谱仪实测数据,对GOSAT数据近红外窄波段、宽波段SIF反演精度进行了全面分析,结果表明基于统计的反演算法可以有效的应用于近红外波段的SIF反演。同时,这种算法也扩展应用到了GOME-2、TROPOMI、OCO-2等数据近红外波段的SIF反演中(Joiner 等,2013;Frankenberg 等,2014;Guanter 等,2015)。受益于近红外部分波段大气透射率较高且变化较小,利用PC组合来代替高频变化的
目前,基于统计的反演算法已经成功应用于各种光谱分辨率的遥感数据中,其中基于GOME-2和OCO-2卫星的叶绿素荧光数据已经应用于全球并产品化。尽管计算PC的参考地表选择、PC数量的选择、红光波段反演等依然存在问题,基于统计的反演算法仍是目前从卫星遥感数据中反演SIF实用性最高的算法。
3 植被叶绿素荧光遥感碳循环应用进展
3.1 基于SIF的碳循环监测进展
3.1.1 基于SIF估算陆地生态系统GPP原理
估算陆地生态系统GPP方面,基于遥感数据的光能利用率模型是当前的主流方法之一,Monteith (1972)提出的光能利用率模型得到了广泛应用,一天中时刻t的GPP可以表示为
| ${\rm{GPP}}(t) = {\rm{PAR}}(t) \times f_ {\rm{PAR}} \times {\rm{LUE}}_ {\rm{p}}(t)$ | (8) |
式中,
| ${\rm{SIF}}(t,{\textit{λ}}) = {\rm{PAR}}(t) \times f_{\rm{PAR}} \times {\rm{LUE}}_ {\rm{f}}\left({t,{\textit{λ}} } \right) \times {f_{{\rm{esc}}}}\left({\textit{λ}} \right)$ | (9) |
式中,λ是SIF的波长,
| $ {\rm{GPP}}\left(t \right) = {\rm{SIF}}\left({t, {\textit{λ}}} \right) \times f_ {\rm{esc}}^{ - 1}\left(\lambda \right) \times \frac{{{\rm{LUE}}_ {\rm{p}}\left(t \right)}}{{{\rm{LUE}}_ {\rm{f}}\left({t, {\textit{λ}}} \right)}} $ | (10) |
考虑到GPP的估算主要是日平均值
| ${\rm{GPP}}\left( {{\rm{day}}} \right) = {\rm{SIF}}\left( {{t_0},{\textit{λ}}} \right) \times {{f}}_ {\rm{esc}}^{ - 1}\left( {\textit{λ}} \right) \times {\alpha _\epsilon}\left( {{t_0},{\textit{λ}}} \right) \times {\alpha _t}\left( {{t_0}} \right)$ | (11) |
式中,
3.1.2 SIF与GPP关系研究进展
最新的研究表明,SIF对光合作用的变化敏感,与GPP在叶片尺度(Meroni 等,2008),植株尺度(Damm 等,2010),冠层尺度(Zarco-Tejada 等,2013)和生态系统尺度(Frankenberg 等,2011;Guanter 等,2012)具有密切相关关系。但是这种关系在叶片和冠层尺度上受各种环境因素影响,远较线性关系复杂(Porcar-Castell 等,2014;Damm 等,2015a)。在叶片尺度上,太阳辐射是主要因素,决定了植物光合、热耗散和发射荧光的能量分配。在低光下,太阳辐射主要用于光合作用,荧光和热耗散都较低。在光胁迫下,热耗散居主导地位,荧光和光合作用的占比都降低,光合作用出现光饱和现象,但是总的来说SIF和光合作用的紧密联系使得其成为监测GPP最有力的手段。
Damm等人(2015a)和Zhang等人(2016)利用SCOPE模型发现了GPP和SIF在短时间尺度下的渐近线关系。这主要归因于
3.1.3 基于SIF的植被初级生产力(GPP)估算
准确地估算陆地生态系统GPP对全球变化研究和粮食燃料安全都具有重要作用。基于卫星SIF遥感数据,有多项研究估算了区域和全球尺度的GPP,并且取得了良好的成果。Frankenberg等人(2011)首次利用物理模型提取了GOSAT SIF,并且建立SIF与GPP的关系。在全球尺度上,SIF与GPP存在良好的线性关系。Guanter等人(2012)采用奇异向量分解从GOSAT数据中提取了SIF,并且与Frankenberg等人(2011)提取的SIF存在很高的一致性。他们也发现GOSAT SIF与GPP之间存在良好的相关关系。Guanter等人(2014)通过比较美国玉米带农田涡度通量站点GPP与GOME-2 SIF及MODIS植被指数的关系发现,SIF与农作物GPP的关系要优于NDVI,而后者出现了饱和现象。进一步地,He等人(2017)对GOME-2 SIF数据进行了角度校正,推算出阳叶和总叶片SIF,结果表明相比于原始SIF,它们分别与阳叶和总叶片GPP具有更稳定的关系。
除了直接建立GPP和SIF之间的关系以外,Zhang等人(2014)利用GOME-2 SIF推算出最大羧化率(Vcmax)并且结合SCOPE模型模拟了农作物GPP。相比于固定Vcmax,基于SIF的Vcmax给出了更好的GPP估计精度(R2从0.85提高到0.93)。同时能够模拟出更精确的光能利用率。Croft等人(2017)分析了季节性变化对叶片生物物理参数和光合过程的影响,结果表明,基于面积的氮含量(Narea)与标准化Vcmax的关系受季节性氮分配策略的影响。但是叶片叶绿素含量与标准化Vcmax的关系更稳定,叶绿素含量能够作为叶片光合能力的一个有效指标。用叶绿素含量估算的标准化Vcmax作为陆地生物模型(TBMs)的输入参数将会显著提高模拟落叶阔叶林叶片光合能力的准确度。Zhang等人(2014)和Croft等人(2017)的研究表明准确计算Vcmax是降低陆地植被系统GPP估测误差的有效途径。但是目前还未得到全球尺度的叶片叶绿素含量数据,而全球尺度的卫星SIF数据已经得到,因此有望得到基于SIF估计的Vcmax,输入到陆地生物模型,从而进一步估算得到全球尺度的光合作用。
在全球作物产量估算方面,如前所述,植被叶绿素荧光作为探测植物光合作用的理想“探针”,能直接反映植物实际光合作用的动态变化,在农作物监测方面优于基于“绿度”的植被指数。guanter等人(2014)首次证明了SIF数据在农作物生产力估测方面具有更高的精度。Guan等人(2016)采用GOME-2 SIF数据得到了更高精度的作物产量估测。归根到底,SIF数据对农业生产力及产量估算的改进仍然在于SIF能够提供更好的GPP估计。
3.1.4 荧光模型与生态系统模型进耦合
陆地上各种下垫面与大气之间相互作用的物理、生化过程的描述,都需要不断改进和发展的陆面过程模式,力求使之接近真实情况,能更精确地预报上述各种交换(动量、能量、水汽、CO2以及辐射交换等)以及模拟地表温度和大气边界层的发展变化等与气候变化。Lee等人(2015)将叶绿素荧光耦合到NCAR CLM4 (National Center for Atmospheric Research Community Land Model version 4)陆面模式中,结果表明叶绿素荧光是光合作用过程的重要诊断量,并利用GOSAT卫星资料评估了CLM4模拟的叶绿素荧光结果,而且CLM4也可以合理的模拟的叶绿素荧光与GPP之间的关系。这一研究显示了叶绿素荧光在提高陆面模式碳循环的模拟能力时有着至关重要的作用。Thum等人(2017)也将叶绿素荧光模型耦合到JSBACH陆面过程模式中,并结合模拟结果进一步讨论了SIF和GPP之间的关系。Koffi等人(2015)利用碳循环数据同化系统(CCDAS)探索了SIF约束GPP的可行性。他们发现在解释SIF时需要特别考虑叶绿素含量和入射辐射。进一步地,Norton等人(2017)耦合了基于过程的陆地生物圈模型(BETHY)和SCOPE模型。他们利用一年的GOSAT SIF数据为例,发现全球GPP的不确定性减少了79%。这些研究表明耦合生态系统模型和荧光模型,同化卫星SIF遥感数据,完善叶片生长过程的参数和提高模型对植被生理过程的敏感性,对于提高陆面模式或者生态系统模型模拟碳循环精度具有重要的应用价值。
3.1.5 基于SIF的CO2监测进展
CO2浓度和地气碳交换监测对全球碳循环和气候变化研究具有重要作用,近年来已有一些研究基于卫星SIF遥感数据探索了碳交换对植被生长状况的响应规律。Parazoo等人(2013)利用GOSAT SIF和XCO2数据评估了亚马逊南部森林季节变率对碳循环的影响。在湿季,GPP的提高稀释了大气CO2浓度,而在干季,植被的光合作用降低,导致大气CO2浓度的显著提高,结论与SIF与XCO2的负相关性(r= −0.53,p<0.001)较为一致。Detmers等人(2015)也应用GOSAT SIF研究了澳大利亚2010年末到2012年初大气碳吸收的异常现象。在拉尼娜阶段,该地区降水活动频繁,导致植被迅速生长,SIF观测数据显著高于其他时期,表明此阶段碳吸收异常主要归因于植被旺盛的光合过程。Sun等人(2017)研究了SIF和GPP复杂的时空变化关系,表明不同植被类型的SIF-GPP的关系在OCO2轨迹上相比之前的研究具有更高的一致性,进一步地用经验正交函数(EOF)分解了OCO2 SIF和GPP的不同数据集在时空变化上的几个主要的正交分量,发现了分解得到的EOF分量分别与OCO2 SIF和GPP的不同数据集在全球尺度上具有很高的时空一致。Luus等人(2017)以阿拉斯加苔原地带为例,研究发现与传统的植被指数(NDVI和EVI)相比,卫星SIF数据与PolarVPRM模型(Polar Vegetation Photosynthesis and Respiration Model)耦合能更好地模拟CO2的季节性变化。Liu等人(2017)基于GOSAT和OCO-2数据分析了南美洲、亚洲和非洲热带地区碳循环对2015年—2016年厄尔尼诺活动的响应。由于气候驱动因子(降雨、温度和干燥季节周期)的不同,这3个地区表现出不一致的响应规律。
3.1.6 基于SIF的大气与植被相互作用研究
陆地生物圈和大气圈存在着环形的反馈作用。陆地植被生长和发育通过调节大气水分和能量来影响气候状况,而气候变化又反过来影响着植被生长。尤其是干旱半干旱地区植被生长对环境变化的响应特别迅速。了解生物大气交互作用能提高气候预测精度和更好地预测植被在异常气候下恢复能力。然而目前的地球系统模型低估了生物大气之间的反馈,尤其是生物圈对大气变量的反馈(Green 等,2017)。Detmers等人(2015)利用GOSAT SIF数据研究了澳大利亚地区在拉尼娜阶段降雨增多导致7%的GPP增加量。Green等人(2017)利用GOME-2 SIF作为植被动态变化的指标,分析了SIF、降雨和太阳辐射之间的反馈规律。他们发现SIF对降雨和表面辐射的反馈能够解释其30%的变化。
3.2 基于SIF的植被胁迫监测进展
3.2.1 地面实验胁迫监测研究
干旱导致的植被枯萎威胁到了全球生态平衡,及时精确地监测大范围干旱胁迫对确保粮食安全和了解植被对气候变化的响应具有重要意义(Breshears 等,2005)。对于陆地生态系统来说,干旱现象可能受到非气象因素的影响,如地下蓄水和农业灌溉等因素导致的干旱(Ji和Peters,2003),仅用传统气象干旱指数不足以监测农业干旱。遥感卫星数据可以对植被进行时空连续观测,评估陆地大面积植被干旱状况,但是卫星遥感指数如NDVI对于响应降雨变化具有大致一至两个月的滞后性(Di 等,1994;Yang 等,1997),不能够及时地监测干旱。SIF提供了一种新的监测全球植被的方法,与传统的基于反射率的植被指数不同,SIF与植被的真实光合作用直接相关,可以反映出植被冠层水分胁迫的快速变化(Perez-Priego 等,2005)。SIF对环境胁迫,如水或热应激(Lee 等,2013;Zhang 等,2014)的响应很敏感,因此SIF不仅可以用于估测陆地植被生产力,还可以作为植被对生物和非生物因子胁迫相应的指标。Ač等人(2015)运用元分析方法分析了主被动荧光在植被受主要胁迫(水分、温度和氮胁迫)的应用。Medrano等人(2002)对葡萄树研究发现由于水分亏缺引起的叶片气孔关闭和产生的一系列的光保护机制,最终导致NPQ的升高和荧光值的降低。其它叶片尺度的研究也表明水分亏缺的生理效应会导致光能利用率和荧光效率的降低(Flexas 等,2002;Amoros-Lopez 等,2008)。在低温条件下,大部分叶片光化学淬灭降低,导致荧光产量升高(Neuner和Larcher,1990)。Agati (1998)发现低温胁迫下红光波段荧光的增加值低于远红光波段荧光的增加值,导致两者比值降低。而高温胁迫通常伴随着水分胁迫,荧光值表现为降低的趋势(Dobrowski 等,2005;Krumov 等,2008)。与水分和温度胁迫相比,氮亏缺引起的荧光变化更加复杂。一方面,由于氮胁迫会降低PSII的电子传递速率,从而减少了荧光信号激发量;另一方面,叶绿素含量在氮素亏缺状态下较低,会导致荧光再吸收减弱进而增加荧光的发射(Ač 等,2015)。此外发生氮胁迫的物种类别和持续时间也影响着荧光的变化趋势。
3.2.2 区域及全球尺度胁迫监测
除了在地面小区尺度的胁迫监测研究,SIF在区域及全球尺度胁迫监测研究也取得了重要进展。目前的GOME-2 SIF是在09:30 am的当地时间测量的,这个时间水分胁迫往往由于植物水分夜供应和清晨相对较低的大气蒸汽压差而减少。Lee等人(2013)用GOSAT-SIF研究了中午荧光随着水分供应的变化而变化,且两者都在亚马逊地区干旱季节减少,GPP也同时下降。Sun等人(2015)研究了卫星GOME-2 SIF的空间模式异常可用于监测一般干旱强度和根系土壤水分亏缺状况,干旱胁迫下的SIF与环境因子呈现显著相关关系,并且空间和时间的变化与SIF反映出的植被生理生化状态的预期一致,是植被光合功能的直接信号。Yoshida等人(2015)研究了2010年俄罗斯干旱时期SIF在不同生态系统的响应机制,结果发现,SIF在草地和农田在高温区都有明显减少,在森林地区没有明显变化。同时也说明,由于干旱导致的GPP的减少,对于农作物和草地地区,主要是因为光能利用率和吸收的用于光合作用的光能的减少,而森林地区主要是因为光能利用率的减少。Wang等人(2016)研究了北美中西部SIF与气象干旱指数的关系,发现SIF与干旱指数在生长季节呈现正相关关系。相比NDVI、NDWI,SIF对短期降水指数SPI的变化更敏感。并且SIF与帕尔默旱度指数(PDSI)有很强的相关性,在干旱期不同程度的干旱区,SIF与GPP同步减少,在植被衰老期,SIF明显减少,而NDVI变化不明显。
3.3 基于SIF的物候遥感监测进展
植被物候是指植物发育或生长活动随季节变化的现象,如叶片发芽、凋落等(Rathcke和Lacey,1985),也是植物对气候变化响应的重要指标。植被物候主要分为形态物候和光合物候,形态物候主要指的是冠层绿度可见的变化,因此受叶子数目大小、色素含量和冠层结构的影响。形态物候的典型活动包含萌芽、展叶、成熟和衰老等。光合物候意味着由叶绿素浓度和环境状况决定的光合能力表现出来的光合活动或者GPP轨迹。已有研究表明,气候变化会导致植株发芽提前(Richardson 等,2009;Dragoni 等,2011),叶片凋落延迟和生长周期延长(Jeong 等,2013)。并且物候变化会引起生态系统总光合和呼吸增加(Piao 等,2008;Richardson 等,2009;Dragoni 等,2011),当前者的增加量高于后者时,生态系统净碳交换量增加,反之降低。因此,准确获取植被的物候信息有助于提高全球碳循环模型预测CO2季节性变化的精度(Bauerle等,2012)。
传统的植被指数(如NDVI和EVI)已被广泛用于植被物候监测研究(Piao 等,2006;White 等,2009;Jeong 等,2011;Shen 等,2014),然而这些指数仅仅反映了植被生长过程中的静态(“绿度”)信息,也就是植被形态物候,不能反映出动态(光合作用)信息,因此基于植被指数提取物候信息往往存在偏差。SIF作为植被光合测量的潜力在于它同时包含了形态物候(FPAR)和荧光效率所反映的胁迫状况的信息。一些研究表明,SIF可以反映与植被指数类似的物候信息,因此能够追踪植被的形态物候。Joiner等人(2014)首次利用GOME2 SIF数据提取了落叶阔叶林、混合林和作物的物候信息。提取的植物生长周期要短于基于MODIS fPAR的提取结果,且与通量塔的观测结果更为相符。落叶林也是一个典型的用SIF监测植被物候的例子(Yang 等,2015)。相比植被指数,在高生产力区域没有观测到远红SIF的饱和现象(Guanter 等,2014),这就使得SIF成为监测APAR的一个有效的指标(Koffi 等,2015;Yang 等,2015)。在光合物候方面,SIF还依赖于荧光效率,因此在色素和形态变化之前,生理变化会影响光合能力。这也就意味着对于相同的绿度指数,植被光合活动也可能有很大的变化范围,可以用SIF成功监测到(Rossini 等,2015;Yang 等,2015)。例如,北方常绿森林在春季复苏阶段的植被生产的光合作用不能被传统的绿度指标及时的监测出来,因为微小的绿度变化以及雪的影响(Walther 等,2016)。另外,草地、作物和森林对干旱胁迫响应不仅与叶绿体吸收的光合有效辐射有关,并且与荧光效率有关,因此可以通过SIF反应出来(Sun 等,2015;Yoshida 等,2015)。相比于叶绿素变化,光合效率变化与亚马逊森林的水分胁迫表现出更高的相关性(Lee 等,2013)。Walther等人(2016)利用GOME-2 SIF数据提取了北方常绿针叶林的物候信息,结果表明SIF揭示的生长季开始日期要比EVI的结果提前1个月以及大约长为6周的光合有效周期。Jeong等人(2017)利用GOME2 SIF和GOSAT SIF数据提取了北方高纬地区森林(40°N—50°N)物候信息,发现生长季要短于基于NDVI的结果。通过分析SIF、GPP和NDVI对温度变化的响应规律,结果表明SIF和GPP的变化更为同步。这些不同植被类型和生长环境的研究表明卫星SIF数据在提取植被的季节性变化,提高全球光合模型精度以及揭示植被-气候交互规律领域具有重要价值。
4 结 语
在植被遥感领域,近30年来以“绿度”为基础的植被指数促进了从宏观尺度上来理解地球生物圈,但植被指数仅反映“潜在光合作用”。植被叶绿素荧光作为一种新的方法为进行大尺度光合作用探测提供了更加直接的手段。近年来植被叶绿素荧光遥感发展迅速,尤其是2011年以来全球卫星SIF遥感产品的出现,极大地推动了叶绿素荧光遥感方法与应用的发展。本文讨论分析了近年来卫星SIF遥感的发展趋势,主要介绍了已有的卫星SIF遥感反演算法和产品进展,重点总结了植被叶绿素荧光在陆地生态系统GPP估算、全球碳循环探测、植被物候与胁迫监测等方面的发展状况。但是由于目前用来反演SIF的卫星均不是专门进行SIF探测,具有空间和时间分辨率低、反演数据精度低等问题,在卫星SIF反演算法、SIF与GPP机理关系、卫星SIF遥感数据同化、植被物候和胁迫监测等领域仍存在较多问题,需要进一步研究。综合目前的研究状况和存在的问题,植被叶绿素荧光遥感在反演和应用方面有以下几点展望:
4.1 卫星植被叶绿素荧光遥感反演趋势
未来三到五年,多个卫星遥感传感器可用于SIF反演,在空间分辨率和数据精度方面将大幅提高。2017年10月发射的哨兵5号卫星上携带的TROPOMI传感器,可以在675—775 nm的光谱范围内以0.5 nm的光谱分辨率连续获取数据。类似于GOME-2,TROPOMI可同时反演红光和远红光SIF两个波段,但其空间分辨率可达3 km×3 km,可每日覆盖全球且每日晴天像元数是GOME-2的200倍。而计划于2022年发射的FLEX卫星上携带FLORIS(FLuORescence Imaging Spectrometer)传感器,其光谱范围为650—780 nm,空间分辨率则达300 m×300 m,也可同时反演两个波段SIF。这些高空间、高时间分辨率的传感器的发展,将会为卫星SIF的反演和应用提供更为丰富的原始数据。
针对新的传感器,目前广泛应用的基于统计方法的反演算法侧重于采用统计方式代替复杂的大气校正过程,已经成功应用于各种卫星数据中,但这种算法同时也存在着更多的参数选择和不确定性因素。目前统计反演算法在以下几个方面仍有待深入研究:包括用于构建主成分的参考地表选择、拟合窗口的选择、PC数量的选择等。此外,目前大多数统计反演算法均集中于近红外波段,红光波段SIF反演算法仍然不够成熟;现有算法的精确度和不确定性仍旧很高,现在还尚未出现较好的解决方案,仍有待后续进行深入研究。
4.2 SIF和GPP关系的机理研究
尽管多项研究表明SIF可用于估算区域或全球尺度陆地生态系统GPP,但SIF和GPP二者之间在不同时间和空间尺度上的机理联系仍然不清楚。利用卫星SIF遥感进行陆地生态系统GPP估算,还需要考虑影响二者机理联系的多项控制因子。
首先,由于冠层结构影响,冠层顶部SIF光谱信号取决于冠层内光谱信号再吸收和散射过程。因为冠层内的叶片光学性质、方向、叶面积指数以及冠层结构都影响荧光的再吸收和散射。而荧光的红光波段更易于被叶绿素吸收,近红外波段则易于被散射。另一方面也需要区分景观尺度上植被覆盖的不均一性对SIF光谱信号的影响。因此需要结合地面观测和3维辐射传输模型研究叶绿素荧光在冠层内的吸收和多次散射过程,进而研究冠层结构对SIF与GPP关系的影响。
其次,季节尺度上SIF和GPP的耦合机理过程需要进一步研究。这包括光合有效辐射吸收、光系统I(PSI)的贡献、NPQ等的季节变化对季节尺度上SIF与GPP机理联系的影响。这就需要结合PAM主动荧光参数与SIF进行季节尺度的观测来研究观测SIF光谱信号与叶片光化学过程之间的机理关系。在叶片尺度和冠层尺度增加不同植被类型的观测可以更好的了解NPQ如何影响SIF和GPP的关系。
4.3 近地面多尺度SIF连续观测
较于卫星SIF遥感的快速发展,近地面SIF的观测研究相对较为滞后,近两年才在全球少数地区开始展开。为研究季节尺度上SIF与GPP机理关系的变化和卫星SIF遥感数据的验证,需要加强近地面SIF光谱的连续观测,并与涡度通量系统协同观测。在冠层SIF观测上,有几个问题需要注意:(1)观测仪器光谱分辨率、辐射定标、反演算法等的统一,以利于不同站点之间的比较;(2)根据植被类型和景观特点,上行—下行通道选择相应观测模式,半球—半球或者半球—锥体;(3)针对森林尤其是针叶林,要考虑多次散射和聚集效应的影响;(4)可联合激光雷达和光谱观测研究冠层3维结构对冠层顶SIF信号的影响。为便于多站点比较,可考虑建立近地面光谱观测网络。鉴于UAV遥感的发展,未来也需要加强无人机非成像光谱观测,与地面协同观测。
4.4 卫星SIF遥感数据同化
陆地生态系统光合作用碳吸收是全球碳循环最大的碳通量,也是不确定性最大的分量。全球卫星SIF遥感数据的反演,为提高全球碳循环监测精度提供了新的手段。如何利用生态系统模型/陆面模式同化卫星SIF遥感数据当前研究的一个热点和难点。目前卫星叶绿素荧光数据仅作为一个诊断量评估模型模拟GPP的能力。需要加强生态系统模型中高效荧光模型的耦合研究以及模型中的关键参数优化问题,同时也需要研究模型参数同化方法,以快速准确的同化卫星SIF遥感数据。
4.5 植被物候和胁迫监测
与传统的植被指数相比,植被叶绿素荧光与光合作用具有机理上的联系。卫星SIF遥感已在北方针叶林的物候探测、干旱胁迫监测上显示出一定的优势。同时,以往实验室和田间植株研究表明植被叶绿素荧光具植被在遭受干旱、高温等胁迫具有提前预警的能力。在区域及全球尺度上,卫星SIF遥感是否具有干旱等胁迫的提前预警能力需要进一步研究,针对不同生态系统是否敏感性有差异也需要加强研究。这就包括需要设计新型的SIF指数,如物候荧光指数PFI(Phenology Fluorescence Index)、温度胁迫荧光指数TSFI(Temperature Stress Fluorescence Index)、干旱胁迫荧光指数DSFI(Drought Stress Fluorescence Index)等。
参考文献(References)
-
Ač A, Malenovský Z, Olejníčková J, Gallé A, Rascher U and Mohammed G. 2015. Meta-analysis assessing potential of steady-state chlorophyll fluorescence for remote sensing detection of plant water, temperature and nitrogen stress. Remote Sensing of Environment, 168 : 420–436. [DOI: 10.1016/j.rse.2015.07.022]
-
Agati G. 1998. Response of the in vivo chlorophyll fluorescence spectrum to environmental factors and laser excitation wavelength . Pure and Applied Optics, 7 (4): 797–807. [DOI: 10.1088/0963-9659/7/4/016]
-
Amoros-Lopez J, Gomez-Chova L, Vila-Frances J, Alonso L, Calpe J, Moreno J and del Valle-Tascon S. 2008. Evaluation of remote sensing of vegetation fluorescence by the analysis of diurnal cycles. International Journal of Remote Sensing, 29 (17/18): 5423–5436. [DOI: 10.1080/01431160802036391]
-
Bauerle W L, Oren R, Way D A, Qian S S, Stoy P C, Thornton P E, Bowden J D, Hoffman F M and Reynolds R F. 2012. Photoperiodic regulation of the seasonal pattern of photosynthetic capacity and the implications for carbon cycling. Proceedings of the National Academy of Sciences of the United States of America, 109 (22): 8612–8617. [DOI: 10.1073/pnas.1119131109]
-
Breshears D D, Cobb N S, Rich P M, Price K P, Allen C D, Balice R G, Romme W H, Kastens J H, Floyd M L, Belnap J, Anderson J J, Myers O B and Meyer C W. 2005. Regional vegetation die-off in response to global-change-type drought. Proceedings of the National Academy of Sciences of the United States of America, 102 (42): 15144–15148. [DOI: 10.1073/pnas.0505734102]
-
Cogliati S, Verhoef W, Kraft S, Sabater N, Alonso L, Vicent J, Moreno J, Drusch M and Colombo R. 2015. Retrieval of sun-induced fluorescence using advanced spectral fitting methods. Remote Sensing of Environment, 169 : 344–357. [DOI: 10.1016/j.rse.2015.08.022]
-
Croft H, Chen J M, Luo X Z, Bartlett P, Chen B and Staebler R M. 2017. Leaf chlorophyll content as a proxy for leaf photosynthetic capacity. Global Change Biology, 23 (9): 3513–3524. [DOI: 10.1111/gcb.13599]
-
Damm A, Elbers J, Erler A, Gioli B, Hamdi K, Hutjes R, Kosvancova M, Meroni M, Miglietta F, Moersch A, Moreno J, Schickling A, Sonnenschein R, Udelhoven T, Van Der Linden S, Hostert P and Rascher U. 2010. Remote sensing of sun-induced fluorescence to improve modeling of diurnal courses of gross primary production (GPP). Global Change Biology, 16 (1): 171–186. [DOI: 10.1111/j.1365-2486.2009.01908.x]
-
Damm A, Guanter L, Paul-Limoges E, van der Tol C, Hueni A, Buchmann N, Eugster W, Ammann C and Schaepman M E. 2015a. Far-red sun-induced chlorophyll fluorescence shows ecosystem-specific relationships to gross primary production: an assessment based on observational and modeling approaches. Remote Sensing of Environment, 166 : 91–105. [DOI: 10.1016/j.rse.2015.06.004]
-
Damm A, Guanter L, Verhoef W, Schläpfer D, Garbari S and Schaepman M E. 2015b. Impact of varying irradiance on vegetation indices and chlorophyll fluorescence derived from spectroscopy data. Remote Sensing of Environment, 156 : 202–215. [DOI: 10.1016/j.rse.2014.09.031]
-
Detmers R G, Hasekamp O, Aben I, Houweling S, van Leeuwen T T, Butz A, Landgraf J, Köhler P, Guanter L and Poulter B. 2015. Anomalous carbon uptake in Australia as seen by GOSAT. Geophysical Research Letters, 42 (19): 8177–8184. [DOI: 10.1002/2015GL065161]
-
Di L P, Rundquis D C and Han L H. 1994. Modelling relationships between NDVI and precipitation during vegetative growth cycles. International Journal of Remote Sensing, 15 (10): 2121–2136. [DOI: 10.1080/01431169408954231]
-
Dobrowski S Z, Pushnik J C, Zarco-Tejada P J and Ustin S L. 2005. Simple reflectance indices track heat and water stress-induced changes in steady-state chlorophyll fluorescence at the canopy scale. Remote Sensing of Environment, 97 (3): 403–414. [DOI: 10.1016/j.rse.2005.05.006]
-
Dragoni D, Schmid H P, Wayson C A, Potter H, Grimmond C S B and Randolph J C. 2011. Evidence of increased net ecosystem productivity associated with a longer vegetated season in a deciduous forest in south-central Indiana, USA. Global Change Biology, 17 (2): 886–897. [DOI: 10.1111/j.1365-2486.2010.02281.x]
-
Du S S, Liu L Y, Liu X J and Hu J C. 2017. Response of canopy solar-induced chlorophyll fluorescence to the absorbed photosynthetically active radiation absorbed by chlorophyll. Remote Sensing, 9 (12): 911 [DOI: 10.3390/rs9090911]
-
Flexas J, Escalona J M, Evain S, Gulías J, Moya I, Osmond C B and Medrano H. 2002. Steady-state chlorophyll fluorescence (Fs) measurements as a tool to follow variations of net CO2 assimilation and stomatal conductance during water-stress in C3 plants . Physiologia Plantarum, 114 (2): 231–240. [DOI: 10.1034/j.1399-3054.2002.1140209.x]
-
Franck F, Juneau P and Popovic R. 2002. Resolution of the Photosystem I and Photosystem II contributions to chlorophyll fluorescence of intact leaves at room temperature. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1556 (2/3): 239–246. [DOI: 10.1016/S0005-2728(02)00366-3]
-
Frankenberg C, Fisher J B, Worden J, Badgley G, Saatchi S S, Lee J E, Toon G C, Butz A, Jung M, Kuze A and Yokota T. 2011. New global observations of the terrestrial carbon cycle from GOSAT: patterns of plant fluorescence with gross primary productivity. Geophysical Research Letters, 38 (17): L17706 [DOI: 10.1029/2011GL048738]
-
Frankenberg C, O’Dell C, Berry J, Guanter L, Joiner J, Köhler P, Pollock R and Taylor T E. 2014. Prospects for chlorophyll fluorescence remote sensing from the Orbiting Carbon Observatory-2. Remote Sensing of Environment, 147 : 1–12. [DOI: 10.1016/j.rse.2014.02.007]
-
Green J K, Konings A G, Alemohammad S H, Berry J, Entekhabi D, Kolassa J, Lee J E and Gentine P. 2017. Regionally strong feedbacks between the atmosphere and terrestrial biosphere. Nature Geoscience, 10 (6): 410–414. [DOI: 10.1038/ngeo2957]
-
Guan K Y, Berry J A, Zhang Y G, Joiner J, Guanter L, Badgley G and Lobell D B. 2016. Improving the monitoring of crop productivity using spaceborne solar-induced fluorescence. Global Change Biology, 22 (2): 716–726. [DOI: 10.1111/gcb.13136]
-
Guanter L, Aben I, Tol P, Krijger J M, Hollstein A, Köhler P, Damm A, Joiner J, Frankenberg C and Landgraf J. 2015. Potential of the TROPOspheric Monitoring Instrument (TROPOMI) onboard the Sentinel-5 Precursor for the monitoring of terrestrial chlorophyll fluorescence. Atmospheric Measurement Techniques, 8 (3): 1337–1352. [DOI: 10.5194/amt-8-1337-2015]
-
Guanter L, Alonso L, Gómez-Chova L, Amorós-López J, Vila J and Moreno J. 2007. Estimation of solar-induced vegetation fluorescence from space measurements. Geophysical Research Letters, 34 : L08401 [DOI: 10.1029/2007GL029289]
-
Guanter L, Alonso L, Gómez-Chova L, Meroni M, Preusker R, Fischer J and Moreno J. 2010. Developments for vegetation fluorescence retrieval from spaceborne high-resolution spectrometry in the O2-A and O2-B absorption bands . Journal of Geophysical Research, 115 : D19303 [DOI: 10.1029/2009JD013716]
-
Guanter L, Frankenberg C, Dudhia A, Lewis P E, Gómez-Dans J, Kuze A, Suto H and Grainger R G. 2012. Retrieval and global assessment of terrestrial chlorophyll fluorescence from GOSAT space measurements. Remote Sensing of Environment, 121 : 236–251. [DOI: 10.1016/j.rse.2012.02.006]
-
Guanter L, Rossini M, Colombo R, Meroni M, Frankenberg C, Lee J E and Joiner J. 2013. Using field spectroscopy to assess the potential of statistical approaches for the retrieval of sun-induced chlorophyll fluorescence from ground and space. Remote Sensing of Environment, 133 : 52–61. [DOI: 10.1016/j.rse.2013.01.017]
-
Guanter L, Zhang Y G, Jung M, Joiner J, Voigt M, Berry J A, Frankenberg C, Huete A R, Zarco-Tejada P, Lee J E, Moran M S, Ponce-Campos G, Beer C, Camps-Valls G, Buchmann N, Gianelle D, Klumpp K, Cescatti A, Baker J M and Griffis T J. 2014. Global and time-resolved monitoring of crop photosynthesis with chlorophyll fluorescence. Proceedings of the National Academy of Sciences of the United States of America, 111 (14): E1327–E1333. [DOI: 10.1073/pnas.1320008111]
-
He L M, Chen J M, Liu J, Mo G and Joiner J. 2017. Angular normalization of GOME-2 Sun-induced chlorophyll fluorescence observation as a better proxy of vegetation productivity. Geophysical Research Letters, 44 (11): 5691–5699. [DOI: 10.1002/2017GL073708]
-
Jeong S J, Schimel D, Frankenberg C, Drewry D T, Fisher J B, Verma M, Berry J A, Lee J E and Joiner J. 2017. Application of satellite solar-induced chlorophyll fluorescence to understanding large-scale variations in vegetation phenology and function over northern high latitude forests. Remote Sensing of Environment, 190 : 178–187. [DOI: 10.1016/j.rse.2016.11.021]
-
Jeong S J, Ho C H, Choi S D, Kim J, Lee E J and Gim H J. 2013. Satellite data-based phenological evaluation of the nationwide reforestation of South Korea. PLoS One, 8 (3): e58900 [DOI: 10.1371/journal.pone.0058900]
-
Jeong S J, Ho C H, Gim H J and Brown M E. 2011. Phenology shifts at start vs. end of growing season in temperate vegetation over the Northern Hemisphere for the period 1982-2008. Global Change Biology, 17 (7): 2385–2399. [DOI: 10.1111/j.1365-2486.2011.02397.x]
-
Ji L and Peters A J. 2003. Assessing vegetation response to drought in the northern Great Plains using vegetation and drought indices. Remote Sensing of Environment, 87 (1): 85–98. [DOI: 10.1016/S0034-4257(03)00174-3]
-
Joiner J, Guanter L, Lindstrot R, Voigt M, Vasilkov A P, Middleton E M, Huemmrich K F, Yoshida Y and Frankenberg C. 2013. Global monitoring of terrestrial chlorophyll fluorescence from moderate-spectral-resolution near-infrared satellite measurements: methodology, simulations, and application to GOME-2. Atmospheric Measurement Techniques, 6 (10): 2803–2823. [DOI: 10.5194/amt-6-2803-2013]
-
Joiner J, Yoshida Y, Guanter L and Middleton E M. 2016. New methods for the retrieval of chlorophyll red fluorescence from hyperspectral satellite instruments: simulations and application to GOME-2 and SCIAMACHY. Atmospheric Measurement Techniques, 9 : 3939–3967. [DOI: 10.5194/amt-2015-387]
-
Joiner J, Yoshida Y, Vasilkov A P, Middleton E M, Campbell P K E, Yoshida Y, Kuze A and Corp L A. 2012. Filling-in of near-infrared solar lines by terrestrial fluorescence and other geophysical effects: simulations and space-based observations from SCIAMACHY and GOSAT. Atmospheric Measurement Techniques, 5 (4): 809–829. [DOI: 10.5194/amt-5-809-2012]
-
Joiner J, Yoshida Y, Vasilkov A P, Schaefer K, Jung M, Guanter L, Zhang Y, Garrity S, Middleton E M, Huemmrich K F, Gu L and Belelli Marchesini L. 2014. The seasonal cycle of satellite chlorophyll fluorescence observations and its relationship to vegetation phenology and ecosystem atmosphere carbon exchange. Remote Sensing of Environment, 152 : 375–391. [DOI: 10.1016/j.rse.2014.06.022]
-
Joiner J, Yoshida Y, Vasilkov A P, Yoshida Y, Corp L A and Middleton E M. 2011. First observations of global and seasonal terrestrial chlorophyll fluorescence from space. Biogeosciences, 8 (3): 637–651. [DOI: 10.5194/bg-8-637-2011]
-
Knyazikhin Y, Schull M A, Stenberg P, Mottus M, Rautiainen M, Yang Y, Marshak A, Latorre Carmona P, Kaufmann R K, Lewis P, Disney M I, Vanderbilt V, Davis A B, Baret F, Jacquemoud S, Lyapustin A and Myneni R B. 2013. Hyperspectral remote sensing of foliar nitrogen content. Proceedings of the National Academy of Sciences of the United States of America, 110 (3): E185–E192. [DOI: 10.1073/pnas.1210196109]
-
Koffi E N, Rayner P J, Norton A J, Frankenberg C and Scholze M. 2015. Investigating the usefulness of satellite derived fluorescence data in inferring gross primary productivity within the carbon cycle data assimilation system. Biogeosciences, 12 (13): 4067–4084. [DOI: 10.5194/bg-12-4067-2015]
-
Köhler P, Guanter L and Joiner J. 2015. A linear method for the retrieval of sun-induced chlorophyll fluorescence from GOME-2 and SCIAMACHY data. Atmospheric Measurement Techniques, 8 (6): 2589–2608. [DOI: 10.5194/amt-8-2589-2015]
-
Krumov A, Nikolova A, Vassilev V and Vassilev N. 2008. Assessment of plant vitality detection through fluorescence and reflectance imagery. Advances in Space Research, 41 (11): 1870–1875. [DOI: 10.1016/j.asr.2007.11.020]
-
Lee J E, Berry J A, van der Tol C, Yang X, Guanter L, Damm A, Baker I and Frankenberg C. 2015. Simulations of chlorophyll fluorescence incorporated into the Community Land Model version 4. Global Change Biology, 21 (9): 3469–3477. [DOI: 10.1111/gcb.12948]
-
Lee J E, Frankenberg C, van der Tol C, Berry J A, Guanter L, Boyce C K, Fisher J B, Morrow E, Worden J R, Asefi S, Badgley G and Saatchi S. 2013. Forest productivity and water stress in Amazonia: observations from GOSAT chlorophyll fluorescence. Proceedings of the Royal Society B: Biological Sciences, 280 (1761): 20130171 [DOI: 10.1098/rspb.2013.0171]
-
Liu J J, Bowman K W, Schimel D S, Parazoo N C, Jiang Z, Lee M, Bloom A A, Wunch D, Frankenberg C, Sun Y, O’Dell C W, Gurney K R, Menemenlis D, Gierach M, Crisp D and Eldering A. 2017. Contrasting carbon cycle responses of the tropical continents to the 2015-2016 El Niño. Science, 358 (6360): eaam5690 [DOI: 10.1126/science.aam5690]
-
Liu X J, Liu L Y, Zhang S and Zhou X F. 2015. New spectral fitting method for full-spectrum solar-induced chlorophyll fluorescence retrieval based on principal components analysis. Remote Sensing, 7 (8): 10626–10645. [DOI: 10.3390/rs70810626]
-
Luus K A, Commane R, Parazoo N C, Benmergui J, Euskirchen E S, Frankenberg C, Joiner J, Lindaas J, Miller C E, Oechel W C, Zona D, Wofsy S and Lin J C. 2017. Tundra photosynthesis captured by satellite-observed solar-induced chlorophyll fluorescence. Geophysical Research Letters, 44 (3): 1564–1573. [DOI: 10.1002/2016GL070842]
-
Mazzoni M, Meroni M, Fortunato C, Colombo R and Verhoef W. 2012. Retrieval of maize canopy fluorescence and reflectance by spectral fitting in the O2–A absorption band . Remote Sensing of Environment, 124 : 72–82. [DOI: 10.1016/j.rse.2012.04.025]
-
Medrano H, Escalona J M, Bota J, Gulías J and Flexas J. 2002. Regulation of photosynthesis of C3 plants in response to progressive drought: stomatal conductance as a reference parameter . Annals of Botany, 89 (7): 895–905. [DOI: 10.1093/aob/mcf079]
-
Meroni M, Picchi V, Rossini M, Cogliati S, Panigada C, Nali C, Lorenzini G and Colombo R. 2008. Leaf level early assessment of ozone injuries by passive fluorescence and photochemical reflectance index. International Journal of Remote Sensing, 29 (17/18): 5409–5422. [DOI: 10.1080/01431160802036292]
-
Meroni M, Rossini M, Guanter L, Alonso L, Rascher U, Colombo R and Moreno J. 2009. Remote sensing of solar-induced chlorophyll fluorescence: review of methods and applications. Remote Sensing of Environment, 113 (10): 2037–2051. [DOI: 10.1016/j.rse.2009.05.003]
-
Monteith J L. 1972. Solar radiation and productivity in tropical ecosystems. The Journal of Applied Ecology, 9 (3): 747–766. [DOI: 10.2307/2401901]
-
Neuner G and Larcher W. 1990. Determination of differences in chilling susceptibility of two soybean varieties by means of in vivo chlorophyll fluorescence measurements. Journal of Agronomy and Crop Science, 164 (2): 73–80. [DOI: 10.1111/j.1439-037X.1990.tb00788.x]
-
Norton A J, Rayner P J, Koffi E N and Scholze M. 2017. Assimilating solar-induced chlorophyll fluorescence into the terrestrial biosphere model BETHY-SCOPE: model description and information content. Geoscientific Model Development : 1–26. [DOI: 10.5194/gmd-2017-34]
-
Parazoo N C, Bowman K, Frankenberg C, Lee J E, Fisher J B, Worden J, Jones D B A, Berry J, Collatz G J, Baker I T, Jung M, Liu J J, Osterman G, O’Dell C, Sparks At, Butz A, Guerlet S, Yoshida Y, Chen H L and Gerbig C. 2013. Interpreting seasonal changes in the carbon balance of southern Amazonia using measurements of XCO2 and chlorophyll fluorescence from GOSAT . Geophysical Research Letters, 40 (11): 2829–2833. [DOI: 10.1002/grl.50452]
-
Perez-Priego O, Zarco-Tejada P J, Miller J R, Sepulcre-Canto G and Fereres E. 2005. Detection of water stress in orchard trees with a high-resolution spectrometer through chlorophyll fluorescence in-filling of the O2-A band . IEEE Transactions on Geoscience and Remote Sensing, 43 (12): 2860–2869. [DOI: 10.1109/TGRS.2005.857906]
-
Piao S L, Ciais P, Friedlingstein P, Peylin P, Reichstein M, Luyssaert S, Margolis H, Fang J Y, Barr A, Chen A P, Grelle A, Hollinger D Y, Laurila T, Lindroth A, Richardson A D and Vesala T. 2008. Net carbon dioxide losses of northern ecosystems in response to autumn warming. Nature, 451 (7174): 49–52. [DOI: 10.1038/nature06444]
-
Piao S L, Mohammat A, Fang J Y, Cai Q and Feng J M. 2006. NDVI-based increase in growth of temperate grasslands and its responses to climate changes in China. Global Environmental Change, 16 (4): 340–348. [DOI: 10.1016/j.gloenvcha.2006.02.002]
-
Plascyk J A and Gabriel F C. 1975. The fraunhofer line discriminator MKII-An airborne instrument for precise and standardized ecological luminescence measurement. IEEE Transactions on Instrumentation and Measurement, 24 (4): 306–313. [DOI: 10.1109/TIM.1975.4314448]
-
Porcar-Castell A, Tyystjärvi E, Atherton J, van der Tol C, Flexas J, Pfündel E E, Moreno J, Frankenberg C and Berry J A. 2014. Linking chlorophyll a fluorescence to photosynthesis for remote sensing applications: mechanisms and challenges. Journal of Experimental Botany, 65 (15): 4065–4095. [DOI: 10.1093/jxb/eru191]
-
Rathcke B and Lacey E P. 1985. Phenological patterns of terrestrial plants. Annual Review of Ecology and Systematics, 16 (1): 179–214. [DOI: 10.1146/annurev.es.16.110185.001143]
-
Richardson A D, Hollinger D Y, Dail D B, Lee J T, Munger J W and O’Keefe J. 2009. Influence of spring phenology on seasonal and annual carbon balance in two contrasting New England forests. Tree Physiology, 29 (3): 321–331. [DOI: 10.1093/treephys/tpn040]
-
Rossini M, Nedbal L, Guanter L, Ač A, Alonso L, Burkart A, Cogliati S, Colombo R, Damm A, Drusch M, Hanus J, Janoutova R, Julitta T, Kokkalis P, Moreno J, Novotny J, Panigada C, Pinto F, Schickling A, Schüttemeyer D, Zemek F and Rascher U. 2015. Red and far red Sun-induced chlorophyll fluorescence as a measure of plant photosynthesis. Geophysical Research Letters, 42 (6): 1632–1639. [DOI: 10.1002/2014GL062943]
-
Sanders A F J, Verstraeten W W, Kooreman M L, van Leth T C, Beringer J and Joiner J. 2016. Spaceborne sun-induced vegetation fluorescence time series from 2007 to 2015 evaluated with australian flux tower measurements. Remote Sensing, 8 (12): 895 [DOI: 10.3390/rs8110895]
-
Shen M G, Tang Y H, Desai A R, Gough C and Chen J. 2014. Can EVI-derived land-surface phenology be used as a surrogate for phenology of canopy photosynthesis?. International Journal of Remote Sensing, 35 (3): 1162–1174. [DOI: 10.1080/01431161.2013.875636]
-
Sun Y, Fu R, Dickinson R, Joiner J, Frankenberg C, Gu L H, Xia Y L and Fernando N. 2015. Drought onset mechanisms revealed by satellite solar-induced chlorophyll fluorescence: insights from two contrasting extreme events. Journal of Geophysical Research: Biogeosciences, 120 (11): 2427–2440. [DOI: 10.1002/2015JG003150]
-
Sun Y, Frankenberg C, Wood J D, Schimel D S, Jung M, Guanter L, Drewry D T, Verma M, Porcar-Castell A, Griffis T J, Gu L, Magney T S, Köhler P, Evans B and Yuen K. 2017. OCO-2 advances photosynthesis observation from space via solar-induced chlorophyll fluorescence. Science, 358 (6360): eaam5747 [DOI: 10.1126/science.aam5747]
-
Thum T, Zaehle S, Köhler P, Aalto T, Aurela M, Guanter L, Kolari P, Laurila T, Lohila A, Magnani F, Van der Tol C and Markkanen T. 2017. Modelling sun-induced fluorescence and photosynthesis with a land surface model at local and regional scales in northern Europe. Biogeosciences, 14 (7): 1969–1987. [DOI: 10.5194/bg-14-1969-2017]
-
Walther S, Voigt M, Thum T, Gonsamo A, Zhang YvG, Köhler P, Jung M, Varlagin A and Guanter L. 2016. Satellite chlorophyll fluorescence measurements reveal large-scale decoupling of photosynthesis and greenness dynamics in boreal evergreen forests. Global Change Biology, 22 (9): 2979–2996. [DOI: 10.1111/gcb.13200]
-
Wang R, Liu Z G, and Yang P Q. 2012. Principle and progress in remote sensing of vegetation solar-induced chlorophyll fluorescence. Advances in Earth Science, 27 (11): 1221–1228. ( 王冉, 刘志刚, 杨沛琦. 2012. 植物日光诱导叶绿素荧光的遥感原理及研究进展. 地球科学进展, 27 (11): 1221–1228. )
-
Wang S H, Huang C P, Zhang L F, Lin Y, Cen Y and Wu T X. 2016. Monitoring and assessing the 2012 drought in the great plains: analyzing satellite-retrieved solar-induced chlorophyll fluorescence, drought indices, and gross primary production. Remote Sensing, 8 (2): 61 [DOI: 10.3390/rs8020061]
-
White M A, De Beurs K M, Didan K, Inouye D W, Richardson A D, Jensen O P, O’Keefe J, Zhang G, Nemani R R, Van Leeuwen W J D, Brown J F, De Wit A, Schaepman M, Lin X M, Dettinger M, Bailey A S, Kimball J, Schwartz M D, Baldocchi D D, Lee J T and Lauenroth W K. 2009. Intercomparison, interpretation, and assessment of spring phenology in North America estimated from remote sensing for 1982-2006. Global Change Biology, 15 (10): 2335–2359. [DOI: 10.1111/j.1365-2486.2009.01910.x]
-
Wolanin A, Rozanov V V, Dinter T, Noël S, Vountas M, Burrows J P and Bracher A. 2015. Global retrieval of marine and terrestrial chlorophyll fluorescence at its red peak using hyperspectral top of atmosphere radiance measurements: feasibility study and first results. Remote Sensing of Environment, 166 : 243–261. [DOI: 10.1016/j.rse.2015.05.018]
-
Yang W, Yang L and Merchant J W. 1997. An assessment of AVHRR/NDVI-ecoclimatological relations in Nebraska, U. S.A. International Journal of Remote Sensing, 18 (10): 2161–2180. [DOI: 10.1080/014311697217819]
-
Yang X, Tang J W, Mustard J F, Lee J E, Rossini M, Joiner J, Munger J W, Kornfeld A and Richardson A D. 2015. Solar-induced chlorophyll fluorescence that correlates with canopy photosynthesis on diurnal and seasonal scales in a temperate deciduous forest. Geophysical Research Letters, 42 (8): 2977–2987. [DOI: 10.1002/2015GL063201]
-
Yoshida Y, Joiner J, Tucker C, Berry J, Lee J E, Walker G, Reichle R, Koster R, Lyapustin A and Wang Y. 2015. The 2010 Russian drought impact on satellite measurements of solar-induced chlorophyll fluorescence: insights from modeling and comparisons with parameters derived from satellite reflectances. Remote Sensing of Environment, 166 : 163–177. [DOI: 10.1016/j.rse.2015.06.008]
-
Zarco-Tejada P J, Morales A, Testi L and Villalobos F J. 2013. Spatio-temporal patterns of chlorophyll fluorescence and physiological and structural indices acquired from hyperspectral imagery as compared with carbon fluxes measured with eddy covariance. Remote Sensing of Environment, 133 : 102–115. [DOI: 10.1016/j.rse.2013.02.003]
-
Zhang Y G, Guanter L, Berry J A, Joiner J, van der Tol C, Huete A, Gitelson A, Voigt M and Köhler P. 2014. Estimation of vegetation photosynthetic capacity from space-based measurements of chlorophyll fluorescence for terrestrial biosphere models. Global Change Biology, 20 (12): 3727–3742. [DOI: 10.1111/gcb.12664]
-
Zhang Y G, Guanter L, Berry J A, van der Tol C, Yang X, Tang J W and Zhang F M. 2016. Model-based analysis of the relationship between sun-induced chlorophyll fluorescence and gross primary production for remote sensing applications. Remote Sensing of Environment, 187 : 145–155. [DOI: 10.1016/j.rse.2016.10.016]
-
Zhang Y J, Liu L Y, Hou M Y, Liu L T and Li C D. 2009. Progress in remote sensing of vegetation chlorophyll fluorescence. Journal of Remote Sensing, 13 (5): 963–978. [DOI: 10.3321/j.issn:1007-4619.2009.05.015] ( 张永江, 刘良云, 侯名语, 刘连涛, 李存东. 2009. 植物叶绿素荧光遥感研究进展. 遥感学报, 13 (5): 963–978. [DOI: 10.3321/j.issn:1007-4619.2009.05.015] )