扩展功能
文章信息
- 刘衍素, 杨静, 范艳珠, 沈迪, 孙若磊, 钮文俊, 方光战
- LIU Yansu, YANG Jing, FAN Yanzhu, SHEN Di, SUN Ruolei, NIU Wenjun, FANG Guangzhan
- 社会隔离对小鼠焦虑水平及神经活动的影响
- Effects of Social Isolation on Anxiety Level and Neural Activities in Mice
- 四川动物, 2022, 41(2): 143-152
- Sichuan Journal of Zoology, 2022, 41(2): 143-152
- 10.11984/j.issn.1000-7083.20210256
-
文章历史
- 收稿日期: 2021-07-27
- 接受日期: 2021-09-26
2. 中国科学院成都生物研究所, 成都 610041
2. Chengdu Institute of Biology, Chinese Academy of Sciences, Chengdu 610041, China
焦虑作为一种情绪反应或对未来威胁的预期,是由于个体经历一定的有害刺激后,从而导致其行为和意识状态的改变(Iftikhar et al., 2020)。不良的早期生活经历可能会破坏与应激反应、情绪行为和情绪状态有关的神经系统的正常发育,造成后期更易罹患如焦虑症、情感障碍等精神疾病,从而对心理健康产生长期不良影响(Lukkes et al., 2009)。通过断乳后即进行社会隔离的动物模型,可模拟人类早期(如童年时期)遭受的不良经历,特别是社会忽视,而焦虑和攻击行为增多则是该时期表现出的显著行为特征之一(Chapple et al., 2005;Pesonen et al., 2010;刘朝宝等,2016;程广超等,2017)。例如,断乳后即开始经历隔离饲养的雄性大鼠在高架十字迷宫(elevated plus maze,EPM)测试中,表现出进入开放臂的时间和次数均减少,表明焦虑行为增加(Parker & Morinan,1986;Wright et al., 1991;Weiss et al., 2004)。
局部场电位(local field potential,LFP)是神经元的群体活动,反映局部脑区群体神经元突触后电位的总和,因其时空分辨率高,可反映动物在不同行为状态下的大脑信息处理模式,是脑科学研究的有力工具之一。在LFP信号中,通常可观察到不同频率的、源于不同皮层和皮层下结构的周期性节律:δ节律(1.5~4 Hz)、θ节律(4~8 Hz)、α节律(8~12 Hz)、β节律(12~30 Hz)和γ节律(30~80 Hz)。同一节律可能参与多种大脑功能的实现,同一大脑功能亦需多种节律参与(Başar et al., 2001)。因此,大脑功能与LFP息息相关,而焦虑行为是动物异常行为的显性表现之一;大脑作为控制动物行为的中枢,焦虑行为就可能伴随着大脑活动(包括LFP)的特定模式。目前经社会隔离饲养引起焦虑行为的研究多集中于行为结果、神经化学变化以及调控焦虑行为的相关脑区,而内侧前额叶皮层(Sewards & Sewards,2003;Morgane et al., 2005)、内侧杏仁核(Kalin et al., 2004;Flores-Gracia et al., 2010)及腹内侧下丘脑(Kim et al., 2008;Zhao et al., 2008)均为与焦虑相关的重要脑区。但是不良的早期经历导致的焦虑行为潜在的神经活动模式还知之甚少。为此,以CD-1小鼠Mus musculus为研究对象,在其断乳后即进行为期2周的隔离或群居饲养,以EPM行为范式为基础,记录内侧前额叶、内侧杏仁核及腹内侧下丘脑的LFP信号,分析其处于不同臂型时的行为特征、不同脑区对应的LFP功率谱变化,进而探讨焦虑行为及其对应的神经活动模式。
1 材料和方法 1.1 实验动物购自成都达硕实验动物有限公司的PD21雄性CD-1小鼠(n=40),随机平分为2组:社会群居组(SG组,每笼5只)和社会隔离组(SI组,单笼单只)。动物均采用小鼠独立通气笼具(ZJ-4,冯氏,中国苏州)饲养,饲养2周后进行EPM行为测试。动物处于固定光照周期(08∶ 00开灯,20∶ 00关灯)、温度和相对湿度分别保持在(22±1)℃和(60±10)%的饲养房中,可自由获取食物和水。所有实验在夜相且暗红光(<2 lux)照明条件下进行。实验流程按中国科学院成都生物研究所实验动物伦理委员会相关要求进行。
1.2 动物手术将小鼠放入诱导盒内使用异氟烷进行深度麻醉后,通过立体定位仪(51603,Stoelting,美国)进行头部固定,连接气体麻醉系统(VMR,Matrx,美国)维持麻醉,然后从前后、左右2个维度调平颅骨表面。根据小鼠脑图谱,分别在双侧的内侧前额叶、内侧杏仁核及腹内侧下丘脑植入6个由单根不锈钢丝(直径0.8 mm)组成的LFP电极(图 1)。相应电极位置坐标如图 1所示,其中,前后方向(anteroposterior,AP)以前囟为参考,前囟前为正,前囟后为负;左右方向(mediolateral,ML)以中缝为参考,左侧为正,右侧为负;深度方向(dorsoventral,DV)以硬脑膜为参考,下方为负:(1)内侧前额叶(mPFC):AP,+1.94 mm;ML,±0.4 mm;DV,-2.1 mm。(2)内侧杏仁核(MeA):AP,-1.34 mm;ML,±1.75 mm;DV,-5.4 mm。(3)腹内侧下丘脑(VMH):AP,-1.94 mm;ML,±0.6 mm;DV,-5.8 mm。将参考电极(C)植入小脑(AP,-6.5 mm;ML,0 mm)上方;电极埋植区前后共植入4个微型不锈钢螺钉用于固定,使用牙托水泥封固,以确保电极的稳固性。动物恢复7 d后再行后续实验。共获得31只小鼠的有效实验数据(SI组16只,SG组15只)。

|
| 图 1 电极位置分布及对应的10 s局部场电位特征波形 Fig. 1 Electrode placements and corresponding typical electroencephalogram tracings of 10 s |
| |
EPM实验是利用动物对高悬敞开环境的恐惧和对新异环境的探究特性,形成一种“规避-探究”的行为冲突,以模仿人类的焦虑状态,是经典的焦虑行为测试,具有简单、快速、结果重复性好等优点(罗丹妮,2019)。该范式利用进入开放臂次数和百分比、开放臂停留时间和百分比等指标评价动物的焦虑水平。EPM高出地面50 cm,由2个开放臂(长30 cm×宽5 cm)、2个闭合臂(长30 cm×宽5 cm×高15 cm)和1个连接4个臂的中央区(长5 cm×宽5 cm)组成。
实验前CD-1小鼠适应测试环境3 h。连接脑电信号采集系统(RM6280,成仪,成都)并在饲养笼内适应15 min,待信号稳定后将小鼠头朝开放臂放入中央区,让其自由探索任意区域。使用位于EPM上方的红外摄像头记录5 min行为视频;同时连续同步记录脑电(electroencephalogram, EEG)信号,采集参数设置为500 Hz低通滤波、50 Hz陷波、1 000 Hz采样率。每个被试测试后,用75%乙醇对测试装置进行清洁除味,方可进行下一被试的实验;动物出场顺序随机。实验完成后,用程控电刺激仪(YC-2,成仪,成都)并以0.4 mA的电流强度,对植入电极的每个脑区进行电流损毁8 s,用组织学方法验证记录电极位点,排除非目标位点的数据。
2 数据处理 2.1 焦虑行为数据分析利用开源的事件记录和分析软件(BORIS)进行行为视频分析。参数为进入开放臂次数(open arm entry,OE)、开放臂停留时间(open arm time,OT)、进入闭合臂次数(closed arm entry,CE)、闭合臂停留时间(closed arm time,CT)、进入中央区次数(central area entry,CEE)、中央区停留时间(central area time,CET)、在开放臂或中央区头向下探究次数、闭合臂内后腿直立次数、进入开放臂次数百分比[OE%=OE/(OE+CE)×100%]、开放臂停留时间百分比[OT%=OT/(OT+CT)×100%]。进入开放臂次数及停留时间越少反映小鼠焦虑水平越高。
2.2 LFP数据分析LFP数据经0.5~80 Hz带通滤波后,提取小鼠位于开放臂远端(即将开放臂从中间位置划分,远离中心区的一端)和闭合臂远端(即将闭合臂从中间位置划分,远离中心区的一端)无伪迹的2 s数据段。利用Welch方法(汉明窗,频谱分辨率为0.5 Hz)分别计算每段数据的δ、θ、α、β和γ节律的绝对功率谱。得到每种节律、每个组别、每个脑区(左右侧内侧前额叶、左右侧内侧杏仁核、左右侧腹内侧下丘脑)、每种臂型(开放臂和闭合臂)对应的绝对功率谱,并进行统计分析。
2.3 统计分析分别用Shapiro-Wilk W检验和Levene检验检测数据分布的正态性和方差齐性。由于闭合臂内后腿直立次数的数据不服从正态分布和方差同质性假设,采用Mann-Whitney U检验检测2组间的行为响应差异,其余的行为数据均使用单因素方差分析统计。
对于绝对功率谱,采用因子“组别”“脑区”和“臂型”进行三因素重复测量方差分析探讨主效应和交互效应。若交互效应显著,采用简单或简单-简单效应分析。采用最小显著差异法(LSD)进行事后检验,对违反球形检验假设的数据进行Greenhouse-Geisser校正。所有统计分析均在SPSS 23.0中进行。显著性水平设置为α=0.05。
3 实验结果 3.1 行为结果SG组小鼠进入开放臂的次数高于SI组(F1, 29= 10.326,P=0.003),差异显著;进入闭合臂(F1, 29=2.373,P=0.134)和中央区的次数(F1, 29= 0.156,P=0.696)在2组间的差异不显著(图 2:A)。SG组小鼠在开放臂的停留时间显著高于SI组(F1, 29=4.268,P=0.048),而在闭合臂的停留时间(F1, 29=0.461,P=0.503)在2组间的差异不显著,SI组在中央区的停留时间显著高于SG组(F1, 29=4.697,P=0.039)(图 2:B);SG组在开放臂或中央区头向下探究的次数高于SI组(F1, 29=4.37,P=0.045),差异显著;在闭合臂内后腿直立的次数(U=80,N=31,P=0.112)在2组间的差异不显著(图 2:C)。SG组小鼠进入开放臂次数百分比高于SI组(F1, 29=23.472,P<0.001),差异极显著;而开放臂停留时间百分比在2组间的差异不显著(F1, 29=3.145,P=0.087;图 2:D)。
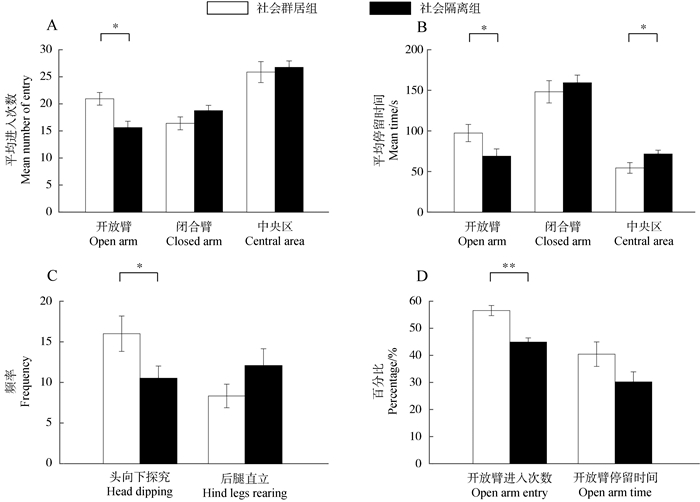
|
| 图 2 焦虑行为不同参数统计结果 Fig. 2 Statistical results of different parameters of anxiety behaviors A. 开放臂、闭合臂和中央区的进入次数, B. 开放臂、闭合臂和中央区的停留时间, C. 头向下探究及后腿直立次数, D. 开放臂进入次数和开放臂停留时间百分比;* P<0.05, ** P<0.001;下同 A. Numbers of entries to the open arm, closed arm and central area, B. time of staying in the open arm, closed arm and central area, C. numbers of head-dipping and hind legs rearing, D. percentages of open arm entry and open arm time; * P < 0.05, ** P < 0.001; the same below |
| |
开放臂和闭合臂的近端与远端对应的LFP数据相似,仅汇报远端结果:δ、θ、α、β和γ节律中,“臂型”和“脑区”的主效应均极显著,且闭合臂对应的绝对功率谱大于开放臂,差异均显著,但“组别”的主效应不显著(表 1)。
| 项目 Item |
绝对功率谱(1, 29)(1, 29)(5, 145)a Absolute power spectra (1, 29)(1, 29)(5, 145)a |
||
| 组别 Group |
臂型 Arm type |
脑区 Brain area |
|
| δ节律 | |||
| F | 0.042 | 20.800 | 7.112 |
| P | 0.838 | <0.001 | <0.001 |
| ε | NA | 1.000 | 0.541 |
| η2 | 0.001 | 0.418 | 0.197 |
| LSD | NA | CA>OA | LP>RP, LM, RM, LH RP>LM, RH; LH, RH>LM, RM |
| θ节律 | |||
| F | 0.050 | 18.863 | 13.931 |
| P | 0.824 | <0.001 | <0.001 |
| ε | NA | 1.000 | 0.645 |
| η2 | 0.002 | 0.394 | 0.324 |
| LSD | NA | CA>OA | LP>RP, LH, RH>LM, RM |
| α节律 | |||
| F | 0.155 | 16.438 | 15.425 |
| P | 0.697 | <0.001 | <0.001 |
| ε | NA | 1.000 | 0.621 |
| η2 | 0.005 | 0.362 | 0.347 |
| LSD | NA | CA>OA | LP>RP, LH>LM, RM LP>RH; RH>RM |
| β节律 | |||
| F | 0.362 | 14.363 | 12.738 |
| P | 0.552 | 0.001 | <0.001 |
| ε | NA | 1.000 | 0.764 |
| η2 | 0.012 | 0.331 | 0.335 |
| LSD | NA | CA>OA | LP>RP>LM, RM, RH; LP>LH |
| γ节律 | |||
| F | 1.551 | 25.108 | 30.853 |
| P | 0.223 | <0.001 | <0.001 |
| ε | NA | 1.000 | 0.813 |
| η2 | 0.051 | 0.464 | 0.515 |
| LSD | NA | CA>OA | LP, RP>LM, RM, LH, RH; LH>RM |
| 注:>. 左侧的绝对功率谱显著大于右侧,同侧间无显著差异; a. 表示“组别”“臂型”和“脑区”的自由度; F. ANOVA的F值;ε. Greenhouse-Geisser校正对应的ε值;η2. ANOVA的效应度;LSD. 最小显著差异法;LP和RP. 左、右内侧前额叶;LM和RM. 左、右内侧杏仁核;LH和RH. 左、右腹内侧下丘脑;OA. 开放臂, CA. 闭合臂, NA. 不适用 Note: >. the absolute power spectra of each rhythm associated with the brain areas or arm type on the left side are significantly larger than those on the right side, and no significant difference exists among the corresponding conditions on the same side; a. the degrees of freedom for the factors ‘group’, ‘arm type’ and ‘brain area’, respectively; F. the F value from ANOVA; ε. the values of epsilon of the Greenhouse-Geisser correction; η2. effect size for ANOVA; LSD. least significant difference test; LP and RP. the left and right medial prefrontal cortex; LM and RM. the left and right medial amygdala; LH and RH. the left and right ventromedial hypothalamus; OA. open arm, CA. closed arm, NA. not applicable |
|||
事后多重比较显示:(1)对δ节律而言,左侧内侧前额叶的绝对功率谱大于右侧内侧前额叶和双侧内侧杏仁核以及左侧腹内侧下丘脑,右侧内侧前额叶的绝对功率谱大于左侧内侧杏仁核及右侧腹内侧下丘脑,双侧腹内侧下丘脑的绝对功率谱大于双侧内侧杏仁核,差异均显著(图 3:A)。(2)对θ节律而言,左侧内侧前额叶的绝对功率谱大于右侧内侧前额叶和双侧腹内侧下丘脑以及双侧内侧杏仁核;右侧内侧前额叶及双侧腹内侧下丘脑的绝对功率谱大于双侧内侧杏仁核,差异均显著(图 3:B)。(3)对α节律而言,左侧内侧前额叶的绝对功率谱大于右侧内侧前额叶和双侧腹内侧下丘脑以及双侧内侧杏仁核;右侧内侧前额叶和左侧腹内侧下丘脑的绝对功率谱大于双侧内侧杏仁核;右侧腹内侧下丘脑的绝对功率谱大于右侧内侧杏仁核,差异均显著(图 3:C)。(4)对β节律而言,左侧内侧前额叶的绝对功率谱大于右侧内侧前额叶和双侧腹内侧下丘脑以及双侧内侧杏仁核;右侧内侧前额叶大于右侧腹内侧下丘脑以及双侧的内侧杏仁核,差异均显著(图 3:D)。(5)对γ节律而言,双侧内侧前额叶的绝对功率谱大于双侧腹内侧下丘脑以及双侧内侧杏仁核;左侧腹内侧下丘脑的绝对功率谱大于右侧内侧杏仁核,差异均显著(图 3:E)。
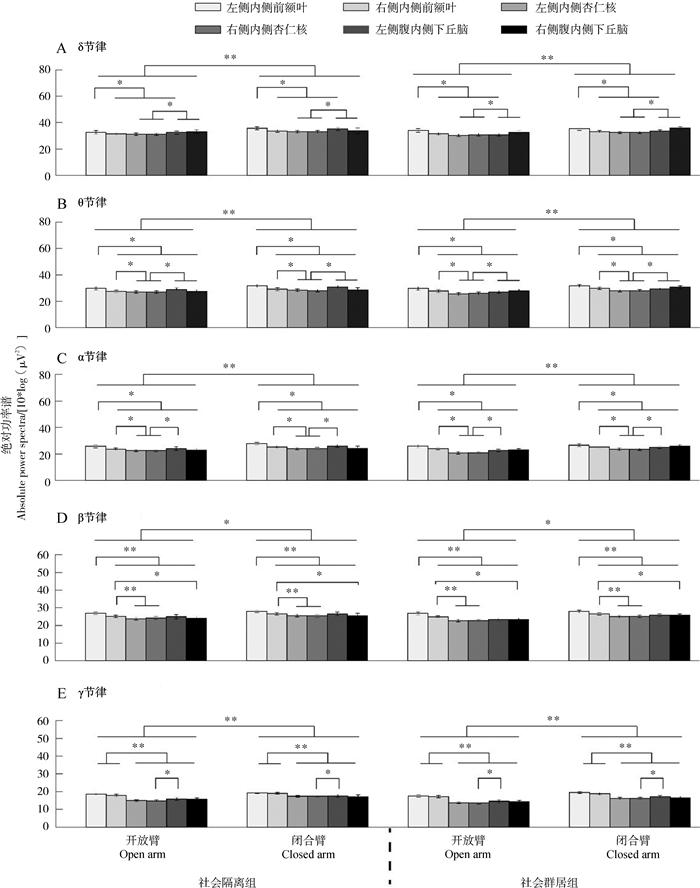
|
| 图 3 独笼(左)和合笼(右)饲养条件下不同脑区、不同臂型条件下的各节律绝对功率谱 Fig. 3 The absolute power spectra of each band with respect to different brain regions and different arm types for isolation (left) and group (right) rearing conditions |
| |
经过电损毁后的电极植入区域的DAPI染色结果(电损毁所在区域均在红色标记区域内)与脑图谱比较结果(图 4)显示,与小鼠脑图谱进行对比,发现电极植入位置与脑图谱所示位置基本一致,说明电极位置正确。

|
| 图 4 内侧前额叶(A)、内侧杏仁核(B)和腹内侧下丘脑(C)双侧脑区的电极位置验证结果 Fig. 4 Verification results of electrode locations for both sides of medial prefrontal cortex (A), medial amygdala (B), and ventromedial hypothalamus (C) areas in the brain |
| |
由于啮齿类动物具有嗜暗性,喜欢在黑暗的环境中活动(比如闭合臂),但面对新环境(比如开放臂)易产生一定的好奇心去探究,EPM范式主要依靠两者之间的冲突产生焦虑心理进行测试。本研究发现CD-1小鼠焦虑行为在不同饲养方式间具有不同的行为表现,即SG组小鼠对应的焦虑行为相关参数(如OE%、OT%、OE%)均显著高于SI组,说明其焦虑水平较低,面对新环境的探究行为多,能够克服对高悬敞开环境的恐惧;反之,SI组小鼠进入开放臂次数以及停留时间少,反映其焦虑水平高、探究性行为少。同时,SG组小鼠在开放臂或中央区头向下探究次数显著多于SI组,表明SG组小鼠在非保护区域内的探索活动更多、更大胆,与其焦虑水平较低相关。本结果与既往啮齿类动物的研究一致(Lukkes et al., 2009;Chang & Gean,2019),即经过社会隔离饲养的CD-1小鼠表现出更高的焦虑水平。
4.2 不同脑区的EEG节律特征受小鼠所处位置调制将CD-1小鼠停留在EPM的臂型和外周生理信号结合起来探究行为表现和生理标记之间的联系,发现低外周状态(生理表现为稳定的呼吸周期以及正常的心率,可理解为非焦虑状态)只出现在闭合臂的远端区域,而在靠近中心区的闭合臂区域没有观察到这种状态(Okonogi et al., 2018)。因本实验没有进行外周生理信号的采集、且近端区域的LFP结果与远端相似,故选取2个臂型的远端区域进行结果汇报与讨论。与以往研究一致,本研究发现闭合臂对应的绝对功率谱均显著大于开放臂,尤其是与表达焦虑状态等情绪相关的θ节律(Pape et al., 2005)。分析大鼠Rattus norvegicus从EPM的闭合臂走向开放臂时的LFPs,发现θ节律的绝对功率谱在闭合臂内会突然增大,在离开闭合臂进入开放臂时显著下降,表明θ节律参与大鼠对开放臂的探索行为,θ节律功率的增大会抑制探索行为,而减少会增加(Lu et al., 2018)。
调控焦虑行为的环路较为复杂,集中于情绪边缘系统,包括内侧前额叶、海马、杏仁核和下丘脑等。本研究发现,相对于SG组而言,SI组小鼠大部分脑区对应的EEG各节律的绝对功率谱在开放臂或闭合臂均具有上调趋势(因未达到统计显著性,结果未汇报)。这一结果与慢性应激造成小鼠杏仁核基底外侧核LFP的EEG各节律的绝对功率谱均具有上调趋势的结果一致(姜方洁等,2016),亦与运动疲劳后大鼠探索行为减少、焦虑样行为增多、并伴有海马CA1区θ节律活动增强(孙丽娜等,2021)以及人类儿童低频EEG节律的功率谱随不利生活环境上调的结果一致(Knyazev,2012)。但是本研究发现的EEG各节律的绝对功率谱在SG组和SI组之间的差异并不显著,这可能与当前研究采用的隔离时长(2周)较短有关。此外,我们发现LFP各节律的绝对功率谱均表现为内侧前额叶最大,这可能与该脑区高度参与小鼠的情绪反应及认知过程(Zheng & Zhang,2015)、前额叶的皮层调控作用(Adhikari et al., 2010;Lesting et al., 2011)、各脑区之间协同响应(Jinks & McGregor,1997;Felix-Ortiz et al., 2013, 2016)等认知活动相关。未来研究可考虑延长隔离时长或者采用双光子显微镜等空间分辨率更高的技术手段进一步研究隔离饲养对大脑神经活动模式或相关脑区树突棘的形态和结构的影响,进而探讨动物焦虑行为与大脑功能之间的因果联系。
程广超, 谢立梦, 王建礼. 2017. 早期社会隔离对雌性ICR小鼠焦虑水平、社会行为及神经内分泌的影响[J]. 四川动物, 36(1): 39-47. |
姜方洁, 付玉, 吴桂生, 等. 2016. 应激诱导小鼠杏仁核theta波段下调介导焦虑反应[J]. 广西师范大学学报(自然科学版), 34(1): 162-167. |
刘朝宝, 王建礼, 詹泊. 2016. 断乳后隔离对BALB/c小鼠的焦虑水平、社会行为及血清应激激素影响的性别差异[J]. 生命科学研究, 20(4): 325-332, 357. |
罗丹妮. 2019. 高架十字迷宫在焦虑大鼠模型判定中的应用[J]. 福建医科大学学报, 53(2): 132-136. |
孙丽娜, 于泓波, 包敬一, 等. 2021. 运动疲劳导致大鼠焦虑并伴有海马CA1区θ节律活动增强[J]. 神经解剖学杂志, 37(1): 8-14. |
Adhikari A, Topiwala MA, Gordon JA. 2010. Synchronized activity between the ventral hippocampus and the medial prefrontal cortex during anxiety[J]. Neuron, 65(2): 257-269. DOI:10.1016/j.neuron.2009.12.002 |
Başar E, Başar-Eroglu C, Karakaş S, et al. 2001. Gamma, alpha, delta, and theta oscillations govern cognitive processes[J]. International Journal of Psychophysiology, 39(2-3): 241-248. DOI:10.1016/S0167-8760(00)00145-8 |
Chang CH, Gean PW. 2019. The ventral hippocampus controls stress-provoked impulsive aggression through the ventromedial hypothalamus in post-weaning social isolation mice[J]. Cell Reports, 28(5): 1195-1205. DOI:10.1016/j.celrep.2019.07.005 |
Chapple CL, Tyler KA, Bersani BE. 2005. Child neglect and adolescent violence: examining the effects of self-control and peer rejection[J]. Violence and Victims, 20(1): 39-53. DOI:10.1891/vivi.2005.20.1.39 |
Felix-Ortiz AC, Beyeler A, Seo C, et al. 2013. BLA to vHPC inputs modulate anxiety-related behaviors[J]. Neuron, 79(4): 658-664. DOI:10.1016/j.neuron.2013.06.016 |
Felix-Ortiz AC, Burgos-Robles A, Bhagat ND, et al. 2016. Bidirectional modulation of anxiety-related and social behaviors by amygdala projections to the medial prefrontal cortex[J]. Neuroscience, 321: 197-209. DOI:10.1016/j.neuroscience.2015.07.041 |
Flores-Gracia C, Nuche-Bricaire A, Crespo-Ramírez M, et al. 2010. GABAA ρ receptor mechanisms in the rat amygdala and its role in the modulation of fear and anxiety[J]. Psychopharmacology, 212(4): 475-484. DOI:10.1007/s00213-010-1973-x |
Iftikhar K, Siddiq A, Baig SG, et al. 2020. Substance P: a neuropeptide involved in the psychopathology of anxiety disorders[J/OL]. Neuropeptides, 79: 101993 [2021-04-02]. https://doi.org/10.1016/j.npep.2019.101993.
|
Jinks AL, McGregor IS. 1997. Modulation of anxiety-related behaviours following lesions of the prelimbic or infralimbic cortex in the rat[J]. Brain Research, 772(1-2): 181-190. DOI:10.1016/S0006-8993(97)00810-X |
Kalin NH, Shelton SE, Davidson RJ. 2004. The role of the central nucleus of the amygdala in mediating fear and anxiety in the primate[J]. Journal of Neuroscience, 24(24): 5506-5515. DOI:10.1523/JNEUROSCI.0292-04.2004 |
Kim KW, Jo YH, Zhao L, et al. 2008. Steroidogenic factor 1 regulates expression of the cannabinoid receptor 1 in the ventromedial hypothalamic nucleus[J]. Molecular Endocrinology, 22(8): 1950-1961. DOI:10.1210/me.2008-0127 |
Knyazev GG. 2012. EEG delta oscillations as a correlate of basic homeostatic and motivational processes[J]. Neuroscience & Biobehavioral Reviews, 36(1): 677-695. |
Lesting J, Narayanan RT, Kluge C, et al. 2011. Patterns of coupled theta activity in amygdala-hippocampal-prefrontal cortical circuits during fear extinction[J/OL]. PLoS ONE, 6(6): e21714 [2021-03-10]. https://doi.org/10.1371/journal.pone.0021714.
|
Lu J, Dong H, Zheng X. 2018. Strengthened functional connectivity among LFPs in rat medial prefrontal cortex during anxiety[J]. Behavioural Brain Research, 349: 130-136. DOI:10.1016/j.bbr.2018.04.013 |
Lukkes JL, Watt MJ, Lowry CA, et al. 2009. Consequences of post-weaning social isolation on anxiety behavior and related neural circuits in rodents[J/OL]. Frontiers in Behavioral Neuroscience, 3: 18 [2021-03-10]. https://doi.org/10.3389/neuro.08.018.2009.
|
Morgane PJ, Galler JR, Mokler DJ. 2005. A review of systems and networks of the limbic forebrain/limbic midbrain[J]. Progress in Neurobiology, 75(2): 143-160. DOI:10.1016/j.pneurobio.2005.01.001 |
Okonogi T, Nakayama R, Sasaki T, et al. 2018. Characterization of peripheral activity states and cortical local field potentials of mice in an elevated plus maze test[J/OL]. Frontiers in Behavioral Neuroscience, 12: 62 [2021-03-10]. https://doi.org/10.3389/fnbeh.2018.00062.
|
Pape HC, Narayanan RT, Smid J, et al. 2005. Theta activity in neurons and networks of the amygdala related to long-term fear memory[J]. Hippocampus, 15(7): 874-880. DOI:10.1002/hipo.20120 |
Parker V, Morinan A. 1986. The socially-isolated rat as a model for anxiety[J]. Neuropharmacology, 25(6): 663-664. DOI:10.1016/0028-3908(86)90224-8 |
Pesonen AK, Räikkönen K, Feldt K, et al. 2010. Childhood separation experience predicts HPA axis hormonal responses in late adulthood: a natural experiment of World WarⅡ[J]. Psychoneuroendocrinology, 35(5): 758-767. DOI:10.1016/j.psyneuen.2009.10.017 |
Sewards TV, Sewards MA. 2003. Representations of motivational drives in mesial cortex, medial thalamus, hypothalamus and midbrain[J]. Brain Research Bulletin, 61(1): 25-49. DOI:10.1016/S0361-9230(03)00069-8 |
Weiss IC, Pryce CR, Jongen-Rêlo AL, et al. 2004. Effect of social isolation on stress-related behavioural and neuroendocrine state in the rat[J]. Behavioural Brain Research, 152(2): 279-295. DOI:10.1016/j.bbr.2003.10.015 |
Wright IK, Upton N, Marsden C. 1991. Resocialisation of isolation-reared rats does not alter their anxiogenic profile on the elevated X-maze model of anxiety[J]. Physiology and Behavior, 50(6): 1129-1132. DOI:10.1016/0031-9384(91)90572-6 |
Zhao L, Kim KW, Ikeda Y, et al. 2008. Central nervous system-specific knockout of steroidogenic factor 1 results in increased anxiety-like behavior[J]. Molecular Endocrinology, 22(6): 1403-1415. DOI:10.1210/me.2008-0034 |
Zheng C, Zhang T. 2015. Synaptic plasticity-related neural oscillations on hippocampus-prefrontal cortex pathway in depression[J]. Neuroscience, 292: 170-180. DOI:10.1016/j.neuroscience.2015.01.071 |
 2022, Vol. 41
2022, Vol. 41




