扩展功能
文章信息
- 杨巧, 谭松, 张月婵, 傅金钟, 陈竞峰
- YANG Qiao, TAN Song, ZHANG Yuechan, FU Jinzhong, CHEN Jingfeng
- 中华蟾蜍静止代谢率与高耗能器官大小的关系
- Association Between Resting Metabolic Rate and Energetically-Expensive Organ Size in Bufo gargarizans
- 四川动物, 2022, 41(2): 133-142
- Sichuan Journal of Zoology, 2022, 41(2): 133-142
- 10.11984/j.issn.1000-7083.20210298
-
文章历史
- 收稿日期: 2021-08-25
- 接受日期: 2021-11-10
2. 中国科学院大学, 北京 100049;
3. 圭尔夫大学, 圭尔夫ON N1G 2W1, 加拿大
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Department of Integrative Biology, University of Guelph, Guelph, ON N1G 2W1, Canada
静止代谢率(resting metabolic rate,RMR)是指动物维持生理稳态的最低能量消耗(Biro & Stamps,2008;孙儒泳等,2019)。在内温动物和外温动物中,RMR分别指代的是基础代谢率(basal metabolic rate,BMR)和标准代谢率(standard metabolic rate,SMR),即成年动物处于非繁殖、静止和消化吸收后的状态时,在热中区(内温动物)或特定温度(外温动物)测得的最低代谢速率。无论外温动物或内温动物,RMR在个体、种群或物种水平上都存在显著差异,且与生长、存活等适合度成分关联密切(Biro & Stamps,2010;Auer et al., 2015;Pettersen et al., 2016;Arnold et al., 2021)。因而探究这些差异的形态、行为、生活史、系统发育方面的原因一直是动物生理生态学、进化生理学的研究重点。
RMR应该与心脏、肝脏、肾脏、小肠等高耗能器官的质量显著正相关(Daan et al., 1990;Hammond & Diamond,1997;Koteja,2000;Ksiazek et al., 2009)。代谢能力更强的有机体可以负荷更高的持续能量支出(如每日能量支出、持续代谢率或者最大代谢率),但它们同时须承受更高的维持代价(即RMR)(Careau et al., 2008)。按照形态功能适应的原则,更高的持续能量支出需要更强大的高耗能器官(主要用于食物同化过程)与之匹配(又称“摄食增量假说”)。这个假说预测,在相关选择作用下,更大的高耗能器官需要更高的RMR以维持其基础运行。该预测在内温动物中得到较普遍的支持。尽管小鼠Mus musculus的小肠、肝脏、肾脏和心脏总重只占体质量的17%,但却贡献了个体间RMR 52%的差异(Konarzewski & Diamond,1995;Ksiazek et al., 2004)。此外,人工选择BMR更高或食物摄入量更多的小鼠品系会导致小肠、肝脏、肾脏和心脏的比重增加(Selman et al., 2001;Ksiazek et al., 2004)。扣除体质量的效应,布氏田鼠Lasiopodomys brandtii的BMR和心脏、肝脏、肾脏以及盲肠干重显著正相关(Song & Wang,2006)。在22种鸟类中,心脏和肾脏的组合相对质量也解释了其BMR 50%的变化(Daan et al., 1990)。然而,该假说很少在外温脊椎动物研究中进行验证,已有的少数研究结论也不一致(Biro & Stamps,2010)。
与器官形态特征不同,生理特征具有较强的可塑性。一般认为RMR的可重复性为0.3~0.4。因此,单次测定往往会与其真实值有较大偏离(Careau & Garland,2015)。进化生理学家极力主张采用重复测量的研究范式,结合随机回归模型分解生理特征的个体间和个体内方差及其相关性(Roche et al., 2016;Careau,2017)。然而,在过往RMR与器官大小的研究中,还未见该实验设计和统计方法的应用。
中华蟾蜍Bufo gargarizans是东亚地区演化最为成功的两栖类之一,分布在20°~50°N,海拔分布从太平洋岛屿延伸至青藏高原(Zhan & Fu,2011;Lu et al., 2021)。在外温脊椎动物中具有较强的代表性。本研究拟从野外采集中华蟾蜍成年个体,重复测定RMR 3次,利用马尔可夫-蒙泰卡罗双变量混合线性模型(MCMCglmm)(Hadfield,2010),探究RMR和高耗能器官相对质量的个体间相关性。预测扣除体质量影响后,中华蟾蜍的RMR和小肠、肝脏、肾脏和心脏正相关,支持“摄食增量假说”。
1 研究方法 1.1 实验动物成年中华蟾蜍为在繁殖季节采自川西山区多个海拔样点(雄性27只,雌性19只)。动物捕获后运送至中国科学院成都生物研究所动物房饲养。动物房内温度控制在20 ℃±1 ℃,光周期设定为12 h∶ 12 h(08∶ 00—20∶ 00开灯)。动物单笼饲养在长35.5 cm×宽25 cm×高15 cm的塑料盒内,盒内放置1块湿润的海绵提供水分,以及1块U形瓦片用于躲藏。饲喂蟾蜍的主要食物是沾有钙粉(Exo Terra)的黄粉虫Tenebrio molitor,每2 d喂食1次。此外,每周给蟾蜍饲喂蟋蟀1次(2~3只)。所有蟾蜍均在实验室驯化3个月以上。所有动物操作均按照中国科学院成都生物研究所动物福利委员会的要求执行。
1.2 呼吸代谢测定RMR采用开放式呼吸代谢仪(TSE Systems,德国)在21 ℃环境下测定(Tan et al., 2021)。代谢测定前后均测量动物体质量(精确到0.1 g)。实验测定前,动物被转移到900 mL的亚力克材质的圆柱形呼吸室中适应2 h。呼吸室内均放置10 cm×10 cm湿纸巾以防止动物在测定过程中脱水。代谢测定时,首先利用气体流速控制器(G246)将压缩空气的气体流速控制在200 mL·min-1。然后,气流开关(G244)将穿过呼吸室的气流与高氯酸锰的干燥柱连接(去除其中的水汽),再将干燥过的气流导入O2和CO2分析装置中(S104氧气分析仪和QS151氧气分析仪)。因为中华蟾蜍为夜行性动物,选择在20∶ 30—06∶ 30测定RMR。代谢仪每批测定5只动物,每次耗时5 h。所有个体测定重复3次,每次测定个体的顺序保持一致。实验数据使用TSE Systems配备的专用软件进行采集。RMR以测定期内5 min内连续、最低耗氧速率的平均值计算。同时计算呼吸熵(CO2生成和O2消耗的比例)用于推断其有氧代谢的底物利用状态(Withers,2001)。
1.3 器官形态测定代谢测定结束后,采用MS222(0.2%M/V)深度麻醉中华蟾蜍(镊子夹挤后腿肌肉无条件反射)。随即分离各内脏器官(心脏、肝脏、脾脏、肺脏、肾脏、性腺)和胴体,并将各器官间的结缔组织剥离干净。消化道用清水清理内容物后,分割成大肠、小肠和胃。各器官用滤纸吸干水分后,用铝箔纸包裹放置于干燥箱中,在65 ℃下干燥直至质量不再变化。
1.4 统计分析数据采用SPSS 21.0和R 4.0.3进行分析。胴体干重和RMR均采用对数转换使其符合正态分布(Shapiro-Wilk检验)。采用一般线性模型分析性别和总干重(待分析的目标器官没有被包括在总干重中)对各器官干重的影响,其中固定效应包括性别、总干重、性别和总干重的交互作用。单变量混合线性模型用于分析重复测定的SMR和呼吸熵,固定效应设置为性别、总干重、性别和总干重的交互作用,个体标签设定为随机效应。随机效应的显著性基于最大似然法进行检验。
采用MCMCglmm双变量混合线性模型探究RMR和各器官质量的相关性。反应变量和解释变量在分析前都进行x=0、SD=1的数据转换以去除截距差异对随机效应的影响。对于每一个协变量分析,性别和代谢测定次数设置成固定效应,总干重和去除目标器官的总干重分别设定为RMR和目标器官的协变量。个体标签设定为随机效应。模型的残差和随机效应的先验设定为:V=diag(2),nu=0.002;V=diag(2)×0.002,nu=1.002,alpha. mu=rep[0.2],alpha. V=diag[252,2,2]。为计算后验分布,模型共运行500 000次迭代,每100次迭代重复抽样一次,舍弃前50 000次重复。由于器官质量缺乏重复测定,因而只有随机方差而无残差。然而,方差成分必须为正值,因此将该变量的残差指定为一个极小的正值(0.000 1)。
2 实验结果 2.1 中华蟾蜍各器官相对干重的性别差异中华蟾蜍雌雄个体存在二型性,雌性各器官的绝对干重均大于雄性(图 1:A)。除去体质量影响后,雌性的脾脏、肾脏干重显著大于雄性(P<0.05),雄性的心脏、肺脏干重显著大于雌性(P<0.05),而肝脏、胃、小肠、大肠、消化道和胴体的性别间差异不显著(P>0.05;图 1:B;表 1)。
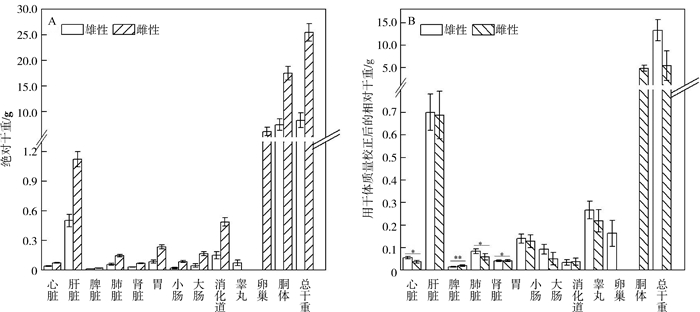
|
| 图 1 中华蟾蜍各器官绝对干重(A)和用干体质量校正后的相对干重(B) Fig. 1 The absolute- (A) and relative- (B) organ mass corrected with dry body mass of Bufo gargarizans |
| |
| F | df1, df2 | P | F | df1, df2 | P | F | df1, df2 | P | |||
| 心脏 | 肾脏 | 消化道 | |||||||||
| 截距 | 15.722 | 1, 42 | <0.001 | 截距 | 19.869 | 1, 42 | <0.001 | 截距 | 23.762 | 1, 42 | <0.001 |
| 性别 | 4.207 | 1, 42 | 0.047 | 性别 | 4.583 | 1, 42 | 0.038 | 性别 | 3.184 | 1, 42 | 0.082 |
| 总干重 | 52.276 | 1, 42 | <0.001 | 总干重 | 89.510 | 1, 42 | <0.001 | 总干重 | 52.577 | 1, 42 | <0.001 |
| 性别×总干重 | 2.410 | 1, 42 | 0.128 | 性别×总干重 | 5.315 | 1, 42 | 0.026 | 性别×总干重 | 2.842 | 1, 42 | 0.099 |
| 肝脏 | 胃 | 胴体 | |||||||||
| 截距 | 6.630 | 1, 42 | 0.014 | 截距 | 10.710 | 1, 42 | 0.002 | 截距 | 2.683 | 1, 42 | 0.109 |
| 性别 | 1.285 | 1, 42 | 0.263 | 性别 | 0.802 | 1, 42 | 0.376 | 性别 | 3.919 | 1, 42 | 0.054 |
| 总干重 | 31.947 | 1, 42 | <0.001 | 总干重 | 30.672 | 1, 42 | <0.001 | 总干重 | 21.315 | 1, 42 | <0.001 |
| 性别×总干重 | 1.391 | 1, 42 | 0.245 | 性别×总干重 | 0.740 | 1, 42 | 0.394 | 性别×总干重 | 0.739 | 1, 42 | 0.395 |
| 脾脏 | 大肠 | ||||||||||
| 截距 | 2.916 | 1, 42 | 0.095 | 截距 | 5.411 | 1, 42 | 0.025 | ||||
| 性别 | 9.209 | 1, 42 | 0.004 | 性别 | 1.422 | 1, 42 | 0.240 | ||||
| 总干重 | 1.162 | 1, 42 | 0.287 | 总干重 | 11.450 | 1, 42 | 0.002 | ||||
| 性别×总干重 | 7.718 | 1, 42 | 0.008 | 性别×总干重 | 1.710 | 1, 42 | 0.198 | ||||
| 肺脏 | 小肠 | ||||||||||
| 截距 | 21.729 | 1, 42 | <0.001 | 截距 | 19.019 | 1, 42 | <0.001 | ||||
| 性别 | 7.310 | 1, 42 | 0.010 | 性别 | 2.972 | 1, 42 | 0.092 | ||||
| 总干重 | 48.973 | 1, 42 | <0.001 | 总干重 | 33.211 | 1, 42 | <0.001 | ||||
| 性别×总干重 | 6.297 | 1, 42 | 0.016 | 性别×总干重 | 2.225 | 1, 42 | 0.143 |
总干重显著影响RMR(P<0.001),但对性别和重复测定的时序没有影响(P>0.05;表 2;图 2)。呼吸熵也不受性别和重复测定的时序影响(P>0.05;表 2)。RMR和呼吸熵的重复性分别为0.321和0.201。
| 静止代谢率/(uL O2·h-1) | 呼吸熵 | |||||
| 固定效应 | F | df1, df2 | P | F | df1, df2 | P |
| 截距 | 93.632 | 1, 42 | <0.001 | 4 806.254 | 1, 44 | <0.001 |
| 性别 | 0.127 | 1, 42 | 0.723 | 0.185 | 1, 44 | 0.716 |
| 重复次数 | 0.909 | 2, 90 | 0.407 | 1.439 | 2, 90 | 0.716 |
| 总干重 | 16.454 | 1, 42 | <0.001 | |||
| 性别×总干重 | 0.200 | 1, 42 | 0.657 | |||
| 随机效应 | Wald Z | 估计值±标准误 | P | Wald Z | 估计值±标准误 | P |
| 个体间方差 | 3.167 | 0.044 6±0.014 1 | 0.002 | 1.799 | 0.003±0.002 | 0.072 |
| 个体内方差 | 6.708 | 0.055 9± 0.008 3 | <0.001 | 6.708 | 0.014 1±0.020 | <0.001 |
| 重复性 | 0.321 | 0.201 | ||||
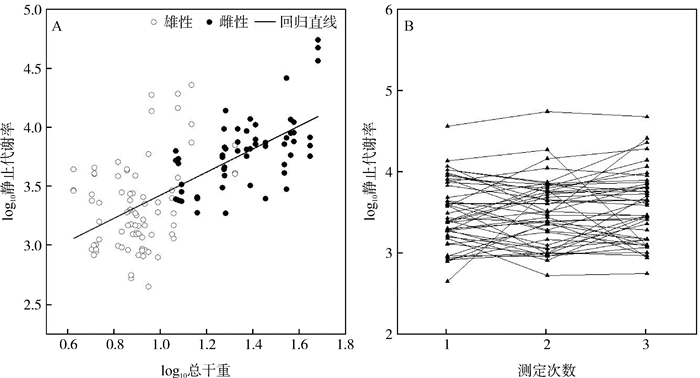
|
| 图 2 中华蟾蜍静止代谢率与总干重的关系(A)及重复测定(B) Fig. 2 The correlation between resting metabolic rate and total dry mass (A) and its repeated measures (B) in Bufo gargarizans |
| |
MCMCglmm分析结果显示,在个体水平上,总干重校正的RMR和器官大小都无显著相关性(P>0.05;表 3;图 3)。
| 特征 | 后验平均值 | l-95%CI | l-95%CI | pMCMC | 特征 | 后验平均值 | l-95%CI | l-95%CI | pMCMC |
| RMR vs. 心脏 | RMR vs. 肝脏 | ||||||||
| 固定效应 | 固定效应 | ||||||||
| RMR | 0.059 | -0.351 | 0.465 | 0.781 | RMR | 0.061 | -0.338 | 0.492 | 0.769 |
| 心脏干重 | -0.371 | -1.001 | 0.359 | 0.287 | 肝脏干重 | 0.005 | -0.630 | 0.671 | 0.996 |
| 测定次数 | 0.072 | -0.130 | 0.278 | 0.479 | 测定次数 | 0.075 | -0.126 | 0.277 | 0.473 |
| RMR∶性别(雄性) | -0.107 | -0.781 | 0.472 | 0.744 | RMR∶性别(雄性) | -0.102 | -0.719 | 0.550 | 0.742 |
| 心脏∶性别(雄性) | 0.630 | -0.402 | 1.637 | 0.232 | 肝脏∶性别(雄性) | -0.012 | -1.080 | 0.941 | 0.991 |
| RMR∶总干重 | 2.190 | 1.1801 | 3.359 | <0.001 | RMR∶总干重 | 2.190 | 1.099 | 3.245 | <0.001 |
| 心脏干重∶总干重 | 3.687 | 1.887 | 5.446 | <0.001 | 肝脏干重∶总干重 | 2.806 | 0.992 | 4.416 | <0.001 |
| 随机效应 | 随机效应 | ||||||||
| RMR | 0.058 | <0.001 | 0.192 | RMR | 0.059 | <0.001 | 0.188 | ||
| RMR∶心脏干重 | -0.002 | -0.006 | 0.045 | RMR∶肝脏干重 | 0.003 | -0.004 | 0.056 | ||
| 心脏干重 | 0.037 | <0.001 | 0.147 | 肝脏干重 | 0.036 | <0.001 | 0.142 | ||
| RMR vs. 脾脏 | RMR vs. 肺脏 | ||||||||
| 固定效应 | 固定效应 | ||||||||
| RMR | 0.060 | -0.338 | 0.489 | 0.776 | RMR | 0.058 | -0.334 | 0.480 | 0.799 |
| 脾脏干重 | 0.350 | -0.365 | 1.023 | 0.313 | 肺脏干重 | -0.172 | -0.841 | 0.495 | 0.617 |
| 测定次数 | 0.071 | -0.132 | 0.280 | 0.505 | 测定次数 | 0.076 | -0.119 | 0.272 | 0.463 |
| RMR∶性别(雄性) | -0.101 | -0.746 | 0.545 | 0.751 | RMR∶性别(雄性) | -0.099 | -0.731 | 0.547 | 0.756 |
| 脾脏∶性别(雄性) | -0.597 | -1.578 | 0.563 | 0.276 | 肺脏∶性别(雄性) | 0.295 | -0.683 | 1.319 | 0.572 |
| RMR∶总干重 | 2.185 | 1.182 | 3.359 | <0.001 | RMR∶总干重 | 2.191 | 1.171 | 3.338 | <0.001 |
| 脾脏干重∶总干重 | 0.666 | -1.254 | 2.463 | 0.461 | 肺脏干重∶总干重 | 3.298 | 1.545 | 5.119 | <0.001 |
| 随机效应 | 随机效应 | ||||||||
| RMR | 0.058 | <0.001 | 0.187 | RMR | 0.057 | <0.001 | 0.186 | ||
| RMR∶脾脏干重 | -0.011 | -0.009 | 0.058 | RMR∶肺脏干重 | <0.001 | -0.005 | 0.046 | ||
| 脾脏干重 | 0.089 | <0.001 | 0.339 | 肺脏干重 | 0.035 | <0.001 | 0.136 | ||
| RMR vs. 肾脏 | RMR vs. 胃 | ||||||||
| 固定效应 | 固定效应 | ||||||||
| RMR | 0.058 | -0.343 | 0.489 | 0.778 | RMR | 0.049 | -0.368 | 0.475 | 0.812 |
| 肾脏干重 | 0.047 | -0.613 | 0.693 | 0.895 | 胃干重 | -0.038 | -0.678 | 0.613 | 0.908 |
| 测定次数 | 0.071 | -0.127 | 0.276 | 0.507 | 测定次数 | 0.074 | -0.121 | 0.284 | 0.484 |
| RMR∶性别(雄性) | -0.098 | -0.716 | 0.541 | 0.757 | RMR∶性别(雄性) | -0.086 | -0.722 | 0.575 | 0.792 |
| 肾脏∶性别(雄性) | -0.086 | -1.095 | 0.940 | 0.866 | 胃∶性别(雄性) | 0.066 | -0.979 | 1.030 | 0.911 |
| RMR∶总干重 | 2.196 | 1.100 | 3.281 | <0.001 | RMR∶总干重 | 2.211 | 1.123 | 3.318 | <0.001 |
| 肾脏干重∶总干重 | 3.072 | 1.385 | 4.878 | <0.001 | 胃干重∶总干重 | 2.926 | 1.119 | 4.656 | 0.001 |
| 随机效应 | 随机效应 | ||||||||
| RMR | 0.059 | <0.001 | 0.186 | RMR | 0.056 | <0.001 | 0.179 | ||
| RMR∶肾脏干重 | 0.002 | -0.004 | 0.052 | RMR∶胃干重 | 0.002 | -0.005 | 0.059 | ||
| 肾脏干重 | 0.030 | <0.001 | 0.113 | 胃干重 | 0.038 | <0.001 | 0.149 | ||
| RMR vs. 大肠 | RMR vs. 小肠 | ||||||||
| 固定效应 | 固定效应 | ||||||||
| RMR | 0.058 | -0.384 | 0.468 | 0.790 | RMR | 0.062 | -0.344 | 0.483 | 0.780 |
| 大肠干重 | 0.067 | -0.611 | 0.736 | 0.853 | 小肠干重 | -0.215 | -0.894 | 0.475 | 0.523 |
| 测定次数 | 0.074 | -0.132 | 0.274 | 0.481 | 测定次数 | 0.073 | -0.139 | 0.271 | 0.498 |
| RMR∶性别(雄性) | -0.098 | -0.736 | 0.522 | 0.743 | RMR∶性别(雄性) | -0.108 | -0.758 | 0.511 | 0.764 |
| 大肠∶性别(雄性) | -0.111 | -1.158 | 0.921 | 0.834 | 小肠∶性别(雄性) | 0.367 | -0.635 | 1.430 | 0.475 |
| RMR∶总干重 | 2.192 | 1.056 | 3.262 | <0.001 | RMR∶总干重 | 2.168 | 1.091 | 3.232 | <0.001 |
| 大肠干重∶总干重 | 2.241 | 0.435 | 3.978 | 0.012 | 小肠干重∶总干重 | 3.242 | 1.553 | 5.106 | <0.001 |
| 随机效应 | 随机效应 | ||||||||
| RMR | 0.057 | <0.001 | 0.187 | RMR | 0.059 | <0.001 | 0.188 | ||
| RMR∶大肠干重 | 0.004 | -0.005 | 0.061 | RMR∶小肠干重 | 0.004 | -0.005 | 0.058 | ||
| 大肠干重 | 0.049 | <0.001 | 0.193 | 小肠干重 | 0.041 | <0.001 | 0.161 | ||
| RMR vs. 卵巢 | RMR vs. 睾丸 | ||||||||
| 固定效应 | 固定效应 | ||||||||
| RMR | 0.002 | -0.283 | 0.321 | 0.988 | RMR | -0.002 | -0.304 | 0.300 | 0.999 |
| 卵巢干重 | 0.002 | -0.489 | 0.497 | 0.997 | 睾丸干重 | 0.004 | -0.382 | 0.409 | 0.991 |
| 测定次数 | 0.186 | -0.141 | 0.507 | 0.262 | 测定次数 | 0.034 | -0.235 | 0.287 | 0.783 |
| RMR∶总干重 | 3.240 | 1.728 | 4.875 | <0.001 | RMR∶总干重 | 2.207 | 0.159 | 4.281 | 0.035 |
| 卵巢干重∶总干重 | 1.832 | -0.444 | 4.222 | 0.127 | 睾丸干重∶总干重 | 4.237 | 1.728 | 7.162 | 0.003 |
| 随机效应 | 随机效应 | ||||||||
| RMR | 0.108 | <0.001 | 0.390 | RMR | 0.331 | <0.001 | 0.748 | ||
| RMR∶卵巢干重 | 0.012 | -0.004 | 0.195 | RMR∶睾丸干重 | 0.023 | -0.016 | 0.216 | ||
| 卵巢干重 | 0.240 | <0.001 | 0.890 | 睾丸干重 | 0.100 | <0.001 | 0.376 | ||
| RMR vs. 消化道 | RMR vs. 胴体 | ||||||||
| 固定效应 | 固定效应 | ||||||||
| RMR | 0.056 | -0.345 | 0.461 | 0.796 | RMR | 0.057 | -0.349 | 0.472 | 0.770 |
| 消化道干重 | -0.091 | -0.705 | 0.623 | 0.797 | 胴体干重 | -0.561 | -1.610 | 0.379 | 0.290 |
| 测定次数 | 0.007 | -0.119 | 0.285 | 0.496 | 测定次数 | 0.076 | -0.134 | 0.275 | 0.455 |
| RMR∶性别(雄性) | -0.095 | -0.774 | 0.507 | 0.763 | RMR∶性别(雄性) | -0.098 | -0.712 | 0.542 | 0.752 |
| 消化道∶性别(雄性) | 0.154 | -0.834 | 1.205 | 0.782 | 胴体∶性别(雄性) | 0.956 | -0.578 | 2.695 | 0.265 |
| RMR∶总干重 | 2.198 | 1.163 | 3.310 | <0.001 | RMR∶总干重 | 2.183 | 1.073 | 3.256 | <0.001 |
| 消化道干重∶总干重 | 3.225 | 1.412 | 4.850 | <0.001 | 胴体干重∶总干重 | 2.355 | 0.836 | 4.025 | 0.004 |
| 随机效应 | 随机效应 | ||||||||
| RMR | 0.058 | <0.001 | 0.187 | RMR | 0.057 | <0.001 | 0.182 | ||
| RMR∶消化道干重 | 0.003 | -0.004 | 0.058 | RMR∶胴体干重 | 0.001 | -0.005 | 0.049 | ||
| 消化道干重 | 0.033 | <0.001 | 0.129 | 胴体干重 | 0.040 | <0.001 | 0.161 |
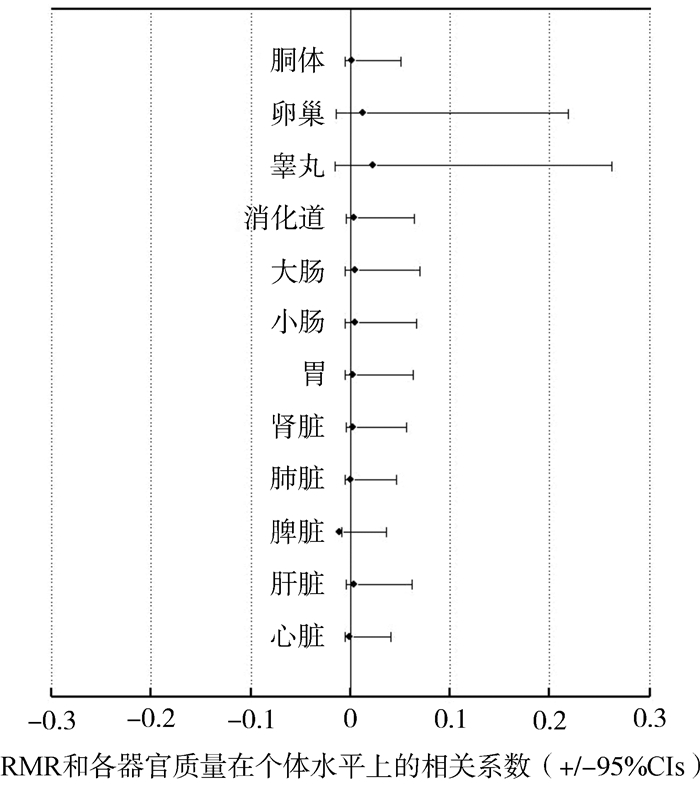
|
| 图 3 中华蟾蜍静止代谢率残差与各器官质量残差的相关性 Fig. 3 Associations between residual of resting metabolic rate and residuals of organ mass in Bufo gargarizans |
| |
中华蟾蜍的高耗能器官质量与RMR不存在相关性:1)在该物种中,RMR和持续能量支出间可能不存在相关选择或其选择压力较小。无论外温动物还是内温动物,种间比较都支持持续能量支出和RMR显著正相关(Taigen,1983;Bozinovic,1992;Merritt et al., 2013)。然而,种内分析二者相关性往往出现不一致的结果。例如,在个体水平上,根田鼠Microtus oeconomus和高原鼠兔Ochotona curzoniae夏季的BMR与最大代谢率并不相关,而冬季根田鼠BMR与最大代谢率显著相关(r=0.612)(王玉山等,2002);花园石龙子Lampropholis delicate的RMR和最大代谢率不相关(Merritt et al., 2013);在福勒蟾蜍Bufo woodhoursei fowleri中二者虽然相关,但相关系数仅为0.37(Walton,1988)。因而,何种生态、进化及生活史因素可以影响RMR和持续能量支出的关联性值得进一步研究。2)在该物种中,持续能量支出的个体差异不是由高耗能器官的质量大小变异来贡献的。在美洲豹蛙Rana pipiens中,仅见RMR和肾脏干重残差显著正相关,而与心脏、肝脏、小肠和腓肠肌干重不相关(Steyermark et al., 2005)。然而,该相关性受单一数据奇值点影响。这说明,即便是用肾脏来解释RMR的个体间变异,也存在较大的不确定性。在安第斯蟾蜍Bufo spinulosus中发现,具有更高RMR的个体拥有更大的小肠、肝脏、肾脏和心脏(Naya et al., 2009),但该研究将冬眠组、短期禁食组和对照组样本合并进行了关联分析。而冬眠、短期禁食处理可能消耗高耗能器官中的脂肪等低代谢身体成分,潜在地增加了数据的极化程度,进而导致器官质量与RMR相关。因此,利用高耗能器官的大小来阐释持续能量支出的个体差异在两栖类中可能并不具有普遍性。将来的研究有必要聚焦于高耗能器官的生理生化特征(如柠檬酸循环或电子呼吸传递链过程中的限速酶),来阐释高耗能器官与RMR的关联性(Bozinovic,1992;Trzcionka et al., 2008;Koch et al., 2021)。
本研究结果也证实,在开展整体生理学特征相关性研究时,进行重复测量设计的必要性。中华蟾蜍的RMR重复性仅为0.321,许多个体在3次测定过程中的RMR出现大幅度波动。如果仅依据单次测定结果进行相关分析,必然会偏离其真实值。实际上,利用单(多)变量随机回归模型分析重复测量的数据集可以解析何种因子限制特征稳定性、可塑性、进化权衡等一系列有趣的进化和生态问题,且日益受到学界关注和重视(Dingemanse & Dochtermann,2013;Sih et al., 2015;Videlier et al., 2019)。因此建议国内动物生理生态学者们在采用非入侵性生理学指标测定时充分利用这一设计理念。
本研究采用的动物来自不同海拔位点,而不同海拔的持续能量支出、RMR和体质量的尺度关系可能存在差异,从而影响器官大小与RMR的关系。然而,前期研究发现不同海拔中华蟾蜍的RMR没有差异,而且其与体质量的尺度关系也不随海拔变化(Tan et al., 2021)。而且,这些动物经过较长时间的室内驯化,很大程度上抵消了采用前即时环境的影响。因此,理论上来说,多个海拔位点取样不会对本研究结果产生显著影响。
本研究发现,中华蟾蜍的高耗能器官大小与其RMR不相关,提示该物种的持续能量支出与其高耗能器官质量不相关,或者持续能量支出与RMR不相关,因而不支持“摄食增量假说”。该研究为扩展外温动物持续能量支出理论奠定了实验基础。
孙儒泳, 王德华, 牛翠娟, 等. 2019. 动物生态学原理[M]. 北京: 北京师范大学出版社.
|
王玉山, 王祖望, 王德华, 等. 2002. 哺乳动物的最大代谢率[J]. 兽类学报, 22(3): 305-317. |
Arnold PA, Delean S, Cassey P, et al. 2021. Meta-analysis reveals that resting metabolic rate is not consistently related to fitness and performance in animals[J/OL]. Journal of Comparative Physiology B, 191: 1097-1110.
|
Auer SK, Salin K, Rudolf AM, et al. 2015. The optimal combination of standard metabolic rate and aerobic scope for somatic growth depends on food availability[J]. Functional Ecology, 29(4): 479-486. DOI:10.1111/1365-2435.12396 |
Biro PA, Stamps JA. 2008. Are animal personality traits linked to life-history productivity?[J]. Trends in Ecology & Evolution, 23(7): 361-368. |
Biro PA, Stamps JA. 2010. Do consistent individual differences in metabolic rate promote consistent individual differences in behavior?[J]. Trends in Ecology & Evolution, 25(11): 653-659. |
Bozinovic F. 1992. Scaling of basal and maximum metabolic rate in rodents and the aerobic capacity model for the evolution of endothermy[J]. Physiological Zoology, 65(5): 921-932. DOI:10.1086/physzool.65.5.30158550 |
Careau V, Garland T. 2015. Energetics and behavior: many paths to understanding[J]. Trends in Ecology & Evolution, 30(7): 365-366. |
Careau V, Thomas D, Humphries MM, et al. 2008. Energy metabolism and animal personality[J]. Oikos, 117(5): 641-653. DOI:10.1111/j.0030-1299.2008.16513.x |
Careau V. 2017. Energy intake, basal metabolic rate, and within-individual trade-offs in men and women training for a half marathon: a reanalysis[J]. Physiological and Biochemical Zoology, 90(3): 392-398. DOI:10.1086/691338 |
Daan S, Masman D, Groenewold A. 1990. Avian basal metabolic rates: their association with body composition and energy expenditure in nature[J]. The American Journal of Physiology, 259(2Pt2): 333-340. |
Dingemanse NJ, Dochtermann NA. 2013. Quantifying individual variation in behaviour: mixed-effect modelling approaches[J]. Journal of Animal Ecology, 82(1): 39-54. DOI:10.1111/1365-2656.12013 |
Hadfield JD. 2010. MCMC methods for multi-response generalized linear mixed models: the MCMCglmm R Package[J]. Journal of Statistical Software, 33(2): 1-22. |
Hammond KA, Diamond J. 1997. Maximal sustained energy budgets in humans and animals[J]. Nature, 386(6624): 457-462. DOI:10.1038/386457a0 |
Koch RE, Buchanan KL, Casagrande S, et al. 2021. Integrating mitochondrial aerobic metabolism into ecology and evolution[J]. Trends in Ecology & Evolution, 36(4): 321-332. |
Konarzewski M, Diamond J. 1995. Evolution of basal metabolic rate and organ masses in laboratory mice[J]. Evolution, 49(6): 1239-1248. DOI:10.1111/j.1558-5646.1995.tb04450.x |
Koteja P. 2000. Energy assimilation, parental care and the evolution of endothermy[J]. Proceedings of the Royal Society B: Biological Sciences, 267(1442): 479-484. DOI:10.1098/rspb.2000.1025 |
Ksiazek A, Czerniecki J, Konarzewski M. 2009. Phenotypic flexibility of traits related to energy acquisition in mice divergently selected for basal metabolic rate (BMR)[J]. The Journal of Experimental Biology, 212(Pt6): 808-814. |
Ksiazek A, Konarzewski M, Lapo IB. 2004. Anatomic and energetic correlates of divergent selection for basal metabolic rate in laboratory mice[J]. Physiological and Biochemical Zoology, 77(6): 890-899. DOI:10.1086/425190 |
Lu B, Jiang JP, Wu H, et al. 2021. A large genome with chromosome-scale assembly sheds light on the evolutionary success of a true toad (Bufo gargarizans)[J]. Molecular Ecology Resources, 21(4): 1256-1273. DOI:10.1111/1755-0998.13319 |
Merritt L, Matthews PGD, White CR. 2013. Performance correlates of resting metabolic rate in garden skinks Lampropholis delicata[J]. Journal of Comparative Physiology B, 183(5): 663-673. DOI:10.1007/s00360-012-0736-x |
Naya DE, Veloso C, Sabat P, et al. 2009. The effect of short- and long-term fasting on digestive and metabolic flexibility in the Andean toad, Bufo spinulosus[J]. The Journal of Experimental Biology, 212(Pt14): 2167-2175. |
Pettersen AK, White CR, Marshall DJ. 2016. Metabolic rate covaries with fitness and the pace of the life history in the field[J/OL]. Proceedings of the Royal Society B: Biological Sciences, 283(1831): 20160323 [2021-06-10]. https://doi.org/10.1098/rspb.2016.0323.
|
Roche DG, Careau V, Binning SA. 2016. Demystifying animal "personality" (or not): why individual variation matters to experimental biologists[J]. The Journal of Experimental Biology, 219(Pt24): 3832-3843. |
Selman C, Lumsden S, Bunger L, et al. 2001. Resting metabolic rate and morphology in mice (Mus musculus) selected for high and low food intake[J]. The Journal of Experimental Biology, 204(Pt4): 777-784. |
Sih A, Mathot KJ, Moiron M, et al. 2015. Animal personality and state-behaviour feedbacks: a review and guide for empiricists[J]. Trends in Ecology & Evolution, 30(1): 50-60. |
Song ZG, Wang DH. 2006. Basal metabolic rate and organ size in Brandt's voles (Lasiopodomys brandtii): effects of photoperiod, temperature and diet quality[J]. Physiology & Behavior, 89(5): 704-710. |
Steyermark AC, Miamen AG, Feghahati HS, et al. 2005. Physiological and morphological correlates of among-individual variation in standard metabolic rate in the leopard frog Rana pipiens[J]. The Journal of Experimental Biology, 208(Pt6): 1201-1208. |
Taigen TL. 1983. Activity metabolism of anuran amphibians-implications for the origin of endothermy[J]. The American Naturalist, 121(1): 94-109. DOI:10.1086/284041 |
Tan S, Li P, Yao ZY, et al. 2021. Metabolic cold adaptation in the Asiatic toad: intraspecific comparison along an altitudinal gradient[J]. Journal of Comparative Physiology B, 191(4): 765-776. DOI:10.1007/s00360-021-01381-x |
Trzcionka M, Withers KW, Klingenspor M, et al. 2008. The effects of fasting and cold exposure on metabolic rate and mitochondrial proton leak in liver and skeletal muscle of an amphibian, the cane toad Bufo marinus[J]. The Journal of Experimental Biology, 211(12): 1911-1918. DOI:10.1242/jeb.016519 |
Videlier M, Rundle HD, Careau V. 2019. Sex-specific among individual covariation in locomotor activity and resting metabolic rate in Drosophila melanogaster[J]. The American Naturalist, 194(6): 164-176. DOI:10.1086/705678 |
Walton M. 1988. Relationships among metabolic, locomotory, and field measures of organismal performance in the Fowlers toad (Bufo woodhousei fowleri)[J]. Physiological Zoology, 61(2): 107-118. DOI:10.1086/physzool.61.2.30156141 |
Withers PC. 2001. Design, calibration and calculation for flow-through respirometry systems[J]. Australian Journal of Zoology, 49(4): 445-461. DOI:10.1071/ZO00057 |
Zhan AB, Fu JZ. 2011. Past and present: phylogeography of the Bufo gargarizans species complex inferred from multi-loci allele sequence and frequency data[J]. Molecular Phylogenetics and Evolution, 61(1): 136-148. DOI:10.1016/j.ympev.2011.06.009 |
 2022, Vol. 41
2022, Vol. 41




