扩展功能
文章信息
- 鸟鹏颖, 时磊
- NIAO Pengying, SHI Lei
- 新疆敏麻蜥3个地理种群趾长及趾长比的两性异形
- Sexual Dimorphism in the Digit Length and Digit Ratios Among Three Geographical Populations of Eremias arguta from Xinjiang
- 四川动物, 2022, 41(1): 42-51
- Sichuan Journal of Zoology, 2022, 41(1): 42-51
- 10.11984/j.issn.1000-7083.20210202
-
文章历史
- 收稿日期: 2021-06-09
- 接受日期: 2021-09-26
两性异形(sexual dimorphism,SD)是指动物两性间在体型大小、形态、色型、生活习性和行为等方面产生差异的现象(Darwin,1871),大致分为广义的两性异形和狭义的两性异形。广义两性异形指两性个体之间的形态大小、色型以及行为差异(Fairbairn & Roff,2006; 史红全等,2021); 狭义两性异形指两性间体型大小(sexual size dimorphism,SSD)差异(Darwin,1871)。关于局部特征的两性异形,性选择假说预测雄性头部较大,在性内斗争中可以获得优势(王欣琪等,2020); 雄性尾基较宽,利于容纳半阴茎,而较长尾部有利于提高对雌性求偶的成功率(梁涛等,2015); 较长的前、后肢有利于提高运动及获取资源的能力(万丽霞等,2018)。繁殖力选择假说则预测雌性有较大的腋跨距(梁涛等,2018),可以增大繁殖输出(姚冲学等,2019)。而关于趾长两性异形的研究不多(Woodhead et al., 2018),此外,鉴于趾长的发育与类固醇激素有关,不同个体生理机能会影响激素的调节从而间接影响趾的生长,因此,趾长的两性异形不仅在同属的不同物种或近缘种中不稳定,且在同一物种中,趾长的两性异形模式可能在前肢和后肢的趾中独立进化(Lofeu et al., 2020)。鸟鹏颖等:新疆敏麻蜥3个地理种群趾长及趾长比的两性异形
趾长比是动物趾长度的比值,第2趾长和第4趾长的比值(2D: 4D)最常使用(Breedlove,2010; 席焕久等,2012),具有较明显的性别、种群以及地理差异。在发育过程中,趾长比会受雌激素或雄激素信号的平衡控制,且胚胎期的性激素水平间的比率可能会导致个体形态、行为特征以及性别之间的差异(Zheng & Cohn,2011)。因此,趾长比被认为是行为和适合度相关的指标(Voracek & Loibl,2009)。在蜥蜴中,2D: 4D的两性异形因物种而异(Gomes & Kohlsdorf,2011; Direnzo & Stynoski,2012)。与雌性蜥蜴相比,雄性后肢的2D: 4D较大(Direnzo & Stynoski,2012),如达尔马提亚壁蜥Podarcis melisellensis 2D: 4D的两性异形差异最大,2D: 3D居中,3D: 4D最小,且雄性比雌性表现出更大的2D: 4D值(Van Damme et al., 2015)。而在两栖动物中,雄性后肢的2D: 4D显著大于雌性(Chang et al., 2006),与在哺乳动物中发现的模式一致(McIntyre et al., 2009)。此外,有关不同地理种群趾长及趾长比的研究不多,Kaczmarski等(2021)的研究表明3个地区大蟾蜍Bufo bufo的趾长比之间没有显著差异。
敏麻蜥Eremias arguta隶属蜥蜴科Lacertidae麻蜥属,分布广泛,目前全世界可分为6个亚种(Sczcerbak,1971),我国新疆有2个亚种,指名亚种E. arguta arguta分布在伊犁谷地,东方亚种E. a. potanini分布在准噶尔盆地(赵尔宓等,1999)。Poyarkov等(2014)依据分子生物学认为东方亚种是指名亚种的同物异名; 龚雄等(2018)基于线粒体细胞色素b基因构建系统发育树,认为伊犁河谷的敏麻蜥可能为一个独立的亚种。目前研究涉及敏麻蜥的运动表现(Bergmann et al., 2017)、繁殖生物学(梁涛等,2018)和两性异形(梁涛,时磊,2018)等,但对其趾长及趾长比的两性异形及其地理变异尚无研究报道。
本文对分布在新疆3个地理种群的敏麻蜥趾长及趾长比的两性异形进行研究,拟解决以下问题:敏麻蜥的哪些趾长、趾长比存在两性异形?3个地理种群的敏麻蜥趾长比是否存在显著差异?3个地理种群的敏麻蜥趾长比存在何种关系?
1 材料与方法 1.1 形态数据试验个体为北疆地区采集的成体敏麻蜥,共计121号(伊犁地区:雌18号,雄29号; 富蕴县:雌25号,雄27号; 塔城地区:雌10号,雄12号),因雌性最小繁殖个体的头体长为54.54 mm,以怀卵个体的最小头体长为分界线,>54.54 mm的个体划定为成体。根据触碰并挤压蜥蜴的尾基处,以有半阴茎来判定雄性个体。用数显游标卡尺(±0.01 mm)测量相关形态数据,包含头体长(snout-vent length,SVL:吻端至泄殖孔前缘的间距)(赵尔宓等,1999)、右侧前肢各趾长(fore toe length,FTL:趾基部至末端间距)、右侧后肢各趾长(hind toe length,HTL:趾基部至末端间距)(赵晓进等,2015)。
1.2 数据处理数据分析前分别用Kolmogorov-Smironov和Levene检验分析正态性及方差同质性。用t检验分析3个地理种群敏麻蜥雌雄个体间的头体长差异,以头体长为协变量进行协方差分析(ANCOVA),比较前5趾、后5趾、前肢及后肢的2D: 3D、2D: 4D、3D: 4D等的两性差异。利用一般线性模型方差分析进一步分析各趾长及趾长比与头体长之间的关系,检验是否有显著的线性关系来分析两性间的异速增长,同样分析了不同趾长比与性别、3个地理种群以及性别和地理种群之间的交互作用。
两性异形指数(sexual dimorphism index,SDI)是反映两性间差异程度的指标,SDI=(雌性某性状的均值/雄性某性状的均值-1)×100%。若雌性均值较大,则该指数为正值并认为雌性占优势; 若雄性均值较大,则该指数为负值并认为雄性占优势; 若SDI值为0,则不存在两性异形现象。计算各趾长比的SDI绝对值之和可以体现3个地理种群间的两性异形的差异程度(Lovich & Gibbons,1992)。
上述数据分析均在SPSS 25.0中完成,绘图在GraphPad Prism中完成。描述性统计值用x±SE表示,显著性水平均设置为α=0.05,所有检验均为双尾。
2 结果 2.1 两性异形独立样本t检验结果表明,伊犁地区敏麻蜥雄性的头体长(60.31 mm±0.70 mm)显著大于雌性(57.57 mm±0.53 mm)(t=-2.775,P < 0.05)。以头体长为协变量的协方差分析结果表明,伊犁地区敏麻蜥雄性后肢的第2趾显著大于雌性(P < 0.05),其余趾长及趾长比不存在显著差异(P>0.05)(表 1)。
| 指标 Traits |
雌性Female (n=18) |
雄性Male (n=29) |
T | F | P | ||
| x±SE | 范围Range | x±SE | 范围Range | ||||
| 头体长SVL/mm | 57.57±0.53 | 54.97~62.36 | 60.31±0.70 | 55.18~71.98 | -2.775 | 0.008 | |
| 前1 F1/mm | 2.71±0.09 | 1.98~3.58 | 3.00±0.07 | 2.43~3.95 | 3.002 | 0.090 | |
| 前2 F2/mm | 3.95±0.12 | 3.03~4.88 | 4.02±0.10 | 3.13~5.62 | 1.241 | 0.271 | |
| 前3 F3/mm | 4.91±0.11 | 3.89~5.68 | 4.99±0.12 | 4.04~6.78 | 0.944 | 0.336 | |
| 前4 F4/mm | 5.70±0.14 | 4.34~6.85 | 5.79±0.12 | 4.81~7.48 | 0.523 | 0.473 | |
| 前5 F5/mm | 3.69±0.07 | 3.21~4.19 | 3.81±0.08 | 3.15~4.96 | 0.151 | 0.700 | |
| 后1 H1/mm | 2.83±0.09 | 2.12~3.60 | 2.98±0.08 | 2.10~3.98 | 0.003 | 0.955 | |
| 后2 H2/mm | 3.72±0.09 | 3.16~4.55 | 4.24±0.09 | 3.23~5.42 | 6.600 | 0.014 | |
| 后3 H3/mm | 5.32±0.11 | 4.68~6.17 | 5.88±0.15 | 4.50~7.17 | 3.493 | 0.068 | |
| 后4 H4/mm | 7.52±0.15 | 6.28~9.11 | 8.09±0.16 | 6.71~9.90 | 1.459 | 0.234 | |
| 后5 H5/mm | 4.45±0.06 | 4.10~4.86 | 4.79±0.09 | 3.85~5.70 | 3.076 | 0.086 | |
| 前肢2D: 4D | 0.69±0.02 | 0.58~0.78 | 0.69±0.01 | 0.61~0.77 | 0.419 | 0.521 | |
| 前肢2D: 3D | 0.80±0.01 | 0.71~0.90 | 0.81±0.00 | 0.76~0.86 | 0.144 | 0.706 | |
| 前肢3D: 4D | 0.86±0.01 | 0.77~0.90 | 0.86±0.01 | 0.76~0.93 | 0.401 | 0.530 | |
| 后肢2D: 4D | 0.50±0.01 | 0.40~0.56 | 0.53±0.01 | 0.40~0.65 | 1.557 | 0.219 | |
| 后肢2D: 3D | 0.70±0.01 | 0.62~0.80 | 0.73±0.02 | 0.53~0.88 | 0.046 | 0.832 | |
| 后肢3D: 4D | 0.71±0.01 | 0.64~0.79 | 0.73±0.01 | 0.60~0.86 | 1.976 | 0.167 | |
富蕴县敏麻蜥雄性的头体长(74.90 mm±1.23 mm) 大于雌性(72.18 mm±1.15 mm),但差异不显著(t=-1.605,P>0.05)。以头体长为协变量的协方差分析结果表明,富蕴县敏麻蜥雄性前、后肢的第2、3、4、5趾显著大于雌性(P < 0.05),但雌性后肢的2D: 4D显著大于雄性(P < 0.05),其余趾长及趾长比不存在显著差异(P>0.05)(表 2)。
| 指标 Traits |
雌性Female (n=25) |
雄性Male (n=27) |
T | F | P | ||
| x±SE | 范围Range | x±SE | 范围Range | ||||
| 头体长SVL/mm | 72.18±1.15 | 63.70~81.21 | 74.90±1.23 | 64.90~83.72 | -1.605 | 0.115 | |
| 前1 F1/mm | 3.71±0.08 | 3.11~4.38 | 3.71±0.04 | 3.38~4.10 | 0.423 | 0.519 | |
| 前2 F2/mm | 4.82±0.08 | 4.12~5.39 | 5.29±0.11 | 4.39~6.69 | 8.996 | 0.004 | |
| 前3 F3/mm | 5.83±0.10 | 4.72~6.99 | 6.41±0.12 | 5.22~8.14 | 10.755 | 0.002 | |
| 前4 F4/mm | 6.90±0.12 | 5.69~8.06 | 7.60±0.14 | 6.48~9.33 | 12.084 | 0.001 | |
| 前5 F5/mm | 4.39±0.13 | 3.57~5.96 | 4.94±0.10 | 3.68~5.90 | 9.081 | 0.004 | |
| 后1 H1/mm | 3.82±0.13 | 2.76~5.37 | 4.20±0.14 | 2.89~5.65 | 1.566 | 0.217 | |
| 后2 H2/mm | 5.38±0.16 | 4.06~6.92 | 5.95±0.15 | 4.66~7.38 | 4.646 | 0.036 | |
| 后3 H3/mm | 7.25±0.23 | 5.22~9.97 | 8.36±0.23 | 5.88~10.88 | 9.101 | 0.004 | |
| 后4 H4/mm | 9.78±0.29 | 7.53~12.81 | 11.68±0.31 | 9.08~15.66 | 19.985 | <0.001 | |
| 后5 H5/mm | 5.62±0.17 | 3.69~6.96 | 6.24±0.15 | 4.65~7.61 | 5.730 | 0.021 | |
| 前肢2D: 4D | 0.70±0.01 | 0.58~0.79 | 0.70±0.01 | 0.55~0.80 | 0.039 | 0.845 | |
| 前肢2D: 3D | 0.83±0.01 | 0.71~0.91 | 0.83±0.01 | 0.67~0.92 | 0.015 | 0.903 | |
| 前肢3D: 4D | 0.85±0.01 | 0.72~0.90 | 0.84±0.01 | 0.74~0.93 | 0.180 | 0.673 | |
| 后肢2D: 4D | 0.55±0.01 | 0.48~0.62 | 0.51±0.01 | 0.44~0.60 | 10.259 | 0.002 | |
| 后肢2D: 3D | 0.75±0.01 | 0.65~0.86 | 0.72±0.02 | 0.60~0.89 | 2.691 | 0.107 | |
| 后肢3D: 4D | 0.74±0.01 | 0.63~0.87 | 0.72±0.01 | 0.60~0.86 | 2.345 | 0.132 | |
塔城地区敏麻蜥雄性的头体长(67.01 mm±2.04 mm)大于雌性(62.71 mm±1.99 mm),但差异不显著(t=-1.491,P>0.05)。以头体长为协变量的协方差分析结果表明,塔城地区敏麻蜥雄性前肢的第1、5趾和后肢的第1、2、3、4趾以及后肢的2D: 3D均显著大于雌性(P < 0.05),其余趾长及趾长比不存在显著差异(P>0.05)(表 3)。
| 指标 Traits |
雌性Female (n=10) |
雄性Male (n=12) |
T | F | P | ||
| x±SE | 范围Range | x±SE | 范围Range | ||||
| 头体长SVL/mm | 62.71±1.99 | 54.74~69.36 | 67.01±2.04 | 55.35~76.91 | -1.491 | 0.151 | |
| 前1 F1/mm | 3.14±0.11 | 2.49~3.55 | 3.70±0.11 | 3.34~4.41 | 12.803 | 0.002 | |
| 前2 F2/mm | 4.46±0.19 | 3.56~5.26 | 4.94±0.13 | 4.02~5.62 | 2.065 | 0.167 | |
| 前3 F3/mm | 5.71±0.14 | 5.00~6.49 | 6.09±0.16 | 5.44~7.23 | 1.076 | 0.313 | |
| 前4 F4/mm | 6.59±0.18 | 5.80~7.85 | 6.92±0.20 | 6.09~8.17 | 0.368 | 0.551 | |
| 前5 F5/mm | 3.76±0.10 | 3.26~4.10 | 4.44±0.18 | 3.36~5.37 | 6.702 | 0.018 | |
| 后1 H1/mm | 2.83±0.09 | 2.44~3.23 | 4.03±0.17 | 3.31~4.93 | 36.526 | <0.001 | |
| 后2 H2/mm | 4.29±0.15 | 3.49~5.08 | 5.41±0.18 | 4.31~6.35 | 18.535 | <0.001 | |
| 后3 H3/mm | 6.16±0.14 | 5.27~6.88 | 7.21±0.23 | 5.93~8.34 | 10.331 | 0.005 | |
| 后4 H4/mm | 8.47±0.17 | 7.75~9.45 | 9.81±0.29 | 8.21~11.27 | 11.473 | 0.003 | |
| 后5 H5/mm | 4.84±0.14 | 4.18~5.55 | 5.69±0.25 | 3.75~6.98 | 3.980 | 0.061 | |
| 前肢2D: 4D | 0.68±0.02 | 0.57~0.78 | 0.72±0.02 | 0.58~0.79 | 0.768 | 0.392 | |
| 前肢2D: 3D | 0.78±0.02 | 0.68~0.88 | 0.81±0.02 | 0.66~0.87 | 0.540 | 0.471 | |
| 前肢3D: 4D | 0.87±0.01 | 0.83~0.92 | 0.88±0.01 | 0.84~0.90 | 0.829 | 0.374 | |
| 后肢2D: 4D | 0.51±0.02 | 0.44~0.57 | 0.55±0.01 | 0.49~0.64 | 4.382 | 0.050 | |
| 后肢2D: 3D | 0.70±0.01 | 0.63~0.75 | 0.75±0.01 | 0.72~0.79 | 14.569 | 0.001 | |
| 后肢3D: 4D | 0.73±0.01 | 0.66~0.78 | 0.74±0.02 | 0.64~0.84 | 0.049 | 0.828 | |
雌雄两性间的前肢的2D: 4D在伊犁地区、富蕴县以及塔城地区的3个地理种群间均不存在显著差异(P>0.05),而后肢的2D: 4D在富蕴县存在显著差异,表现为雌性显著大于雄性(P < 0.05),但在伊犁和塔城地区差异不显著(P>0.05)(图 1)。
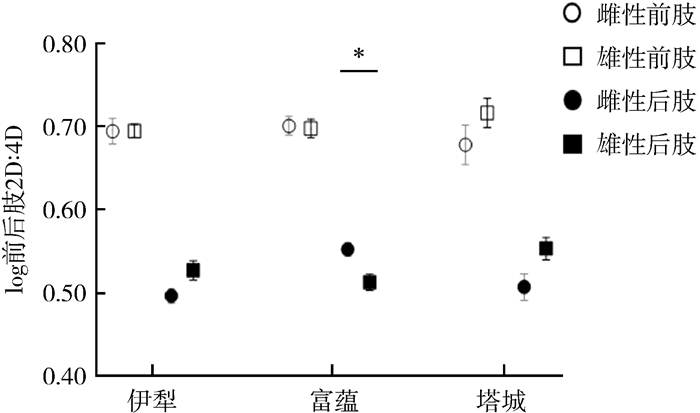
|
| 图 1 敏麻蜥两性间在3个地理种群的前后肢2D: 4D差异 Fig. 1 Differences in the 2D: 4D between the fore and hind limbs among the three geographical populations of Eremias arguta * P < 0.05; 下同 * P < 0.05; the same below |
| |
雌雄两性间的前肢的2D: 3D在伊犁地区、富蕴县以及塔城地区的3个地理种群间都不存在显著差异(P>0.05),而后肢的2D: 3D在塔城地区存在显著差异,表现为雄性显著大于雌性(P < 0.05),但在伊犁地区以及富蕴县差异不显著(P>0.05)(图 2)。

|
| 图 2 敏麻蜥两性间在3个地理种群的前后肢2D: 3D差异 Fig. 2 Differences in the 2D: 3D between the fore and hind limbs among the three geographical populations of Eremias arguta |
| |
伊犁地区敏麻蜥两性间前肢的第1、2趾和前肢的2D: 4D、2D: 3D存在异速增长(P < 0.05)(图 3:A,B,图 4),其余趾长及趾长比不存在显著的异速增长(P>0.05)。富蕴县敏麻蜥两性间的各趾长及趾长比均不存在显著的异速增长(P>0.05)。塔城地区敏麻蜥两性间的各趾长及趾长比除前肢的第1趾存在异速增长(P < 0.05)(图 3:C)外,其余均不存在显著的异速增长(P>0.05)。

|
| 图 3 敏麻蜥两性间在伊犁地区(A、B)和塔城地区(C)地理种群趾长异速增长 Fig. 3 The digit length allometric growth between the two sexes of Eremias arguta in Yili (A, B) and Tacheng Region (C) |
| |
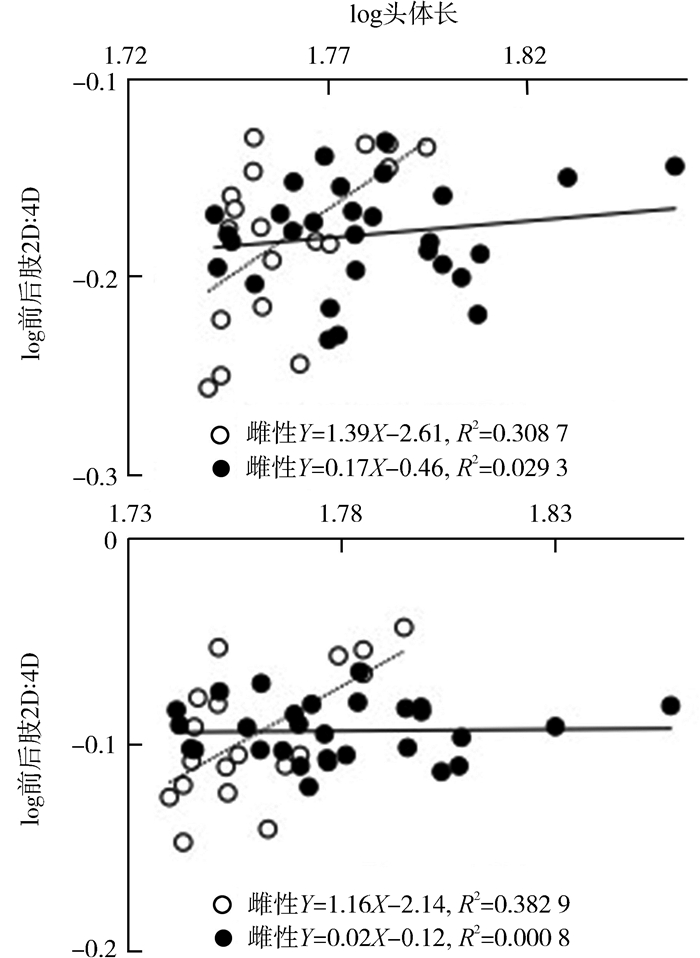
|
| 图 4 敏麻蜥两性间在伊犁地区趾长比异速增长 Fig. 4 The ratio of digit length allometric growth between the two sexes of Eremias arguta in Yili Basin |
| |
交互作用分析结果显示,地理种群对前肢的2D: 3D和3D: 4D存在着显著的影响(P < 0.05),而性别和地理种群交互作用对于2D: 4D和2D: 3D存在显著影响(P < 0.05)(表 4)。
| 前肢Fore limb | 后肢Hind limb | |||
| F | P | F | P | |
| 2D: 4D | ||||
| 性别 | 1.224 | 0.271 | 1.451 | 0.231 |
| 地理种群 | 0.072 | 0.931 | 2.372 | 0.098 |
| 性别*地理种群 | 1.085 | 0.341 | 8.372 | <0.001 |
| 2D: 3D | ||||
| 性别 | 1.233 | 0.269 | 1.404 | 0.239 |
| 地理种群 | 3.241 | 0.043 | 0.789 | 0.457 |
| 性别*地理种群 | 0.894 | 0.412 | 3.523 | 0.033 |
| 3D: 4D | ||||
| 性别 | 0.146 | 0.703 | 0.000 | 0.984 |
| 地理种群 | 4.049 | 0.020 | 0.732 | 0.483 |
| 性别*地理种群 | 0.249 | 0.780 | 1.902 | 0.154 |
趾长SDI的结果显示,除了富蕴县的前肢的第1趾(SDI<0.001)在两性间的差异不显著外,其余3个地理种群的趾长指标均显示负值(图 5)。3个地理种群的趾长SDI绝对值之和的结果表明,塔城地区两性异形程度最大(178%),富蕴县的居中(109%),伊犁地区的最低(66%)。
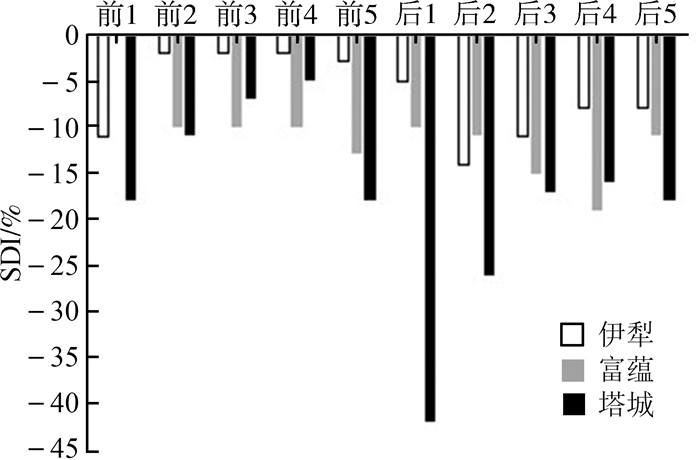
|
| 图 5 敏麻蜥3个地理种群趾长的两性异形指数 Fig. 5 Sexual dimorphism index (SDI) of digit length in three geographical populations of Eremias arguta |
| |
伊犁地区雌雄个体间前肢的3D: 4D (SDI=0.001 3%)为正值,其余均为负值,表明除了前肢的3D: 4D之外,伊犁地区雄性的趾长比均大于雌性。富蕴县个体的所有趾长比均为正值,表明雌性的趾长比大于雄性。塔城地区个体的趾长比均为负值,表明雄性的趾长比大于雌性(表 5)。3个地理种群的趾长比SDI绝对值之和的结果表明,塔城地区雌性间两性异形程度最大(29.66%),富蕴县的居中(15.97%),伊犁地区的最低(13.04%)。
| 种群 Population |
两性异形指数SDI/% | SDI绝对值之和 Sum of absolute SDI/% |
|||||
| 前肢Fore limb | 后肢Hind limb | ||||||
| 2D: 4D | 2D: 3D | 3D: 4D | 2D: 4D | 2D: 3D | 3D: 4D | ||
| 伊犁 | -0.05 | -0.27 | 0.13 | -6.21 | -3.77 | -2.61 | 13.04 |
| 富蕴 | 0.47 | 0.22 | 0.22 | 7.76 | 3.91 | 3.39 | 15.97 |
| 塔城 | -5.65 | -4.17 | -1.48 | -9.14 | -7.96 | -1.26 | 29.66 |
两性异形的研究主要关注体型大小(Manicom et al., 2014)和局部形态、色型(Bruinjé et al., 2019)。趾长可能会受到激素、附肢等相关因素的影响。有研究表明,激素对于蜥蜴不同性别的前肢趾长、后肢趾长和趾长比的影响有所不同(Direnzo & Stynoski,2012),可能是因为前肢趾长和后肢趾长所经历的激素环境以及激素受体的密度不同而发育程序不统一,可能是源于异时性(Bininda-Emonds et al., 2007),而蜥蜴的前、后肢长可能与趾长长度呈正相关。类固醇激素水平的变化在某种程度上与成年蜥蜴行为及其特定形态的差异性有密切的联系(Tobler et al., 2011)。在动物中,雌激素被认为能够促进第2趾的生长,雄激素会促进第4趾的生长。性选择预测雄性频繁的运动需求驱使它们进化出更长的附肢,引起雌雄两性在运动表现或行为上的差异(Iraeta et al., 2011)。第3趾主要用于推动蜥蜴向前移动; 而第4趾主要用作支撑以及获得更快移动速度(Tulli et al., 2011),后肢长和趾长在很大程度上影响了最大冲刺速度,拥有较长后肢的蜥蜴更具优势(王莉等,2020)。
目前对趾长的两性异形研究不多,有学者报道仅在蜥蜴最长趾有两性异形的趋势(Woodhead et al., 2018),也有学者认为热带地区蜥蜴趾长的两性异形可能是独立进化的,并且在不同的趾中分别进化,甚至在同一物种中,趾长的两性异形模式可能在不同趾中独立进化(Lofeu et al., 2020)。本研究结果表明,敏麻蜥不同地理种群的不同趾长表现出一定的两性异形现象,但没有稳定或统一的模式,可能是独立进化的。
3.2 趾长比的两性异形趾长比研究最初主要关注2D: 4D(Voracek & Loibl,2009),还包括一些两栖动物、爬行动物、鸟类或哺乳动物的研究中的其他指标,如2D: 3D(Leoni et al., 2008; Woodhead et al., 2018)、2D: 5D(Leoni et al., 2008)、3D: 4D(Tobler et al., 2011),或同时对上述3个比率(Ruuskanen et al., 2011; Balogová et al., 2015;Van Damme et al., 2015; Kazimirski et al., 2020)进行研究报道。一般来说,在大多数哺乳动物(Leoni et al., 2005; McIntyre et al., 2009)以及有尾两栖动物(Kaczmarski et al., 2015)中,雌性的2D: 4D比雄性大。而无尾两栖动物、爬行动物和鸟类大多具有相反的特征(Chang,2008; Leoni et al., 2008; Van Damme et al., 2015)。
在蜥蜴中观察到的2D: 4D模式无两性差异(Lombardo & Thorpe,2008),到Anois carolinesis仅在个别肢体中有两性差异(Chang et al., 2006),而在Podarcis melisellensis中前肢和后肢均有两性差异(Van Damme et al., 2015)。敏麻蜥富蕴种群的后肢2D: 4D存在显著两性异形,且雌性显著大于雄性,与爬行动物中报道的一般模式不同,而与哺乳动物的模式类似,其余2个种群的2D: 4D没有显著的两性差异。Gomes和Kohlsdorf(2011)通过研究25种鬣蜥,并在使用微生境和系统发育背景下进行分析,结果发现树栖物种的趾长比(2D: 4D)更多表现出两性差异。
蜥蜴2D: 3D在不同物种之间的两性差异是高度可变的。在成年Woodworthia sp.上,2D: 3D仅在右后肢中存在显著的两性异形,且雄性更大(Woodhead et al., 2018),P. siculus仅在左后肢发现有两性异形(Van Damme et al., 2015)。在P. muralis中,雄性左侧的2D: 3D大于雌性,而雄性Mabuya planifron的2D: 3D小于雌性(Rubolini et al., 2006)。敏麻蜥塔城种群的后肢2D: 3D存在显著的两性差异,且雄性显著大于雌性,与在蜥蜴中已报道的模式类似。敏麻蜥其余2个种群前肢及后肢的2D: 3D均没有显著的两性差异。
趾长比SDI的绝对值之和可以反映雌雄间的差异程度,塔城地区的差异程度最大,富蕴县的差异程度居中,而伊犁地区的差异程度最小,富蕴县与伊犁地区数值较为接近。鉴于3个地区敏麻蜥生境的植被类型有很大差异(Liang et al., 2018),以及“形态-表现-适合度”的范式(Tan et al., 2020),上述差异可能与微生境利用及运动表现有关,需要进一步研究确定。
4 结论敏麻蜥的趾长及趾长比可能受到早期激素、前后肢长的影响。敏麻蜥3个地理种群的趾长及趾长比的两性异形没有统一的模式,可能是独立进化的。伊犁地区后肢的趾长存在两性差异,富蕴县和塔城地区前肢和后肢的趾长均存在两性差异,且富蕴县和塔城地区的后肢趾长比存在两性差异,上述结果可能与种内变异有关。
龚雄, 刘金龙, 周天和, 等. 2018. 新疆博乐和伊犁河谷敏麻蜥的种下分类地位探讨[J]. 四川动物, 37(4): 387-399. |
梁涛, 吕士鹏, 武开乐, 等. 2015. 旱地沙蜥的两性异形和雌性繁殖投入[J]. 生态学杂志, 34(6): 1602-1606. |
梁涛, 时磊. 2018. 敏麻蜥卵形状的异速增长与卵大小和数量的权衡[J]. 生态学杂志, 37(9): 2761-2767. |
梁涛, 郑鹏, 李叶, 等. 2018. 敏麻蜥的两性异形和雌性繁殖输出[J]. 干旱区研究, 35(5): 1160-1166. |
史红全, 柏军鹏, 范俊功. 2021. 麻雀身体大小的性二态和基于身体量度的性别判定[J]. 四川动物, 40(3): 261-269. |
万丽霞, 张海军, 李海娇. 2018. 甘肃密点麻蜥三个地理种群的两性异形研究[J]. 四川动物, 37(2): 139-148. |
王莉, 郑鹏, 时磊. 2020. 不同基质上快步麻蜥的运动表现及其与形态特征的相关性[J]. 干旱区研究, 37(3): 799-808. |
王欣琪, 梁涛, 安静, 等. 2020. 草原蜥两性的咬合力及头部形态特征比较[J]. 动物学杂志, 5(1): 29-36. |
席焕久, 赵红, 李文慧, 等. 2012. 对指长比研究现状的初步分析[J]. 解剖学报, 43(4): 569-573. |
姚冲学, 吕婷, 王方, 等. 2019. 大蹼铃蟾的两性异形[J]. 四川动物, 38(2): 194-199, 205. |
赵尔宓, 赵肯堂, 周开亚, 等. 1999. 中国动物志爬行纲: 第二卷(有鳞目: 蜥蜴亚目)[M]. 北京: 科学出版社.
|
赵晓进, 田华香, 胡海洋, 等. 2015. 太行山猕猴指(趾)长比性差[J]. 解剖学报, 46(5): 673-678. |
Balogová M, Nelson E, Uhrin M, et al. 2015. No sexual dimorphism detected in digit ratios of the fire salamander (Salamandra salamandra)[J]. Anatomical Record, 298(10): 1786-1795. |
Bergmann PJ, Pettinelli KJ, Crockett ME, et al. 2017. It's just sand between the toes: how particle size and shape variation affect running performance and kinematics in a generalist lizard[J]. Journal of Experimental Biology, 220(20): 3706-3716. |
Bininda-Emonds OR, Jeffery JE, Sánchez-Villagra MR, et al. 2007. Forelimb-hindlimb developmental timing changes across tetrapod phylogeny[J/OL]. BMC Evolutionary Biology, 7(1): 182[2021-03-01]. https://doi.org/10.1186/1471-2148-7-182.
|
Breedlove SM. 2010. Minireview: organizational hypothesis: instances of the fingerpost[J]. Endocrinology, 151(9): 4116-4122. |
Bruinjé AC, Coelho FEA, Paiva TMA, et al. 2019. Aggression, color signaling, and performance of the male color morphs of a Brazilian lizard (Tropidurus semitaeniatus)[J/OL]. Behavioral Ecology and Sociobiology, 73: 72[2021-03-01]. https://doi.org/10.1007/s00265-019-2673-0.
|
Chang JL, Doughty S, Wade J, et al. 2006. Sexual dimorphism in the second-to-fourth digit length ratio in green anoles, Anolis carolinensis (Squamata: Polychrotidae), from southeastern United States[J]. Canadian Journal of Zoology, 42(2): 1489-1494. |
Chang JL. 2008. Sexual dimorphism of the second-to-fourth digit length ratio (2D: 4D) in the strawberry poison dart frog (Oophaga pumilio) in Costa Rica[J]. Journal of Herpetology, 42(2): 414-416. |
Darwin CR. 1871. The descent of man, and selection in relation to sex[M]. Princeton: Princeton University Press.
|
Direnzo GV, Stynoski JL. 2012. Patterns of second-to-fourth digit length ratios (2D: 4D) in two species of frogs and two species of lizards at La Selva, Costa Rica[J]. The Anatomical Record: Advances in Integrative Anatomy and Evolutionary Biology, 295(4): 597-603. |
Fairbairn DJ, Roff DA. 2006. The quantitative genetics of sexual dimorphism: assessing the importance of sex-linkage[J]. Heredity, 97(5): 319-328. |
Gomes CM, Kohlsdorf T. 2011. Evolution of sexual dimorphism in the digit ratio 2D: 4D relationships with body size and microhabitat use in iguanian lizards[J/OL]. PLoS ONE, 6(12): e28465[2021-01-10]. https://doi.org/10.1371/journal.pone.0028465.
|
Iraeta P, Monasterio C, Salvador A, et al. 2011. Sexual dimorphism and interpopulation differences in lizard hind limb length: locomotor performance or chemical signalling?[J]. Biological Journal of the Linnean Society, 104(2): 318-329. |
Kaczmarski M, Kaczmarek JM, Jankowia Ł, et al. 2021. Digit ratio in the common toad Bufo bufo: the effects of reduced fingers and of age dependency[J/OL]. Zoological Letters, 7: 5[2021-01-20]. https://doi.org/10.1186/s40851-021-00174-y.
|
Kaczmarski M, Kubicka AM, Tryjanowski P, et al. 2015. Females have larger ratio of second-to-fourth digits than males in four species of Salamandridae, Caudata[J]. Anatomical Record, 298(8): 1424-1430. |
Kazimirski P, Kaczmarsk M, Zagalska-Neubauer MM, et al. 2020. Absence of sex differences in digit ratio in nestlings of the white stork Ciconia ciconia, a monomorphic bird species[J]. Bird Study, 66(2): 503-509. |
Leoni B, Canova L, Saino N. 2005. Sexual dimorphism in metapodial and phalanges length ratios in the wood mouse[J]. Anatomical Record, 286(2): 955-961. |
Leoni B, Rubolini D, Romano M, et al. 2008. Avian hind-limb digit length ratios measured from radiographs are sexually dimorphic[J]. Journal of Anatomy, 213(4): 425-430. |
Liang T, Zhou L, He WF, et al. 2018. Variation in reproductive strategies of three populations of Phrynocephalus helioscopus in China[J/OL]. PeerJ, 6: e5705[2021-01-20]. https://doi.org/10.7717/peerj.5705.
|
Lofeu L, Brandt R, Kohlsdorf T. 2020. Digit identity matters: origin and evolution of sexual dimorphism in the digit lengths of tropidurid lizards[J]. Biological Journal of the Linnean Society, 131(1): 109-121. |
Lombardo MP, Thorpe PA. 2008. Digit ratios in green Anolis lizards (Anolis carolinensis)[J]. Anatomical Record, 291(4): 433-440. |
Lovich JE, Gibbons JW. 1992. A review of techniques for quantifying sexual size dimorphism[J]. Growth Development and Aging, 56(4): 269-281. |
Manicom C, Alford R, Schoener TW, et al. 2014. Mechanisms causing variation in sexual size dimorphism in three sympatric, congeneric lizards[J]. Ecology, 95(6): 1531-1544. |
McIntyre MH, Herrmann E, Wobber V, et al. 2009. Bonobos have a more human-like second-to-fourth finger length ratio (2D: 4D) than chimpanzees: a hypothesized indication of lower prenatal androgens[J]. Journal of Human Evolution, 56(4): 361-365. |
Poyarkov NA, Orlova VF, Chirikova MA. 2014. The mitochondrial phylogeography and intraspecific taxonomy of the steppe racerunner, Eremias arguta (Pallas) (Lacertidae: Sauria, Reptilia), reflects biogeographic patterns in Middle Asia[J]. Zootaxa, 3895(2): 208-224. |
Rubolini D, Pupin F, Sacchi R, et al. 2006. Sexual dimorphism in digit length ratios in two lizard species[J]. Anatomical Record, 288A(5): 491-497. |
Ruuskanen S, Helle S, Ahola M, et al. 2011. Digit ratios have poor indicator value in a wild bird population[J]. Behavioral Ecology and Sociobiology, 65(5): 983-994. |
Sczcerbak NN. 1971. Taxonomy of the racerunner genus Eremias (Sauria, Reptilia) in relation with areas of desert-steppe faunal formation in the Palaearctics[J]. Vestnik Zoologii, 3895(2): 47-55. |
Tan WC, Vanhooydonck B, Measey J, et al. 2020. Morphology, locomotor performance and habitat use in southern African agamids[J]. Biological Journal of the Linnean Society, 130(1): 166-177. |
Tobler M, Healey M, Olsson M. 2011. Digit ratio, color polymorphism and egg testosterone in the Australian painted dragon[J/OL]. PLoS ONE, 6(1): e16225[2021-01-20]. https://doi.org/10.1371/journal.pone.0016225.
|
Tulli MJ, Abdala V, Cruz FB. 2011. Relationships among morphology, clinging performance and habitat use in Liolaemini lizards[J]. Journal of Evolutionary Biology, 24(4): 843-855. |
Van Damme R, Wijnrocx K, Boeye J, et al. 2015. Digit ratios in two lacertid lizards: sexual dimorphism and morphological and physiological correlates[J]. Zoomorphology, 134(4): 565-575. |
Voracek M, Loibl LM. 2009. Scientometric analysis and bibliography of digit ratio (2D: 4D) research, 1998-2008[J]. Psychological Reports, 104(3): 922-956. |
Woodhead N, Hare KM, Cree A. 2018. Sexual dimorphism of digit-length ratio in a viviparous lizard: influence of age, but not preservation state or sex of interuterine twin[J]. Anatomical Record, 301(7): 1169-1178. |
Zheng Z, Cohn MJ. 2011. Developmental basis of sexually dimorphic digit ratios[J]. Proceedings of the National Academy of Sciences, 108(39): 16289-16294. |
 2022, Vol. 41
2022, Vol. 41




