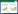扩展功能
文章信息
- 钮文俊, 李照, 沈迪, 张保卫, 方光战
- NIU Wenjun, LI Zhao, SHEN Di, ZHANG Baowei, FANG Guangzhan
- 仙琴蛙对不同类型声音的感知差异研究
- Differences in Auditory Perception for Different Types of Sounds in the Music Frog (Nidirana daunchina)
- 四川动物, 2022, 41(1): 1-13
- Sichuan Journal of Zoology, 2022, 41(1): 1-13
- 10.11984/j.issn.1000-7083.20210248
-
文章历史
- 收稿日期: 2021-07-21
- 接受日期: 2021-11-10
2. 湖南农业大学生物科学技术学院,长沙 410128;
3. 中国科学院成都生物研究所,成都 610041;
4. 中国科学院大学,北京 100049
2. College of Bioscience and Biotechnology, Hunan Agricultural University, Changsha 410128, China;
3. Chengdu Institute of Biology, Chinese Academy of Sciences, Chengdu 610041, China;
4. University of the Chinese Academy of Sciences, Beijing 100049, China
听觉是大脑感知外界信息的重要功能之一,通过听觉系统感知不同的声音信息,并整合其他模态输入(如视觉和嗅觉等)的处理结果,最终决定动物捕食、逃逸和交配等行为,对维系个体与种群的生存具有极其重要的意义(Schrode et al., 2014)。听觉感知包括对声音信息的觉察、感觉、注意和知觉等多个认知过程,既往研究对这些过程进行了深入研究(Janik,2000;Charrier et al., 2001;Vlgnal et al., 2004;Elie & Theunissen,2018),但是大脑如何对复杂的声音信号进行解码和处理依然是神经生物学的核心问题之一。例如,大脑在处理不同类型的复杂声音信号时,大脑活动的动态特征依然不清楚;对这一问题进行研究有助于深入理解大脑功能、听觉感知和听觉目标识别的相关机理。
哺乳类(包括人)、鸟类和爬行类的听觉行为往往受多模信息影响,视觉、听觉和嗅觉等信息的时空交互给听觉感知的研究带来一定困难。由于大脑功能的保守性,脊椎动物在一定程度上共享着基于对信号的选择性处理而指导行为响应的基本环路(Krauzlis et al., 2018),因此可选择单模通讯动物(比如主要依赖声音通讯的夜行性蛙类)作为模型对听觉感知进行研究。对蛙类而言,雄性广告鸣叫(复杂声音信号)传递着物种、个体、繁殖状态、所处位置、资源占有、体型等复杂信息,即声学成分编码了物种/个体识别所需的信息;雌性根据广告鸣叫识别物种、亚种或个体,并选择最适雄性作为配偶。雄性仙琴蛙Nidirana daunchina在繁殖季节能产生2种广告鸣叫(产生于巢穴内的洞内鸣叫和巢穴外的洞外鸣叫),雌雄两性均偏好响应洞内鸣叫(Cui et al., 2012;Fang et al., 2014);而在非繁殖季节,仙琴蛙通常将自己埋于泥土之中,进入或准备进入冬眠状态,此时很少听到外界声音,尤其不可能听到同种广告鸣叫(Yang et al., 2018)。行为学研究发现,雌雄两性对同种鸣叫和非同种鸣叫(如白噪声)的行为响应不同(Cui et al., 2012;Fang et al., 2014),而且仙琴蛙的脑网络特征受声音信号的生物学意义调制(Xue et al., 2018),说明仙琴蛙能分辨不同类型的声音信号。但仙琴蛙在感知不同类型的声音时其大脑活动的动态特征尚不清楚。
脑电(electroencephalogram,EEG)是神经元群电活动在大脑皮层的总体反映,是脑功能信息传输的内部载体,蕴藏丰富、动态的生理信息。EEG功率谱反映了同步放电的神经元数量(Klimesch,1999),即功率谱增加表明参与当前任务的神经元数量增加。通常将EEG划分为delta、theta、alpha、beta和gamma 5个频段,各频段对听觉认知均具有重要作用(Klimesch et al., 2007;Klimesch,2012;Wang et al., 2016),各频段不同功率谱与特定的大脑状态相关联,反映了与注意力、学习、记忆和决策相关的感觉和认知过程(Klimesch, 1999, 2012;Engel,2001;Thut & Miniussi,2009)。Delta频段与最古老的信息传递系统有关,需要内部专注的任务往往伴随着delta出现,它抑制干扰任务解决的其他过程(Harmony,2013);其抑制作用可能是由较高的系统抑制较低的系统,即下行抑制机制(Knyazev & Slobodskaya,2003)。Theta频段在认知过程中起着重要作用,包括感知、注意、学习、空间导航、情景记忆和工作记忆(Kahana,2006;Soltani Zangbar et al., 2020)。Alpha频段参与听觉注意的调制,皮层中alpha频段振荡是选择性注意的关键标志(Klimesch,2012)。Beta频段的活动与刺激加工相关,参与对新奇刺激的处理(Haenschel et al., 2000)。Gamma频段在动态选择信息过程中起重要作用,还与语言的加工和运动协调有关(Uhlhaas et al., 2011)。但仙琴蛙仅有delta、theta、alpha和beta频段,缺少gamma频段,这可能与两栖动物大脑缺少新皮质有关(Fang et al., 2012)。由于大脑功能具有保守性,脊椎动物之间的EEG节律没有本质的系统发育差异(Segura & De Juan,1966),所以EEG是研究听觉感知的理想信号。
由于处于繁殖期的仙琴蛙能对声音信号产生相应的行为响应;而处于非繁殖期的仙琴蛙通常埋于泥土之中,很少听到外界声音,尤其不可能听到同种广告鸣叫。因此,选择繁殖期的仙琴蛙作为研究对象,更接近于其自然条件下的生存状态,也更能揭示其自然条件下的听觉感知特征。为此,本研究以繁殖期的仙琴蛙为对象,采用等概率实验范式,在随机播放白噪声和洞内鸣叫2种不同类型的声音刺激时,实时采集仙琴蛙相关脑区的EEG信号;分析和探讨听觉感知过程中EEG各频段的动态特征,相关结果将有助于深入理解蛙类在进行同种鸣声识别时各EEG频段的功能。
1 实验材料和方法 1.1 实验动物在繁殖季节,从四川省峨眉山地区采集16只仙琴蛙(雌雄各半)。按性别分装于2只不透明塑料箱子里(长54 cm×宽40 cm×高33 cm),箱内有适量的泥和水。在室内饲养条件下,雄性往往会发出广告鸣叫,而雌性通常有卵,保证雌雄两性在实验过程中的激素水平维持在一个相对较高的水平。饲养箱置于12L: 12D光照周期(08:00开灯)的饲养房中,室温23 ℃±1 ℃。每隔3 d喂食新鲜活蟋蟀一次。手术时,动物平均体质量为9.96 g±1.64 g,平均体长为4.65 cm±0.24 cm。所有实验操作均遵守中国科学院成都生物研究所动物福利相关规定。
1.2 手术过程将仙琴蛙浸入0.15%的鱼安定(MS-222)溶液中麻醉(保持头部外露,避免眼部不适),通过夹趾反应判断麻醉程度,无夹趾反应时停止麻醉。用湿润纱布包裹动物身体,留出头部手术区域,依次使用碘伏、75%医用酒精及消炎药对手术区域进行处理,避免术后感染。去除手术区皮肤,暴露头骨,将7个不锈钢电极(φ=0.8 mm)植入颅骨内直至接触硬脑膜为止(通过平均颅骨厚度、不锈钢螺丝的螺距及电极植入时眼部变化共同确定),其中6个电极分别位于端脑(left telencephalon,LT;right telencephalon,RT)、间脑(left diencephalon,LD;right diencephalon,RD)和中脑(left mesencephalon,LM;right mesencephalon,RM)的左右两侧,参考电极(cerebellum,C)位于小脑上方(图 1)。电极埋植完成后,用牙托水泥对电极进行封固;用自封膜对接插件进行防水密封。动物术后单独置于装有适量纯净水的饲养盒中,恢复7 d后开始实验。实验结束后,对动物进行安乐死,并在电极相应位点注射苏木精染料,检查电极位置是否与预期一致,排除与目标位置不一致的数据。

|
| 图 1 电极位置分布及相应的10 s EEG特征波形 Fig. 1 Electrode placements and 10 s typical EEG tracings for each brain area 3条粗体虚线表示颅骨骨缝; LT、RT、LD、RD、LM、RM分别表示端脑、间脑和中脑的左右两侧; C表示植入小脑上方的参考电极 Three dashed lines in bold denote the intersection among the suture lines in the frog skull; LT, RT, LD, RD, LM, RM denote the left and right sides of telencephalon, diencephalon and mesencephalon, respectively; while C denotes the reference electrode implanted above the cerebellum |
| |
实验使用白噪声和洞内鸣叫2种刺激。雄蛙听觉敏感的频率范围通常比雌性更宽(Liu et al., 2014),为了更好地检测听觉感知的性别差异,需要采用带宽比同种鸣叫更宽的声音刺激。由于理想的白噪声具有无限带宽(实际使用的白噪声带宽与声音播放设备的频率响应带宽相等),同时白噪声在整个频域范围内的所有频率分量具有相等的功率谱密度,所以白噪声适合用于对包括神经系统在内的生理系统的刺激响应进行识别和分析(Marmarelis & Marmarelis,1978);并且生理系统对白噪声的刺激响应在很大程度上不受出现在该系统中的其他类型噪声影响。为避免伪重复,选用4只非实验对象的同种雄性个体的、包含5个音节的洞内广告鸣叫,每个洞内鸣叫分别与白噪声配对,组成4组刺激对(图 2)。白噪声上升/下降沿均为7.5 ms(正弦调制),时长等于4个洞内鸣叫的平均时长(约1.28 s)。随机选取1组刺激对用于随机选取的4只仙琴蛙(雌雄各半)。声音刺激通过2个便携式扬声器(SME-AFS;Saul Mineroff Electronics,Elmont,New York,USA)播放,扬声器置于实验箱两端,并与实验箱等距。声音强度通过声压计(AWA6291,爱华,杭州)调整为65 dB±0.5 dB SPL(在实验箱中心测得,C计权)。
|
| 图 2 声音刺激的波形图和频谱图 Fig. 2 Waveforms and spectrograms of the five stimuli a. 白噪声, b~e. 来自4只同种个体的洞内鸣叫 a. white noise, b-e. 4 advertisement calls acquired from four conspecific individuals |
| |
实验在隔音的电磁屏蔽室(背景噪声23.0 dB±1.7 dB)进行。恢复7 d后,动物被放入装有泥和水的不透明实验箱(长80 cm×宽60 cm×高55 cm),并连接至信号采集系统(RM6280C,成仪,成都),适应24 h;实验箱上方装有红外摄像机,监测被试行为。采用随机、等概率方式回放白噪声与洞内鸣叫,刺激呈现顺序随机(即下一个刺激是什么不可预测)、刺激间隔在2 s、2.5 s、3 s、3.5 s和4 s中随机(下一个刺激什么时候出现不可预测;由于在自然条件下雄性广告鸣叫之间的平均间隔为3.3 s,且雄性对时间间隔为3 s的声音回放的预测准确率最高(Fang et al., 2014),所以选取以3 s为中心的5个时长为刺激间隔),最大化消除有意注意影响,实验共随机回放了40次声音刺激(白噪声回放20次,洞内鸣叫回放20次)。刺激播放起始时刻,播放程序向信号采集系统发送TTL电平用于数据同步。采集动物的EEG信号和行为数据,带通滤波设置为0.05~200 Hz,采样频率为1 000 Hz。实验前一天喂食,实验过程中不进食,以保证信号受营养代谢的影响最小。
1.5 数据处理EEG信号经过50 Hz陷波和0.5~45 Hz带通滤波后,分别取刺激起始点前后1 s且无伪迹的原始数据进行分析。利用Welch算法(汉明窗,频谱分辨率为0.5 Hz)计算每段数据的delta(0.5~5.5 Hz)、theta(5.5~8.5 Hz)、alpha(8.5~17 Hz)、beta(17~45 Hz)的绝对功率谱(Fang et al., 2012)。得到每个EEG频段、每种刺激(白噪声和洞内鸣叫)、每个脑区(左右端脑、左右间脑和左右中脑)在不同时间(刺激前和刺激后)的绝对功率谱。
1.6 统计分析对绝对功率谱进行正态分布检验(Shapiro-Wilk W检验)和方差同质检验(Levene's检验)。利用5个因素(刺激组别、性别、刺激类型、时间和脑区)重复测量ANOVA对数据进行分析,发现在刺激组别和性别这2个因素上均无显著差异,说明本实验已排除伪重复可能造成的不利影响。进一步采用三因素(刺激类型、时间和脑区)重复测量ANOVA。若交互效应显著,进行简单或简单-简单效应分析。事后检验采用Bonferroni检验;若有必要,进行Greenhouse-Geisser矫正;分别用Partial η2和Cohen's d检测方差分析和t检验的效应度(0.20为低效应度,0.50为中效应度,0.80为高效应度)。统计分析使用SPSS 26。显著水平定义为α=0.05。
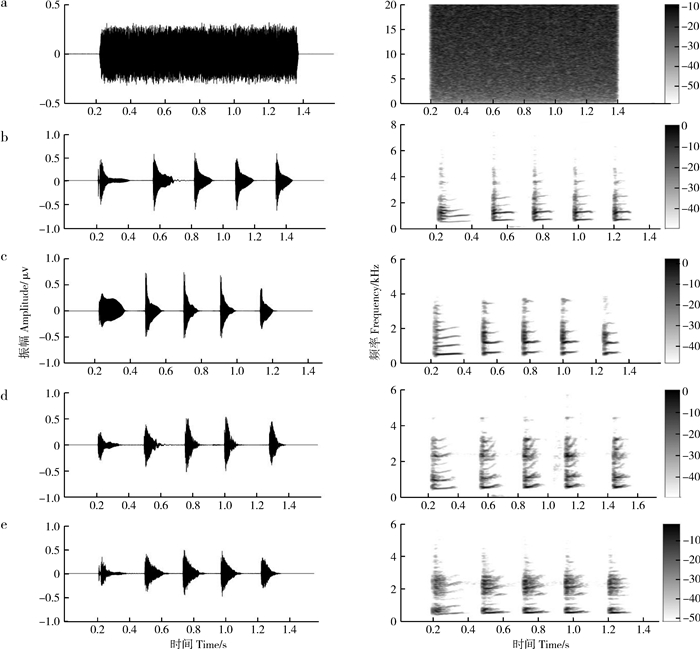
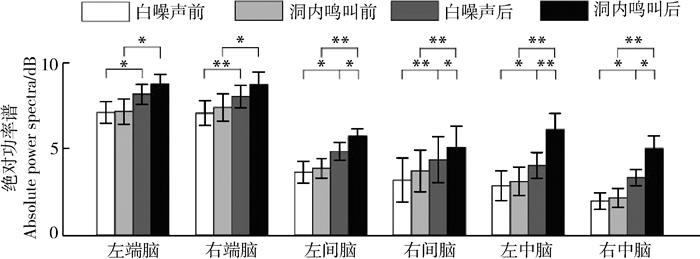
2 结果 2.1 Delta频段刺激类型(F1, 15=13.140,partial η2=0.467,P=0.002)、时间(F1, 15=43.385,partial η2=0.752,P < 0.0001)和脑区(F5, 75=11.590,partial η2=0.436,P=0.001)的主效应均显著;且三交互效应显著(F5, 75=3.061,partial η2=0.169,P=0.039;表 1)。简单-简单效应分析和简单效应分析结果显示,对不同刺激而言:左右间脑和左右中脑在白噪声刺激下的绝对功率谱均显著小于洞内鸣叫刺激;对刺激前后而言:白噪声和洞内鸣叫均表现出刺激前的绝对功率谱显著小于刺激后;对不同脑区而言:脑区间的差异主要表现为端脑最大、间脑次之、中脑最小,但左右端脑、左右间脑、左右中脑之间均无显著差异(表 2;图 3)。
| 因子 Factors |
方差分析 ANOVA |
P值 P-value |
效应度 Partial η2 |
事后比较 Bonferroni |
| 刺激 | F1, 15=13.140 | 0.002 | 0.467 | IC>WN |
| 时间 | F1, 15=43.385 | < 0.000 1 | 0.752 | POST>PRE |
| 脑区 | F5, 75=11.590 | 0.001 | 0.436 | LT, RT>LD, LM, RM |
| 刺激*时间*脑区 | F5, 75=3.061 | 0.039 | 0.169 | * |
| 注:“>”表示左侧条件下的绝对功率谱大于右侧, 同侧间无显著差异; WN. 白噪声, IC. 洞内鸣叫, PRE. 刺激前, POST. 刺激后, LT, RT. 左右端脑, LD, RD. 左右间脑, LM, RM. 左右中脑, NA. 不适用; * 结果详见后表; 下同 Notes: the symbol “>” denotes that the absolute power spectra of the four bands associated with various conditions on the left side of “ > ” are significantly larger than those on the right side, and no significant difference exists among the corresponding conditions on the same side of “ > ” for each case; WN. white noise, IC. inside call, PRE. pre stimulation, POST. post stimulation, LT, RT. the left and right telencephalon, LD, RD. the left and right diencephalon, LM, RM. the left and right mesencephalon, NA. not applicable; * see the table below; the same below |
||||
| 因子|条件 Factor|Condition |
统计量 F/t |
P值 P-value |
效应度 Partial η2/Cohen's d |
事后比较 Bonferroni |
| 刺激|(LD, POST) | t15=-3.212 | 0.006 | 0.451 | IC>WN |
| 刺激|(RD, POST) | t15=-2.475 | 0.026 | 0.146 | IC>WN |
| 刺激|(LM, POST) | t15=-4.681 | < 0.001 | 0.610 | IC>WN |
| 刺激|(RM, POST) | t15=-2.840 | 0.012 | 0.687 | IC>WN |
| 时间|WN | F1, 15=21.374 | < 0.001 | 0.588 | POST>PRE |
| 时间|LT | F1, 15=17.229 | 0.001 | 0.535 | POST>PRE |
| 时间|RT | F1, 15=30.566 | < 0.000 1 | 0.671 | POST>PRE |
| 时间|LD | F1, 15=24.054 | < 0.001 | 0.616 | POST>PRE |
| 时间|RD | F1, 15=40.795 | < 0.000 1 | 0.731 | POST>PRE |
| 时间|(LT, IC) | t15=-2.971 | 0.010 | 0.608 | POST>PRE |
| 时间|(RT, IC) | t15=-4.082 | 0.001 | 0.433 | POST>PRE |
| 时间|(LD, IC) | t15=-4.999 | < 0.001 | 0.922 | POST>PRE |
| 时间|(RD, IC) | t15=-4.551 | < 0.001 | 0.289 | POST>PRE |
| 时间|(LM, IC) | t15=-5.324 | < 0.000 1 | 0.844 | POST>PRE |
| 时间|(RM, IC) | t15=-4.474 | < 0.001 | 1.117 | POST>PRE |
| 脑区|WN | F5, 75=12.137 | 0.001 | 0.477 | LT, RT>LD, LM, RM; LD>RM |
| 脑区|(IC, PRE) | F5, 75=13.664 | < 0.000 1 | 0.477 | LT>LD, RD, LM, RM; RT>LD, LM, RM; LD>RM |
| 脑区|(IC, POST) | F5, 75=7.031 | 0.002 | 0.319 | LT, RT>LD, RM |
| 脑区|PRE | F5, 75=12.907 | < 0.001 | 0.463 | LT, RT>LD, LM, RM; LD>RM |
| 脑区|(WN, POST) | F5, 75=11.894 | 0.001 | 0.442 | LT, RT>LD, LM, RM; LD>RM |
|
| 图 3 白噪声和洞内鸣叫刺激下不同脑区、不同时间(刺激前后)对应的delta频段的绝对功率谱 Fig. 3 Absolute power spectra of delta band elicited in different brain regions before and after playbacks of white noise and inside call *P<0.05,* *P<0.001; 下同,the same below |
| |
时间(F1, 15=98.923,partial η2=0.868,P < 0.000 1)和脑区(F5, 75=12.987,partial η2=0.464,P < 0.000 1)的主效应均显著;且三交互效应显著(F5, 75=5.267,partial η2=0.260,P=0.006;表 3)。简单-简单效应分析和简单效应分析结果显示,对不同刺激而言:左中脑和右中脑在白噪声刺激下的绝对功率谱均显著小于洞内鸣叫;对刺激前后而言:白噪声和洞内鸣叫刺激前的绝对功率谱均显著小于刺激后;对不同脑区而言:脑区之间的差异主要表现为端脑最大、间脑次之、中脑最小;但左右端脑、左右间脑、左右中脑之间均无显著差异(表 4;图 4)。
| 因子 Factors |
方差分析 ANOVA |
P值 P-value |
效应度 Partial η2 |
事后比较 Bonferroni |
| 刺激 | F1, 15=3.141 | 0.097 | 0.173 | NA |
| 时间 | F1, 15=98.923 | < 0.000 1 | 0.868 | POST>PRE |
| 脑区 | F5, 75=12.987 | < 0.000 1 | 0.464 | LT, RT>LD, LM, RM |
| 刺激*时间*脑区 | F5, 75=5.267 | 0.006 | 0.260 | * |
| 因子|条件 Factor|Condition |
统计量 F/t |
P值 P-value |
效应度 Partial η2/Cohen's d |
事后比较 Bonferroni |
| 刺激|(LM, POST) | t15=-3.499 | 0.003 | 0.545 | IC>WN |
| 刺激|(RM, POST) | t15=-2.423 | 0.029 | 0.521 | IC>WN |
| 时间|(LT, WN) | t15=-2.279 | 0.038 | 0.173 | POST>PRE |
| 时间|(RT, WN) | t15=-2.582 | 0.021 | 0.184 | POST>PRE |
| 时间|(LD, WN) | t15=-6.689 | < 0.000 1 | 0.471 | POST>PRE |
| 时间|(RD, WN) | t15=-4.880 | < 0.001 | 0.235 | POST>PRE |
| 时间|(LM, WN) | t15=-9.870 | < 0.000 1 | 0.614 | POST>PRE |
| 时间|(RM, WN) | t15=-9.277 | < 0.000 1 | 0.685 | POST>PRE |
| 时间|(LT, IC) | t15=-3.711 | 0.002 | 0.298 | POST>PRE |
| 时间|(RT, IC) | t15=-3.055 | 0.008 | 0.236 | POST>PRE |
| 时间|(LD, IC) | t15=-4.954 | < 0.001 | 0.501 | POST>PRE |
| 时间|(RD, IC) | t15=-5.481 | < 0.000 1 | 0.371 | POST>PRE |
| 时间|(LM, IC) | t15=-8.319 | < 0.000 1 | 1.089 | POST>PRE |
| 时间|(RM, IC) | t15=-5.183 | < 0.001 | 1.106 | POST>PRE |
| 脑区|(WN, PRE) | F5, 75=16.480 | < 0.000 1 | 0.524 | LT, RT>LD, LM, RM; LD>RM |
| 脑区|(WN, POST) | F5, 75=10.237 | 0.001 | 0.406 | LT, RT>LD, LM, RM; LD>RM |
| 脑区|(IC, PRE) | F5, 75=24.572 | < 0.000 1 | 0.621 | LT, RT>LD, RD, LM, RM; LD, RD>RM |
| 脑区|(IC, POST) | F5, 75=4.753 | 0.006 | 0.241 | LT, RT>LD |
|
| 图 4 白噪声和洞内鸣叫刺激下不同脑区、不同时间(刺激前后)对应的theta频段的绝对功率谱 Fig. 4 Absolute power spectra of theta band elicited in different brain regions before and after playbacks of white noise and inside call |
| |
刺激类型(F1, 15=8.751,partial η2=0.368,P=0.010)、时间(F1, 15=36.185,partial η2=0.707,P < 0.000 1)和脑区(F5, 75=13.863,partial η2=0.480,P < 0.001)的主效应均显著;且三交互效应显著(F5, 75=5.016,partial η2=0.251,P=0.011;表 5)。简单-简单效应分析和简单效应分析结果显示,对不同刺激而言:左端脑、左中脑和右中脑在白噪声刺激下的绝对功率谱均显著小于洞内鸣叫;对刺激前后而言:绝大部分脑区在白噪声和洞内鸣叫刺激前的绝对功率谱显著小于刺激后;对不同脑区而言:整体而言,端脑最大、间脑次之、中脑最小;但左右端脑、左右间脑、左右中脑之间均无显著差异(表 6;图 5)。
| 因子 Factors |
方差分析 ANOVA |
P值 P-value |
效应度 Partial η2 |
事后比较 Bonferroni |
| 刺激 | F1, 15=8.751 | 0.010 | 0.368 | IC>WN |
| 时间 | F1, 15=36.185 | < 0.000 1 | 0.707 | POST>PRE |
| 脑区 | F5, 75=13.863 | < 0.001 | 0.480 | LT>LD, LM, RM; RT>LD, RD, LM, RM |
| 刺激*时间*脑区 | F5, 75=5.016 | 0.011 | 0.251 | * |
| 因子|条件 Factor|Condition |
统计量 F/t |
P值 P-value |
效应度 Partial η2/Cohen's d |
事后比较 Bonferroni |
| 刺激|(LT, POST) | t15=-2.431 | 0.028 | 0.208 | IC>WN |
| 刺激|(LM, POST) | t15=-3.708 | 0.002 | 0.640 | IC>WN |
| 刺激|(RM, POST) | t15=-2.448 | 0.027 | 0.499 | IC>WN |
| 时间|(RT, WN) | t15=-2.222 | 0.042 | 0.200 | POST>PRE |
| 时间|(LD, WN) | t15=-4.019 | 0.001 | 0.353 | POST>PRE |
| 时间|(RD, WN) | t15=-3.948 | 0.001 | 0.254 | POST>PRE |
| 时间|(LM, WN) | t15=-6.102 | < 0.000 1 | 0.503 | POST>PRE |
| 时间|(RM, WN) | t15=-5.211 | < 0.001 | 0.519 | POST>PRE |
| 时间|(LT, IC) | t15=-3.697 | 0.002 | 0.328 | POST>PRE |
| 时间|(RT, IC) | t15=-4.190 | 0.001 | 0.363 | POST>PRE |
| 时间|(LD, IC) | t15=-4.308 | 0.001 | 0.540 | POST>PRE |
| 时间|(RD, IC) | t15=-4.827 | < 0.001 | 0.387 | POST>PRE |
| 时间|(LM, IC) | t15=-6.900 | < 0.000 1 | 1.030 | POST>PRE |
| 时间|(RM, IC) | t15=-4.138 | 0.001 | 0.896 | POST>PRE |
| 脑区|(WN, PRE) | F5, 75=19.140 | < 0.000 1 | 0.561 | LT, RT>LD, RD, LM, RM; LD>RM |
| 脑区|(WN, POST) | F5, 75=11.445 | 0.001 | 0.433 | LT, RT>LD, LM, RM; LD>RM |
| 脑区|(IC, PRE) | F5, 75=22.340 | < 0.000 1 | 0.598 | LT, RT>LD, RD, LM, RM; LD>RM |
| 脑区|(IC, POST) | F5, 75=5.531 | 0.005 | 0.269 | LT>LD; RT>LD, RD, RM |
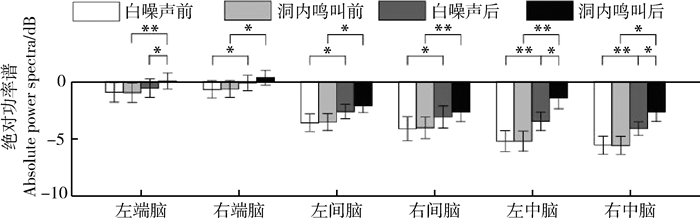
|
| 图 5 白噪声和洞内鸣叫刺激下不同脑区、不同时间(刺激前后)对应的alpha频段的绝对功率谱 Fig. 5 Absolute power spectra of alpha band elicited in different brain regions before and after playbacks of white noise and inside call |
| |
刺激类型(F1, 15=5.761,partial η2=0.277,P=0.030)、时间(F1, 15=18.979,partial η2=0.559,P=0.001)和脑区(F5, 75=16.324,partial η2=0.521,P < 0.000 1)的主效应均显著;刺激与时间的交互作用显著(F5, 75=8.632,partial η2=0.365,P=0.010)、时间与脑区的交互作用显著(F5, 75=8.305, partial η2=0.356,P=0.001;表 7)。简单效应分析结果显示,对不同刺激而言:白噪声刺激后的绝对功率谱显著小于洞内鸣叫;对刺激前后而言:白噪声和洞内鸣叫刺激前的绝对功率谱显著小于刺激后;对不同脑区而言:脑区之间的差异具体表现为端脑最大、间脑次之、中脑最小;但左右端脑、左右间脑、左右中脑之间均无显著差异(表 8;图 6)。
| 因子 Factors |
方差分析 ANOVA |
P值 P-value |
效应度 Partial η2 |
事后比较 Bonferroni |
| 刺激 | F1, 15=5.761 | 0.030 | 0.277 | IC>WN |
| 时间 | F1, 15=18.979 | 0.001 | 0.559 | POST>PRE |
| 脑区 | F5, 75=16.324 | < 0.000 1 | 0.521 | LT, RT>LD, RD, LM, RM |
| 刺激*时间 | F5, 75=8.632 | 0.010 | 0.365 | 简单效应分析 |
| 时间*脑区 | F5, 75=8.305 | 0.001 | 0.356 | * |
| 因子|条件 Factor|Condition |
统计量 F |
P值 P-value |
效应度 Partial η2/Cohen's d |
事后比较 Bonferroni |
| 刺激|POST | F1, 15=23.020 | 0.008 | 0.382 | IC>WN |
| 时间|WN | F1, 15=11.512 | 0.004 | 0.434 | POST>PRE |
| 时间|IC | F1, 15=19.951 | < 0.000 1 | 0.571 | POST>PRE |
| 时间|LT | F1, 15=11.441 | 0.004 | 0.433 | POST>PRE |
| 时间|RT | F1, 15=8.398 | 0.011 | 0.359 | POST>PRE |
| 时间|LD | F1, 15=10.761 | 0.005 | 0.418 | POST>PRE |
| 时间|RD | F1, 15=12.989 | 0.003 | 0.464 | POST>PRE |
| 时间|LM | F1, 15=27.175 | < 0.001 | 0.644 | POST>PRE |
| 时间|RM | F1, 15=15.518 | 0.001 | 0.508 | POST>PRE |
| 脑区|PRE | F5, 75=21.332 | < 0.000 1 | 0.587 | LT, RT>LD, RD, LM, RM; LD>LM, RM; RD>RM |
| 脑区|POST | F5, 75=11.328 | < 0.000 1 | 0.430 | LT, RT>LD, RD, LM, RM |
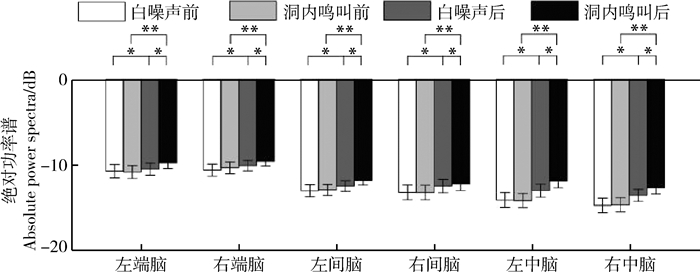
|
| 图 6 白噪声和洞内鸣叫刺激下不同脑区、不同时间(刺激前后)对应的beta频段的绝对功率谱 Fig. 6 Absolute power spectra of beta band elicited in different brain regions before and after playbacks of white noise and inside call |
| |
本研究发现,在播放白噪声和洞内鸣叫时,仙琴蛙EEG各频段活动均表现出刺激后大于刺激前,说明各频段共同参与了仙琴蛙的听觉感知过程;不同脑区对应的各频段活动模式主要表现为端脑最大、间脑次之、中脑最小,说明仙琴蛙听觉感知需全脑共同参与;洞内鸣叫刺激下EEG各频段的绝对功率谱强于白噪声刺激,说明EEG各频段活动强度受到声音刺激的生物学意义调制。
3.1 声音刺激使EEG各频段的活动增加注意、知觉、学习和记忆等认知过程的基础是EEG振荡,这些认知过程并非相互独立,而是紧密相关的(Baar,2005)。因此,讨论各频段的认知功能对于阐明听觉感知的神经机制具有重要意义。本研究发现仙琴蛙EEG各频段在给予声音刺激后均出现绝对功率谱增大的现象,这与EEG各频段的认知功能密切相关。
Delta频段参与注意和刺激显著性检测等认知过程(Knyazev,2007;Knyazev et al., 2009;Güntekin & Basar,2016),在低等脊椎动物的大脑活动中占主导地位(Knyazev & Slobodskaya,2003)。本研究发现声音刺激引起delta频段活动增加,说明其参与了仙琴蛙的听觉感知过程。蛙类通过工作记忆保持对声音信号的注意(Akre & Ryan,2010),而记忆信息存储在分布式theta网络之中,并与大脑后部区域的传入感觉痕迹相匹配(Sauseng et al., 2008)。同时,theta频段与多种感觉共享注意和注意分配,如视听整合,这也是theta频段具有认知控制功能的原因之一(Wang et al., 2016;Keller et al., 2017)。声音刺激引起仙琴蛙theta频段活动增加,说明仙琴蛙可能与其他蛙类一样,运用工作记忆保持对声音信号的注意(Akre & Ryan,2010)。传统认为alpha频段表征大脑的空闲态,但最近研究发现,alpha频段与注意的2个基本功能(抑制和选择)密切相关,前者通过事件相关同步实现,后者通过事件相关去同步解除抑制实现(Klimesch et al., 2007;Klimesch,2012);即alpha频段表征大脑通过抑制与当前任务不相关的认知过程,提高大脑相关认知任务的信号处理的皮层信噪比。本研究发现刺激后alpha功率增大可能也体现了alpha的抑制作用。Beta频段活动与刺激加工(Siniscalchi et al., 2013)和注意调节相关(Wrobel et al., 2007),本研究发现beta频段活动增加,体现其频段参与仙琴蛙的听觉感知过程。
综上可知,声音刺激引起的EEG各频段的绝对功率谱增大(即相关频段的活动增强),与刺激呈现时仙琴蛙需要调用注意等认知资源处理相关信息匹配;同时与“同一频段可能参与多种大脑功能的实现,同一大脑功能亦需多个频段的共同参与”的结论一致(Sauseng & Klimesch,2008;Kim & Davis,2021)。
3.2 EEG各频段的活动强度受声音信号的生物学意义调制洞内鸣叫刺激下的端脑、间脑、中脑的绝对功率谱比白噪声刺激更大,反映了处于繁殖期的仙琴蛙在处理不同类型的声音信息时会投入不同的认知资源。在繁殖季节,雄性仙琴蛙通常发出广告鸣叫与同种其他雄性个体竞争并吸引雌性,雌性则根据雄性发出的广告鸣叫,选择最适雄性作为配偶(Cui et al., 2012),因此广告鸣叫对雌雄两性的成功繁殖至关重要,这类繁殖相关信息需投入更多的认知处理资源;而白噪声在自然界中并不存在,不包含特定的生物学信息,仙琴蛙投入的认知资源就会相对较少。本研究结果亦说明仙琴蛙能辨别2类声音,且EEG各频段活动强度受声音信号的生物学意义调制,这与Xia等(2018)发现的仙琴蛙脑网络受声音信号的生物学意义调制的结论一致。无尾类的中脑存在响应同种鸣叫中特定声学特征的特异性神经元(Feng et al., 1990;Gooler & Feng,1992;Edwards et al., 2008)和可能与调节听觉处理有关的类固醇受体(Forlano et al., 2010),而雌二醇可增强对声音的听觉反应(Yovanof & Feng,1983)及同种鸣叫和其他声音之间的听觉差异性(Chakraborty & Burmeister,2015)。本研究采用繁殖期的仙琴蛙,其激素水平相对稳定,中脑特异性神经元的存在可解释其繁殖期如何对繁殖信息投入更多的认知资源。本研究并未发现大脑活动的性别差异,说明在电生理层面,雌雄两性对不同类型声音(同种鸣叫和白噪声)的处理过程存在相似性。
本研究发现EEG各频段的绝对功率谱由端脑到间脑再到中脑依次减小;这可能与听觉感知或电极布局相关。一方面,端脑、间脑和中脑共同参与了无尾类的听觉感知。比如损毁纹状体(位于端脑)和丘脑的浅层或深层结构(位于间脑)损害无尾类的鸣叫识别,而中脑(包含半环隆枕)是无尾类听觉感知的中枢,也是无尾类听觉系统中首个基于声音信号的时频域信息进行复杂特征检测的脑区(Narins et al., 2006);声音信号中的“what”和“where”信息在半环隆枕中整合(Fang et al., 2015),损毁半环隆枕严重影响无尾类的趋声性行为,说明听觉感觉阶段(比如简单刺激特征的识别和声源定位)在中脑水平就基本完成(Wilczynski & Endepols,2006);但对复杂声音信号的处理(如同种鸣叫的识别与感知)需端脑参与(Yang et al., 2018)。本研究发现EEG各频段的绝对功率谱表现为端脑最大、间脑次之、中脑最小,这可能在一定程度上也反映了仙琴蛙的听觉感知需要全脑共同参与。另一方面,当前结果可能与电极布局有关,本研究的参考电极位于小脑上方,端脑电极离参考电极最远,中脑电极离参考电极最近;由于EEG信号随距离增加而衰减,因此对差分放大器而言,相同的信号在端脑采集会比在间脑和中脑采集时更大(由于电极数较少,不便于用平均参考或重参考)。同时,本研究通过分析仙琴蛙EEG各频段绝对功率谱的变化,探讨各频段在仙琴蛙听觉感知过程中的功能和大脑活动在不同类型声音之间的差异,但由于研究方法和技术条件的限制,未能揭示各频段在听觉感知过程中的确切功能及其对辨别不同类型声音的具体作用,未来可以使用空间密度更大的电极采集听觉感知相关核团的局部场电位信号或采用事件相关电位中的Oddball实验范式,并结合行为学进一步探讨仙琴蛙听觉感知过程中EEG各频段的活动特征与功能。
Akre KL, Ryan MJ. 2010. Complexity increases working memory for mating signals[J]. Current Biology, 20(6): 502-505. DOI:10.1016/j.cub.2010.01.021 |
Baar E. 2005. Memory andbrain dynamics oscillations integrating attention, perception, learning, and memory[M]. Florida, USA: CRC Press.
|
Chakraborty M, Burmeister SS. 2015. Effects of estradiol on neural responses to social signals in female Túngara frogs[J]. Journal of Experimental Biology, 218(22): 3671-3677. |
Charrier I, Mathevon N, Jouventin P. 2001. Mother's voice regognition by seal pups[J]. Nature, 412(6850): 873-874. |
Cui JG, Tang YZ, Narins PM. 2012. Real estate ads in Emei music frog vocalizations: female preference for calls emanating from burrows[J]. Biology Letters, 8(3): 337-340. DOI:10.1098/rsbl.2011.1091 |
Edwards CJ, Leary CJ, Rose GJ. 2008. Mechanisms of long-interval selectivity in midbrain auditory neurons: roles of excitation, inhibition, and plasticity[J]. Journal of Neurophysiology, 100(6): 3407-3416. DOI:10.1152/jn.90921.2008 |
Elie JE, Theunissen FE. 2018. Zebra finches identify individuals using vocal signatures unique to each call type[J]. Nature Communications, 9(1): 1-11. DOI:10.1038/s41467-017-02088-w |
Engel A. 2001. Dynamic predictions: oscillations and synchrony in top-down processing[J]. Nature Reviews Neuroscience, 2(10): 704-716. DOI:10.1038/35094565 |
Fang GZ, Chen Q, Cui JG, et al. 2012. Electroencephalogram bands modulated by vigilance states in an anuran species: a factor analytic approach[J]. Journal of Comparative Physiology A, 198(2): 119-127. DOI:10.1007/s00359-011-0693-y |
Fang GZ, Jiang F, Yang P, et al. 2014. Male vocal competition is dynamic and strongly affected by social contexts in music frogs[J]. Animal Cognition, 17(2): 483-494. DOI:10.1007/s10071-013-0680-5 |
Fang GZ, Yang P, Xue F, et al. 2015. Sound classification and call discrimination are decoded in order as revealed by event-related potential components in frogs[J]. Brain Behavior Evolution, 86(3-4): 234-245. |
Feng AS, Hall JC, Gooler DM. 1990. Neural basis of sound pattern recognition in anurans[J]. Progress in Neurobiology, 34(4): 313-329. DOI:10.1016/0301-0082(90)90008-5 |
Forlano PM, Deitcher DL, Bass AH. 2010. Distribution of estrogen receptor alpha mRNA in the brain and inner ear of a vocal fish with comparisons to sites of aromatase expression[J]. Journal of Comparative Neurology, 483(1): 91-113. |
Gooler DM, Feng AS. 1992. Temporal coding in the frog auditory midbrain: the influence of duration and rise-fall time on the processing of complex amplitude-modulated stimuli[J]. Journal of Neurophysiology, 67(1): 1-22. DOI:10.1152/jn.1992.67.1.1 |
Güntekin B, Basar E. 2016. Review of evoked and event-related delta responses in the human brain[J]. International Journal of Psychophysiology, 103(2016): 43-52. |
Haenschel C, Baldeweg T, Croft RJ, et al. 2000. Gamma and beta frequency oscillations in response to novel auditory stimuli: a comparison of human electroencephalogram (EEG) data with in vitro models[J]. Proceedings of the National Academy of Sciences, 97(13): 7645-7650. DOI:10.1073/pnas.120162397 |
Harmony T. 2013. The functional significance of delta oscillations in cognitive processing[J]. Frontiers in Integrative Neuroscience, 7(83): 1-10. |
Janik VM. 2000. Whistle matching in wild bottlenose dolphins (Tursiops truncatus)[J]. Science, 289(5483): 1355-1357. DOI:10.1126/science.289.5483.1355 |
Kahana MJ. 2006. The cognitive correlates of human brain oscillations[J]. Journal of Neuroscience, 26(6): 1669-1672. DOI:10.1523/JNEUROSCI.3737-05c.2006 |
Keller AS, Payne L, Sekuler R. 2017. Characterizing the roles of alpha and theta oscillations in multisensory attention[J]. Neuropsychologia, 99(2017): 48-63. |
Kim JA, Davis KD. 2021. Neural oscillations: understanding a neural code of pain[J]. Neuroscientist, 27(5): 544-570. DOI:10.1177/1073858420958629 |
Klimesch W. 1999. EEG alpha and theta oscillations reflect cognitive and memory performance: a review and analysis[J]. Brain Research Reviews, 29(2-3): 169-195. DOI:10.1016/S0165-0173(98)00056-3 |
Klimesch W. 2012. Alpha-band oscillations, attention, and controlled access to stored information[J]. Trends in Cognitive Sciences, 16(12): 606-617. DOI:10.1016/j.tics.2012.10.007 |
Klimesch W, Sauseng P, Hanslmayr S. 2007. EEG alpha oscillations: the inhibition-timing hypothesis[J]. Brain Research Reviews, 53(1): 63-88. DOI:10.1016/j.brainresrev.2006.06.003 |
Knyazev GG. 2007. Motivation, emotion, and their inhibitory control mirrored in brain oscillations[J]. Neuroscience and Biobehavioral Reviews, 31(3): 377-395. DOI:10.1016/j.neubiorev.2006.10.004 |
Knyazev GG, Slobodskaya HR. 2003. Personality trait of behavioral inhibition is associated with oscillatory systems reciprocal relationships[J]. International Journal of Psychophysiology, 48(3): 247-261. DOI:10.1016/S0167-8760(03)00072-2 |
Knyazev GG, Slobodskoj-Plusnin JY, Bocharov AV. 2009. Event-related delta and theta synchronization during explicit and implicit emotion processing[J]. Neuroscience, 164(4): 1588-1600. DOI:10.1016/j.neuroscience.2009.09.057 |
Krauzlis RJ, Bogadhi AR, Herman JP, et al. 2018. Selective attention without a neocortex[J]. Cortex, 102(2018): 161-175. |
Liu WR, Shen JX, Zhang YJ, et al. 2014. Auditory sexual difference in the large odorous frog Odorrana graminea[J]. Journal of Comparative Physiology A, 200(4): 311-316. DOI:10.1007/s00359-014-0885-3 |
Marmarelis PZ, Marmarelis VZ. 1978. The white noise method in system identification[M]// Marmarelis PZ, Marmarelis VZ. Analysis of physiological systems. Boston, USA: Springer.
|
Narins PM, Feng AS, Fay RR, et al. 2006. Hearing and sound communication in amphibians[M]. New York: Springer.
|
Sauseng P, Klimesch W. 2008. What does phase information of oscillatory brain activity tell us about cognitive processes?[J]. Neuroscience and Biobehavioral Reviews, 32(5): 1001-1013. DOI:10.1016/j.neubiorev.2008.03.014 |
Sauseng P, Klimesch W, Gruber WR, et al. 2008. Cross-frequency phase synchronization: a brain mechanism of memory matching and attention[J]. NeuroImage, 40(1): 308-317. DOI:10.1016/j.neuroimage.2007.11.032 |
Schrode KM, Buerkle NP, Brittan-Powell EF, et al. 2014. Auditory brainstem responses in Cope's gray treefrog (Hyla chrysoscelis): effects of frequency, level, sex and size[J]. Journal of Comparative Physiology A, 200(3): 221-238. DOI:10.1007/s00359-014-0880-8 |
Segura ET, De Juan A. 1966. Electroencephalographic studies in toads[J]. Electroencephalogrohy and Clinical Neurophysiology, 21(4): 373-380. DOI:10.1016/0013-4694(66)90043-5 |
Siniscalchi M, Lusito R, Vallortigara G, et al. 2013. Seeing left- or right-asymmetric tail wagging produces different emotional responses in dogs[J]. Current Biology, 23(22): 2279-2282. DOI:10.1016/j.cub.2013.09.027 |
Soltani ZH, Ghadiri T, Seyedi VM, et al. 2020. Theta oscillations through hippocampal/prefrontal pathway: importance in cognitive performances[J]. Brain Connectivity, 10(4): 157-169. DOI:10.1089/brain.2019.0733 |
Thut G, Miniussi C. 2009. New insights into rhythmic brain activity from TMS-EEG studies[J]. Trends in Cognitive Sciences, 13(4): 182-189. DOI:10.1016/j.tics.2009.01.004 |
Uhlhaas PJ, Haenschel C, Nikolić D, et al. 2008. The role of oscillations and synchrony in cortical networks and their putative relevance for the pathophysiology of schizophrenia[J]. Schizophrenia Bulletin, 34(5): 927-943. DOI:10.1093/schbul/sbn062 |
Vlgnal C, Mathevon N, Mottin S. 2004. Audience drives male songbird response to partner's voice[J]. Nature, 430(6998): 448-451. DOI:10.1038/nature02645 |
Wang W, Viswanathan S, Lee T, et al. 2016. Coupling between theta oscillations and cognitive control network during cross-modal visual and auditory attention: supramodal vs modality-specific mechanisms[J/OL]. PLoS ONE, 11(7): e0158465[2021-03-10]. https://doi.org/10.1371/journal.pone.0158465.
|
Wilczynski W, Endepols H. 2006. Central auditory pathways in anuran amphibians: the anatomical basis of hearing and sound communication[M]. New York: Springer.
|
Wrobel A, Ghazaryan A, Bekisz M, et al. 2007. Two streams of attention-dependent beta activity in the striate recipient zone of cat's lateral posterior-pulvinar complex[J]. Journal of Neuroscience, 27(9): 2230-2240. DOI:10.1523/JNEUROSCI.4004-06.2007 |
Xue F, Yue XZ, Fan YZ, et al. 2018. Auditory neural networks involved in attention modulation prefer biologically significant sounds and exhibit sexual dimorphism in anurans[J/OL]. Journal of Experimental Biology, 221(5): jeb167775[2021-03-10]. https://doi.org/10.1242/jeb.167775.
|
Yang P, Xue F, Cui JG, et al. 2018. Auditory sensitivity exhibits sexual dimorphism and seasonal plasticity in music frogs[J]. Journal of Comparative Physiology A, 204(12): 1029-1044. DOI:10.1007/s00359-018-1301-1 |
Yovanof S, Feng AS. 1983. Effects of estradiol on auditory evoked responses from the frog's auditory midbrain[J]. Neuroscience Letters, 36(3): 291-297. DOI:10.1016/0304-3940(83)90015-0 |
 2022, Vol. 41
2022, Vol. 41