扩展功能
文章信息
- 王桂英, 曹静, 赵志军
- WANG Guiying, CAO Jing, ZHAO Zhijun
- 热中性区临界温度对黑线仓鼠哺乳期能量收支的影响
- Effect of Critical Point Temperature of Thermal Neutral Zone on Energy Budget of Lactating Striped Hamsters
- 四川动物, 2021, 40(5): 481-488
- Sichuan Journal of Zoology, 2021, 40(5): 481-488
- 10.11984/j.issn.1000-7083.20210070
-
文章历史
- 收稿日期: 2021-03-01
- 接受日期: 2021-05-19
2. 温州大学生命与环境科学学院, 浙江温州 325035
2. College of Life and Environmental Science, Wenzhou University, Wenzhou, Zhejiang Province 325035, China
能量代谢的生理适应性调节是小型哺乳动物应对环境温度变化的最主要能量学策略之一,对提高生存适应能力具有重要意义(王德华,2011)。繁殖期是小型哺乳动物生活史的重要阶段,哺乳期是繁殖过程中能量摄入和支出效率最高的时期,母体显著增加摄食量以增加能量摄入,通过增加泌乳的能量支出以满足后代生长发育,哺乳期能量收支通常达到最大的状态(阈值),即最大能量收支受到了限制(Speakman & Król,2011)。
对哺乳期最大能量收支的限制因素和机制已有很多研究,"热耗散限制假说"认为哺乳期能量代谢率显著增加,释放"热"也显著增加,由于机体散热能力存在一定的限制,这将导致体温升高,暖温环境下由于体温与环境温度的温差减小,热传导降低,机体散热能力减弱,母体必须抑制哺乳期最大能量摄入和泌乳支出以降低体温异常升高的风险;而低温下动物的热传导率增加,打破了散热能力的限制,从而"准许"其提高能量摄入和代谢支出,从而使繁殖输出增加(Speakman & Król,2011)。Król和Speakman(2003)比较了低温(8 ℃)、室温(21 ℃)和暖温(30 ℃)下MF1小鼠Mus musculus的能量摄入和泌乳能量支出,发现与室温组相比,暖温组能量摄入和繁殖能量支出显著降低,而低温组显著增加。暖温(30 ℃)下哺育大胎仔数的布氏田鼠Lasiopodomys brandtii繁殖输出显著低于室温组(Wu et al., 2009)。这些研究结果均符合"热耗散限制假说"的预测。与此相反,哺乳期暴露于暖温(30 ℃)的黑线仓鼠Cricetulus barabensis,摄入能量显著降低,而繁殖输出未出现显著变化(Zhao,2011)。显然,这些研究结果并不一致,"热耗散限制假说"难以给出合理的解释。
温度是影响小型哺乳动物能量代谢的最主要环境因子之一。通常在一定温度范围内,动物代谢率可以维持在稳定的最低水平,此温度范围称为热中性区(thermal neutral zone,TNZ)(IUPS Thermal Commission,1987)。TNZ及其上、下临界点具有种属差异,也与动物生活史阶段和环境有关,其中,黑线仓鼠的TNZ范围较宽,即在较宽的温度范围内维持体温和代谢率的稳定,也许是暖温驯化的黑线仓鼠未出现"热耗散限制"的原因之一(Zhao et al., 2010a),但遗憾的是,TNZ特征与"热耗散限制"的内在联系和机制尚不清楚。
黑线仓鼠是栖息于我国华北地区农田和草原的主要啮齿动物之一,在自然环境下该鼠面临温度的季节性变化较大:夏季干燥炎热,冬季寒冷(张知彬,王祖望,1998;Zhao et al., 2010a;赵志军等,2014)。黑线仓鼠可通过增加能量摄入和代谢产热应对哺乳和低温环境的双重能量需求,其最大能量收支限制在5.0×基础代谢率(basal metabolic rate,BMR)(赵志军,2015);其TNZ为25~32.5 ℃(Zhao et al., 2014)。本研究将哺乳期黑线仓鼠分别暴露于TNZ上、下临界点温度,通过测定哺乳期体质量、能量收支、静息代谢率(resting metabolic rate,RMR)、热传导率(C),以及血清催乳素含量、褐色脂肪组织(brown adipose tissue,BAT)解偶联蛋白1(uncoupling protein 1,UCP1)mRNA表达等的变化,研究TNZ不同临界点温度下哺乳期最大能量摄入、静息代谢能量支出和繁殖输出的差异,深入理解催乳素和BAT UCP1在哺乳期最大能量收支和代谢产热中的调节作用。
1 材料方法 1.1 实验动物实验用黑线仓鼠为野生个体的繁殖后代(温州大学动物福利委员会,实验动物使用许可证号:WZU-048),动物用塑料盒(长29 cm×宽15 cm×高18 cm)饲养于聊城大学实验动物人工气候室,温度为21 ℃±1 ℃,光照周期为12 h∶ 12 h,饲喂标准鼠饲料(北京科奥协力饲料有限公司)。动物自由取食和饮水,塑料盒中加锯末作为巢材。取3.5~4.5月龄健康雌鼠30只(均为处女鼠),单笼饲养,与年龄相近的雄鼠配对。将19只妊娠的雌鼠隔离饲养,在哺乳期第5天将母鼠及其幼体随机分为2组:TNZ下临界点温度组(LP:25 ℃,n=10)和上临界点温度组(UP:32.5 ℃,n=9),随即分别暴露于相应的温度,至断乳(哺乳期第17天)。在此期间,每日测定体质量、摄食量、胎仔数和胎仔质量。
1.2 摄食量、摄入能、消化率和泌乳能量支出摄食量以当日添加饲料块质量扣除次日剩余量和饲养笼内残渣量来计算。在哺乳期第13~14天以食物平衡法测定摄入能和消化率(宋志刚,王德华,2001;余静欣等,2020)。收集食物残渣、垫料和粪便置于恒温干燥箱60 ℃烘至恒重,手工分离食物残渣和粪便并称量干重(精度0.001 g)。用氧弹热量仪(Parr 1281,Parr Instrument,USA)测定烘干后食物和粪便的热值。摄入能、消化能及消化率计算公式(Grodzinski & Wunder,1975;刘全生等,2010):摄入能(kJ/d)=摄食量(g/d)×饲料干物质含量(%)×食物能值(kJ/d)、消化能(kJ/d)=摄入能-粪便质量(g/d)×粪能(kJ/g)、消化率(%)=摄入能/消化能×100%。幼体的生长发育和活动行为等能量支出全部来自母乳,根据幼体的能量支出计算母体的泌乳能量支出(Król & Speakman,2003;Zhao et al., 2010b)。
1.3 RMR和热传导率RMR以开放式呼吸代谢仪(Sable System,美国) 测定,呼吸室气体流速为650~750 mL·min-1,气体经硅胶干燥后进入氧分析仪,气体二次抽样速率为150~175 mL·min-1,每10 s采集一次数据(STD-UI2,Sable System),以标准数据分析软件分析。RMR持续测定2.5 h,测定温度为30 ℃±0.5 ℃(TNZ温度; Zhao et al., 2010a),以5 min内连续稳定的最低耗氧速率的平均值作为RMR[mL O2/(g·h)]。C[mL O2/(g·h·℃)]=RMR[mL O2/(g·h)]/(Tb-Ta)(℃)计算,其中,Tb为体温,Ta为环境温度(战新梅,王德华,2004)。
1.4 催乳素RMR测定后,断颈处死动物,迅速分离肩胛间BAT和下丘脑,称重(精度0.001 g)后置于液氮中,转移低温冰箱(-80 ℃)备用。取血,自然凝集2 h后,离心(3 500 r·min-1)10 min,吸取血清,-80 ℃保存。用放射性免疫测定试剂盒测定血清催乳素含量(北京北方生物技术研究所),批内和批间测定变异系数均小于10%。
1.5 实时荧光定量PCR分析用TRIzol试剂(TaKaRa,China)提取BAT和下丘脑总RNA,以RNA为模板反转录合成cDNA,然后进行荧光定量PCR反应(Forrentrasse CH-6343 Rotkreuz, Switzerland),反应体系组成:模板cDNA 2 μL,SYBR Premix EX Tag TM(2×)10 μL,上、下游引物各0.4 μL,用DEPC水配足20 μL体系,反应程序为95 ℃ 30 s;95 ℃ 5 s,55 ℃ 30 s,40个循环;72 ℃ 30 s。UCP1上游引物:5'-GGGACCATCACCACCCTGGCAAAAA-3',下游引物:5'-GGCTTTCTGTTGTGGCTAT-3';下丘脑神经肽Y(neuropeptide Y,NPY)上游引物:5'-ACCCTCGCTCTGTCCCTG-3',下游引物:5'-AATCAGTGTCTCAGGGCTA-3';刺鼠相关蛋白(agouti-related protein,AgRP)上游引物:5'-TGTTCCCAGAGTTCCCAGGTC-3',下游引物:5'-ATTGAAGAAGCGGCAGTAGCAC-3';以actin为参照:上游引物:5'-CGTAAAGACCTCTATGCCAA-3',下游引物:5'-GCGCAAGTTAGGTTTTGTC-3'(Zhao et al., 2014)。
1.6 统计分析数据处理采用SPSS 21.0分析。经Kolmogorov-Smirnov检验,所有数据符合正态分布;体质量、摄食量、胎仔数和胎仔质量的组间差异以独立样本t检验进行统计分析。摄入能、消化能、消化率、RMR、泌乳能量支出(MEO)、热传导率,以及血清催乳素含量、BAT和下丘脑基因mRNA表达的组间差异也以独立样本t检验进行统计分析。文中数据以x±SE表示,显著性水平设置为α=0.05。
2 结果 2.1 TNZ临界温度对体质量和摄食量的影响哺乳期第5天,LP组和UP组体质量相近,温度的影响不显著(t17=0.54,P>0.05),但整个哺乳期体质量呈下降趋势,组间差异未达到显著水平(t17=1.51,P>0.05;图 1:A)。哺乳期第5天,摄食量组间差异不显著(t17=0.13,P>0.05;图 1:B),暴露于TNZ下临界点温度的显著升高,而暴露于TNZ上临界点温度的变化趋势不明显,自哺乳期第6天后,UP组显著低于LP组(t17=7.98,P<0.01),第14天,UP组比LP组低36.2%(t17=3.47,P<0.01)。
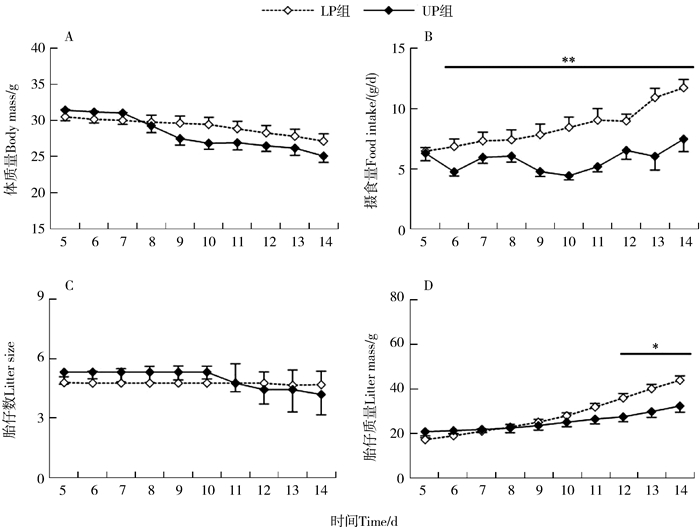
|
| 图 1 热中性区临界温度对黑线仓鼠哺乳期体质量(A)、摄食量(B)、胎仔数(C)和胎仔质量(D)的影响 Fig. 1 Effects of thermal neutral zone temperature (TNZ) on body mass (A), food intake (B), litter size (C) and litter mass (D) of lactating striped hamsters LP. 热中性区下临界点温度(25 ℃), UP. 热中性区上临界点温度(32.5 ℃); * P<0.05, ** P<0.01; 下同 LP. lower point of TNZ (25 ℃), UP. upper point of TNZ (32.5 ℃); * P < 0.05, ** P < 0.01; the same below |
| |
哺乳初期胎仔数组间差异不显著,LP组和UP组哺育幼体的数量相近(第5天:t17=1.71,P>0.05),整个哺乳期胎仔数未出现明显变化,LP组和UP组胎仔数相近,组间差异不显著(第6天:t17=1.03,P>0.05;第14天:t17=0.36,P>0.05;图 1:C)。哺乳期第5天,胎仔质量组间差异不显著(t17=0.01,P>0.05),暴露于TNZ下临界点温度的幼体显著增长,但暴露于TNZ上临界点温度的增长趋势变缓,自哺乳期第12天后,UP组显著低于LP组(第12天:t17=2.66,P<0.05;第14天:t17=3.31,P<0.05;图 1:D)。
2.3 TNZ临界温度对摄入能和消化率的影响温度对哺乳高峰期摄入能的影响显著,UP组比LP组低36.2%(t17=3.51,P<0.01;图 2:A)。粪能也受温度的显著影响,UP组表现出较低的粪能(t17=3.15,P<0.01;图 2:B)。与摄入能的变化相似,消化能的组间差异显著,UP组显著低于LP组(t17=3.42,P<0.01;图 2:C)。但消化率未受到温度的显著影响(t17=0.37,P>0.05;图 2:D)。
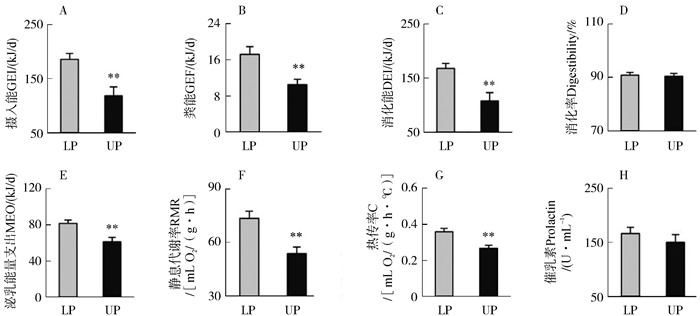
|
| 图 2 热中性区临界温度对黑线仓鼠哺乳期摄入能(A)、粪能(B)、消化能(C)、消化率(D)、泌乳能量支出(E)、静息代谢率(F)、热传导率(G)和血清催乳素水平(H)的影响 Fig. 2 Effects of thermal neutral zone temperature (TNZ) on gross energy intake (A), gross energy of feces (B), digestive energy intake (C), digestibility (D), milk energy output (E), resting metabolic rate (F), thermal conductance (G) and serum prolactin levels (H) of lactating striped hamsters LP. 热中性区下临界点温度(25 ℃), UP. 热中性区上临界点温度(32.5 ℃) LP. lower point of TNZ (25 ℃), UP. upper point of TNZ (32.5 ℃) |
| |
温度对泌乳能量支出的影响显著,与LP组相比, UP组降低了25.1%(t17=3.33,P<0.01;图 2:E)。RMR也受温度的显著影响,UP组显著低于LP组(t17=3.60,P<0.01;图 2:F)。热传导率组间差异达到显著水平,UP组显著低于LP组,受温度的影响显著(t17=3.54,P<0.01;图 2:G)。
2.5 TNZ临界温度对催乳素含量、BAT UCP1和下丘脑NPY mRNA表达的影响LP组和UP组血清催乳素水平相近,组间差异不显著,未受温度的显著影响(t17=0.86,P>0.05;图 2:H)。BAT UCP1 mRNA表达受温度的显著影响,UP组比LP组下调了42.9%(t17=2.14,P<0.05;图 3:A)。温度对下丘脑NPY和AgRp mRNA表达的影响未达到显著水平(NPY:t17=1.17,P>0.05,图 3:B;AgRp:t17=0.05,P>0.05,图 3:C)。

|
| 图 3 热中性区临界温度对黑线仓鼠哺乳期BAT UCP1(A)、下丘脑NPY(B)和AgRp(C)基因mRNA表达的影响 Fig. 3 Effects of thermal neutral zone temperature (TNZ) on the expressions of BAT UCP1 (A), hypothalamic NPY (B) and AgRp (C) of lactating striped hamsters LP. 热中性区下临界点温度(25 ℃),UP. 热中性区上临界点温度(32.5 ℃);BAT UCP1. 褐色脂肪组织解偶联蛋白1,NPY. 神经肽Y, AgRp. 刺鼠相关蛋白 LP. lower point of TNZ (25 ℃), UP. upper point of TNZ (32.5 ℃); BAT UCP1. brown adipose tissue uncoupling protein 1, NPY. neuropeptide Y, AgRp. agouti-related protein |
| |
哺乳期是小型哺乳动物繁殖期能量需求最高的阶段,许多动物会通过提高摄食量来满足能量需求的增加。本研究发现,LP组黑线仓鼠哺乳期摄食量显著增加,而UP组未显著增加,哺乳高峰期最大摄食量比LP组低36.2%,消化能和粪能也显著降低,研究结果支持"热耗散限制假说"。赵志军(2015)对比了低温(5 ℃)、室温(21 ℃)和暖温(30 ℃)下黑线仓鼠哺乳期能量摄入,发现暖温组和室温组的摄入能和繁殖输出差异不显著。Huang等(2020)发现哺育大胎仔数的母体能量收支在30 ℃下受到显著抑制,而哺育小胎仔数的未发生显著变化。然而,在30 ℃下小鼠哺乳期摄食量显著低于室温对照组(Król & Speakman,2003;Zhao et al., 2020)。显然,这些研究结果并不一致,原因可能在于动物的散热能力具有种间差异。与小鼠相比,黑线仓鼠的代谢率相对较高,因此散热能力对哺乳期最大能量收支限制的水平也较高(Wen et al., 2017),30 ℃暖温的环境未达到其限制水平。此外,30 ℃处于TNZ内,而本文设计的高温为32.5 ℃,恰好处于黑线仓鼠TNZ的上临界点,结合本研究结果,表明TNZ的上临界温度可能导致黑线仓鼠的"热耗散限制",动物散热能力导致的哺乳期最大能量收支限制是温度依赖性的,与动物所处的环境温度密切相关。
哺乳期能量摄入的增加主要用于满足能量需求,如BMR、行为活动或后代生长发育(通过泌乳)的能量支出等(Kenagy et al., 1990;赵志军, 2011, 2015)。在哺乳期最大能量收支受到限制的条件下,动物在自身维持和哺育后代之间存在权衡,通过降低维持将更多的能量分配于后代的生长发育,本研究发现UP组的RMR和泌乳能量支出显著低于LP组,导致幼体的体质量显著降低,这与"热耗散限制假说"的预测一致(Król & Speakman,2003),表明散热能力对最大能量收支限制水平与环境温度有关。
本研究中UP组的RMR和热传导率显著低于LP组,表明上临界温度使母体的热耗散能力受到抑制,导致机体面临体温异常升高的风险更大,因此母体必须降低能量代谢效率以减少代谢产热。此外,由于不同物种的TNZ及其上、下临界点温度存在明显差异,特定的环境温度对不同动物来讲意义不同。例如,Pan等(2014)研究发现,暴露于上临界点温度的长爪沙鼠Meriones unguiculatus的代谢产热显著降低。这些研究结果表明,TNZ上临界点温度对哺乳期动物的代谢水平和热传导率具有显著影响。
BAT是小型哺乳动物主要的产热来源,其线粒体密度高,线粒体内膜分布的UCP1使氧化和磷酸化解偶联,形成质子漏,发挥产热作用(叶祖承,蔡益鹏,1994;李庆芬等,2001)。本研究发现,UP组的BAT UCP1 mRNA表达显著低于LP组,表明高温环境下哺乳期动物的BAT产热受到抑制。已有研究发现,为防止体温上升,许多动物哺乳期代谢活性组织产热能力受到显著抑制,包括BAT质量显著减少,UCP1 mRNA表达显著下调,BAT产热显著降低(赵志军等,2014)。本研究表明,哺乳期BAT代谢产热活性也随温度升高而显著减弱,这与Pan等(2014)的研究结果相似,支持"热耗散限制假说"。
催乳素是一种由垂体前叶分泌的蛋白质激素,具有发动并维持泌乳的作用。幼体吸吮刺激会反射性增加催乳素的分泌(Rillema & Bell,2007)。本研究发现,UP组的黑线仓鼠血清催乳素水平与LP组相比未发生显著变化。而高温下小鼠尽量减少哺乳时的聚群效应,以防体温升高,表现为频繁中断哺乳,导致催乳素合成和分泌减少,被认为是"热耗散限制假说"的内分泌机制之一(Speakman & Król,2011;Zhao et al., 2016)。然而本研究结果与小鼠的不一致,暗示散热能力对最大能量收支影响的调节机制可能存在种间差异。催乳素参与下丘脑与摄食调控相关的神经肽(比如NPY和AgRp等)的表达(Friedman & Halaas,1998)。已有研究表明,哺乳期大鼠的NPY mRNA表达显著上调,暗示NPY在哺乳期发挥刺激摄食的重要作用(Malabu et al., 1994)。但本研究发现,黑线仓鼠下丘脑NPY和AgRp基因的mRNA表达在TNZ上、下临界点温度间无显著差异,表明高温下哺乳期最大能量收支的热耗散限制可能与下丘脑NPY和AgRp基因的mRNA表达无关。
总之,与LP组相比,UP组的黑线仓鼠热传导率显著降低、能量摄入和泌乳能量支出受到显著抑制,导致繁殖输出显著减少。UP组的BAT UCP1 mRNA表达显著下调,表明高温环境下哺乳的动物BAT产热受到抑制,研究结果支持"热耗散限制假说"。TNZ上、下临界点温度组间的血清催乳素水平、下丘脑NPY和AgRp基因的mRNA表达差异不显著,表明催乳素介导的神经内分泌调节机制可能未参与高温下黑线仓鼠哺乳期最大能量收支的热耗散限制。
李庆芬, 刘小团, 黄晨西, 等. 2001. 长爪沙鼠冷驯化中褐色脂肪组织产热活性及解偶联蛋白基因表达[J]. 动物学报, 47: 388-393. |
刘全生, 冯志勇, 龚鹏博, 等. 2010. 高纤维食物对黄毛鼠摄食和消化的影响[J]. 兽类学报, 30(3): 291-296. |
宋志刚, 王德华. 2001. 内蒙古草原布氏田鼠的最大同化能[J]. 兽类学报, 21: 271-278. DOI:10.3969/j.issn.1000-1050.2001.04.005 |
王德华. 2011. 我国哺乳动物生理生态学的一些进展和未来发展的建议[J]. 兽类学报, 31(1): 15-19. |
叶祖承, 蔡益鹏. 1994. 棕色脂肪的产热及其调控机制[J]. 生物化学和生物物理进展, 21: 135-139. |
余静欣, 邓光敏, 鲍雨帆, 等. 2020. 黑线仓鼠断乳后能量代谢和脂肪累积的适应性调节[J]. 兽类学报, 40(6): 595-605. |
战新梅, 王德华. 2004. 内蒙古浑善达克沙地小毛足鼠的能量代谢和体温调节[J]. 兽类学报, 24: 152-159. DOI:10.3969/j.issn.1000-1050.2004.02.011 |
张知彬, 王祖望. 1998. 农业重要害鼠的生态学及控制对策[M]. 北京: 海洋出版社.
|
赵志军, 曹静, 陈可新. 2014. 黑线仓鼠体重和能量代谢的季节性变化[J]. 兽类学报, 34(2): 149-157. |
赵志军. 2011. 黑线仓鼠繁殖输出与基础代谢率的关系[J]. 兽类学报, 31(1): 69-78. |
赵志军. 2015. 黑线仓鼠自身生存和繁殖输出间的权衡不受温度影响[J]. 兽类学报, 35(4): 359-368. |
Friedman JM, Halaas JL. 1998. Leptin and the regulation of body weight in mammals[J]. Nature, 395(6704): 763-770. DOI:10.1038/27376 |
Grodzinski W, Wunder BA. 1975. Ecological energetics of small mammals[M]//Golley EB, Petrusewiez K, Ryszkowski L. Small mammals: their productivity and copulation dynamics. Cambridge, UK: Cambridge University Press.
|
Huang YX, Li HH, Wang L, et al. 2020. The ability to dissipate heat is likely to be a more important limitation on lactation in striped hamsters with greater reproductive efforts under warmer conditions[J]. Physiology Biochemistry Zoology, 93(4): 282-295. DOI:10.1086/709538 |
IUPS Thermal Commission. 2001. Glossary of terms for thermal physiology[J]. Japanese Journal of Physiology, 51: 245-280. |
Kenagy GJ, Masman D, Sharbaugh SM, et al. 1990. Energy expenditures during lactation in relation to litter size in free-living golden mantled ground squirrels[J]. Journal of Animal Ecology, 59: 73-88. DOI:10.2307/5159 |
Król E, Speakman JR. 2003. Limits to sustained energy intake. Ⅶ. Milk energy output in laboratory mice at thermoneutrality[J]. Journal of Experimental Biology, 206: 4267-4281. DOI:10.1242/jeb.00675 |
Malabu UH, Kilpatrick A, Ware M, et al. 1994. Increased neuropeptide Y concentrations in specific hypothalamic regions of lactating rats: possible relationship to hyperphagia and adaptive changes in energy balance[J]. Peptides, 15(1): 83-87. DOI:10.1016/0196-9781(94)90174-0 |
Pan Q, Li M, Shi YL, et al. 2014. Lipidomics reveals mitochondrial membrane remodeling associated with acute thermoregulation in a rodent with a wide thermoneutral zone[J]. Lipids, 49(7): 715-730. DOI:10.1007/s11745-014-3900-0 |
Rillema JA, Bell AC. 2007. Effect of prolactin on inositol uptake in mouse mammary gland explants[J]. Endocrine, 31(1): 27-32. DOI:10.1007/s12020-007-0003-1 |
Speakman JR, Król E. 2011. Limits to sustained energy intake. XIII. Recent progress and future perspectives[J]. Journal of Experimental Biology, 214: 230-241. DOI:10.1242/jeb.048603 |
Wen J, Tan S, Qiao QG, et al. 2017. Sustained energy intake in lactating Swiss mice: a dual modulation process[J]. Journal of Experimental Biology, 220(Pt 12): 2277-2286. |
Wu SH, Zhang LN, Speakman JR., et al. 2009. Limits to sustained energy intake. XI. A test of the heat dissipation limitation hypothesis in lactating Brandt's voles (Lasiopodomys brandtii)[J]. Journal of Experimental Biology, 212: 3455-3465. DOI:10.1242/jeb.030338 |
Zhao ZJ, Cao J, Chi QS. 2010b. Milk energy output during peak lactation in shaved Swiss mice[J]. Physiology and Behavior, 101: 59-66. DOI:10.1016/j.physbeh.2010.04.017 |
Zhao ZJ, Cao J, Meng XL, et al. 2010a. Seasonal variations in metabolism and thermoregulation in the striped hamster (Cricetulus barabensis)[J]. Journal of Thermal Biology, 35: 52-57. DOI:10.1016/j.jtherbio.2009.10.008 |
Zhao ZJ, Chi QS, Liu QS, et al. 2014. The shift of thermoneutral zone in striped hamster acclimated to different temperatures[J/OL]. PLoS ONE, 9(1): e84396[2020-10-20]. https://doi.org/10.1371/journal.pone.0084396.
|
Zhao ZJ, Hambly C, Shi LL, et al. 2020. Late lactation in small mammals is a critically sensitive window of vulnerability to elevated ambient temperature[J]. Proceedings of the National Academy of Sciences of the United States of America, 117(39): 24352-24358. |
Zhao ZJ, Li L, Yang DB, et al. 2016. Limits to sustained energy intake. XXV: milk energy output and thermogenesis in Swiss mice lactating at thermoneutrality[J/OL]. Scientific Report, 6: 31626[2020-10-20]. https://www.nature.com/articles/srep31626.
|
Zhao ZJ. 2011. Energy budget during lactation in striped hamsters at different ambient temperature[J]. Journal of Experimental Biology, 214: 988-995. |
 2021, Vol. 40
2021, Vol. 40



