扩展功能
文章信息
- 史红全, 柏军鹏, 范俊功
- SHI Hongquan, BAI Junpeng, FAN Jungong
- 麻雀身体大小的性二态和基于身体量度的性别判定
- Sexual Size Dimorphism and Body Measurement Based Sex Identification of Eurasian Tree Sparrow
- 四川动物, 2021, 40(3): 261-269
- Sichuan Journal of Zoology, 2021, 40(3): 261-269
- 10.11984/j.issn.1000-7083.20210003
-
文章历史
- 收稿日期: 2021-01-04
- 接受日期: 2021-03-16
2. 南昌大学生命科学学院, 南昌 330031;
3. 中国科学院生态环境研究中心, 北京 100089
2. School of Life Sciences, Nanchang University, Nanchang 330031, China;
3. Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100089, China
性二态指同种生物两性个体除生殖器官之外的差异,包括身体大小、形状、颜色、生理和行为等(Barrows,2011)。在许多动物中,身体大小的不同是最明显的两性差异(Andersson,1994)。一些鸟类,特别是多配制鸟类,显示出明显的身体大小的性二态(Andersson,1994;Hartley,2007;Székely et al., 2007),而性单态鸟类(sexually monomorphic birds)很难通过形态、大小和羽色等特征判定性别。但越来越多的研究(Delestrade,2001;Berkunsky et al., 2009;Mónus et al., 2011;阮祥锋,溪波,2011;Nunes et al., 2013;Sáez-Gómez et al., 2017;胥帅帅等,2018)表明,性单态鸟类也存在着一定程度的身体大小和羽色的性二态。性二态的研究是探究鸟类的性选择和自然选择的切入点(Shine,1989;Björklund,1990;Andersson,1994;Owens & Hartley,1998;Székely et al., 2000, 2007;Blanckenhorn,2005)。同时,性二态的研究也能为性单态鸟类的野外快速性别判定提供依据(Berkunsky et al., 2009;阮祥锋,溪波,2011;Calabuig et al., 2011;柯娩娟等,2017;Sáez-Gómez et al., 2017)。因而,性二态一直是鸟类生态学研究重点关注的问题。
麻雀Passer montanus通常被认为是性单态鸟类(Summers-Smith,1988),胥帅帅等(2018)的研究显示麻雀两性既无显著的羽色差异,也无显著的身体大小差异,但赵正阶(2001)的记录显示麻雀存在羽色两性差异,更有不少研究表明麻雀存在身体大小的两性差异(ST. Louis & Barlow,1991;Heeb,2001;Mónus et al., 2011;Sun et al., 2016,2017)。
尽管麻雀身体大小的两性差异较小,但已有研究表明,通过身体量度构建的判别方程可以较准确判定其性别(Mónus et al., 2011)。这类探索为麻雀的野外性别生态研究快速准确判定性别提供了可能。判别方程的性别判定准确率受鸟类性二态程度、样本量等因素影响(Dechaume-Moncharmont et al., 2011)。一些研究(Sun et al., 2017;兰敏敏等,2018;赵文海等,2018)显示麻雀的身体大小随纬度和/或海拔的增大而增大,而身体大小的性二态程度随身体大小变化可能发生变化(Andersson,1994;Hartley,2007;Székely et al., 2007),因此不同地理区域麻雀身体大小的性二态程度很可能存在差异,而这种差异会影响判别方程对性别判定的准确率,限制了已有研究结果更广泛的应用,需在不同的地理区域进一步开展相关研究。然而,与麻雀数量多、分布广相比,麻雀性二态的资料和研究较少。因此,为了探究麻雀身体量度的两性差异和这种差异能否作为可靠的性别判定依据,2017—2018年每年的1—3月,在陇东学院校园捕捉并测量了67只麻雀的10个身体量度,解剖观察生殖腺鉴定了性别[采样工作得到了庆阳市林业局野生动物保护管理站的批准(庆市动管发[2017]03号),解剖实验得到陇东学院实验动物伦理审核部门的批准(批准文号:LAE20170003)],比较两性身体量度的差异,进而用判别分析法研究这些身体量度在性别判定中的准确率。
1 材料和方法 1.1 研究物种麻雀属雀形目Passeriformes,主要栖息在人居环境,以谷物、草子、种子、果实等为食(赵正阶,2001),在甘肃省庆阳市陇东学院校园(107°41′E,35°44′N,海拔1 380 m)是常见鸟类。
1.2 数据的收集麻雀在秋季完成一次完整的换羽(Lind et al., 2004;Pinowski et al., 2009),因此冬季捕捉可避免换羽影响麻雀的测量。新生的麻雀在次年3月后即可配对繁殖(Summers-Smith,1988),因而在1—3月捕捉的麻雀可全部视作成鸟。2017—2018年每年的1—3月,于繁殖前用雾网捕获67只麻雀。用电子天平(双杰PT200A,精度0.01 g)测量体质量(精度0.1 g),用直尺测量全长、左右翅长和尾长(精度1 mm)。用游标卡尺(哈量,精度0.02 mm)测量嘴峰长、嘴裂长、嘴裂宽、左右跗跖长、左右中趾长、左右后趾长(精度0.1 mm)。测量标准详细描述参照王香亭(1991)和Gosler(2004)。测量人员经过多次严格训练且所有测量均由同一人完成。在使用游标卡尺测量时,重复测量至连续的2个测量数据差在0.1 mm以内,记录最后一次测量的数据。
1.3 性别鉴定可通过行为观察、解剖观察、泄殖腔观察、分子生物学方法等鉴定性别,其中解剖观察法和分子生物学方法适合冬季鉴定性别。分子生物学方法鉴定性别经过相对复杂的实验过程和较长的时间,而解剖观察生殖腺鉴定性别快速准确。本研究样本还用于分子系统地理研究和解剖教学实验,故采取解剖观察法鉴定性别。
1.4 数据分析以左右翅长、左右跗跖长、左右中趾长、左右后趾长的均值分别作为该鸟的翅长、跗跖长、中趾长、后趾长。数据以x±SD表示。分别计算雄性和雌性身体量度的变异系数(coefficient of variation,CV),CV=SD/x,以此分析身体大小的性内变异程度。计算每个身体量度的性二态指数(sexual dimorphism index,SDI),SDI=100×(Xm-Xf)/Xf,式中,Xm和Xf分别是雄鸟和雌鸟身体量度的均值,以此分析麻雀的性二态程度(Lovich & Gibbons,1992)。
用Kolmogorov-Smirnov检验数据的分布型,用Levene统计量检验数据的方差同质性,结果表明所有的身体量度数据都符合正态分布且方差齐性,因此用多元方差分析(MANOVA)检验两性间总体的身体量度差异,用独立样本t-test比较两性间特定的身体量度差异。用Origin 2018绘制两性10个身体量度变量的频数分布,用以判断这些身体量度变量在两性间的重叠情况。对两性比较中差异显著的身体量度变量,用Pearson相关分析和偏相关分析检查其相关性,其中偏相关分析检验2个身体量度之间的相关性,控制其余身体量度变量。如2个或以上变量高度相关(相关系数≥0.8,P < 0.01),则判定t-test中t值最大的变量是两性最主要的身体量度差异(Sáez-Gómez et al., 2017)。
判别分析采用常用的形态测量判定鸟类性别的方法(Dechaume-Moncharmont et al., 2011)。用Box's M-test对两性样本进行组间协方差矩阵齐性检验,结果表明方差齐性。分别通过单变量判别分析和多变量判别分析构建性别判定模型,其中,多变量判别分析采用典型判别分析和逐步判别分析,从而比较2种方法对性别判定的准确性。构建的判别方程都是非标准化的判别函数。采用交叉验证检验判别方程对性别判定的准确性(Dechaume-Moncharmont et al., 2011;Mónus et al., 2011;阮祥锋,溪波,2011)。
使用SPSS 20.0处理分析数据,双尾检验,显著性水平设置为α=0.05。
2 结果通过解剖观察生殖腺鉴定性别,67只麻雀中31只雄性,36只雌性。
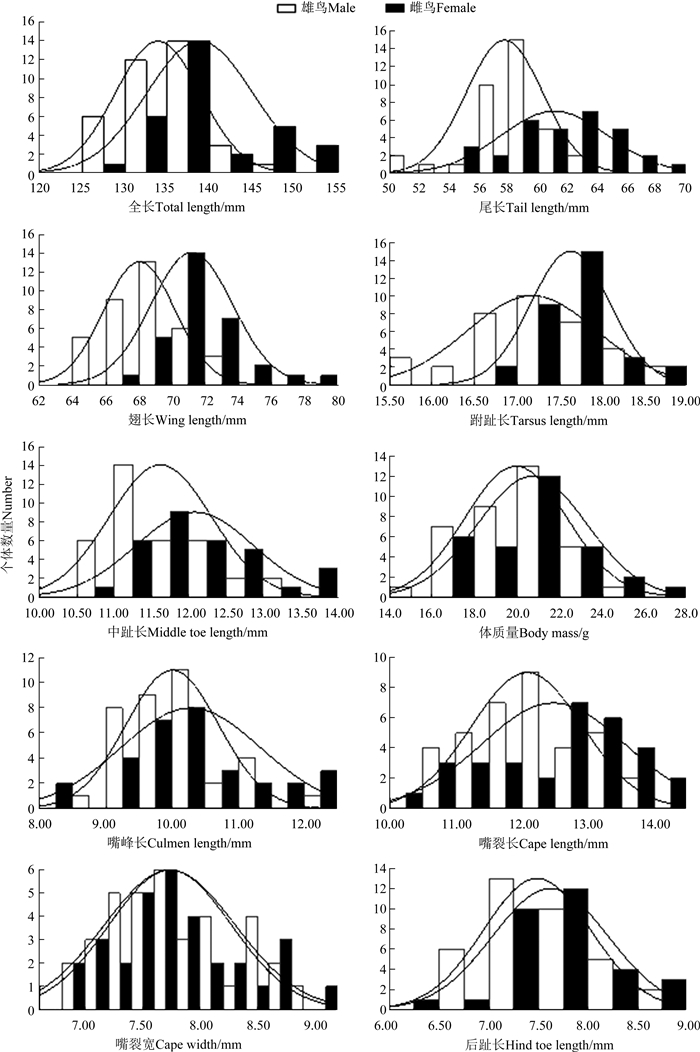
2.1 麻雀身体大小的性二态10个身体量度的性间比较显示,麻雀在总体上存在显著的身体大小两性差异(MANOVA:Pillai's Trace=0.492,F10, 56=5.426,P < 0.001),表明该种群存在显著的身体大小的性二态。雄鸟在全长、尾长、翅长、跗跖长和中趾长5个身体量度上均显著大于雌鸟,其中,翅长和尾长的性二态指数最大(表 1)。从变异系数看,身体量度存在较大的性内变异,其中体质量变异最大,而翅长变异最小(表 1)。麻雀身体量度存在一定的性间重叠,但翅长在两性间重叠最少(图 1)。
| 身体量度 | 雄性(n=31) | 雌性(n=36) | 雄性CV/% | 雌性CV/% | 性二态指数/% | t | P |
| 体质量/g | 20.7±2.6 | 19.9±2.4 | 12.4 | 12.0 | 3.8 | 1.263 | 0.211 |
| 全长/mm | 138.8±6.3 | 133.9±5.0 | 4.5 | 3.7 | 3.7 | 3.572 | 0.001 |
| 尾长/mm | 61.1±3.6 | 57.7±2.6 | 5.9 | 4.5 | 5.8 | 4.305 | < 0.001 |
| 翅长/mm | 71.2±2.5 | 68.0±2.2 | 3.5 | 3.2 | 4.7 | 5.602 | < 0.001 |
| 嘴峰长/mm | 10.3±1.1 | 10.0±0.7 | 10.3 | 7.0 | 2.8 | 1.249 | 0.217 |
| 嘴裂长/mm | 12.5±1.1 | 12.1±0.8 | 8.7 | 7.0 | 3.3 | 1.680 | 0.098 |
| 嘴裂宽/mm | 7.7±0.6 | 7.7±0.5 | 7.4 | 6.9 | 0 | -0.025 | 0.980 |
| 跗跖长/mm | 17.6±0.5 | 17.2±0.8 | 2.7 | 4.4 | 2.6 | 2.962 | 0.004 |
| 中趾长/mm | 12.1±0.8 | 11.6±0.7 | 6.5 | 5.9 | 3.9 | 2.541 | 0.013 |
| 后趾长/mm | 7.6±0.6 | 7.5±0.5 | 7.6 | 7.2 | 1.8 | 0.971 | 0.335 |
|
| 图 1 麻雀两性(雄鸟31只, 雌鸟36只)身体量度的频数分布 Fig. 1 Frequency distributions of body measurements of 31 male and 36 female Passer montanus |
| |
Pearson相关分析显示,5个身体量度变量间多存在显著的相关性,但偏相关分析显示只有翅长和尾长、翅长和跗跖长、尾长和中趾长之间显著相关,且所有的相关系数都小于0.5(表 2),小于设定的标准,因而不能判断哪个身体量度变量的差异是两性间最主要的。尽管相关系数较小,但翅长和尾长有极显著的偏相关(表 2)。
| 全长 | 尾长 | 翅长 | 跗跖长 | 中趾长 | ||||||
| r | rp | r | rp | r | rp | r | rp | r | rp | |
| 全长 | — | — | 0.331** | 0.221 | 0.256* | 0.047 | 0.324** | 0.219 | 0.109 | -0.037 |
| 尾长 | — | — | — | — | 0.467** | 0.327** | 0.314** | 0.077 | 0.393* | 0.322* |
| 翅长 | — | — | — | — | — | — | 0.424** | 0.311* | 0.242* | 0.065 |
| 跗跖长 | — | — | — | — | — | — | — | — | 0.155 | 0.021 |
| 中趾长 | — | — | — | — | — | — | — | — | — | — |
| 注:r为Pearson相关系数,rp为偏相关系数; *P < 0.05,**P < 0.01 Notes: r. Pearson correlation coefficient, rp. partial correlation coefficient; *P < 0.05, **P < 0.01 |
||||||||||
身体量度较大的性内变异和性间重叠使通过身体量度判定性别较为困难,但翅长等量度相对较小的性内变异和性间重叠为麻雀的性别判定提供了可能。用全部两性间比较差异显著的身体量度变量构建的典型判别方程为:DF1=0.075×全长+0.097×尾长+0.285×翅长+0.065×跗跖长+0.286×中趾长-40.233,逐步判别方程为:DF2=0.092×全长+0.364×翅长-37.803,对麻雀的性别判定准确率分别是82.1%和79.1%。单变量判别方程对麻雀性别的判定准确率都超过62%,其中翅长是判定性别最准确的单变量,能准确判定77.6%麻雀的性别,该判别方程为:DF=0.434×翅长-30.128(表 3)。
| 身体量度 | Wilks' lambda | df | P | 判别准确性/% | ||
| 雄鸟 | 雌鸟 | 所有 | ||||
| 全长 | 0.836 | 1 | 0.001 | 58.1 | 69.4 | 64.2 |
| 尾长 | 0.769 | 1 | < 0.001 | 64.5 | 80.6 | 73.1 |
| 翅长 | 0.674 | 1 | < 0.001 | 80.6 | 75.0 | 77.6 |
| 跗跖长 | 0.888 | 1 | 0.006 | 64.5 | 61.1 | 62.7 |
| 中趾长 | 0.910 | 1 | 0.013 | 58.1 | 69.4 | 64.2 |
| DF1 | 0.559 | 5 | < 0.001 | 80.6 | 83.3 | 82.1 |
| DF2 | 0.603 | 2 | < 0.001 | 77.4 | 80.6 | 79.1 |
| 注:DF1为包括全长、尾长、翅长、跗跖长和中趾长的非标准化的典型判别方程,DF2为包括全长和翅长的非标准化的逐步判别方程 Notes: DF1 is unstandardized canonical discriminant equation calculated by total length, tail length, wing length, tarsus length and middle toe length, DF2 is unstandardized stepwise discriminant function equation calculated by total length and wing length |
||||||
研究比较了麻雀雄鸟和雌鸟的10个身体量度,发现总体上存在显著的身体大小两性差异,雄鸟的全长、尾长、翅长、跗跖长和中趾长5个身体量度均显著大于雌鸟,其中,翅长和尾长是麻雀两性间最显著的差异。结果表明,本研究的麻雀种群存在较显著的身体大小的性二态。这与已有的很多麻雀性二态的研究结果(ST. Louis & Barlow,1991;Heeb,2001;Mónus et al., 2011;Sun et al., 2016,2017)一致。胥帅帅等(2018)的研究发现,无论是在非繁殖季节还是繁殖季节,麻雀总体上都没有显著的身体大小的两性差异,但该研究并未分析单个身体量度上是否存在两性差异。对胥帅帅等(2018)的数据进一步分析发现,无论是非繁殖季(t=3.393,P=0.002)还是繁殖季(t=2.502,P=0.019),麻雀的翅长都存在显著的两性差异。综上,麻雀存在一定程度的身体大小的性二态。样本量越大,统计检验功效越大,上述研究的差异可能和样本量有关。Mónus等(2011)的研究样本量(54只雄鸟和58只雌鸟)最大,本研究的样本量(31只雄鸟和36只雌鸟)次之,而胥帅帅等(2018)研究的样本量(非繁殖季12雄和17雌;繁殖季10雄和19雌)最小。此外,胥帅帅等(2018)研究的麻雀来自人工饲养的种群,而本研究和Mónus等(2011)研究的麻雀均来自野生种群。人工饲养可能对麻雀两性羽色产生影响(胥帅帅等,2018),也可能对麻雀两性身体大小的生长发育有影响。
包括本研究在内的一些研究(Heeb,2001;Mónus et al., 2011;Sun et al., 2016,2017;胥帅帅等,2018)都检验出翅长在麻雀两性间存在显著的差异。在一些麻雀的近缘种中,如家麻雀Passer domesticus(Moreno-Rueda, 2003, 2005)、黑顶麻雀Passer ammodendri(赵青山,2012)、死海麻雀Passer moabiticus(Yosef et al., 2004),其翅长也都存在显著的两性差异。翅长的差异可能是麻雀属Passer鸟类最主要的身体大小的两性差异,可能受到了相同选择压力的影响。翅的形状和大小与鸟类的飞翔能力密切相关(Videler,2005)。家麻雀的逃避捕捉研究显示,长翅个体更难被捕捉到,但逃避捕捉的能力与性别无关(Moreno-Rueda,2003)。尾长和翅长对逃避捕捉起到相反的作用,而在翅长和尾长上,家麻雀的雄鸟均显著大于雌鸟(Moreno-Rueda, 2003, 2005),这可能是造成研究中发现逃避捕捉能力与性别无关的原因。本研究发现,麻雀雄鸟的翅长和尾长显著大于雌鸟,但飞翔能力和逃避能力的两性差异尚未研究。
解释鸟类身体大小的性二态有4种主要假说(Székely et al., 2007):婚配竞争假说(mating-competition hypothesis)、活动敏捷性假说(display-agility hypothesis)、资源分化假说(resource-division hypothesis)和繁殖力假说(fecundity hypothesis)。其中活动敏捷性假说和繁殖力假说预测产生较小的雄性或较大的雌性,从而降低两性差异程度,与麻雀雄鸟显著大于雌鸟的事实不符。而资源分化假说预测雌雄在一起觅食的鸟类,为避免两性间的竞争,进化塑造两性身体大小的差异以产生营养结构、觅食行为的差异(Selander,1966;Shine,1989),如喙的大小的差异。已有研究表明,翅长是麻雀主要的两性差异,而喙的大小(宽度)存在一定的两性差异(Mónus et al., 2011),或没有显著的两性差异(胥帅帅等,2018;本研究),喙的咬合力也没有显著的两性差异(霍娟等,2016)。上述情况表明,资源分化假说不能很好解释麻雀身体大小的两性差异。婚配竞争假说,即雄-雄竞争常会塑造动物明显的两性差异(Andersson,1994;Owens & Hartley,1998;Székely et al., 2007)。对家麻雀的研究发现,雄性在体质量、翅长和尾长上明显大于雌性,并且显现出选型交配(assortative mating)模式(Moreno-Rueda,2003),表明婚配竞争可能是导致家麻雀性二态的重要原因。目前尚无与麻雀身体大小性二态进化机制相关研究报道。
3.2 性别判定基于身体量度构建的判别分析被广泛应用于性单态鸟类的性别判定(Berkunsky et al., 2009;Mónus et al., 2011;阮祥锋,溪波,2011;柯娩娟等,2017;Sáez-Gómez et al., 2017)。本研究构建的判别方程能较准确判定麻雀的性别,其中翅长构建的单变量判别方程对性别判别准确率为77.6%,而全长和翅长构建的逐步判别方程能准确识别79.1%的麻雀性别。Mónus等(2011)对性别判别准确率高于本研究,但2个研究都发现翅长在判别分析中的重要作用,甚至Mónus等(2011)显示翅长构建的单变量判别方程在所有的判别方程中具有最高的判别准确率。性二态程度越大,样本量越大,性别判别准确率越高(Dechaume-Moncharmont et al., 2011)。样本量大小的差异可能是造成2个研究性别判别准确率差异的主要原因。
可靠和方便的性别判定方法对于进一步研究麻雀这类性单态鸟类性别相关的生态问题非常重要。对于麻雀这种两性身体量度差异不大的所谓性单态鸟类,提高研究的样本量是构建更准确的判别方程最合适的途径。本研究提供了相对可靠的性别判定参考,但要在相关的研究中应用,应做更深入的研究。
本研究在小空间范围(校园内)和时间范围(1—3月)研究了麻雀的性二态和性别判定,考虑到麻雀数量大、分布广、变异多的特点,显然需要更多、更广、更深入的研究。同时,麻雀的这一特点也使得麻雀非常适合作为鸟类生态学的研究对象,在不同的地域和环境中的研究结果可以相互比较,可以为一些生态问题,如身体大小的海拔和纬度变异、性二态的地理变异等,提供更好的洞见。然而,至今对麻雀的了解仍不多,亟待开展更多的研究。
致谢: 感谢信瑞航、马龙、李万有等同学协助采集数据,感谢贾海燕老师在论文修改中提供的建议。
霍娟, 粟通萍, 陈光平, 等. 2016. 两种近缘鸟种麻雀和山麻雀的咬合力比较[J]. 动物学杂志, 51(5): 771-776. |
柯娩娟, 张守栋, 马强, 等. 2017. 基于形态特征判定五种鹬类性别的可靠性[J]. 动物学杂志, 52(4): 555-564. |
兰敏敏, 范龙梅, 刘方庆, 等. 2018. 树麻雀表型的环境适应进化[J]. 生态学报, 38(4): 1392-1400. |
阮祥锋, 溪波. 2011. 发冠卷尾性别判定的初步研究[J]. 动物学杂志, 46(5): 146-150. |
王香亭. 1991. 甘肃脊椎动物志[M]. 兰州: 甘肃科学技术出版社.
|
胥帅帅, 邓竹青, 陈功, 等. 2018. 麻雀两性羽色的比较[J]. 动物学杂志, 53(5): 693-700. |
赵青山. 2012. 安西黑顶麻雀生活史特征研究[D]. 兰州: 兰州大学.
|
赵文海, 刘方庆, 文陇英. 2018. 四川盆地的陆地岛屿效应——基于树麻雀的形态变异[J]. 四川动物, 37(2): 172-178. |
赵正阶. 2001. 中国鸟类志(下卷)[M]. 长春: 吉林大学出版社.
|
Andersson M. 1994. Sexual selection[M]. Princeton: Princeton University Press.
|
Barrows EM. 2011. Animal behavior desk reference: a dictionary of animal behavior, ecology, and evolution(3rd ed)[M]. Boca Raton: CRC Press.
|
Berkunsky I, Mahler B, Reboreda JC. 2009. Sexual dimorphism and determination of sex by morphometries in blue-fronted Amazons (Amazona aestiva)[J]. Emu, 109(3): 192-197. DOI:10.1071/MU08072 |
Björklund M. 1990. A phylogenetic interpretation of sexual dimorphism in body size and ornament in relation to mating system in birds[J]. Journal of Evolutionary Biology, 3: 171-183. DOI:10.1046/j.1420-9101.1990.3030171.x |
Blanckenhorn WU. 2011. Behavioral causes and consequences of sexual size dimorphism[J]. Ethology, 111(11): 977-1016. |
Calabuig CP, Green AJ, Ferrer M, et al. 2011. Sexual size dimorphism and sex determination by morphometric measurements in the Coscoroba swan[J]. Studies on Neotropical Fauna and Environment, 46(3): 177-184. DOI:10.1080/01650521.2011.617545 |
Dechaume-Moncharmont FX, Monceau K, Cezilly F. 2011. Sexing birds using discriminant function analysis: a critical appraisal[J]. The Auk, 128(1): 78-86. DOI:10.1525/auk.2011.10129 |
Delestrade A. 2001. Sexual size dimorphism and positive assortative mating in alpine choughs (Pyrrhocorax graculus)[J]. The Auk, 118(2): 553-556. DOI:10.1093/auk/118.2.553 |
Gosler A. 2004. Bird in the hand[M]//Sutherland WJ, Newton I, Green R. Bird ecology and conservation: a handbook of techniques. Oxford: Oxford University Press.
|
Hartley IR. 2007. Sexual dimorphism[M]//Jamieson BGM. Reproductive biology and phylogeny of birds, part b. Boca Raton: CRC Press.
|
Heeb P. 2001. Pair copulation frequency correlates with female reproductive performance in tree sparrows Passer montanus[J]. Journal of Avian Biology, 32: 120-126. DOI:10.1034/j.1600-048X.2001.320204.x |
Lind J, Gustin M, Sorace A. 2004. Compensatory bodily changes during moult in tree sparrows Passer montanus in Italy[J]. Ornis Fennica, 81(2): 75-83. |
Lovich JE, Gibbons JW. 1992. A review of techniques for quantifying sexual size dimorphism[J]. Growth Development and Aging, 56: 269-281. |
Mónus F, Szabó K, Lózsa A, et al. 2011. Intersexual size and plumage differences in Passer montanus-a morphological study based on molecular sex determination[J]. Acta Zoologica Academiae Scientiarum Hungaricae, 57: 269-276. |
Moreno-Rueda G. 2003. The capacity to escape from predators in Passer domesticus: an experimental study[J]. Journal of Ornithology, 144(4): 438-444. |
Moreno-Rueda G. 2005. Sexual size dimorphism and assortative mating for morphological traits in Passer domesticus[J]. Journal of Ethology, 24(3): 227-230. |
Nunes GT, Leal GDR, Campolina C, et al. 2013. Sex determination and sexual size dimorphism in the red-billed tropicbird (Phaethon aethereus) and white-tailed tropicbird (P. lepturus)[J]. Waterbirds, 36(3): 348-352. DOI:10.1675/063.036.0312 |
Owens IPF, Hartley IR. 1998. Sexual dimorphism in birds: why are there so many different forms of dimorphism?[J]. Proceedings of the Royal Society of London B: Biological Sciences, 265(1394): 397-407. DOI:10.1098/rspb.1998.0308 |
Pinowski J, Pinowsk AB, Zduniak P, et al. 2009. Autumn sexual display in tree sparrows (Passer montanus L.) as a component of the winter survival strategy[J]. Polish Journal of Ecology, 57(1): 159-169. |
Sáez-Gómez P, Camacho C, Álvarez A, et al. 2017. Sexual dimorphism and sex determination in black-necked grebes Podiceps nigricollis: on the need to account for geographical variation in morphology and sex ratio[J]. Bird Study, 64(4): 502-512. DOI:10.1080/00063657.2017.1410096 |
Selander RK. 1966. Sexual dimorphism and differential niche utilization in birds[J]. Condor, 68(2): 113-151. DOI:10.2307/1365712 |
Shine R. 1989. Ecological causes for the evolution of sexual dimorphism: a review of the evidence[J]. The Quarterly Review of Biology, 64(4): 419-461. DOI:10.1086/416458 |
ST. Louis VL, Barlow JC. 1991. Morphometric analyses of introduced and ancestral populations of the tree sparrow[J]. The Wilson Journal of Ornithology, 103: 1-12. |
Summers-Smith JD. 1988. The sparrows: a study of the genus Passer[M]. London: T & AD Poyser.
|
Sun YF, Li M, Song G, et al. 2017. The role of climate factors in geographic variation in body mass and wing length in a passerine bird[J]. Avian Research, 8(1): 1-9. DOI:10.1186/s40657-016-0059-9 |
Sun YF, Ren ZP, Wu YF, et al. 2016. Flying high: limits to flight performance by sparrows on the Qinghai-Tibet Plateau[J]. Journal of Experimental Biology, 219: 3642-3648. |
Székely T, Lislevand T, Figuerola J. 2007. Sexual size dimorphism in birds[M]//Fairbairn DJ, Blanckenhorn W, Székely T. Sex, size and gender roles: evolutionary studies of sexual size dimorphism. Oxford: Oxford University Press.
|
Székely T, Reynolds JD, Figuerola J. 2000. Sexual size dimorphism in shorebirds, gulls, and alcids: the influence of sexual and natural selection[J]. Evolution, 54(4): 1404-1413. DOI:10.1111/j.0014-3820.2000.tb00572.x |
Videler J. 2005. Avian flight[M]. Oxford: Oxford University Press.
|
Yosef R, Zduniak P, Tryjanowski P. 2004. Age, sex and season related biometrics of the Dead Sea sparrow (Passer moabiticus)[J]. Ardeola Revista Ibeérica De Ornitología, 51(2): 297-302. |
 2021, Vol. 40
2021, Vol. 40




