扩展功能
文章信息
- 张芬熙, 董自梅, 陈广文, 刘德增
- ZHANG Fenxi, DONG Zimei, CHEN Guangwen, LIU Dezeng
- 日本三角涡虫体内Djcullin1基因和Djtinp1基因的相互作用研究
- Study on the Interaction of Djcullin1 and Djtinp1 Genes in Planarian Dugesia japonica
- 四川动物, 2021, 40(2): 142-149
- Sichuan Journal of Zoology, 2021, 40(2): 142-149
- 10.11984/j.issn.1000-7083.20200247
-
文章历史
- 收稿日期: 2020-06-27
- 接受日期: 2021-01-11
2. 新乡医学院基础医学院, 河南新乡 453003
2. Basic Medical College of Xinxiang Medical College, Xinxiang, Henan Province 453003, China
涡虫是动物界最早出现的两侧对称、具有三胚层的类群,在动物系统演化过程中占有重要地位,日本三角涡虫Dugesia japonica是涡虫纲Turbellaria的代表动物(张合彩等,2009)。涡虫由于具有很强的再生能力,被广泛地用于再生生物学研究。Cullin1是泛素连接酶复合体的重要组成分子,对复合体的形成起关键调节作用(Chen et al., 2015)。Cullin1可通过调控细胞周期进程从G1期到G0期转变,进而调控细胞的增殖与凋亡(Johnston et al., 2005)。Strand等(2018)发现Smedcullin1基因在地中海涡虫Schmidtea mediterranea中阳性表达,敲减Smedcullin1基因可抑制涡虫体内细胞分化以及神经系统再生,并导致地中海涡虫再生缺陷。
泛素蛋白酶体途径对细胞内错误折叠蛋白的降解具有重要的调节作用,且参与胞内关键生理进程,Cullin1参与构成Skp1-Cullin1-F-box(CF)复合体,是泛素E3连接酶的重要组成部分,SCF复合体可以与携带泛素分子的E2酶相互识别,参与泛素化过程中底物的识别并招募(Skaar et al., 2013;杨杨杨等,2015)。Cullin1是经典TGF-β信号通路中Smad2/3的抑制因子,有可能通过TGF-β信号通路在涡虫再生过程中发挥一定调控作用。
Chen和Xu(2017)利用二维电泳鉴定三角涡虫尾部再生过程中蛋白质组学的变化,发现TGF-β及其下游信号Smad4在涡虫尾部再生过程中明显升高,提示TGF-β信号通路可能在涡虫尾部再生过程中发挥重要作用。Ermakov等(2014)利用药物抑制剂干预TGF-β和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MEK)可明显抑制地中海涡虫头部再生以及干细胞增殖,提示TGF-β信号通路可能参与涡虫头部的再生。
TGF-β诱导核蛋白1基因(TGF-β-inducible nuclear protein 1,tinp1)是近期在研究毛细胞白血病的抑癌基因过程中被发现的,因此又被命名为毛细胞白血病蛋白1基因(hairy cell leukemia protein 1,hclp1)。tinp1基因是酵母nsa2基因的同源物,Nsa2蛋白被证明是核糖体生物发生的限制因子及细胞增殖必需因子,亦被认为是从酵母到人类最保守的蛋白之一(Lebreton et al., 2006;Zhang et al., 2010)。相关研究显示,在白血病病人体内或人白血病细胞中,TGF-β的活化可诱导Tinp1表达上调(Even et al., 2019)。此外,Shahni等(2013)的研究还显示,给予体外培养的系膜细胞外源性TGF-β1不仅可以增强Tinp1 mRNA/protein在细胞内的表达水平,还可影响其在细胞内的分布与定位,诱导细胞浆内的Tinp1蛋白迅速向细胞核内迁移。Sun等(2019)研究显示,敲减smad4基因可抑制TGF-β信号通路,进而降低涡虫体内tinp1基因的表达,抑制涡虫中枢神经系统的再生。上述研究进展提示,TGF-β信号通路可以通过调控tinp1参与涡虫再生。
日本三角涡虫中cullin1基因(Djcullin1)和tinp1基因(Djtinp1)二者之间是否存在关系,是否可以通过TGF-β信号通路发生作用,当前仍不清楚。因此,本研究通过敲减日本三角涡虫体内Djcullin1基因,研究TGF-β信号通路smad2/3(Djsmad2/3)、smad4(Djsmad4)和Djtinp1等基因及蛋白在涡虫体内的表达,然后又敲减Djtinp1基因,研究Djcullin1基因及蛋白在涡虫体内的表达,从而推断Djcullin1和Djtinp1基因在涡虫中的相互作用关系。
1 材料与方法 1.1 日本三角涡虫的来源与饲养日本三角涡虫采自河南省鹤壁市鱼泉泉水。采集后利用鱼泉泉水于20 ℃恒温培养箱中避光养殖,第2天换掉一半鱼泉泉水,加入一半曝气的自来水,第3天全部用曝气的自来水,以后每日于曝气自来水中培养,每7 d左右喂食新鲜牛肝匀浆1次,喂食2 h后换曝气自来水。
1.2 RNAi干扰涡虫体内Djcullin1和Djtinp1 基因将Djcullin1或Djtinp1基因的目的片段通过双酶切法与L4440载体相连接,转入大肠杆菌HT115感受态细胞,通过在培养基中添加IPTG诱导目的基因双链RNA的合成后,将菌种离心沉淀后混合在1 mL牛肝匀浆中,通过喂食达到干扰目的,对照组涡虫喂食未转染目的基因的HT115菌液。每隔1 d干扰喂食1次,共喂食6次,每天更换曝气自来水,实验处理前饥饿涡虫1周。
1.3 总RNA的提取取干扰后饥饿1周的涡虫,用灭菌水和DEPC水依次冲洗涡虫3遍,转入无RNA酶的EP管中,加入1 mL Trizol,-80 ℃冷冻1 h,而后轻柔吹打,待涡虫完全溶解后,4 ℃ 12 000 r·min-1离心5 min。取上清850 μL,加入200 μL氯仿,混匀后室温静置5 min,4 ℃ 12 000 r·min-1离心15 min。离心后,取上层无色水相(约300 μL),与等量异丙醇混匀,室温静置10 min,而后4 ℃ 12 000 r·min-1离心10 min,弃上清,利用1 mL 75%乙醇洗涤沉淀RNA 2次。离心后,室温干燥5 min,加入30 μL DEPC水溶解RNA沉淀。
1.4 实时荧光定量PCR(qPCR)利用DNA Synthesis Kit(TaKaRa)试剂盒说明书进行cDNA合成,Nanodrop检测cDNA浓度,具体步骤参见程方方(2016)。利用ABI PRISM 7500实时荧光定量PCR仪器(Applied Biosystems)、SYBR Green qPCR Master Mix (TaKaRa)和1 μg cDNA进行PCR,反应体系50 μL。采用2-ΔΔCt法分别计算Djcullin1和Djtinp1 mRNA的相对表达量,每个实验重复3次,每次6只涡虫(表 1)。引物见表 1。
| 引物作用 | 引物名称 | 引物方向 | 引物序列(5’-3’) |
| qPCR | Djcullin1 | Forward | CCTTGGTGGCTTGGACAGAG |
| Reverse | CTTCCTCCAATTCTACCAACCTC | ||
| Djtinp1 | Forward | CTTTCAGAGTTCAGCGTAGTGGT | |
| Reverse | TGGCTCGTTTTAATCTCAATGC | ||
| Djsmad2/3 | Forward | ATTGTTGAATGACTTGTCTGCTGT | |
| Reverse | CTGATGTAAAGGCGTCACCAAC | ||
| Djsmad4 | Forward | TTCCATGAATAATCTTAGTGCGG | |
| Reverse | GACGAGGATAATCAGGACCCC | ||
| RNAi | Djcullin1 | Forward | GCTCTAGATTTAATACTGCACATACTGGACG |
| Reverse | GGGGTACCGGACACTTGTGGATTGAACTTG | ||
| Djtinp1 | Forward | GCTCTAGATTGAGACTGTCGTTGGAGATATTC | |
| Reverse | GGGGTACCATTGCATTACAACAACCCTCATT | ||
| Probe | Djsmad2/3 | Forward | TTAATTCCAGGATCTGTAGAACC |
| Reverse | GATCACTAATACGACTCACTATAGGGGATGTAAAGGCGTCACCAAC | ||
| Djsmad4 | Forward | TCCACTAAAAGCCAGAGTATGC | |
| Reverse | GATCACTAATACGACTCACTATAGGGATACATCCCCTTCACCTACATT | ||
| Djcullin1 | Forward | TTTAATACTGCACATACTGGACG | |
| Reverse | GATCACTAATACGACTCACTATAGGGGGACACTTGTGGATTGAACTTG | ||
| Djtinp1 | Forward | TTGAGACTGTCGTTGGAGATATTC | |
| Reverse | GATCACTAATACGACTCACTATAGGGATTGCATTACAACAACCCTCATT |
按Cheng等(2015)的方法对涡虫进行整体原位杂交染色,分别检测Djcullin1和Djtinp1的表达。每组选取6条涡虫,2%盐酸处死后,4%多聚甲醛固定,梯度甲醇脱水,H2O2漂白过夜。第2天梯度甲醇复水,蛋白酶K室温孵育10 min,然后4%多聚甲醛固定20 min。用含探针的杂交液(1∶400)处理涡虫16 h。MABT洗涤2次后,马血清封闭2 h。加入马血清稀释的Antibody solution(1∶ 2 000)4 ℃过夜。MABT洗涤后,NBT/BCTP显色。
1.6 Western Blotting干扰喂食涡虫结束后再饥饿7 d,将涡虫组织研磨碎,并提取蛋白。采用蛋白提取试剂盒,其中含有20 mL 5×裂解缓冲液、0.5 mL蛋白酶抑制剂、0.5 mL磷酸酶抑制剂和0.5 mL苯甲基磺酰氟[宝生物工程(大连)有限公司]。用标准的Bradford蛋白测定法测定蛋白浓度。后续试验参考Zhang等(2019)进行Western Blotting分析。电泳后将蛋白转移到PVDF膜上。在TBS-T中,用5%BSA或5%脱脂奶(生产商说明)将膜封住,然后4 ℃环境样本与Smad2/3(CST,8685s)、Smad4(BIOSS,bs-23966r)、Cullin1(Servicebio,PA1557);Tinp1(Signalway,29601)及β-actin(Servicebio,GB1 2001)抗体(1∶ 100)孵育过夜后在室温下用酶标二抗(1∶ 3 000)对印迹孵育1 h。增强化学发光检测免疫反应条带。
1.7 统计学分析实验数据均以x ±SD表示,用SPSS 13.0进行分析,组间比较采用t检验分析,显著性水平设置为α=0.05。
2 结果 2.1 Djcullin1和Djtinp1基因干扰效果喂食未转染目的基因HT115菌液的涡虫为对照组。喂食含Djcullin1基因或Djtinp1基因的目的片段的TH115菌液的涡虫为干扰组。在基因干扰结束后,利用qPCR及整体原位杂交技术检测Djcullin1基因干扰组和对照组涡虫体内Djcullin1基因的表达,检测Djtinp1基因干扰组和对照组涡虫体内Djtinp1基因的表达,验证2个基因的干扰效果。与对照组比较,Djcullin1基因干扰组涡虫体内Djcullin1基因的mRNA表达明显降低(图 1:A,C),Djtinp1基因干扰组涡虫体内Djtinp1基因的mRNA表达也显著降低(图 1:B,D),这说明2个基因敲减成功。

|
| 图 1 涡虫Djcullin1基因和Djtinp1基因干扰效果 Fig. 1 Knockdown of Djcullin1 gene and Djtinp1 gene A, B. qPCR结果显示2个基因干扰效果; C, D. 整体原位杂交结果显示2个基因干扰效果, 标尺=500 μm Interference effects of Djcullin1 gene and Djtinp1 gene as determined by qPCR (A, B) and whole-mount in situ hybridization (C, D), scale bars=500 μm |
| |
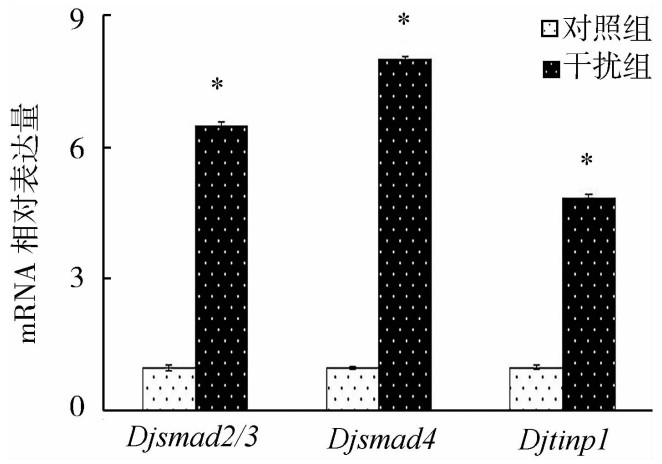
qPCR发现,Djcullin1基因敲减后TGF-β信号通路相关分子Djsmad2/3、Djsmad4和Djtinp1基因的mRNA表达量明显增高(图 2)。
|
| 图 2 敲减Djcullin1后Djsmad2/3、Djsmad4和Djtinp1 mRNA在涡虫体内的表达 Fig. 2 mRNA levels of Djsmad2/3, Djsmad4 and Djtinp1 in planarian after knockdown of Djcullin1 as determined by qPCR * P < 0.05 |
| |
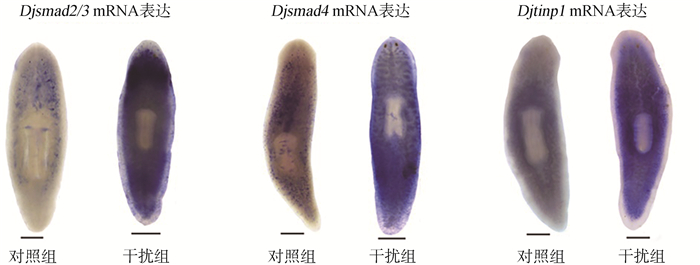
结果显示,Djcullin1基因干扰后, Djsmad2/3、Djsmad4和Djtinp1基因的表达与qPCR结果一致,表达明显增高(图 3)。
|
| 图 3 整体原位杂交实验中,敲减Djcullin1后Djsmad2/3、Djsmad4和Djtinp1 mRNA在涡虫体内的表达 Fig. 3 mRNA levels of Djsmad2/3, Djsmad4 and Djtinp1 in planarian after knockdown of Djcullin1 as determined by whole-mount in situ hybridization 每组实验重复3次, 每次6条涡虫(标尺=500 μm) Each experiment was repeated for 3 times, and 6 worms per time (scale bars=500 μm) |
| |
Western Blotting结果显示,Djcullin1基因干扰后,涡虫体内与TGF-β通路相关的Smad2/3、Smad4和Tinp1蛋白的表达与荧光定量结果及原位杂交一样,均明显增高(图 4)。

|
| 图 4 敲减Djcullin1后Smad2/3、Smad4和Tinp1蛋白在涡虫体内的表达 Fig. 4 Expression levels of Smad2/3, Smad4 and Tinp1 protein in planarian after knockdown of Djcullin1 |
| |
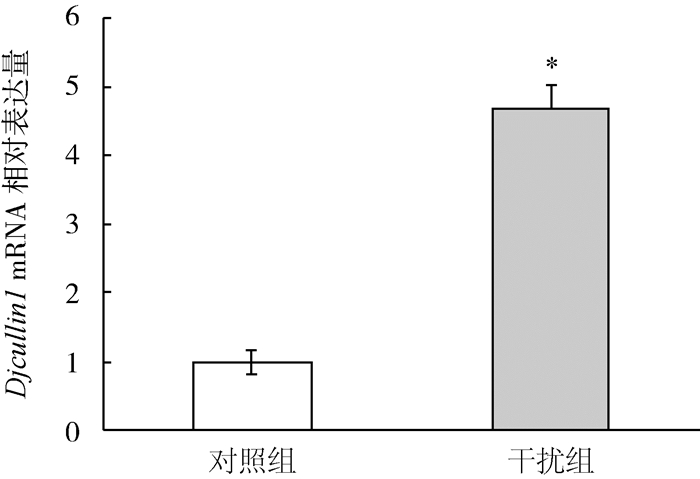
qPCR结果显示,与对照组比较,Djtinp1基因干扰组涡虫体内Djcullin1基因的mRNA表达量明显升高(图 5)。
|
| 图 5 敲减Djtinp1基因后涡虫体内Djcullin1基因的mRNA表达 Fig. 5 mRNA levels of Djcullin1 gene after knockdown of Djtinp1 as determined by qPCR |
| |
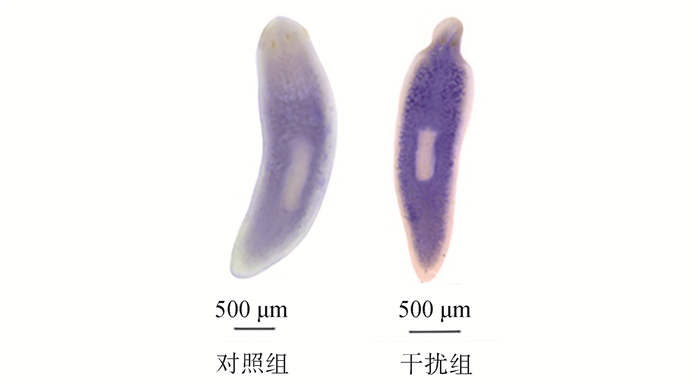
原位杂交检测结果显示,与对照组比较,Djtinp1基因干扰组涡虫体内Djcullin1基因的mRNA表达量明显升高(图 6)。
|
| 图 6 敲减Djtinp1基因后涡虫体内Djcullin1基因的mRNA表达 Fig. 6 mRNA level of Djcullin1 gene after knockdown of Djtinp1 |
| |
Western Blotting结果显示,Djtinp1基因干扰后,Cullin1蛋白的表达明显增高(图 7)。
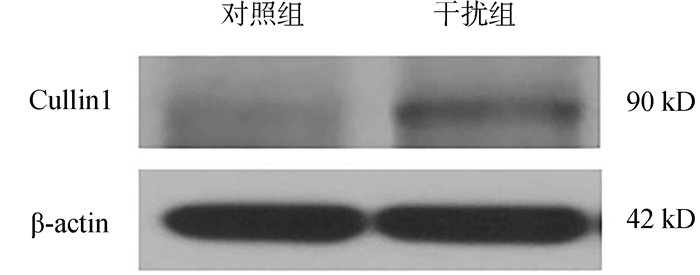
|
| 图 7 Western Blotting显示涡虫Djtinp1基因敲减后体内Cullin1蛋白的表达 Fig. 7 Expression of Cullin1 protein after knockdown of Djtinp1 |
| |
日本三角涡虫由于其强大的再生能力,已被广泛地应用于再生生物学研究。Cullin1为细胞周期重要调控分子,与细胞增殖、凋亡和分化均有密切关系(Johnston et al., 2005;Chen et al., 2015)。Tinp1为TGF-β信号通路的下游信号分子,也与细胞增殖和凋亡有一定的关系(Chen & Xu,2017)。cullin1基因和tinp1基因均在涡虫体内呈阳性表达,且参与涡虫多种组织和器官的再生(Strand et al., 2018;Sun et al., 2019)。但涡虫体内两者之间的关系仍不清楚。
Cullin1蛋白是Cullins家族中最早发现的成员,也是构成E3泛素连接酶复合体的关键分子(Jiang et al., 2015;Strand et al., 2018)。在复合体中,Cullin1蛋白可通过skp1调控f-box蛋白,由f-box蛋白与特定底物接触,并以特异的方式降解底物蛋白,进而发挥其对信号转导和细胞生理功能的调控作用(Chen et al., 2012)。E3泛素连接酶复合体是TGF-β信号通路活化的重要调控因素(Imamura et al., 2013;Huang et al., 2016),提示作为TGF-β信号通路的下游分子tinp1基因也可能受到E3泛素连接酶复合体(包括cullin1基因)的影响,因此两基因之间有可能通过TGF-β信号通路发生相互作用。
本研究利用RNAi技术敲减Djcullin1基因表达,运用qPCR、整体原位杂交技术及Western Blotting技术检测了Djsmad2/3、Djsmad4及Djtinp1基因及其翻译后蛋白水平的表达。敲减Djcullin1基因后qPCR结果显示, TGF-β信号通路相关分子Djsmad2/3、Djsmad4及Djtinp1基因的mRNA水平明显增高,整体原位杂交结果显示,涡虫体内Djsmad2/3、Djsmad4及Djtinp1基因表达较对照组涡虫明显增高,Western Blotting数据表明,Djcullin1基因干扰后涡虫体内Smad2/3、Smad4及Tinp1蛋白的表达明显调高。说明敲减Djcullin1基因可以增强TGF-β信号通路相关基因及蛋白的表达。利用RNAi技术敲减Djtinp1基因后,qPCR及整体原位杂交结果显示涡虫体内Djcullin1基因表达明显增高,qPCR结果表明敲减Djtinp1基因后Djcullin1基因的表达水平增加了4.7倍,Western Blotting数据也表明, Cullin1蛋白水平明显增高。
综上所述,作为TGF-β信号通路Smad2/3的抑制因子,Djcullin1基因在日本三角涡虫体内可通过TGF-β信号通路增强Djtinp1基因的表达,Djtinp1基因也可影响Djcullin1基因表达,两者之间为负性调节机制,具体Djtinp1基因如何反向影响Djcullin1基因表达,目前原因还不清楚。由于目前未见任何有关cullin1基因、TGF-β信号通路及tinp1基因相关互作的报道,所以上述创新性发现可为研究三角涡虫的再生机制提供新的理论视角。但本课题仅研究了Djcullin1和Djtinp1基因在日本三角涡虫体内的相互作用,并未涉及哺乳动物和人类,因此2个基因的互相调节作用是否普遍存在于其他生物体内还不清楚,仍有待深入研究。
程方方. 2016. 日本三角涡虫Neurotrophin信号通路关键基因及flotillins基因的克隆及功能分析[D]. 河南: 河南师范大学.
|
杨杨杨, 李淑晶, 伍会健, 等. 2015. F-box蛋白家族在肿瘤发生中的作用[J]. 中国细胞生物学学报, 37(8): 1180-1186. |
张合彩, 陈广文, 孙健, 等. 2009. 三肠亚目(扁形动物门: 涡虫纲: 序列目)涡虫系统发育研究进展[J]. 河南师范大学学报(自然科学版), 37(2): 172-176. |
Chen J, Shen BY, Deng XX, et al. 2012. SKP1-CULLIN1-F-box (SCF)-mediated DRG2 degradation facilitated chemotherapeutic drugs induced apoptosis in hepatocellular carcinoma cells[J]. Biochemical and Biophysical Research Communications, 420(3): 651-655. DOI:10.1016/j.bbrc.2012.03.058 |
Chen X, Xu C. 2017. Proteomic analysis reveals the contribution of TGFβ/Smad4 signaling pathway to cell differentiation during planarian tail regeneration[J]. Applied Biochemistry & Biotechnology, 182(2): 529-545. DOI:10.1007/s12010-016-2342-y |
Chen Z, Sui J, Zhang F, et al. 2015. Cullin family proteins and tumorigenesis: genetic association and molecular mechanisms[J]. Journal of Cancer, 6(3): 233-242. DOI:10.7150/jca.11076 |
Cheng F, Dong Z, Dong Y, et al. 2015. Identification and expression analysis of a heat-shock protein 70 gene in Polycelissp[J]. Cell Stress Chaperones, 20(6): 907-915. DOI:10.1007/s12192-015-0608-x |
Ermakov AM, Ermakova ON, Ermolaeva SA. 2014. Study of possible involvement of MEK mitogen-activated protein kinase and TGF-β receptor in planarian regeneration processes using pharmacological inhibition analysis[J]. Russian Journal of Developmental Biology, 45: 292-296. DOI:10.1134/S106236041405004X |
Even İ, Akiva İ, İ yison NB. 2019. An in vivo RNAi mini-screen in Drosophila cancer models reveals novel potential Wnt targets in liver cancer[J]. The Turkish Journal of Gastroenterology, 30(2): 198-207. DOI:10.5152/tjg.2018.18241 |
Huang XL, Zhang L, Duan Y, et al. 2016. E3 ubiquitin ligase: a potential regulator in fibrosis and systemic sclerosis[J]. Cellular Immunology, 306-307: 1-8. DOI:10.1016/j.cellimm.2016.07.003 |
Imamura T, Oshima Y, Hikita A. 2013. Regulation of TGF-β family signalling by ubiquitination and deubiquitination[J]. The Journal of Biochemistry, 154(6): 481-489. DOI:10.1093/jb/mvt097 |
Jiang H, He D, Xu H, et al. 2015. Cullin-1 promotes cell proliferation via cell cycle regulation and is a novel in prostate cancer[J]. International Journal of Clinical & Experimental Pathology, 8(2): 1575-1583. |
Johnston JB, Wang G, Barrett JW, et al. 2005. Myxoma virus M-T5 protects infected cells from the stress of cell cycle arrest through its interaction with host cell cullin1[J]. Journal of Virology, 79(16): 10750-10763. DOI:10.1128/JVI.79.16.10750-10763.2005 |
Lebreton A, Saveanu C, Decourty L, et al. 2006. Nsa2 is an unstable, conserved factor required for the maturation of 27 SB pre-rRNAs[J]. Journal of Biological Chemistry, 281(37): 27099-27108. DOI:10.1074/jbc.M602199200 |
Shahni R, Czajka A, Mankoo BS, et al. 2013. Nop-7-associated 2 (NSA2), a candidate gene for diabetic nephropathy, is involved in the TGFβ1 pathway[J]. The International Journal of Biochemistry & Cell Biology, 45(3): 626-635. |
Skaar JR, Pagan JK, Pagano M. 2013. Mechanisms and function of substrate recruitment by F-box proteins[J]. Nature Reviews: Molecular Cell Biology, 14(6): 369-381. DOI:10.1038/nrm3582 |
Strand NS, Allen JM, Ghulam M, et al. 2018. Dissecting the function of cullin-RING ubiquitin ligase complex genes in planarian regeneration[J]. Developmental Biology, 433(2): 210-217. DOI:10.1016/j.ydbio.2017.10.011 |
Sun Y, Gao T, Zhang S, et al. 2019. TINP1 homolog is required for planarian regeneration[J]. Bioscience Biotechnology and Biochemistry, 83(7): 1248-1254. DOI:10.1080/09168451.2019.1594677 |
Zhang FX, Dong ZM, Gao S, et al. 2019. AT1R-mediated apoptosis of bone marrow mesenchymal stem cells is associated with mtROS production and mtDNA reduction[J/OL]. Oxidative Medicine and Cellular Longevity, 2019: 4608165[2020-04-05]. https://doi.org/10.1155/2019/4608165.
|
Zhang H, Ma X, Shi T, et al. 2010. NSA2, a novel nucleolus protein regulates cell proliferation and cell cycle[J]. Biochemical and Biophysical Research Communications, 391(1): 651-658. DOI:10.1016/j.bbrc.2009.11.114 |
 2021, Vol. 40
2021, Vol. 40




