扩展功能
文章信息
- 宋智煜, 陈双臣, 白小军, 董钧锋, 宋月芹
- SONG Zhiyu, CHEN Shuangchen, BAI Xiaojun, DONG Junfeng, SONG Yueqin
- 双委夜蛾感觉神经元膜蛋白编码基因鉴定及组织表达谱分析
- Cloning and Expression Pattern of the Sensory Neuron Membrane Protein-Encoding Genes of Athetis dissimilis
- 四川动物, 2021, 40(2): 121-129
- Sichuan Journal of Zoology, 2021, 40(2): 121-129
- 10.11984/j.issn.1000-7083.20200424
-
文章历史
- 收稿日期: 2020-11-09
- 接受日期: 2021-01-04
2. 宜阳县林业技术指导站, 河南洛阳 471600
2. Yiyang Forestry Technical Guidance Station, Luoyang, Henan Province 471600, China
昆虫的化学感受系统在其生存和繁殖过程中起着极其重要的作用(Kaupp,2010;Sun et al., 2014;Zhang et al., 2015)。研究者对昆虫触角嗅觉信号传导的分子机制研究有了突出的进步:在昆虫嗅觉识别时,气味分子从触角感器孔渗入,然后被气味结合蛋白(odorant binding proteins,OBPs)或化学感受蛋白(chemosensory proteins,CSPs)识别和转移,最后激活位于嗅觉感觉神经元(olfactory sensory neurons,OSNs)树突膜上的嗅觉受体(odorant receptors,ORs)或离子型受体(ionotropic receptors,IRs),产生电位,指导昆虫做出相应的行为反应(Benton et al., 2009;Leal,2013;Brito et al., 2016;de Fouchier et al., 2017;Yang et al., 2017)。此外,还有一些蛋白如感觉神经元膜蛋白(sensory neuron membrane proteins,SNMPs)在昆虫气味识别过程中也扮演着至关重要的角色(Leal,2013)。
昆虫SNMPs是一种膜蛋白,与脊椎动物CD36家族为同源基因,具有2个跨膜区域,其功能主要是识别和转运亲脂性气味分子如脂肪酸和脂类化合物等(Rogers et al., 1997, 2001a;Febbraio & Silverstein,2007;Levy et al., 2007;Vogt et al., 2009;Martin et al., 2011)。昆虫第一个 SNMP 基因被鉴定在多音蚕蛾Antheraea polyphemus中,命名为ApolSNMP1。随后 SNMP 的第二个亚类型在烟草天蛾Mauduca sexta中被发现,命名为MsexSNMP2(Rogers et al., 1997, 2001a, 2001b)。紧接着SNMP的同源基因在鳞翅目Lepidoptera(Rogers et al., 2001a, 2001b;Forstner et al., 2008)、双翅目Diptera(Jin et al., 2008)、鞘翅目Coleoptera(Nichols & Vogt,2008)、直翅目Orthoptera(Vogt et al., 2009)和膜翅目Hymenoptera(Hu et al., 2013)等昆虫中都有发现。SNMP 基因家族一直以来被认为只有2个成员,即SNMP1和SNMP2。而昆虫SNMP家族的第三个成员SNMP3在鳞翅目中被鉴定(Zhang et al., 2018),被认为主要与昆虫的免疫反应有关,这还需要进一步证明。
双委夜蛾Athetis dissimilis属鳞翅目夜蛾科Noctuidae委夜蛾属Athetis,近年逐渐成为小麦Triticum aestivum和玉米Zea mays地的主要害虫。外形类似于二点委夜蛾A. lepigone,食量极大,对小麦和玉米产量造成极大的威胁(王振营等,2012;郭婷婷等, 2016a, 2016b),发展新型友好的杀虫剂迫在眉睫。本研究鉴定了双委夜蛾的2个SNMP基因,即AdisSNMP1和AdisSNMP2,并通过荧光定量PCR技术对双委夜蛾AdisSNMP1和AdisSNMP2在不同组织中的表达情况进行分析。以期为进一步探索双委夜蛾SNMPs的化学通讯功能奠定基础。
1 材料与方法 1.1 试虫的准备双委夜蛾来自河南科技大学林学院昆虫实验室,该群体为自2012年7月在河南省洛阳市周边玉米田诱集的成虫,在室内继代饲养至今(宋月芹等,2015)。室内饲养条件为:温度27 ℃±1 ℃,相对湿度80%±5%,光周期16L∶ 8D。
1.2 总RNA的提取与第一链cDNA的合成选取双委夜蛾羽化后第3天的雌雄成虫,收集触角各50头、头部各30头、胸部各20头、腹部各3头、足各30头、翅各50头,每个样品收集重复3次。将双委夜蛾各部分组织解剖后立即放入浸在液氮中的1.5 mL离心管内,-80 ℃保存。
总RNA的提取采用RNAiso Plus Kit(TaKaRa,北京)试剂盒进行,并使用RNase-free DNase I(TaKaRa,北京)对提取的RNA进行除DNA处理。采用1%琼脂糖凝胶电泳和NanoDrop 2000c分光光度计(Thermo Scientific)进行质量检测。采用PrimeScriptTM 1st Strand cDNA Synthesis Kit(TaKaRa,北京)试剂盒对RNA进行反转录。
1.3 双委夜蛾SNMPs基因的克隆从本实验室前期对双委夜蛾触角转录组测序注释结果中(Dong et al., 2016)搜索到2个 SNMP 基因。根据该序列设计特异性引物,AdisSNMP1-F:5’-ATGGCGCTTCCTAAGGAGATA-3’,AdisSNMP1-R:5’-AATGTACAACTAGAACCGACC-3’;AdisSNMP2-F:5’-ATGTTGGGAAAACATTCGAAAATG-3’,AdisSNMP2-R:5’-AGTTAAGGGAAATAATTGCACTC-3’。PCR反应体系为20 μL:雌蛾触角cDNA模板1 μL,上、下游引物各1.5 μL (10 μmol·L-1),dNTPs混合液1.6 μL(2.5 μmol·L-1),Ex Taq DNA聚合酶0.2 μL(TaKaRa,大连),10×Ex Taq buffer 2 μL,ddH2O 12.2 μL。PCR反应条件为:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35个循环;最后72 ℃ 10 min。胶回收目的片段,将目的片段克隆到pMDTM19-T载体上,转化DH5α感受态细胞,挑取阳性克隆培养过夜,送去测序。
1.4 双委夜蛾SNMPs基因的序列分析核酸序列采用在线工具(http://www.bio-soft.net/sms/)翻译;采用在线工具(http://www.cbs.dtu.dk/services/TMHMM)进行跨膜区域预测;利用在线工具(https://web.expasy.org/protparam/)对蛋白序列特性进行分析;采用在线工具(https://web.expasy.org/protscale/)分析蛋白亲疏水性;采用线下DNAMAN进行多重序列比对;采用线下MEGA 6.0构建进化树。
1.5 荧光定量PCR通过荧光定量PCR检测双委夜蛾SNMPs基因在不同组织中的表达情况。根据双委夜蛾SNMPs基因的开放阅读框和荧光定量引物设计原则设计特异性引物(5'-3'),AdisSNMP1-F:TCCTGTTCCCTGTCATACTCAA,AdisSNMP1-R:GTGCCCTCTCCTTTAGTAACAG,AdisSNMP2-F:CTGCTCTACTAACGGTCCACGA,AdisSNMP2-R:ACGAAACCCTGACCACACGCCT。内参基因为双委夜蛾GADPH基因,引物为:AdisGADPH-F:CTGCTCATTTAGAGGGTGGTGC;AdisGADPH-R:TCTTCTGGGTAGCGGTGGTAG。
荧光定量PCR在ABI 7500 PCR仪(ABI,Carlsbad,CA,USA)上进行,每个反应体系20 μL,包括10 μL的2×SYBR Green PCR Master Mix(TaKaRa,大连)、0.8 μL的正反向引物(10 μmol·L-1)、2 μL的cDNA模板(200 ng)和6.4 μL的DEPC水。PCR程序:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 31 s,40个循环。试验重复3次。
1.6 数据分析所有SNMPs基因在双委夜蛾不同组织中的相对表达量为ΔCt=Ct目标基因-Ct内参基因。利用SPSS 17.0中的ANOVA方法对AdisSNMPs基因在双委夜蛾不同组织中的表达量进行差异比较(新复极差法检验,P≤0.05)。
2 结果与分析 2.1 双委夜蛾SNMPs基因克隆及序列特征反转录及PCR结果(图 1)显示,在1 000~ 2 000 bp之间有1条明显的单一条带,结果与预期大小相符。测序结果在NCBI上的同源性搜索结果表明,所测序列与多种昆虫的SNMP基因序列高度同源,证明这2个基因就是双委夜蛾的SNMP基因,分别命名为AdisSNMP1和AdisSNMP2,GenBank登录号分别为MT954936和MT954937。
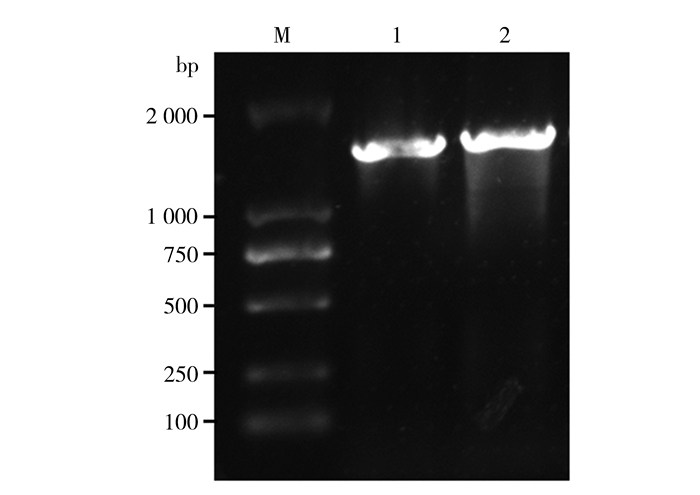
|
| 图 1 双委夜蛾SNMP基因的PCR扩增 Fig. 1 Amplification of SNMP genes from Athetis dissimilis M. DNA Marker DL2000, 1. AdisSNMP1, 2. AdisSNMP2 |
| |
这2个SNMPs基因都具有全长的开放阅读框,AdisSNMP1长度为1 572 bp,编码523个氨基酸(图 2);而AdisSNMP2长度为1 563 bp,编码520个氨基酸(图 3)。这2个基因编码蛋白质都是酸性,AdisSNMP1的等电点是5.96,蛋白分子量是59.09 kD;AdisSNMP2的等电点是5.69,蛋白分子量是58.72 kD。

|
| 图 2 双委夜蛾SNMP1的核苷酸和氨基酸序列 Fig. 2 Nucleotide and deduced amino acid sequences of Athetis dissimilis SNMP1 方框内为6个保守的半胱氨酸残基the six conserved cysteine resides are boxed;星号代表终止密码子the stop codon is marked with an asterisk;下划线表示2个跨膜区域the underlines below the two transmembrane domains; 下同the same below |
| |

|
| 图 3 双委夜蛾SNMP2的核苷酸和氨基酸序列 Fig. 3 Nucleotide and deduced amino acid sequences of Athetis dissimilis SNMP2 |
| |
AdisSNMP1和AdisSNMP2都有3个短的膜内区域,分别是1~8,482~523和1~8,9~28;还有3个跨膜区域,分别是9~31,459~481和9~28,472~494;剩余部分32~458和29~471分别为这2个蛋白的膜外区域(图 4)。在膜外区域6个保守的半胱氨酸残基位点被预测,并组成3个二硫键,AdisSNMP1的二硫键位点是Cys268-Cys333、Cys297-Cys352和Cys335-Cys341,AdisSNMP2的是Cys267-Cys337、Cys298-Cys350和Cys339-Cys361(图 4)。这6个保守的半胱氨酸位点与CD36基因家族相似。

|
| 图 4 双委夜蛾SNMP1和SNMP2与鳞翅目其他昆虫SNMPs的序列比对 Fig. 4 Alignment of Athetis dissimilis SNMP1 and SNMP2 with SNMPs from other lepidopteran insects 方框内为2个跨膜区域the two transmembrane domains are boxed;6个保守的半胱氨酸位点用星号表示the six conserved cysteines are marked with an asterisk;缩写的种名分别是abbreviated species names:Adis. 双委夜蛾Athetis dissimilis, Aips. 小地老虎Agrotis ipsilon, Msex. 烟草天蛾Manduca sexta, Slit. 斜纹夜蛾Spodoptera litura |
| |
双委夜蛾2个SNMPs基因的亲水性和疏水性预测发现,AdisSNMP1和AdisSNMP2在氨基酸序列的C-端和N-端跨膜区域有2个明显的疏水位点(图 5)。
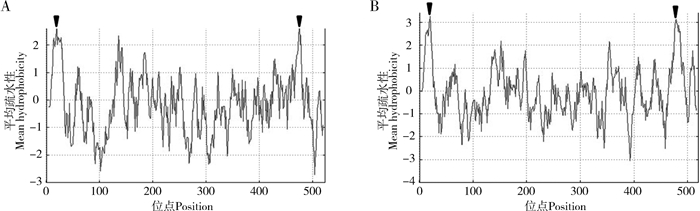
|
| 图 5 双委夜蛾SNMP1和SNMP2疏水性预测图谱 Fig. 5 Predicted hydrophobicity profiles of Athetis dissimilis SNMP1 and SNMP2 黑三角形表示昆虫SNMPs 2个跨膜区域的保守疏水位点 Black triangles show the two conserved hydrophobic regions of transmembrane domains in insect SNMPs |
| |
将双委夜蛾AdisSNMP基因与已报道的其他昆虫SNMP基因的氨基酸序列在NCBI中的Blastp在线搜索工具进行同源性分析,发现AdisSNMP基因与不同种类昆虫SNMP基因差别较大。与同目昆虫SNMP基因一致性较高,如AdisSNMP1与小地老虎Agrotis ipsilon AipsSNMP1序列一致性为85.69%;与斜纹夜蛾Spodoptera litura SlitSNMP1序列一致性为86.64%。AdisSNMP2与小地老虎AipsSNMP2序列一致性为86.54%;与斜纹夜蛾SlitSNMP2序列一致性为85.38%。与不同目昆虫 SNMP 基因一致性较低,如AdisSNMP1与烟飞虱Bemisia tabaci BtabSNMP1序列一致性为33.84%;与茶翅蝽Halyomorpha halys HhalSNMP1序列一致性为37.45%。AdisSNMP2与烟飞虱BtabSNMP2序列一致性为27.27%;与茶翅蝽HhalSNMP2序列一致性为25.52%。双委夜蛾AdisSNMP1和AdisSNMP2序列一致性为27.05%。
使用MEGA 6.0对11种昆虫的SNMP同源基因进行进化树比较。SNMPs基因被分成2个亚组,即SNMP1和SNMP2 (图 6)。双委夜蛾的AdisSNMP1和AdisSNMP2基因分别被聚集到这2个亚组,并且与同为鳞翅目昆虫的小地老虎和斜纹夜蛾SNMP基因进化关系最近,与其他目昆虫SNMP关系较远。
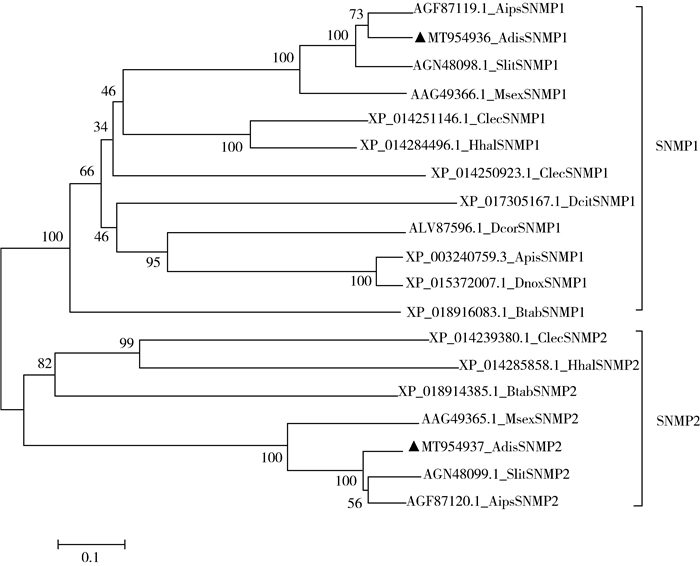
|
| 图 6 双委夜蛾SNMPs与其他昆虫SNMPs氨基酸序列的系统进化树 Fig. 6 Phylogenetic tree of the SNMPs of Athetis dissimilis and other insects based on amino acid sequences using the neighbor-joining method ▲本研究获得的基因the genes obtained in this study |
| |
使用荧光定量PCR对双委夜蛾AdisSNMP1和AdisSNMP2在不同组织中的表达情况进行分析,结果发现:AdisSNMP1和AdisSNMP2在雌雄蛾触角中高度表达,雄蛾的表达量普遍比雌蛾高。除触角外,AdisSNMP1几乎不在其他组织中表达或表达量甚微。AdisSNMP2除在触角中表达量丰富外,在足中也有少量表达(图 7)。

|
| 图 7 双委夜蛾SNMPs基因在不同组织中的相对表达量 Fig. 7 Expression level of SNMPs gene in different tissues of Athetis dissimilis 不同字母表示不同组织间基因表达存在显著差异(P < 0.05) The different letters above bars indicate there is a significant difference between different tissues (P < 0.05) |
| |
本研究根据前期双委夜蛾触角转录组的数据,通过BLASTX在线搜索和同源性比较鉴定出2个SNMPs基因,即AdisSNMP1和AdisSNMP2。这2个基因与其他昆虫SNMPs具有类似的特征,如在氨基酸序列N端和C端附近有2个保守的跨膜区域,并且由6个保守的半胱氨酸残基形成二硫键组成一个大的胞外环,此结构也与CD36基因家族极其相似(Huang et al., 2016;Sun et al., 2019;Yang et al., 2020)。根据对这2个跨膜蛋白结构投影预测,这部分的功能是转运和结合脂类分子(Herboso et al., 2011;Pregitzer et al., 2014),推测双委夜蛾SNMPs的2个跨膜区具有同样的功能。
双委夜蛾AdisSNMP基因同源性搜索发现AdisSNMP基因与不同种类昆虫SNMP基因差别较大。与同目昆虫SNMP基因一致性较高,与不同目昆虫SNMP基因一致性较低。双委夜蛾AdisSNMP1和AdisSNMP2之间序列一致性也比较低。进化树结果也显示,双委夜蛾AdisSNMP1和AdisSNMP2分别被聚集到SNMP1和SNMP2,在同一组内,同为鳞翅目昆虫的SNMP基因进化关系最近,与其他目昆虫SNMP关系较远。此结果与大多数昆虫SNMP基因特性相同(Gu et al., 2013;胡颖颖等,2013;Yang et al., 2020)。在鳞翅目中曾经鉴定出SNMP3亚家族基因(Zhang et al., 2018),而在双委夜蛾触角转录组数据中没有发现该基因,可能是这个基因在幼虫肠中高度表达的原因。
组织特异性表达可以为功能预测提供可靠性的参考。本研究发现双委夜蛾SNMP1主要表达在雌雄蛾的触角中,此结果与多音蚕蛾(Rogers et al., 1997)、脐橙螟Amyelois transitella(Leal et al., 2009)和甜菜夜蛾Spodoptera exigua(Liu et al., 2014)等多种昆虫SNMP1的表达模式相同。Benton等(2007)在黑腹果蝇Drosophila melanogaster中发现,DmelSNMP1能够识别集合信息素cVA,激活受体HR13。Pregitzer等(2014)在烟芽夜蛾Heliothis virescens中也发现,HvirSNMP1能明显增强HR13对信息素Z11-16:Ald的结合力。以上研究都暗示昆虫SNMP1的功能是调节信息素的识别和通过SNMP-OR互作转运信息素。相对于AdisSNMP1,AdisSNMP2的表达相对广泛,除嗅觉感器触角外,在非嗅觉感器足中也有少量表达,此结果与小菜蛾Plutella xylostella(Li & Qin,2011)、二化螟Chilo suppressalis(Liu et al., 2013a)、稻纵卷叶螟Cnaphalocrocis medinalis (Liu et al., 2013b)和甜菜夜蛾(Liu et al., 2014)一致。昆虫身体上分布有大量的味觉感器(Montell,2009),而CD36蛋白的主要功能是转运脂类化合物,因此可推测AdisSNMP2和GRs在这些组织中共同表达,识别脂类分子完成味觉过程。
本研究通过前期双委夜蛾触角转录组数据鉴定出2个SNMPs基因,并且研究了这些基因在双委夜蛾不同组织中的表达情况,不仅丰富了昆虫SNMPs基因的数量,也为今后对双委夜蛾SNMPs基因功能的研究提供参考。
郭婷婷, 门兴元, 于毅, 等. 2016a. 温度对双委夜蛾实验种群生长发育及繁殖的影响[J]. 昆虫学报, 59(8): 865-870. |
郭婷婷, 于志浩, 门兴元, 等. 2016b. 双委夜蛾不同虫态耐寒性及体内生化物质含量变化[J]. 昆虫学报, 59(12): 1291-1297. |
胡颖颖, 徐书法, 李微, 等. 2013. 中华蜜蜂感觉神经元膜蛋白基因克隆、组织表达分析及原核表达[J]. 昆虫学报, 56(1): 9-17. |
宋月芹, 李文亮, 刘顺通, 等. 2015. 双委夜蛾非典型嗅觉受体Orco的克隆、分子特征及表达[J]. 植物保护学报, 42(6): 997-1003. |
王振营, 石洁, 董金皋. 2012. 2011年黄淮海夏玉米区二点委夜蛾暴发危害的原因与防治对策[J]. 玉米科学, 20(1): 132-134. DOI:10.3969/j.issn.1005-0906.2012.01.027 |
Benton R, Vannice KS, Gomez-Diaz C, et al. 2009. Variant ionotropic glutamate receptors as chemosensory receptors in Drosophila[J]. Cell, 136(1): 149-162. DOI:10.1016/j.cell.2008.12.001 |
Benton R, Vannice KS, Vosshall LB. 2007. An essential role for a CD36-related receptor in pheromone detection in Drosophila[J]. Nature, 450(7167): 289-293. DOI:10.1038/nature06328 |
Brito NF, Moreira MF, Melo ACA. 2016. A look inside odorant-binding proteins in insect chemoreception[J]. Journal of Insect Physiology, 95: 51-65. DOI:10.1016/j.jinsphys.2016.09.008 |
de Fouchier A, Walker WBIII, Montagné N, et al. 2017. Functional evolution of Lepidoptera olfactory receptors revealed by deorphanization of a moth repertoire[J/OL]. Nature Communications, 8: 15709[2020-08-30]. https://doi.org/10.1038/ncomms15709.
|
Dong J, Song Y, Li W, et al. 2016. Identification of putative chemosensory receptor genes from the Athetis dissimilis antennal transcriptome[J/OL]. PLoS ONE, 11(1): e0147768[2020-08-30]. https://doi.org/10.1371/journal.pone.0147768.
|
Febbraio M, Silverstein RL. 2007. CD36:implications in cardiovascular disease[J]. The International Journal of Biochemistry & Cell Biology, 39(11): 2012-2030. |
Forstner M, Gohl T, Gondesen I, et al. 2008. Differential expression of SNMP-1 and SNMP-2 proteins in pheromone sensitive hairs of moths[J]. Chemical Senses, 33(3): 291-299. DOI:10.1093/chemse/bjm087 |
Gu SH, Yang RN, Guo MB, et al. 2013. Molecular identification and differential expression of sensory neuron memebrane proteins in the antennae of the black cutworm moth Agrotis ipsilon[J]. Journal of Insect Physiology, 59: 430-443. DOI:10.1016/j.jinsphys.2013.02.003 |
Herboso L, Talamillo A, Pérez C, et al. 2011. Expression of the scavenger receptor class B type Ⅰ (SR-BⅠ) family in Drosophila melanogaster[J]. International Journal of Developmental Biology, 55(6): 603-611. DOI:10.1387/ijdb.103254lh |
Hu YY, Xu SF, Wubie AJ, et al. 2013. Molecular characterization and tissue localization of sensory neuron membrane protein from Chinese honey bee, Apiscerana cerana (Hymenoptera: Apidae)[J]. Applied Entomology and Zoology, 48(4): 533-545. DOI:10.1007/s13355-013-0215-1 |
Huang XL, Liu L, Fang YQ, et al. 2016. Expression of a sensory neuron membrane protein SNMP2 in olfactory sensilla of codling moth Cydia pomonella (Lepidoptera: Tortricidae)[J]. Journal of Economic Entomology, 4(109): 1907-1913. |
Jin X, Ha TS, Smith DP. 2008. SNMP is a signaling component required for pheromone sensitivity in Drosophila[J]. Proceedings of the National Academy of Sciences of the United States of America, 105(31): 10996-11001. DOI:10.1073/pnas.0803309105 |
Kaupp UB. 2010. Olfactory signalling in vertebrates and insects: differences and commonalities[J]. Nature Reviews Neuroscience, 11(3): 188-200. DOI:10.1038/nrn2789 |
Leal WS. 2013. Odorant reception in insects: roles of receptors, binding proteins, and degrading enzymes[J]. Annual Review of Entomology, 58: 373-391. DOI:10.1146/annurev-ento-120811-153635 |
Leal WS, Ishida Y, Pelletier J, et al. 2009. Olfactory proteins mediating chemical communication in the navel orangeworm moth, Amyelois transitella[J/OL]. PLoS ONE, 4(9): e7235[2020-08-31]. https://doi.org/10.1371/journal.pone.0007235.
|
Levy E, Spahis S, Sinnett D, et al. 2007. Intestinal cholesterol transport proteins: an update and beyond[J]. Current Opinion in Lipidology, 18(3): 310-318. DOI:10.1097/MOL.0b013e32813fa2e2 |
Li PY, Qin YC. 2011. Molecular cloning and characterization of sensory neuron membrane protein and expression pattern analysis in the diamondback moth, Plutella xylostella (Lepidoptera: Plutellidae)[J]. Applied Entomology and Zoology, 46(497): 497-504. DOI:10.1007/s13355-011-0067-5 |
Liu C, Zhang J, Liu Y, et al. 2014. Expression of SNMP1 and SNMP2 genes in antennal sensilla of Spodoptera exigua (Hübner)[J]. Archives of Insect Biochemistry and Physiology, 85(2): 114-126. DOI:10.1002/arch.21150 |
Liu S, Qiao F, Liang QM, et al. 2013a. Molecular characterization of two sensory neuron membrane proteins from Chilo suppressalis (Lepidoptera: Pyralidae)[J]. Annals of the Entomological Society of America, 106(3): 378-384. DOI:10.1603/AN12099 |
Liu S, Zhang YR, Zhou WW, et al. 2013b. Identification and characterization of two sensory neuron membrane proteins from Cnaphalocrocis medinalis (Lepidoptera: Pyralidae)[J]. Archives of Insect Biochemistry and Physiology, 82(1): 29-42. DOI:10.1002/arch.21069 |
Martin C, Chevrot M, Poirier H, et al. 2011. CD36 as a lipid sensor[J]. Physiology & Behavior, 105: 36-42. |
Montell C. 2009. A taste of the Drosophila gustatory receptors[J]. Current Opinion in Neurobiology, 19(4): 345-353. DOI:10.1016/j.conb.2009.07.001 |
Nichols Z, Vogt RG. 2008. The SNMP/CD36 gene family in Diptera, Hymenoptera and Coleoptera: Drosophila melanogaster, D. pseudoobscura, Anopheles gambiae, Aedes aegypti, Apis mellifera, and Tribolium castaneum[J]. Insect Biochemistry and Molecular Biology, 38(4): 398-415. DOI:10.1016/j.ibmb.2007.11.003 |
Pregitzer P, Greschista M, Breer H, et al. 2014. The sensory neuron membrane protein SNMP1 contributes to the sensitivity of a pheromone detection system[J]. Insect Molecular Biology, 23(6): 733-742. DOI:10.1111/imb.12119 |
Rogers ME, Krieger J, Vogt RG. 2001a. Antennal SNMPs (sensory neuron membrane proteins) of Lepidoptera define a unique family of invertebrate CD36-like proteins[J]. Journal of Neurobiology, 49(1): 47-61. DOI:10.1002/neu.1065 |
Rogers ME, Steinbrecht RA, Vogt RG. 2001b. Expression of SNMP-1 in olfactory neurons and sensilla of male and female antennae of the silkmoth Antheraea polyphemus[J]. Cell and Tissue Research, 303(3): 433-446. DOI:10.1007/s004410000305 |
Rogers ME, Sun M, Lerner MR, et al. 1997. Snmp-1, a novel membrane protein of olfactory neurons of the silk moth Antheraea polyphemus with homology to the CD36 family of membrane proteins[J]. Journal of Biological Chemistry, 272(23): 14792-14799. DOI:10.1074/jbc.272.23.14792 |
Sun L, Wang Q, Zhang Y, et al. 2019. Expression patterns and colocalization of two sensory neurone membrane proteins in Ectropis oblique Prout, a geometrid moth pest that uses Type-Ⅱ sex pheromones[J]. Insect Molecular Biology, 28(3): 342-354. DOI:10.1111/imb.12555 |
Sun L, Xiao HJ, Gu SH, et al. 2014. Perception of potential sex pheromones and host-associated volatiles in the cotton plant bug, Adelphocoris fasciaticollis (Hemiptera: Miridae): morphology and electrophysiology[J]. Applied Entomology and Zoology, 49(1): 43-57. DOI:10.1007/s13355-013-0223-1 |
Vogt RG, Miller NE, Litvack R, et al. 2009. The insect SNMP gene family[J]. Insect Biochemistry and Molecular Biology, 39(7): 448-456. DOI:10.1016/j.ibmb.2009.03.007 |
Yang HY, Ning SY, Sun X, et al. 2020. Identification and characterization of two sensory neuron membrane proteins from onion maggot (Diptera: Anthomyiidae)[J]. Journal of Economic Entomology, 113(1): 418-426. |
Yang K, Huang LQ, Ning C, et al. 2017. Two single-point mutations shift the ligand selectivity of a pheromone receptor between two closely related moth species[J/OL]. eLife, 6: e29100[2020-07-30]. https://doi.org/10.7554/eLife.29100.001.
|
Zhang HJ, Xu W, Sun LN, et al. 2018. Functional characterization of sensory neuron membrane proteins (SNMPs)[J/OL]. BioRxiv: 262154[2020-07-30]. https://doi.org/10.1001/262154.
|
Zhang J, Walker WB, Wang G. 2015. Pheromone reception in moths: from molecules to behaviors[J]. Progress in Molecular Biology and Translational Science, 130: 109-128. |
 2021, Vol. 40
2021, Vol. 40




