扩展功能
文章信息
- 肖繁荣, 卜荣平, 黄婷婷, 史海涛
- XIAO Fanrong, BU Rongping, HUANG Tingting, SHI Haitao
- 加博边缘混隐比率法在研究动物混隐色中的应用
- Application of Gabor Edge Disruption Ratio Method in Animal Disruptive Coloration
- 四川动物, 2021, 40(1): 34-38
- Sichuan Journal of Zoology, 2021, 40(1): 34-38
- 10.11984/j.issn.1000-7083.20200215
-
文章历史
- 收稿日期: 2020-06-09
- 接受日期: 2020-11-02
伪装体色普遍存在于动物界,其作用是减少被天敌检测和识别的风险(Stevens & Merilaita,2011;肖繁荣等,2015)。混隐色(disruptive coloration)是一种重要伪装策略,猎物体表高亮度的条纹或斑纹破坏身体轮廓而产生虚假边缘,妨碍天敌检测其真实边缘,从而很难被发现(Thayer,1909;Cott,1940;Stevens & Merilaita,2011)。如斑点草蛙Limnodynastes tasmaniensis体表具有黑白相间的斑块,这些斑块使其捕食者束带蛇Thamnophis sirtali不能区分自然背景的边界和蛙身体的轮廓(Osorio & Srinivasan,1991)。除动物自身斑纹的颜色和排列方式外,混隐色的混隐程度与微生境基质密切相关。一般认为,微生境中的基质组成及颜色越复杂,混隐程度越高,伪装就越有效(Stevens & Merilaita,2011;Price et al., 2019)。肖繁荣等:加博边缘混隐比率法在研究动物混隐色中的应用
混隐色的研究可追溯到Poulton(1890)观察具有高对比度斑纹的鳞翅目Lepidoptera幼虫。随后,Thayer(1909)认为动物可能利用这种斑纹破坏身体的外貌和轮廓,从而达到伪装目的。Cott(1940)正式提出混隐色概念,并提出了一系列关于混隐色的外貌特征及其功能的假说。然而,此时期及以后很长一段时间,混隐色的研究仅仅停留在定性描述层面,缺乏定量研究。Osorio和Srinivasan(1991)在数码摄影技术基础上,首次使用计算机控制的帧捕捉器将照片数字化,并通过扫描照片中斑点草蛙的身体轮廓量化混隐色。然而,该研究并未量化边缘检测的难易程度。Lovell等(2013)使用Matlab中的Canny边缘检测子测量日本鹌鹑Coturnix japonica边缘可见率,结果表明,斑点较多的卵产在颜色较深的基质中时,其可见率较低,边缘检测难度较大。Kang等(2014)使用ImageJ的多边形和波段选择工具选择蛾(Hypomecis roboraia和Jankowskia fuscaria)的身体轮廓,通过计算轮廓边缘与身体边缘的比值来确定混隐比率,以此量化混隐色。然而,这2种方法均未考虑动物感知边缘的方向,因此无法区分猎物的虚假边缘和连贯边缘(相当于真实边缘)。虚假边缘使猎物具有的最大混隐程度,而连贯边缘使猎物更容易被检测(Troscianko et al., 2009)。为了区分虚假边缘和连贯边缘,进而计算混隐比率,Troscianko等(2017)创立加博边缘混隐比率法(Gabor edge disruption ratio method,GabRat法)来量化混隐色。该方法是基于生物(人类)视觉的新方法,比基于计算机视觉的Canny边缘检测法更适合用于研究动物的混隐色。然而,目前该方法仅用于量化无脊椎动物的混隐色(如海滨蟹Carcinus maenas; Price et al., 2019),需进一步在不同动物类群中检验其有效性。
黄额闭壳龟Cuora galbinifrons为条纹体色,背甲顶部(脊盾)具宽而色深的纵带,向两侧(肋盾)为黄色纵带,再向下到边缘(缘盾)颜色又变深(Shi et al., 2013;图 1),属于典型的混隐色。黄额闭壳龟栖息于热带林下的陆地生境中,常出现在倒木和落叶基质上,极少出现在石质和裸地基质上(Xiao et al., 2017)。推测黄额闭壳龟在倒木和落叶基质上的混隐比率应比在石质和裸地上的高。因此,本文以黄额闭壳龟为研究实例,详细阐述如何利用GabRat法对动物的混隐色进行量化,并比较混隐比率在不同微生境基质中的差异,以期为国内的混隐色研究提供方法参考,推动动物伪装研究的发展。

|
| 图 1 黄额闭壳龟体色及其落叶微生境(肖繁荣 摄) Fig. 1 Carapace coloration and deciduous microhabitat of Cuora galbinifrons (photoed by Xiao Fanrong) |
| |
采用摄影技术对动物及其选择的基质进行拍照。相机镜头设置为手动模式,照片格式设置为非压缩的RAW格式,保持相机的参数一致,拍照时利用三脚架保持相机镜头与样方垂直(Xiao et al., 2016)。拍照前用灰度卡对相机进行白平衡校正,拍照时将多个灰度标准的比色卡(或灰度卡)放置在样方内进行拍摄,后期再对照片进行标准化校正(Troscianko et al., 2015)。本研究在海南吊罗山国家级自然保护区内拍摄黄额闭壳龟在不同微生境基质中的照片。根据Xiao等(2017)的微生境选择研究结果,以黄额闭壳龟偏好的落叶基质和较偏好的倒木微生境作为实验组,以黄闭壳龟极少出现的裸地和石质基质为对照组。设置基质样方大小约50 cm× 50 cm,然后将黄额闭壳龟放入样方中,使用佳能相机(EF-S24-70mm f/2.8,1 800万像素)对龟和基质进行拍照。拍照时间段为晴天的10: 00—16: 00。
2 颜色校正数码相机已成为众多学科测量颜色和图案的强大工具。然而,在普通的未校准的电子照片中,像素值并不会随着传感器测量的光量线性缩放,这就不能在同一水平比较不同时间拍摄的照片(Stevens et al., 2007;Troscianko et al., 2015)。因此,在进行图像分析之前需要进行线性标准化校正。在ImageJ中使用“Generate multispectral image”校准图像。首先,设置相机参数为“Visible”,灰度标准为18%,图像输出格式设置为“Linear color image”,然后,打开RAW格式图像后,在图像中选择18%灰度卡,即可完成校准。
3 测量加博边缘混隐比率动物照片首先被转换成二值掩模图像(黑色背景白色猎物),通过选择工具选择目标动物的边缘,然后以一定角度将加博滤波器应用于猎物边缘的每个像素上,测量动物身体边缘的绝对能量(|E|)。滤波器大小由像素与比例尺的比值确定。这是以与动物身体轮廓平行和垂直的角度测量身体轮廓的每个点,所以每个点上有2个绝对能量测量值。平行方向测量的是绝对平行能量(|Ep|),相当于连贯边缘的混隐程度,而垂直方向则为绝对正交能量(|Eo|),相当于虚假边缘的混隐程度。然后,将身体轮廓上的每一点都计算一个混隐比率[|Eo|/(|Eo|+|Ep|)]。最后,计算这些比率在整个身体轮廓上的平均值,得出最终的加博边缘混隐比率(GabRat):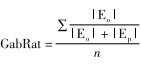
GabRat是测量身体轮廓的虚假边缘与其真实边缘的比率,可表示身体轮廓被色斑破坏的程度。GabRat值在0~1之间,值越大,身体轮廓被破坏的越严重,混隐程度就越高,身体轮廓就越难被天敌检测出来; 值越小,身体轮廓就越容易被检测出来。GabRat值超过0.4被认为具有高混隐程度,而低于0.2则表示混隐程度低(Price et al., 2019)。
GabRat值可使用ImageJ中新开发的GabRat测量工具进行测量(Troscianko et al., 2017)。主要测量步骤是先将RAW格式的图像转为TIFF格式的二值掩模图像,然后使用“Freehand selections”工具选择动物身体轮廓,再通过“mica Toolbox”中的“GabRat Disruption Measurement”窗口,设置“sigma”(滤波器大小)后,即可得出GabRat值。本研究设置sigma=10以测量黄额闭壳龟背甲的混隐比率。
4 结果与分析测量结果显示,黄额闭壳龟(n=4)无论在何种基质中,其体色具有明显的混隐作用(GabRat值均大于0.38;表 1)。单因素方差分析表明,黄额闭壳龟在这4种不同基质中的混隐比率差异有统计学意义(F=17.427,P<0.000 1),在落叶基质中的混隐比率最高,倒木基质次之,裸地和石质最低(表 1)。此外,本研究发现黄额闭壳龟在落叶和倒木基质上的GabRat值均超过了0.4(表 1),表明其在这2种基质上属于高混隐程度,能提高其伪装效果,从而降低被天敌检测身体轮廓的概率。这些结果从伪装的角度解释了黄额闭壳龟偏好落叶微生境,但极少出现在石质和裸地的行为生态学原因。
| 基质类型 Substrate |
样本量 Sample size |
样方数量 Quadrat number |
平均值±标准差 x±SD |
最小值 Minimum |
最大值 Maximum |
| 落叶 | 4 | 20 | 0.430±0.024a | 0.419 6 | 0.442 1 |
| 倒木 | 4 | 20 | 0.414±0.016b | 0.407 0 | 0.422 4 |
| 裸地 | 4 | 19 | 0.389±0.026c | 0.376 3 | 0.401 3 |
| 石质 | 4 | 19 | 0.387±0.023c | 0.375 5 | 0.397 7 |
| 注:所有GabRat数据均呈正态分布且方差同质,小写字母表示LSD多重比较结果(P<0.01) Notes: All GabRat data were normally distributed with homogeneous variances, lowercase letters represent multiple LSD comparison results (P<0.01) | |||||
虚假边缘在动物的混隐色伪装中具有非常重要的作用,它决定了动物的混隐程度。因此,量化动物轮廓周围的虚假边缘与连贯边缘的比例(混隐比率)是研究混隐色的最佳方法。本研究使用GabRat法测量的结果表明,黄额闭壳龟的背甲体色产生的虚假边缘具有明显的混隐作用。以往研究发现,混隐色动物的混隐作用受微生境基质影响(Stevens & Merilaita,2011),而使用加博过滤器测量图像中动物身体轮廓时是在基质背景中进行,能很好地体现动物与基质背景之间的相互作用。本研究发现黄额闭壳龟在其偏好的微生境基质中具有较高的混隐比率,符合预期假设,表明了GabRat法的生物学合理性,这不仅有助于理解混隐色的定义和机制,也有利于解释混隐色的生态适应性。因此,利用GabRat法量化脊椎动物的混隐色是有效可行的,这对推动动物混隐色研究发展具有重要意义。此外,GabRat法简便易行,通过摄影和ImageJ处理后就能快速获取混隐比率,有利于在野外开展动物的混隐色研究。然而,GabRat法是模拟人类的视觉系统,研究混隐色时需要弄清具体捕食者的视觉系统。加博滤波器与人类视觉皮层的二维(形状)感受野剖面非常相似,具有良好的空间局部性和方向选择性(许伟等,2015),当捕食者视觉为类似的二维模式时,使用GabRat法研究猎物的混隐色会更加客观合理。同时,混隐色涉及斑纹的颜色,基于人类色觉的GabRat法适合研究三色视觉捕食者的混隐色猎物。
肖繁荣, 杨灿朝, 史海涛. 2015. 动物的伪装方式[J]. 四川动物, 34(6): 955-960. |
许伟, 赖惠成, 齐立飞, 等. 2015. 基于Gabor特征的人脸识别算法的对比研究与实现[J]. 激光杂志, 36(2): 41-44. |
Cott HB. 1940. Adaptive coloration in animals[M]. London: Methuen & Co. Ltd.
|
Kang C, Stevens M, Moon JY, et al. 2014. Camouflage through behavior in moths:the role of background matching and disruptive coloration[J]. Behavioral Ecology, 26(1): 45-54. |
Lovell PG, Ruxton GD, Langridge KV, et al. 2013. Egg-laying substrate selection for optimal camouflage by quail[J]. Current Biology, 23(3): 260-264. DOI:10.1016/j.cub.2012.12.031 |
Osorio D, Srinivasan MV. 1991. Camouflage by edge enhancement in animal coloration patterns and its implications for visual mechanisms[J]. Proceedings of the Royal Society B:Biological Sciences, 244(1310): 81-85. DOI:10.1098/rspb.1991.0054 |
Poulton EB. 1890. The colours of animals: their meaning and use, especially considered in the case of insects[M]. New York: Appleton.
|
Price N, Green S, Troscianko J, et al. 2019. Background matching and disruptive coloration as habitat-specific strategies for camouflage[J]. Scientific Reports, 9(1): 1-10. DOI:10.1038/s41598-018-37186-2 |
Shi HT, Hou M, Pritchard P, et al. 2013. Identification manual for the conservation of turtles in China[M]. Beijing: Encyclopedia of China Publishing House.
|
Stevens M, Merilaita S. 2011. Animal camouflage:mechanisms and function[M]. Cambridge: Cambridge University Press.
|
Stevens M, Parraga CA, Cuthill IC, et al. 2007. Using digital photography to study animal coloration[J]. Biological Journal of the Linnean Society, 90(2): 211-237. DOI:10.1111/j.1095-8312.2007.00725.x |
Thayer GH. 1909. Concealing-colouration in the animal kingdom: an exposition of the laws of disguise through colour and pattern, being a summary of Abbot H. Thayer's discoveries[M]. New York: Macmillan.
|
Troscianko J, Benton CP, Lovell PG, et al. 2009. Camouflage and visual perception[J]. Philosophical Transactions of the Royal Society B, 364(1516): 449-461. DOI:10.1098/rstb.2008.0218 |
Troscianko J, Skelhorn J, Stevens M. 2017. Quantifying camouflage: how to predict detectability from appearance[J/OL].BMC Evolutionary Biology, 17(1): 7[2020-03-30]. https://doi.org/10.1186/s12862-016-0854-2.
|
Troscianko J, Stevens M, Rands S. 2015. Image calibration and analysis toolbox-a free software suite for objectively measuring reflectance, colour and pattern[J]. Methods in Ecology and Evolution, (11): 1320-1331. |
Xiao F, Wang J, Shi H, et al. 2017. Ecomorphological correlates of microhabitat selection in two sympatric Asian box turtle species (Geoemydidae:Cuora)[J]. Canadian Journal of Zoology, 95(10): 753-758. DOI:10.1139/cjz-2016-0218 |
Xiao F, Yang C, Shi H, et al. 2016. Background matching and camouflage efficiency predict population density in four-eyed turtle (Sacalia quadriocellata)[J]. Behavioural Processes, 131: 40-46. DOI:10.1016/j.beproc.2016.08.007 |
 2021, Vol. 40
2021, Vol. 40




