扩展功能
文章信息
- 宋文皓, 刘丹梅, 杨君
- SONG Wenhao, LIU Danmei, YANG Jun
- 抗柞蚕核型多角体病毒病免疫卵黄抗体制备和防治效果研究
- Study on the Preparation and Control Effect of Egg Yolk Immunoglobulin of Anti-ApNPV
- 四川动物, 2020, 39(6): 652-657
- Sichuan Journal of Zoology, 2020, 39(6): 652-657
- 10.11984/j.issn.1000-7083.20200120
-
文章历史
- 收稿日期: 2020-04-08
- 接受日期: 2020-08-20
2. 四川农业大学动物与科技学院, 成都 611130;
3. 大连理工大学生物工程学院, 辽宁大连 116024
2. College of Animal Science and Technology, Sichuan Agricultural University, Chengdu 611130, China;
3. College of Bioengineering, Dalian University of Technology, Dalian, Liaoning Province 116024, China
柞蚕Antheraea pernyi属鳞翅目Lepidoptera天蚕蛾科Saturniidae,是一种完全变态昆虫,其地理种群、生态类型有上百种,分布在我国10多个省(姜义仁,秦利,2011;刘丹梅等,2019)。柞蚕作为一种野外养殖的经济型昆虫,为我国经济发展和农民致富做出了重大贡献(徐晓男,2019)。柞蚕蚕丝蛋白对生物医学应用具有很大的潜在价值(Silva et al., 2019)。柞蚕脓病是由柞蚕核型多角体病毒(Antheraea pernyi nuclear polyhedrosis virus,ApNPV)引起的,是柞蚕养殖的主要病害,主要发生在幼虫期和蛹期,染病后的小蚕体和蛹出现明显的发病症状(赵江涛,2018)。由于蚕种、气象、病原等多种因素,柞蚕脓病容易爆发,一般年份危害率约15%,大爆发年份发病率可达80%以上。柞蚕脓病目前尚无良药可防治,预防措施以消毒为主(徐国东,2013;夏润玺,秦利,2015;赵江涛,2018)。该病的爆发会大大减损蚕农养蚕的积极性,使柞蚕的生产及研究严重受限(魏庆国等,2009;张金福,2017)。
免疫卵黄抗体(egg yolk immunoglobulin,IgY)技术是利用高产母鸡接受细菌、病毒等外来微生物抗原的剌激后产生免疫应答反应,生成相应抗体且主要富积在鸡蛋蛋黄中的特点,以产蛋母鸡作为生物反应器,大量连续生产特异性卵黄抗体的技术(Rǜdiger et al., 2004;李晓宇等,2014;王业华等,2019)。IgY被美国FDA认定为“公认安全类(GRAS)”物质。由于IgY不在兽药或生物制品管理范畴内,生产和应用无需批准文号(李晓宇等,2014),且更加经济实用、绿色高效、免疫原性强、操作便捷、费用低,作为一种具有诸多优势的饲料添加剂发展迅速(邱涛涛等,2019;王业华等,2019)。研究表明,在家蚕Bombyx mori脓病病毒(何丽华等,2003)、抗猪流行性腹泻病毒(覃有曼,2019)和大口黑鲈Micropterus salmoides弹状病毒(袁雪梅等,2019)等的卵黄抗体技术都取得都了良好的预防或治疗效果。本研究建立了抗ApNPV IgY有效制备的较为完整的技术体系,用酶联免疫试验鉴定了存在抗原和抗体反应并测定了其效价,通过饲喂试验对IgY预防柞蚕脓病的效果进行了探讨,为柞蚕脓病的防治探索了一条新途径。
1 材料及方法 1.1 材料及主要试剂蒙古栎Quercus mongolica又称柞树,柞树叶和柞蚕品种青6号由辽宁省蚕业科学研究所提供。140日龄蛋鸡由大连天德牧业有限公司提供。
弗氏完全佐剂、弗氏不完全佐剂购自Sigma-Aldrich公司。灭活疫苗组抗原使用双推法(吴琼,2013)乳化制成疫苗,冰箱冷藏室保存。
1.2 方法 1.2.1 免疫卵黄抗体的制备和效价测定采用皮下肌肉注射灭活疫苗免疫蛋鸡获得抗ApNPV IgY。采集静脉血,收集血清。在第一次免疫后每周取蛋,第4周进行第三次免疫后,每日取蛋,收集卵黄,用蒸馏水稀释成IgY水溶性组分,以最适抗原浓度进行包被,检测免疫卵黄中的特异性卵黄抗体效价随时间的变化,测定第7天、第14天、第21天、第28天的IgY效价,4周后测定每天的IgY效价。其中最适包被浓度选择阳性对照OD450/630=0.8,且阴性对照OD450/630 < 0.1的抗原稀释液。
1.2.2 酶联免疫吸附法(ELISA)使用最佳包被浓度的病毒液包被,4 ℃过夜,清洗后37 ℃封闭2 h。清洗后,将不同免疫周次收集的免疫卵黄水溶性组分按适当比例倍比稀释制成一抗,PBS作空白对照,阴性对照组免疫卵黄水溶性组分按对应实验组稀释比例进行稀释,加入98孔酶标版,温育。清洗,加入1: 5 000倍稀释的兔抗鸡IgG-HRP,温育。清洗,加入TMB(底物)单组份显色液,室温避光显色20 min。每孔迅速加入终止液50 μL。用酶标仪检测,选择实验组OD值为阴性对照组,平均值2.1倍条件下的稀释倍数作为抗体效价。
1.2.3 安全性试验将5 mL稀释50倍的最高效价的IgY涂抹到每片柞树叶上,阴干后分别给1~3龄蚕添食1次,4龄蚕添食2次,5龄蚕添食3次。饲喂抗体叶的为添食组,饲喂未处理的柞树叶的为空白对照组。
1.2.4 饲喂试验检测最高效价下IgY不同稀释倍数和同时添食IgY对柞蚕脓病的防治效果。将最高效价IgY一定倍数的稀释液涂抹在叶片上,阴干后制成抗体叶;阴干后再涂上ApNPV液,制成抗体-病毒的混合叶。
不同稀释倍数的IgY对柞蚕脓病的防治效果方案见表 1,将最高效价的卵黄分别用磷酸盐缓冲液(PBS)稀释0、16、32、64、128、256倍,制成抗体-病毒混合叶饲喂柞蚕;继续将发病率最低的稀释倍数的卵黄作为A组,同时设置只添加PBS的非免疫卵黄对照B组、只涂抹ApNPV的病毒叶的攻毒对照C组和正常饲养的空白对照D组。添食IgY的试验方案见表 2,处理方式1完成后给叶方式更换为处理方式2。每组设3个重复,均在不同的蚕箱分开饲养。
| 分区 | 稀释倍数 | 重复区数 | 供试蚕/(头/区) |
| A.免疫卵黄 | 0 | 3 | 20 |
| 16 | 3 | 20 | |
| 32 | 3 | 20 | |
| 64 | 3 | 20 | |
| 128 | 3 | 20 | |
| 256 | 3 | 20 | |
| B.非免疫卵黄对照 | 3 | 20 | |
| C.攻毒对照 | 3 | 20 | |
| D.空白对照 | 3 | 20 |
| 分区 | 处理方式1 | 处理方式2 | 重复区数 | 供试蚕/(头/区) |
| A' | 抗体-病毒混合叶24 h | 普通叶 | 3 | 20 |
| B' | 抗体-病毒混合叶24 h | 抗体叶24 h | 3 | 20 |
| C' | 抗体-病毒混合叶24 h | 抗体叶48 h | 3 | 20 |
| D' | 病毒叶24 h | 抗体叶24 h | 3 | 20 |
| E'.攻毒对照组 | 病毒叶24 h | 普通叶 | 3 | 20 |
| F'.空白对照组 | 普通叶 | 普通叶 | 3 | 20 |
所有试验至少进行3次,每次3个生物学重复。采用独立样本t检验对各组进行比较。数据由GraphPad Prism计算,P < 0.05表示差异有统计学意义。
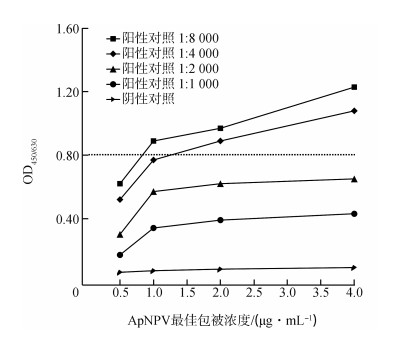
2 结果与分析 2.1 抗原最适包被浓度的确定当抗原浓度为1.0 μg·mL-1且阳性对照为1: 4 000时,OD450/630值最接近0.8(图 1),且此时阴性对照的OD450/630=0.054。因此,选取1.0 μg·mL-1作为最适包被浓度。
|
| 图 1 抗原最适包被浓度 Fig. 1 Optimal concentration of antigen coating |
| |
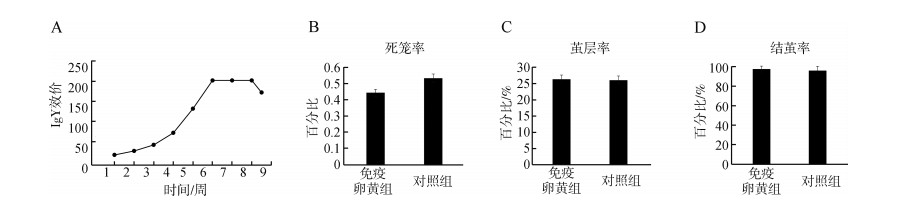
免疫后的卵黄抗体效价升高,并且从第三次免疫开始抗体效价显著上升,第6周、第7周、第8周效价达到最高值(1: 210)并保持不变,随后效价开始下降(图 2:A)。因此,选定最高效价时的卵黄,在柞蚕饲喂试验中制备复合饲料。
|
| 图 2 免疫卵黄抗体效价和安全性试验结果 Fig. 2 IgY titer and security test results |
| |
安全性试验结果表明,免疫卵黄组和对照组所有重复区蚕的死笼率低、茧层率和结茧率良好(图 2:B~D),差异无统计学意义(P>0.05),蚕体无任何异常症状。
2.3 抗ApNPV IgY对柞蚕饲喂试验制备6~8周的鸡源IgY,效价为1: 210,进行饲喂试验。
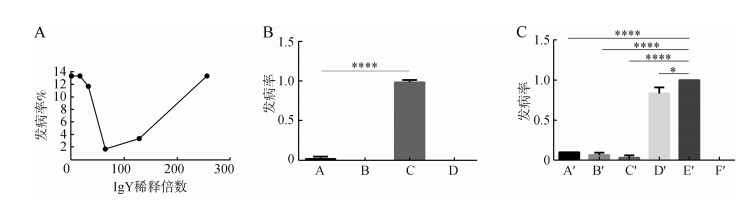
2.3.1 不同稀释倍数的IgY对柞蚕脓病的防治效果稀释倍数为64倍时的发病率最低,仅1.67%,其他稀释倍数的发病率分别为:0倍13.33%、16倍13.33%、32倍11.67%、128倍3.33%和256倍13.33%(图 3:A)。同时非免疫卵黄对照组和空白对照组无发病蚕,证明柞蚕良好,添食方式正确,攻毒对照组中柞蚕脓病发病率达98.33%,64倍卵黄稀释液发病率极显著降低(P < 0.000 1)(图 3:B)。
|
| 图 3 免疫卵黄抗体饲喂试验结果 Fig. 3 The results of feeding test of anti-ApNPV IgY *P < 0.05,****P < 0.000 1 |
| |
A'组发病率为10%、B'组为5%、C'组为3.33%、D'组为83.33%,攻毒对照组和空白对照组分别为100%和0%(图 3:C)。A'、B'、C'组的发病率与攻毒对照组之间的差异有高度统计学意义(P < 0.000 1)。同时,与攻毒对照组相比,D'组的发病率也显著降低(P < 0.05)。
3 结论与讨论卵黄抗体能够很好地中和特定病毒(张璐等,2017),相较于其他抗体具有一些显著的优势:外来抗原的需求量较小(高岭,2014)、产蛋鸡有较长的周期可产生抗体(Edzard et al., 2012)、抗体量较大且成本低、避免了动物应激反应、化学性质稳定等(高岭等,2013)。柞蚕脓病发生给蚕养殖业带来极大的困难。由于缺乏特效药物,目前主要是一些消毒手段,操作繁琐、预防不彻底、经济效益低,并且卵黄抗体技术在柞蚕脓病防治方面的研究和应用匮乏。特异性卵黄抗体的有效制备存在安全性问题和技术难点,如IgY最适包被浓度、抗体效价、卵黄抗体稀释倍数、对特定物种的饲喂方式。本研究采用ApNPV抗原免疫蛋鸡制备的特异性多克隆卵黄抗体,通过合理的饲喂可使柞蚕脓病发病率降低,是预防柞蚕脓病的良好生物制品。
本研究用灭活的ApNPV免疫产蛋母鸡收集卵黄,使用酶联免疫吸附试验测定卵黄抗体效价,并利用合适效价的卵黄制备柞蚕饲喂试验的复合饲料。选择纯化ApNPV的OD值为0.396,在免疫效果最佳时的抗原量为10~1 000 μg·mL-1(Rǜdiger,2001);通过酶联免疫吸附法检测ApNPV的最适包被浓度为1.0 μg·mL-1,以此作为测定效价的浓度,测得的最高卵黄抗体效价为1: 210;效价从第4周开始明显上升,第6周达到最高且持续3周,第8周结束后开始下降,因此可以选取第6、7、8周的鸡蛋大量提取卵黄进行安全性试验和制备复合饲料;安全性试验中免疫卵黄组和对照组的死笼率、茧层率和结茧率之间的差异均无统计学意义,说明抗ApNPV IgY安全可用;在柞蚕饲喂试验中,测定了6~8周最高效价的卵黄抗体最佳稀释倍数为64倍,此时柞蚕脓病发病率最低(1.67%),说明抗ApNPV IgY能够显著降低柞蚕脓病的发病率;此外,首先饲喂抗体-病毒混合的A'、B'、C'组的发病率均极显著降低,D'组发病率显著高于前3组,但也显著低于攻毒对照组,说明IgY对柞蚕脓病有显著的预防作用和治疗效果。预防和治疗效果相比,采取预防手段饲喂柞蚕可以更有效地阻断柞蚕脓病的发生。
何丽华等(2003)用家蚕核型多角体病毒为抗原给蛋鸡注射后,获得卵黄抗体的效价为1: 160。本研究测得的最高卵黄抗体效价为1: 210。与家蚕NPV卵黄抗体的效价差异可能是因为两者为不同物种,并且检测效价的方案不同。死笼率、结茧率、茧层率被用来判断家蚕品种的生命力(司马杨虎等,2007;冉瑞法,2012),在安全性试验中通过检测死笼率、结茧率和茧层率来确定抗ApNPV IgY对柞蚕的正常发育是否有影响,用稀释50倍的免疫卵黄与正常食物作为对照饲喂柞蚕,两组间差异无统计学意义,说明抗ApNPV IgY安全可用。此外,IgY的稀释倍数(闵嗣璠等,2007;任春芝,2011;赵鹏等,2014)和对动物的饲喂方式(何丽华等,2003;李厚伟等,2018)是影响卵黄抗体作用效果的关键因素。因此本研究在柞蚕饲喂试验中,检测了不同稀释倍数的IgY和添食IgY的方式,以此探索ApNPV IgY对柞蚕脓病的防治效果。本研究制备的抗ApNPV IgY在选择正确稀释倍数和饲喂方式下可以有效预防柞蚕脓病及存在治疗效果,为ApNPV的综合防治提供了一种有效的预防手段和参考。
高岭, 刘聚祥, 杨娜娜. 2013. 鸡卵黄抗体及其在养猪业中的应用研究进展[J]. 动物医学进展, 34(5): 110-114. |
高岭. 2014.猪传染性胃肠炎病毒与猪流行性腹泻病毒卵黄抗体的制备及纯化工艺研究[D].河北: 河北农业大学.
|
何丽华, 曾健, 骆承军, 等. 2003. 免疫卵黄抗体预防家蚕血液型脓病的探讨[J]. 蚕桑通报, 34(3): 27-29. |
姜义仁, 秦利. 2011.柞蚕种质资源研究: 回顾与展望[C].中国蚕学会第八届暨国家蚕桑产业技术体系家(柞)蚕遗传育种及良种繁育学术研讨会论文集.
|
李厚伟, 孙林杰, 孙永珍, 等. 2018. 小鹅瘟冻干卵黄抗体被动免疫持续期研究[J]. 中国兽药杂志, 52(4): 10-16. |
李晓宇, 徐永平, 尤建嵩, 等. 2014.特异性卵黄抗体作为药效营养品在饲料中的应用[C]//李爱科, 李绍钰.中国畜牧兽医学会动物营养学分会第七届中国饲料营养学术研讨会论文集.北京: 中国农业大学出版社.
|
刘丹梅, 李文利, 王丹丹, 等. 2019. 基于RAPD标记对71个柞蚕品种的聚类分析[J]. 江苏农业科学, 47(11): 61-66. |
闵嗣璠, 肖锡湘, 王萍, 等. 2007. 稀释倍数和处理时间对水稀释法提取鸡卵黄抗体的影响[J]. 西北农业学报, 16(1): 229-231. |
邱涛涛, 徐振林, 甘庆庆, 等. 2019. 卵黄抗体体内代谢及中和毒素研究进展[J]. 食品科学, 40(5): 303-308. |
冉瑞法. 2012. 家蚕少回育对全茧量和茧层率的影响[J]. 安徽农业科学, 392(31): 15285-15287. |
任春芝. 2011.鸡球虫多价卵黄抗体IgY的制备及其抗球虫效果评价[D].江苏: 扬州大学.
|
Rǜdiger S, 张小莺, 郑礼. 2004. IgY技术及其医药应用:理论基础[J]. 中国药理学通报, 20(5): 491-495. |
司马杨虎, 何斯美, 钱荷英, 等. 2007. 家蚕茧丝量性状和生命力性状的综合选择研究[J]. 蚕业科学, 2007(4): 646-649. |
覃有曼. 2019. 猪流行性腹泻病毒卵黄抗体治疗效果分析[J]. 今日畜牧兽医, 35(8): 83-84. |
王业华, 单春乔, 冯柳柳, 等. 2019. 卵黄抗体在病毒性疾病防治中的应用[J]. 动物医学进展, 40(7): 120-124. |
魏庆国, 陈凤林, 孙勇. 2009. 2008年辽宁省秋柞蚕脓病大发生原因浅析[J]. 北方蚕业, 30(1): 39-40. |
吴琼. 2013.抗仔猪腹泻卵黄抗体膏的研制及应用[D].辽宁: 大连理工大学.
|
夏润玺, 秦利. 2015. 柞蚕常见病害及防治(一)[J]. 中国蚕业, 36(2): 92-94. |
徐国东. 2013. 柞蚕脓病的防治措施[J]. 农民致富之友, 2013(9): 127. |
徐晓男. 2019. 浅谈凤城市柞蚕产业存在问题及建议[J]. 新农业, 2019(19): 51-52. |
袁雪梅, 吕孙建, 施伟达, 等. 2019. 大口黑鲈弹状病毒的分离培养及其卵黄抗体的制备[J]. 渔业科学进展, 41(3): 151-157. |
张金福. 2017. 柞蚕主要病害的发病诱因及预防措施[J]. 吉林农业, 2017(19): 82. |
张璐, 刘珍珍, 宁长申, 等. 2017. IgY在免疫检测及治疗中的应用进展[J]. 动物医学进展, 38(1): 78-81. |
赵江涛. 2018. 柞蚕脓病的发生与防治[J]. 现代农业科技, 2018(24): 239-240. |
赵鹏, 李德庆, 董宣, 等. 2014. SPF鸡感染禽白血病病毒A/B亚群后血清抗体与卵黄抗体的变化及其相关性[J]. 畜牧兽医学报, 45(4): 614-620. |
Edzard S, Ingke B, Kerstin G, et al. 2012. Avian IgY antibodies and their recombinant equivalents in research, diagnostics and therapy[J]. Biologicals, 40(5): 1045-1056. |
Rǜdiger S. 2001. Chicken egg yolk antibodies, production and application[M]. Berlin, Heidelberg: Springer.
|
Silva SS, Kundu B, Lu S, et al. 2019. Chinese oak tasar silkworm Antheraea pernyi silk proteins: current strategies and future perspectives for biomedical applications[J/OL]. Macromolecular Bioscience, 19(3): e1800252[2020-02-20]. https://doi.org/10.1002/mabi.201800252.
|
 2020, Vol. 39
2020, Vol. 39




