扩展功能
文章信息
- 吴小清, 柳梦雨, 伍勇, 王刚
- WU Xiaoqing, LIU Mengyu, WU Yong, WANG Gang
- 峨眉齿蟾蝌蚪功能性状种内变异的研究
- Study of Intraspecific Variation in Functional Traits of Oreolalax omeimontis Tadpoles
- 四川动物, 2020, 39(5): 508-516
- Sichuan Journal of Zoology, 2020, 39(5): 508-516
- 10.11984/j.issn.1000-7083.20200075
-
文章历史
- 收稿日期: 2020-03-05
- 接受日期: 2020-06-29
2. 成都师范学院生态环境保护研究所, 成都 611130
2. Institute of Ecological Environment Protection, Chengdu Normal University, Chengdu 611130, China
在传统的生物多样性研究中, 生态学家主要关注物种本身, 强调物种丰富度在生态系统中的重要性(Tilman, 1997)。但实际上生物多样性是一个集合的概念, 涵盖了诸多方面(Gaston, 1996;Purvis & Hector, 2000)。因为每一个物种在生态系统中扮演的角色和功能各不相同, 单纯的关注物种丰富度不能准确地解析生物多样性和生态系统功能之间的关系(Lavorel & Garnier, 2002;Bolnick et al., 2011)。因此, 近20年来, 越来越多的生态学家提出了功能生态学的概念, 建议用功能多样性这一生物多样性的重要组成部分来解析种群生态学和群落生态学的诸多问题, 如物种与物种之间的关系、群落形成机制、生物多样性对干扰的响应, 以及生产率和营养循环等生态系统过程等(Rudolf, 2006, 2008;Yang et al., 2014;Zhao et al., 2019a)。
功能多样性需要根据物种的功能性状和其在群落中所占的丰度来进行计算(Villéger et al., 2008)。而功能性状则指那些能够影响生物体自身状况的生物体特性, 如植物的功能性状涉及其生长(如植物高度和植物结构)、形态(如叶片面积和厚度)和营养组成(如C: N比值和叶片干重)等(Díaz et al., 2013)。而大多数动物的功能性状主要通过生态形态学性状(即形态学性状的比值)来获取, 以反映其在生态系统中的重要功能(Zhao et al., 2017), 如蝌蚪的摄食和栖息地利用(Strauß et al., 2010)、鸟类的觅食运动(Ricklefs, 2012), 以及鱼类的摄食和运动(Zhao et al., 2014)等。在最初的功能生态学研究中, 生态学家常常假设功能性状的种内变异远远小于种间变异, 因而采用同一物种多个个体功能性状的平均值来进行计算(Villéger et al., 2010;Ricklefs, 2012)。但随着研究的深入, 生态学家逐渐发现同一物种不同个体的生物学和生态学性状也存在差异(如繁殖力、寿命和大小等;Bolnick et al., 2011)。针对这一发现, 生态学家进一步揭示了功能性状种内变异和种间变异的程度可能同样重要, 并据此提出了基于个体的功能生态学(individual based functional ecology)的概念(Bolnick et al., 2011)。
随着这一概念的提出, 生态学家们陆续对植物和动物功能性状的种内变异进行了研究, 不仅揭示了生物体功能性状种内变异的产生可能由多种原因造成, 还发现这种变异同样会对生态系统功能产生重要影响。如Auger和Shipley(2013)对加拿大高特自然保护区落叶乔木林群落的功能性状进行了研究, 发现种内变异占群落中功能性状总变异的28%, 主要与栖息地及其外界环境因子相关。而Zhao等(2014)揭示了大口黑鲈 Micropterus salmoides 功能性状的种内变异系数在5%~32%之间, 主要与其个体发育和食性分化相关。但现有功能性状种内变异的研究集中于植物、无脊椎动物和鱼类等, 对两栖动物特别是其幼体蝌蚪的关注较少。蝌蚪在淡水生态系统中具有重要的作用, 通过摄食和运动影响水体中初级消费者的丰度和组成, 进而影响生态系统功能和过程(Ranvestel et al., 2004;Connelly et al., 2008)。因此, 揭示蝌蚪功能性状的种内变异不仅可以为我们提供两栖动物多样性保护的基础数据, 还能帮助我们更好地了解蝌蚪多样性和淡水生态系统之间的关系, 丰富生物多样性和生态系统功能关系的理论。本研究以峨眉齿蟾 Oreolalax omeimontis 蝌蚪为研究对象, 通过计算该物种不同发育阶段在功能生态位中占据的空间, 采用3个指标(功能丰富度、功能定位和不同发育阶段功能生态位的重叠度)对其功能性状的种内变异进行研究。
1 材料与方法 1.1 模式动物和标本峨眉齿蟾隶属两栖纲Amphibia无尾目Anura角蟾科Megophryidae齿蟾属 Oreolalax , 主要分布在四川峨眉、洪雅等地(费梁等, 2012), 被世界自然保护联盟(IUCN)濒危物种红色名录列为濒危(EN)等级(IUCN, 2016)、《中国两栖动物受威胁现状评估》(江建平等, 2016)列为易危(VU)物种, 亟需开展保护生物学的相关研究工作。为了不对动物的野生资源造成破坏, 从中国科学院成都生物研究所两栖爬行动物标本馆借阅了85号峨眉齿蟾蝌蚪福尔马林浸制标本开展相关研究工作。这些标本均在1963年9月由研究人员采用手抄网随机采集于四川峨眉山扁担沟, 能较好地代表当地的峨眉齿蟾蝌蚪野生种群。随着全球生物多样性的急速下降, 福尔马林浸制标本在科学研究中扮演着越来越重要的角色, 已经被全球科学家广泛应用于系统学(Huang et al., 2016)、形态学(Arratia & Quezada-Romegialli, 2017)、生态学(Zhao et al., 2017;许丹等, 2020)和骨骼学(Zhang et al., 2019)研究。
1.2 数据获取动物在生态系统中具有多种功能性表现, 如摄食、运动、营养循环、繁殖和反捕食等, 而每一种功能性表现均可采用对应的功能性状来进行描述(Villéger et al., 2017)。在蝌蚪功能生态学研究中, 常常关注其在水生生态系统中最主要的2个功能性表现, 即摄食和运动(Zhao et al., 2017;许丹等, 2020)。因此, 一般采用多个生态形态学性状对蝌蚪的这2个功能性表现进行描述。一方面这些性状被广泛认为能在某种程度上反映蝌蚪的功能性表现, 另一方面也满足功能生态学研究中选取功能性状的准则:即功能性状需要较为容易地在大批量样本中获取以便于开展计算和研究(Dumay et al., 2004)。参考Zhao等(2017)和许丹等(2020)的研究, 共选取了10个蝌蚪的生态形态学性状作为其功能性状(表 1)。作为无单位的比值, 这些功能性状能够较好地排除蝌蚪个体大小对形态学变化的干扰(Winemiller, 1991;Villéger et al., 2010)。在这10个功能性状中, 体质量的对数转换值同时与蝌蚪的摄食和运动功能相关;口器形状、口器位置和眼睛位置等3个功能性状和蝌蚪的摄食功能相关;而尾部形状、尾部位置、尾部控制方式、身体形状、躯干弯曲形状和出水孔位置等6个功能性状与蝌蚪的运动功能相关。每一个功能性状都具有其特殊的生态学意义, 如口器位置反映了蝌蚪在水体中捕食的位置, 口器形状反映了蝌蚪的主要食物来源及获取, 而尾部控制方式则反映了蝌蚪在水体中运动的推进能力和机动性。
| 功能性状 Functional traits |
主要功能 Function |
公式 Formula |
生态学意义 Ecological meaning |
| 体质量 | 捕食/运动 | log(M+1) | 体积, 肌肉质量 |
| 口器位置 | 捕食 | OD/BL | 水中捕食的位置 |
| 口器形状 | 捕食 | OD/BMW | 主要食物及获取 |
| 眼睛位置 | 捕食 | IO/BMW | 发现食物的能力 |
| 尾部形状 | 运动 | TMW/BMW | 流体力学和耐力 |
| 尾部位置 | 运动 | TAL/BL | 耐力、加速度和 /或机动性 |
| 尾部控制方式 | 运动 | TMH/BMH | 推进和/或机动性 |
| 身体形状 | 运动 | BMW/BMH | 水体中的位置 和流体力学 |
| 躯干弯曲形状 | 运动 | BL/TL | 游泳方式和耐力 |
| 出水孔位置 | 运动 | SS/BL | 游泳和流体力学 |
| 注 Notes:BL. 体长 body length, BMH. 体高 body maximum height, BMW. 体宽 body maximum width, IO. 眼间距 interocular distance, OD. 口宽 oral disk width, SS. 吻到出水孔距离 distance from tip of snout to opening of spiracle, TAL. 尾长 tail length, TL. 全长 total length, TMH. 尾高 tail muscle height, TMW. 尾肌宽 tail musclewidth | |||
实际上, 这些功能性状是由10个蝌蚪外部形态学性状计算所得, 包括了全长、体长、体高、体宽、尾长、尾肌宽、尾高、口宽、眼间距和吻到出水孔距离。每1号蝌蚪标本的这些外部形态学性状均结合游标卡尺和带有图像分析系统(Mc50-N)的体式解剖镜(JSZ8T;江南永新, 中国)在实验室中测量所得, 精确到0.01 mm。同时采用电子天平称量了每1号蝌蚪标本的体质量, 精确到0.01 g。此外, 每1号蝌蚪标本所处的发育时期根据Gosner(1960)的方法进行判定。为保证一致性, 形态学性状的测量和发育时期的判定工作均由同一人完成。
1.3 数据统计分析首先计算每一个功能性状的变异系数以反映单个性状种内变异的强度。然后参照赵尔宓(1990)的方法, 将85号峨眉齿蟾蝌蚪标本按照其所处的Gosner时期分为3个不同的发育阶段, 即胚胎发育期(Gosner 1~25期)、后肢芽发育期(Gosner 26~30期)和五趾分化期(Gosner 31~37期)。采用Kruskal-Wallis秩和检验计算各发育阶段的每一个功能性状之间的差异是否有统计学意义。接着参照许丹等(2020)的方法, 通过计算3个指标(功能丰富度、功能定位和不同发育阶段功能生态位的重叠度)来反映峨眉齿蟾蝌蚪功能性状在不同发育阶段的种内变异状况。
将85号峨眉齿蟾标本的10个功能性状进行离差标准化, 以赋予每个功能性状相同的权重, 得到均值为0, 方差为1的功能性状矩阵(Villéger et al., 2008)。接着对这个功能性状矩阵进行主成分分析(PCA), 选取特征值大于1的主成分构建多维功能生态位, 将每一个个体投放在功能生态位中。采用快速凸包算法(quickhull algorithm)计算每一个发育时期在功能生态位中所占据的空间(即凸多边形的体积), 得到每一个发育时期功能丰富度的实际测量值(Villéger et al., 2008)。通过计算每一个发育时期功能性状的丰度加权平均值来反映其功能定位(FIde):
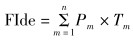
|
式中, Pm 表示个体 m 在其对应的发育阶段中的相对丰度, n 表示个体数, Tm 表示个体 m 的功能性状值。
采用非参数多元方差分析(PERMANOVA)检验3个发育阶段的功能定位差异是否有统计学意义。峨眉齿蟾蝌蚪3个发育阶段之间功能生态位的重叠度(FOve)是其两两之间所占据的功能生态位的共享体积,

|
式中, FRic(Sn)是发育阶段 n 所占据的凸多边形体积, FRic(Sm)是发育阶段 m 所占据的凸多边形体积, FRic(Sn∩Sm)是2个发育阶段占据的凸多边形体积的交集。FOve值越低, 表示2个发育阶段所占据的功能生态位差异越大, 反之则表明2个发育阶段所占据的功能生态位差异越小。
85号峨眉齿蟾蝌蚪标本处于Gosner 24~37期之间。其中有34号标本处于胚胎发育期(Gosner 24~25期)、22号标本处于后肢芽发育期(Gosner 26~28期)、29号标本处于五趾分化期(Gosner 31~37期)。为了消除每个发育阶段个体数的不同对功能丰富度和功能生态位的重叠度产生的影响, 进一步采用了自助法(bootstrap)从初始样本中进行随机替换抽样, 每次从3个发育阶段中分别抽取15号(前期忽略功能性状种内变异的研究常测量计算同一物种15号个体的平均值来代表该物种的功能性状值;Mason et al., 2008;Villéger et al., 2010)、22号(后肢芽发育期个体总数)和29号(五趾分化期个体总数)个体并重新计算每个发育阶段的功能丰富度和每2个发育阶段之间的功能生态位的重叠度。通过重复10 000次计算产生的平均值和95%置信区间来判定3个发育阶段的功能丰富度之间的差异是否有统计学意义。所有的计算和统计分析均在R中进行(R Development Core Team, 2011)。
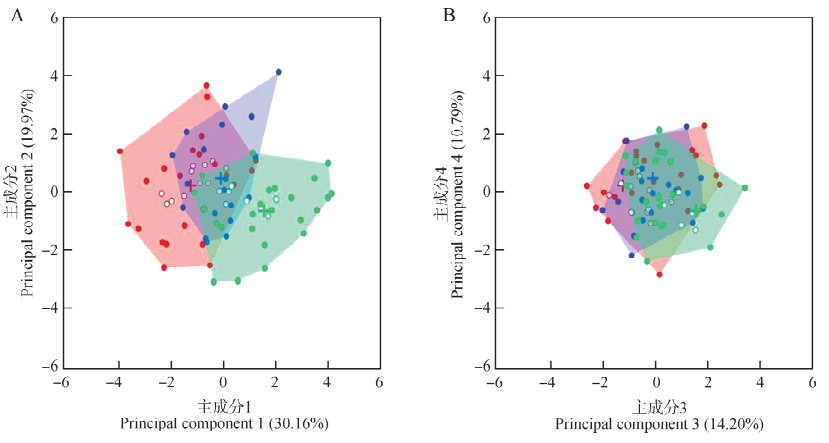
2 结果85号峨眉齿蟾蝌蚪标本中有34号标本处于胚胎发育期, 体全长为43.54 mm±7.13 mm;22号标本处于后肢芽发育期, 体全长为61.00 mm±7.39 mm;29号标本处于五趾分化期, 体全长为83.82 mm±10.18 mm。Kruskal-Wallis秩和检验的结果表明, 随着个体发育的进行, 10个功能性状中的体质量、眼睛位置、尾部形状、尾部位置、尾部控制方式和躯干弯曲形状等6个功能性状之间的差异有统计学意义(P < 0.05), 而口器位置、口器形状、身体形状和出水孔位置等4个功能性状虽然也会出现一定的变化, 但差异无统计学意义(P < 0.05)。根据PCA分析结果, 选取前4个主成分构建四维功能生态位。前4个主成分的特征值>1, 共解释了75.12%的总变异量(PC1=30.16%, PC2=19.97%, PC3=14.20%, PC4=10.79%)。其中, PC1主要与描述蝌蚪摄食功能与运动功能的功能性状相关, 随着PC1值的增加, 个体表现为体质量更大, 口器大而圆, 尾部高但尾柄较薄, 多采取背腹弯曲运动的方式, 虽然游泳时的耐力较差, 但却具有较强的推进能力和灵活性。PC2主要与描述蝌蚪摄食功能的功能性状相关, 随着PC2值的增加, 个体表现为体质量减小, 口器大而圆, 因此能捕获的食物范围越广(表 2)。
| 功能性状 Functional traits |
PC1 (30.16%) | PC2 (19.97%) | PC3 (14.20%) | PC4 (10.79%) |
| 体质量 | 0.75* | -0.23* | 0.20 | -0.10 |
| 口器位置 | 0.39* | 0.88* | -0.13 | 0.09 |
| 口器形状 | 0.33* | 0.72 | -0.26* | 0.52* |
| 眼睛位置 | 0.39* | 0.47 | 0.10 | -0.65* |
| 尾部形状 | 0.80* | 0.09 | 0.27* | -0.28* |
| 尾部位置 | 0.81* | -0.43* | -0.20 | 0.23* |
| 尾部控制方式 | 0.27* | 0.11 | 0.72* | 0.13 |
| 身体形状 | -0.13 | 0.07 | 0.75* | 0.42* |
| 躯干弯曲形状 | -0.79* | 0.44* | 0.22* | -0.22* |
| 出水孔位置 | 0.13 | 0.17 | -0.20 | 0.05 |
| 注 Note:* P < 0.001 | ||||
在10个功能性状中, 体质量对数值的变异系数最大, 达到48.78%;出水孔位置的变异系数最小, 为5.38%;口器位置为10.78%, 口器形状为9.64%, 眼睛位置为7.08%, 尾部形状为13.60%, 尾部位置为9.97%, 尾部控制方式为11.27%, 身体形状为8.30%, 躯干弯曲形状为6.15%(图 1)。全部功能性状变异系数的平均值为13.95%±12.79%。功能丰富度实测值的计算结果表明, 峨眉齿蟾蝌蚪胚胎发育期为31.08%(n=34), 后肢芽发育期为11.29%(n=22), 五趾分化期为18.76%(n=29)。功能丰富度bootstrap的计算结果表明, 当从3个发育阶段内分别随机抽样15号个体时, 胚胎发育期的功能丰富度为9.09%±3.47%, 后肢芽发育期的功能丰富度为5.99%±1.45%, 五趾分化期的功能丰富度为7.52%±2.00%。通过比较95%置信区间, 3个发育阶段的功能丰富度之间的差异无统计学意义。当随机抽样22号个体时, 胚胎发育期的功能丰富度为17.44%±4.14%, 五趾分化期的功能丰富度为13.52%±1.83%。通过比较95%置信区间, 二者的功能丰富度之间的差异无统计学意义(表 3)。当随机抽样29号个体时, 胚胎发育期的功能丰富度为25.51%±3.33%。非参数多元方差分析结果表明, 峨眉齿蟾蝌蚪3个发育阶段在四维功能生态位中的功能定位之间的差异有统计学意义(P < 0.001;图 2)。此外, 胚胎发育期和后肢芽发育期之间功能生态位重叠度的实测值为17.08%, 胚胎发育期和五趾分化期之间功能生态位重叠度的实测值为1.12%, 后肢芽发育期和五趾分化期之间功能生态位重叠度的实测值为4.41%。随机抽样15号个体时, 胚胎发育期和后肢芽发育期之间的功能生态位重叠度为8.24%±4.77%, 胚胎发育期和五趾分化期之间为0.08%±0.20%, 后肢芽发育期和五趾分化期之间为1.24%±1.31%。随机抽取22号个体时, 胚胎发育期和五趾分化期之间的功能生态位重叠度为0.33%±0.40%。

|
| 图 1 不同发育阶段峨眉齿蟾蝌蚪10个功能性状的平均值和标准差 Fig. 1 Bar plots of the mean and SD values of 10 functional traits belonging to different stages of Oreolalax omeimontis tadpoles 红色.胚胎发育期, 蓝色.后肢芽发育期, 绿色.五趾分化期;圆点表示异常值 Red. embryonic stage, Blue. hind limb bud stage, Green. five-toed stage; the dots indicate the outliers |
| |
| 发育阶段 Stage |
功能丰富度Functional richness | ||||
| 个体数 Individual number |
实测值 Observed value |
Bootstrapped (n=15) |
Bootstrapped (n=22) |
Bootstrapped (n=29) |
|
| 胚胎发育期 | 34 | 31.08% | 3.78%~17.00% | 10.43%~26.09% | 18.30%~30.52% |
| 后肢芽发育期 | 22 | 11.29% | 3.42%~8.76% | — | — |
| 五趾分化期 | 29 | 18.76% | 4.06%~11.59% | 9.85%~17.04% | — |
|
| 图 2 峨眉齿蟾蝌蚪不同发育阶段在功能生态位中的分布情况 Fig. 2 The distribution of different stages of Oreolalax omeimontis tadpoles in the 4 dimensional functional niche A.构成四维功能生态位的PC1和PC2轴, B.构成四维功能生态位的PC3和PC4轴;彩色多边形代表各发育阶段的功能丰富度(多边形体积);实心圆点代表各发育阶段在四维功能生态位中分别形成的多边形的顶点;红色圆点:胚胎发育期个体;蓝色圆点:后肢芽发育期个体;绿色:五趾分化期个体 A. PC1 and PC2 axes of the four dimensional functional niche, B. PC3 and PC4 of the four dimensional functional niche; Colored polygons represent the functional richness (convex hull volume) of each stage, and filled points are vertices of the convex hull computed in four dimensions; red, blue, and green circles represent individuals in embryonic stage, the hind limb bud stage, and the five-toed stage, respectively |
| |
本研究探讨了峨眉齿蟾蝌蚪功能性状的种内变异情况, 通过变异系数揭示了各功能性状的种内变异大小存在差异, 但约14%的平均变异系数提示我们在未来的蝌蚪功能生态学研究中不能简单采用平均值来反映物种的功能性状, 而应充分考虑物种功能性状的种内变异。尽管这种种内的变异并非在全部功能性状中呈现出显著性差异, 但大多数与运动相关的功能性状均随个体发育在不同阶段呈现显著性差异(如体质量、尾部形状、尾部位置、尾部控制方式和躯干弯曲形状等), 表明峨眉齿蟾蝌蚪的运动方式和运动能力随着发育的进行而出现了明显的变化。这与其他类群的动物在个体发育中的表现一致, 如鱼类(Zhao et al., 2014)和哺乳类(Wells & Turnquist, 2001)等, 即随着个体发育的进行, 动物会改变与运动相关的功能性状以增强其运动能力, 从而更好地适应其生存的栖息地(Prondvai et al., 2018)。
此外, 尽管峨眉齿蟾蝌蚪不同发育阶段功能丰富度的实测值和随机抽样值之间的差异均不具有统计学意义, 但其功能定位之间的差异却有统计学意义。而三者之间功能生态位重叠度的实测值和随机抽样值均较低。以上3个指标的计算结果反映了峨眉齿蟾蝌蚪的不同发育阶段在功能性状空间中占据了不同的功能生态位。因此, 建议在未来的功能生态学研究中, 应当考虑将不同发育阶段的蝌蚪作为独立的功能性单元。同时, 本研究证明了峨眉齿蟾蝌蚪和鱼类(Zhao et al., 2014, 2019b)类似, 个体发育是造成其功能性状的种内变异形成的重要原因。这可能跟不同发育阶段蝌蚪食性的转化和运动方式的转变有关, 并且由各发育阶段所占据的功能生态位位置所反映。具体来说, 和大多数蝌蚪类似, 胚胎发育期的峨眉齿蟾蝌蚪个体表现为个体和口器均较小, 主要利用卵黄囊中的营养物质, 自我摄食的能力较弱, 能通过自我摄食所选择的食物较少(Randrianiaina et al., 2009;Strauß et al., 2010;Grosjean et al., 2011)。同时, 该发育阶段蝌蚪的尾巴较短且尾高较小, 主要采取背腹弯曲的游泳方式, 表明其游泳能力较弱(Eidietis, 2006;Azizi et al., 2007)。但随着个体发育的进行, 峨眉齿蟾蝌蚪逐渐进入后肢芽发育期, 这个发育阶段的个体表现为更大且更强壮, 口器也变得圆而大, 不仅运动能力越来越强, 也能主动捕食更多更大潜在的食物(Mainara et al., 2019)。当进入到到五趾分化期, 个体的功能性状进一步变化并开始为登陆准备, 以进一步适应水陆两栖生活的需要(赵尔宓, 1990)。尽管本研究揭示了峨眉齿蟾蝌蚪功能性状的种内变异, 但在未来的研究中, 应该更多地关注蝌蚪功能性状种内的变异对生态系统功能造成的潜在影响(Rudolf & Rasmussen, 2013)。
本文详细解析了峨眉齿蟾蝌蚪功能性状的种内变异, 揭示了个体发育是造成这种变异的重要原因。因此, 在进行蝌蚪种群内的功能生态学研究和计算群落的功能多样性研究时, 采用平均值代表单个物种的功能性状是不准确的, 这是因为蝌蚪功能性状的平均值会随着其种群结构的动态变化而变化。鉴于个体发育是造成蝌蚪功能性状种内变异的重要原因, 我们建议未来应更多采用基于发育阶段的功能生态学研究方法, 以便增强生态学家了解和预测生态系统功能和宏观生态格局的能力(Violle et al., 2012)。
费梁, 叶昌媛, 江建平. 2012. 中国两栖动物及其分布彩色图鉴[M]. 成都: 四川科学技术出版社.
|
江建平, 谢锋, 臧春鑫, 等. 2016. 中国两栖动物受威胁现状评估[J]. 生物多样性, 24(5): 588-597. |
许丹, 吴小清, 赵春霖, 等. 2020. 用功能生态学方法揭示峨眉髭蟾蝌蚪和棘腹蛙蟾蝌蚪共存的原因[J]. 生态学报, 40(1): 43-50. |
赵尔宓. 1990. 介绍一种蛙类胚胎及蝌蚪发育的分期[J]. 生物学通报, (1): 13-15. |
Arratia G, Quezada-Romegialli C. 2017. Understanding morphological variability in a taxonomic context in Chilean diplomystids (Teleostei: Siluriformes), including the description of a new species[J/OL]. PeerJ, 5: e2991[2020-01-20]. https://doi.org/10.7717/peerj.2991.
|
Auger S, Shipley B. 2013. Inter-specific and intra-specific trait variation along short environmental gradients in an old-growth temperate forest[J]. Journal of Vegetation Science, 24: 419-428. DOI:10.1111/j.1654-1103.2012.01473.x |
Azizi E, Landberg T, Wassersug RJ. 2007. Vertebral function during tadpole locomotion[J]. Zoology, 110: 290-297. DOI:10.1016/j.zool.2007.02.002 |
Bolnick DI, Amarasekare P, Araújo MS, et al. 2011. Why intraspecific trait variation matters in community ecology[J]. Trends in Ecology & Evolution, 26: 183-192. |
Connelly S, Pringle CM, Bixby RJ, et al. 2008. Changes in stream primary producer communities resulting from large-scale catastrophic amphibian declines:can small-scale experiments predict effects of tadpole loss?[J]. Ecosystems, 11: 1262-1276. DOI:10.1007/s10021-008-9191-7 |
Díaz S, Purvis A, Cornelissen JHC, et al. 2013. Functional traits, the phylogeny of function, and ecosystem service vulnerability[J]. Ecology and Evolution, 3: 2958-2975. DOI:10.1002/ece3.601 |
Dumay O, Tari PS, Tomasini JA, et al. 2004. Functional groups of lagoon fish species in Languedoc Roussillon, southern France[J]. Journal of Fish Biology, 64: 970-983. DOI:10.1111/j.1095-8649.2004.00365.x |
Eidietis L. 2006. The tactile-stimulated startle response of tadpoles:acceleration performance and its relationship to the anatomy of wood frog (Rana sylvatica), bullfrog (Rana catesbeiana), and American toad (Bufo americanus) tadpoles[J]. Journal of Experimental Zoology Part A:Comparative Experimental Biology, 305A: 348-362. DOI:10.1002/jez.a.269 |
Gaston KJ. 1996. Biodiversity:a biology of numbers and difference[M]. Cambridge, MA: Blackwell Science.
|
Gosner KL. 1960. A simplified table for staging anuran embryos and larvae with notes on identification[J]. Herpetologica, 16: 183-190. |
Grosjean S, Strauß A, Glos J, et al. 2011. Morphological and ecological uniformity in the funnel-mouthed tadpoles of Malagasy litter frogs, subgenus Chonomantis[J]. Zoological Journal of the Linnean Society, 162: 149-183. DOI:10.1111/j.1096-3642.2010.00667.x |
Huang Y, Hu JH, Wang B, et al. 2016. Integrative taxonomy helps to reveal the mask of the genus Gynandropaa (Amphibia:Anura:Dicroglossidae)[J]. Integrative Zoology, 11: 134-150. DOI:10.1111/1749-4877.12169 |
IUCN. 2016. IUCN red list of threatened species[EB/OL].[2020-01-20]. http://www.iucnredlist.org/initiatives/amphibians.
|
Lavorel S, Garnier E. 2002. Predicting changes in community composition and ecosystem functioning from plant traits:revisiting the Holy Grail[J]. Functional Ecology, 16: 545-556. DOI:10.1046/j.1365-2435.2002.00664.x |
Mainara XJ, Nicolas M, Lilian C, et al. 2019. Intraspecific and interspecific trait variability in tadpole meta-communities from the Brazilian Atlantic rainforest[J]. Ecology and Evolution, 9: 4025-4037. DOI:10.1002/ece3.5031 |
Mason NWH, Lanoiselée C, Mouillot D, et al. 2008. Does niche overlap control relative abundance in French lacustrine fish communities? A new method incorporating functional traits[J]. Journal of Animal Ecology, 77: 661-669. DOI:10.1111/j.1365-2656.2008.01379.x |
Prondvai E, Godefroit P, Adriaens D, et al. 2018. Intraskeletal histovariability, allometric growth patterns, and their functional implications in bird-like dinosaurs[J]. Scientific Reports, 8: 258[2018-01-10]. https://doi.org/10.1038/s41598-017-18218-9.
|
Purvis A, Hector A. 2000. Getting the measure of biodiversity[J]. Nature, 405: 212-219. DOI:10.1038/35012221 |
R Development Core Team. 2011. R: a language and environment for statistical computing[EB/OL].[2020-01-30]. http://www.R-project.org/.
|
Randrianiaina RD, Raharivololoniaina L, Preuss C, et al. 2009. Descriptions of the tadpoles of seven species of Malagasy treefrogs, genus Boophis[J]. Zootaxa, 2021: 23-41. DOI:10.11646/zootaxa.2021.1.2 |
Ranvestel AW, Lips KR, Pringle CM, et al. 2004. Neotropical tadpoles influence stream benthos:evidence for the ecological consequences of decline in amphibian populations[J]. Freshwater Biology, 49: 274-285. DOI:10.1111/j.1365-2427.2004.01184.x |
Ricklefs RE. 2012. Species richness and morphological diversity of passerine birds[J]. Proceedings of the National Academy of Sciences, 109: 14482-14487. DOI:10.1073/pnas.1212079109 |
Rudolf VHW. 2006. The influence of size-specific indirect interactions in predator-prey systems[J]. Ecology, 87: 362-371. DOI:10.1890/05-0961 |
Rudolf VHW. 2008. Consequences of size structure in the prey for predator-prey dynamics:the composite functional response[J]. Journal of Animal Ecology, 77: 520-528. DOI:10.1111/j.1365-2656.2008.01368.x |
Rudolf VHW, Rasmussen NL. 2013. Population structure determines functional differences among species and ecosystem processes[J]. Nature Communications, 4: 2318. DOI:10.1038/ncomms3318 |
Strauß A, Reeve E, Randrianiaina RD, et al. 2010. The world's richest tadpole communities show functional redundancy and low functional diversity: ecological data on Madagascar's stream-dwelling amphibian larvae[J/OL]. BMC Ecology, 10: 12[2020-01-10]. https://doi.org/10.1186/1472-6785-10-12.
|
Tilman D. 1997. The influence of functional diversity and composition on ecosystem processes[J]. Science, 277: 1300-1302. DOI:10.1126/science.277.5330.1300 |
Villéger S, Brosse S, Mouchet M, et al. 2017. Functional ecology of fish:current approaches and future challenges[J]. Aquatic Sciences, 79: 783-801. DOI:10.1007/s00027-017-0546-z |
Villéger S, Mason NWH, Mouillot D. 2008. New multidimensional functional diversity indices for a multifaceted framework in functional ecology[J]. Ecology, 89: 2290-2301. DOI:10.1890/07-1206.1 |
Villéger S, Miranda JR, Hernández DF, et al. 2010. Contrasting changes in taxonomic vs. functional diversity of tropical fish communities after habitat degradation[J]. Ecological Applications, 20: 1512-1522. DOI:10.1890/09-1310.1 |
Violle C, Enquist BJ, McGill BJ, et al. 2012. The return of the variance:intraspecific variability in community ecology[J]. Trends in Ecology & Evolution, 27: 244-252. |
Wells JP, Turnquist JE. 2001. Ontogeny of locomotion in rhesus macaques (Macaca mulatta):Ⅱ. postural and locomotor behavior and habitat use in a free-ranging colony[J]. American Journal of Physical Anthropology, 115: 80-94. DOI:10.1002/ajpa.1059 |
Winemiller KO. 1991. Ecomorphological diversification in lowland freshwater fish assemblages from five biotic regions[J]. Ecological Monographs, 61: 343-365. DOI:10.2307/2937046 |
Yang J, Zhang GC, Ci XQ, et al. 2014. Functional and phylogenetic assembly in a Chinese tropical tree community across size classes, spatial scales and habitats[J]. Functional Ecology, 28: 520-529. DOI:10.1111/1365-2435.12176 |
Zhang MH, Chen XH, Ye CY, et al. 2019. Osteology of the Asian narrow-mouth toad Kaloula borealis (Amphibia, Anura, Microhylidae) with comments on its osteological adaptation to fossorial life[J/OL]. Acta Zoologica, 2019; 00: 1-18[2020-01-10]. https://doi.org/10.1111/azo.12305.
|
Zhao T, Li C, Wang XY, et al. 2017. Unraveling the relative contribution of inter-and intrapopulation functional variability in wild populations of a tadpole species[J]. Ecology and Evolution, 7: 4726-4734. DOI:10.1002/ece3.3048 |
Zhao T, Villéger S, Cucherousset J. 2019a. Accounting for intraspecific diversity when examining relationships between non-native species and functional diversity[J]. Oecologia, 189: 171-183. DOI:10.1007/s00442-018-4311-3 |
Zhao T, Villéger S, Lek S, et al. 2014. High intraspecific variability in the functional niche of a predator is associated with ontogenetic shift and individual specialization[J]. Ecology and Evolution, 4: 4649-4657. DOI:10.1002/ece3.1260 |
Zhao T, Wang XY, Wang XG, et al. 2019b. Effects of urea on behavior and functional traits of Asiatic toad (Bufo gargarizans) tadpoles[J]. Aquatic Ecology, 53: 9-19. DOI:10.1007/s10452-018-9669-0 |
 2020, Vol. 39
2020, Vol. 39




