扩展功能
文章信息
- 刘安然, 胥婷婷, 宋丽美, 郝锡联, 朱慧, 任炳忠
- LIU Anran, XU Tingting, SONG Limei, HAO Xilian, ZHU Hui, REN Bingzhong
- 温度变化对家蟋蟀卵孵化率的影响
- Effects of Temperature Change on Hatchability of Acheta domesticus Eggs
- 四川动物, 2020, 39(4): 401-407
- Sichuan Journal of Zoology, 2020, 39(4): 401-407
- 10.11984/j.issn.1000-7083.20200062
-
文章历史
- 收稿日期: 2020-02-18
- 接受日期: 2020-05-15
2. 东北师范大学生命科学学院, 植被生态科学教育部重点实验室, 长春 130024
2. School of Life Sciences, Northeast Normal University, Key Laboratory of Vegetation Ecology, Ministry of Education, Changchun 130024, China
昆虫在自然界中占有重要地位,是动物界中种类最多的类群,数量庞大,栖息地遍布全球(宋大祥,2006)。作为陆地生态系统的主要组成部分,昆虫是食物链中必不可少的重要环节,它们使自然界不同物种之间通过取食或被取食产生了相互依存、相互制约的关系,对维持生物多样性、促进生态系统的物质循环、能量流动有重要作用。昆虫在自然界中有丰富的种类和数量主要与其复杂的生活史有着密切关系。一般情况下,完全变态发育的昆虫经历卵、幼虫、蛹和成虫阶段,不完全变态发育的昆虫则经历卵、幼虫和成虫阶段。卵是昆虫生活史的第一个阶段,也是昆虫个体发育非常重要的阶段(丁武龙,2009),卵自母体产下在卵壳内完成胚胎发育后,变为幼虫破壳而出,进入适应环境条件的独立生活阶段,这2个从胚胎发育阶段转化为胚后发育阶段的分界线就是卵的孵化(朱弘复,王林瑶,1983)。所以,卵孵化是昆虫生活史中重要的一步,对于昆虫种群,甚至昆虫群落的稳定都具有重要的意义。
昆虫卵的孵化率受多种因素影响,已有研究关注影响卵孵化的内在因素和外在因素(Kight,1997;Amiri et al., 2020)。内在因素包括成虫产卵质量(与成虫的营养状况有关)、卵胚胎发育情况等自身条件:成虫产卵质量越好,卵孵化率越高;卵胚胎发育越好,卵孵化率越高(Donoughe & Extavour,2016)。外在因素包括昆虫卵孵化时所需的环境条件,例如温度、湿度、光照(丁武龙,2009)和海拔等(Maclean et al., 2016)。有研究发现,在不同温度条件下铜绿丽金龟Anomala corpulenta卵的孵化率无显著差异,但卵的孵化天数随着温度的升高逐渐缩短,且湿度过大能显著延长卵的孵化时间,降低卵的孵化率(段爱菊等,2019);虫草蝠蛾Cordyceps sinensis卵的发育速度会随着温湿度的升高而加快,卵的孵化率也随之升高,在低温或极端低温情况下,卵的发育速度会降低,过低的湿度也会导致卵孵化失败、孵化率降低(郑方毅等,2018)。温度是影响卵孵化的重要生态因子之一(新野孝男,1983)。丁武龙(2009)发现,温度过低或过高都会使昆虫卵孵化率下降。袁盛勇等(2005)对桔小实蝇Bactrocera dorsalis在不同温度条件下的未成熟期各虫态的发育历期等方面进行了研究,发现温度过高或过低均对卵的存活有明显的抑制作用。在自然环境中,昆虫卵孵化过程中一般要经过低温萌动和高温孵化2个温度的影响(Ross-Gillespie et al., 2018),特别是在有明显季节性变化的北方地区,萌动温度和孵化温度都将显著影响昆虫卵的孵化。昆虫卵孵化过程中所需的热能基本上由周围环境的温度所提供,外界温度的变化影响着昆虫卵的孵化率。因此,温度对昆虫卵的孵化非常重要。探究昆虫卵孵化过程中萌动温度和孵化温度的变化对昆虫卵孵化率的影响,不但可为昆虫的人工养殖提供理论依据,而且对深入探究昆虫繁殖与温度之间的动态关系也有重要的参考价值。
家蟋蟀Acheta domesticus隶属昆虫纲Arthropoda直翅目Orthoptera蟋蟀科Gryllidea,是卵生的不完全变态昆虫,是一种世界性分布的、杂食性的、容易饲养的昆虫(刘竞泽,安瑞勇,1999)。家蟋蟀的味道好、蛋白质含量高、食物转换效能强(Nakagaki & Defoliart,1991)。因而,家蟋蟀是有前景的、候选的、并推广的一种食物和动物饲料(Defoliart,1989)。目前关于家蟋蟀室内研究主要集中在饲料配方优化方面(马俊等,2019),而对于家蟋蟀卵孵化的环境条件研究还存在着一定的不足,特别是温度变化对家蟋蟀卵孵化影响还缺乏一定的认识。因此,本研究通过室内控制条件,研究不同的低温萌动温度和高温孵化温度对家蟋蟀卵孵化率的影响,从而为深入理解环境中温度变化对家蟋蟀卵孵化的影响提供有利的理论证据,同时也为家蟋蟀饲养提供理论指导。
1 材料与方法 1.1 实验虫源卵源为东北师范大学昆虫研究室提供的家蟋蟀实验种群成虫繁殖的同一批卵,实验前4 ℃保存。
1.2 实验方法 1.2.1 温度处理设置低温萌动温度和高温孵化温度,每个温度处理2个水平,即低温萌动温度为4 ℃和7 ℃、高温孵化温度为25 ℃和29.5 ℃。采用2×2因子实验设计,得到4种实验处理:(1)4 ℃低温萌动和25 ℃高温孵化(4 ℃/25 ℃),(2)7 ℃低温萌动和25 ℃高温孵化(7 ℃/25 ℃),(3)4 ℃低温萌动和29.5 ℃高温孵化(4 ℃/29.5 ℃),(4)7 ℃低温萌动和29.5 ℃高温孵化(7 ℃/29.5 ℃)。低温萌动温度通过冰箱(型号:LSC-236C,浙江星星冷链集成股份有限公司)设置实现;高温孵化温度通过人工气候箱(型号:BIC-300,上海博讯实业有限公司医疗设备厂)设置实现。每个实验处理为5个重复,每个处理为500个虫卵。虫卵被放置在装有细沙的盒中,先进行低温萌动处理,即虫卵放置在设置好的冰箱中7 d,然后拿出放置在人工气候箱中,温度分别调至高温孵化温度处理,直至昆虫卵孵化完成。在实验过程中相对湿度范围为75%±5%。每天早上喷水1次,以保持产卵土的湿度。
1.2.2 孵化计数每天进行观察,从每盒第一个卵孵出时开始计数,每天计数2次(10: 00和15: 00),直到卵无孵化为止(连续3 d没有记录孵化的个体)。
1.3 数据统计与分析所有数据进行统计分析前进行同质性检验,且无数据转换。采用双因素方差分析(Two-Way ANOVA)检验低温萌动温度和高温孵化温度对家蟋蟀卵孵化率的影响;采用单因素方差分析(One-Way ANOVA)比较4个不同温度处理对家蟋蟀卵孵化率和每一天家蟋蟀卵孵化率的影响;多重比较采用Tukey法在显著水平(α=0.05)下进行。所有数据采用SPSS 20.0进行分析。数值以x±SE表示。
2 结果 2.1 不同温度处理对家蟋蟀卵孵化率的作用低温萌动温度显著影响家蟋蟀卵的孵化率(F1,13=23.737,P < 0.000 1)。当低温萌动温度为4 ℃时,卵孵化率显著低于7 ℃(图 1)。但是,高温孵化温度对卵孵化率无显著作用(F1,13=0.000 1,P=0.984),高温与低温的交互作用对卵孵化率无显著作用(F1,13=0.008,P=0.930)。当低温萌动温度处理分别为4 ℃和7 ℃时,卵孵化率在高温萌动温度为25 ℃和29.5 ℃之间的差异无统计学意义。
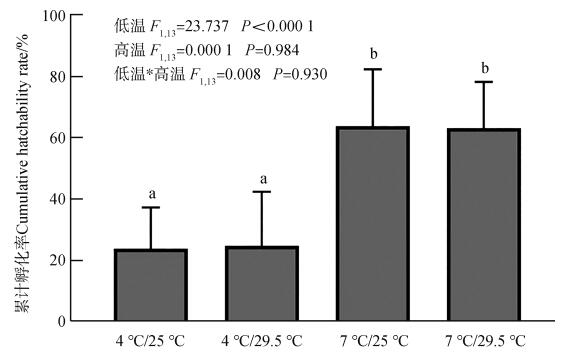
|
| 图 1 不同温度处理对家蟋蟀卵累计孵化率的影响 Fig. 1 Effects of different temperature treatments on the cumulative hatchability rate of Acheta domesticus eggs 4℃/25 ℃. 4 ℃为萌动温度,25 ℃为孵化温度;不同字母表示组间差异有统计学意义;下同 4℃/25 ℃. 4 ℃ refers to the germinating temperature, while 25 ℃ refers to the hatching temperature; different letters indicate that there is a significant difference between groups; the same below |
| |
第1天各温度处理下的卵孵化率无差异。第2天,4 ℃/29.5 ℃的卵孵化率最大;第3天至第5天,7 ℃/29.5 ℃的卵孵化率最大。第6天开始,7 ℃/25 ℃的卵孵化率最大,并持续7 d。第8天,7 ℃/29.5 ℃的卵停止孵化。第13天,4 ℃/29.5 ℃的卵停止孵化,其余2个温度处理的卵孵化率之间的差异无统计学意义。第14天和第15天,4 ℃/25 ℃和7 ℃/25 ℃的卵也分别停止孵化(图 2)。

|
| 图 2 相同孵化天数不同温度对家蟋蟀卵孵化率的影响 Fig. 2 Effects of different temperature treatments on the hatchability rate of Acheta domesticus eggs at the same time * P<0.05,ns. P>0.05 |
| |
在同一温度处理下,卵每天的孵化率会发生显著波动:随孵化时间的增加,孵化率先上升再下降,最后逐渐趋于平缓,孵化率为0。不同温度处理下卵达到最大孵化率的时间存在差异。
4 ℃/25 ℃时,卵在第7天达到单日的最大孵化率(4.870%)(图 3:A);4 ℃/29.5 ℃时,第3天达到单日的最大孵化率(7.225%)(图 3:B)。而7 ℃/25 ℃时,达到最大孵化率的时间是第6天和第7天(图 3:C);7 ℃/29.5 ℃时,第4天达到单日的最大孵化率(23.390%)(图 3:D)。

|
| 图 3 不同温度处理下家蟋蟀卵孵化率的时间动态 Fig. 3 Temporal dynamics of the hatchability rate of Acheta domesticus eggs treated at different temperatures A. 4 ℃/25 ℃,B. 4 ℃/29.5 ℃,C. 7 ℃/25 ℃,D. 7 ℃/29.5 ℃ |
| |
本实验采用控制低温萌动温度和高温孵化温度的方法,研究了不同温度变化对家蟋蟀卵孵化率的影响,发现低温萌动温度处理使卵孵化率降低;高温孵化温度处理使卵提前了达到最大孵化率的时间。本研究对深入分析温度对家蟋蟀个体发育的作用效应提供重要的理论基础,对人工饲养家蟋蟀具有关键的指导意义。
低温对昆虫生活史的影响是显著的,极端的低温甚至可以直接杀死昆虫。卵是昆虫生活史的重要阶段,低温对卵孵化尤为重要(陈丽芳等,2015)。本研究发现低温萌动温度处理对家蟋蟀卵孵化率有显著影响,使家蟋蟀卵孵化率降低;低温处理时间越长,对家蟋蟀卵孵化率的影响越大,说明低温萌动温度对家蟋蟀卵孵化率起到更重要的作用。这与张翠平(2007)研究低温对中华蜜蜂Apis cerana cerana和意大利蜜蜂Apis mellifera ligustica卵孵化率的影响的结论基本吻合。这种影响也在对甜菜夜蛾Spodoptera exigua、油葫芦Telegryllus emma低温处理下卵孵化率变化的研究中得到证实(王竑晟,2003;熊仁次,2003)。家蟋蟀卵在孵化过程中需要物质代谢和热能供应,持续低温刺激下,卵孵化率会出现下降趋势,不利于卵的孵化,这可能是由于家蟋蟀卵一经产出就暴露在外界环境中,过低的温度不能为卵孵化提供充足的热能。昆虫卵含有糖、脂肪、蛋白质等,这些物质同原生质形成一定的有机结构可以对抗低温,这一般是可忍耐0 ℃以下低温生存的昆虫越冬卵面对低温的应对策略,例如东亚飞蝗Locusta migratoria manilensis(王洁,2014)。由于不同昆虫胚胎发育的差异性,家蟋蟀卵在低温处理的影响下,物质代谢速率下降,并不能形成抵御低温的结构,从而不能完成胚胎发育,表现为卵孵化率降低,不同温度影响卵孵化率和孵化时间。
本研究表明,在有效温度范围内,家蟋蟀卵的发育速度与温度成正比,卵的发育速度随温度升高而加快,发育所需的天数越少。因此,可以认为当低温萌动温度相同、高温孵化温度不同时,家蟋蟀卵达到最高孵化率的时间不同,29.5 ℃时达到最大孵化率的时间比25 ℃短。然而,高温孵化温度相同时,达到最大孵化率的时间并不依赖于低温萌动温度,即当高温孵化温度同为25 ℃时,4 ℃和7 ℃低温萌动温度下的卵孵化率达到最大的时间都在第6天至第7天;当高温孵化温度为29.5 ℃时,4 ℃和7 ℃低温萌动温度下的卵孵化率达到最大的时间在第3天和第4天。这表明,高温孵化温度使家蟋蟀卵达到最大孵化率的时间提前。这与魏春艳(2002)在温度对黄褐油葫芦Teleogryllus derelictus卵孵化率影响的结论相吻合。昆虫的胚胎发育自卵裂、胚盘、胚带、胚层及胚膜的形成,至胚胎的分节、附肢的形成、体壁形成及背合等,可划分为若干阶段(崔双双,朱道弘,2011)。在高温有利条件下,胚胎能迅速启动正常的细胞反应和代谢功能,并调整和加快特定生理机制的发生,表现为卵孵化率提高,卵达到最大孵化率的时间提前。由于范兰芬等(2011)证明在家蚕Bombyx mori胚期进行高温处理保育,所产下的子代滞育卵中的酶类活性变化:过氧化氢酶的活性随发育上升,而乳酸脱氢酶的活性随发育下降。由此推测,高温处理可能通过促进卵中酶类活性的上升使卵完成胚胎发育,对家蟋蟀卵孵化起到一定的促进作用。从促进卵完成胚胎发育这个层面上讲,高温孵化温度对维持昆虫生活史的完整性具有重要的生态意义。然而,江天宝(2004)研究温度对蜜蜂卵发育影响的结论与本实验不一致,其研究认为中华蜜蜂与意大利蜜蜂的卵对高温更敏感,高温对蜜蜂卵孵化率有显著影响,随着高温处理时间延长,蜜蜂卵孵化率显著下降。出现不一致的结论可能是由于昆虫种类的不同,每一种昆虫卵的孵化对温度都有不同的适应范围,在高温胁迫下,昆虫为了延续生命而选择减少潜在生殖力而增加存活率,表现出卵孵化率降低。对莲草直胸跳甲Agasicles hygrophila不同发育阶段进行高温处理后的存活率变化的研究发现,卵的耐热性较差,可能是夏季高温莲草直胸跳甲种群数量骤减的主要原因(Jia et al., 2020)。
本研究针对温度变化对家蟋蟀卵孵化率的影响进行了探讨,发现低温萌动和高温孵化都是家蟋蟀卵孵化的重要影响因素。温度变化与生殖力的关系能够指导有益昆虫和经济昆虫的饲养,提高饲养质量和数量。研究温度对昆虫卵孵化率的影响可以预测昆虫种群密度的变化和分布情况。此外,除了温度,其他环境因子如湿度、光周期、地理差异等因素对家蟋蟀卵孵化也可能有着不同程度的影响,特别是可能与温度之间有着互作作用。因此,需要加强对影响家蟋蟀卵孵化的这些因子之间的交互研究,全面地研究多种环境影响因子的综合作用,从而为家蟋蟀的人工大量繁殖提供理论基础,提高家蟋蟀资源的开发与利用。
陈丽芳, 邵东华, 段景攀, 等. 2015. 温度对昆虫的影响[J]. 内蒙古林业科技, 41(2): 57-61. |
崔双双, 朱道弘. 2011. 中华稻蝗的胚胎发育及卵滞育发生的胚胎发育阶段[J]. 应用昆虫学报, 4: 845-853. |
丁武龙. 2009.温度对中华蜜蜂卵发育的影响研究[D].福州: 福建农林大学. http://cdmd.cnki.com.cn/article/cdmd-10389-2009170422.htm
|
段爱菊, 王淑枝, 王利霞, 等. 2019. 温湿度对铜绿丽金龟卵生长发育的影响[J]. 陕西农业科学, 65(10): 71-74. |
范兰芬, 钟杨生, 林健荣. 2011. 家蚕滞育卵与非滞育卵中几种关键酶活性的比较[J]. 昆虫学报, 54(11): 1258-1263. |
江天宝. 2004.温度对蜜蜂卵发育影响的研究[D].福州: 福建农林大学. http://cdmd.cnki.com.cn/Article/CDMD-10389-2004109085.htm
|
刘竞泽, 安瑞勇. 1999. 实验室内蟋蟀的长期饲养和诱捕方法[J]. 生物学通报, 34(2): 39. |
马俊, 张泽华, 李进庭. 2019. 蟋蟀规模化人工养殖技[J]. 中国畜禽种业, 9: 65-66. |
宋大祥. 2006. 节肢动物的分类和演化[J]. 生物学通报, 41(3): 1-3. |
王竑晟. 2003.温度和营养对甜菜夜蛾生殖的影响[D].山东: 山东农业大学. http://cdmd.cnki.com.cn/Article/CDMD-10434-2003080632.htm
|
王洁. 2014.温度影响飞蝗卵滞育研究[D].北京: 中国农业科学院. http://cdmd.cnki.com.cn/Article/CDMD-82101-1014326890.htm
|
魏春艳. 2002.黄褐油葫芦实验种群生物学及生态学的研究[D].长春: 吉林农业大学. http://cdmd.cnki.com.cn/Article/CDMD-10193-2002102754.htm
|
新野孝男. 1983. 温度条件对家蚕卵孵化的影响[J]. 庄大桓(摘译).日本蚕丝学杂志, 52(4): 341-347. |
熊仁次. 2003.北京油葫芦的人工养殖与成分分析[D].陕西: 西北农林科技大学. http://cdmd.cnki.com.cn/Article/CDMD-10712-2003101224.htm
|
袁盛勇, 孔琼, 肖春, 等. 2005. 温度对桔小实蝇发育、存活和繁殖的影响[J]. 华中农业大学学报, 24(6): 588-591. |
张翠平. 2007.低温24℃对蜜蜂卵孵化率及发育历期的影响[D].福州: 福建农林大学. http://cdmd.cnki.com.cn/article/cdmd-10389-2007135931.htm
|
郑方毅, 王忠, 黄雪峰, 等. 2018. 温湿度对虫草蝠蛾卵孵化率的影响[J]. 现代农业科技, 3: 90-96. |
朱弘复, 王林瑶. 1983. 昆虫卵的孵化及破卵器[J]. 昆虫学报, 26(3): 256-259. |
Amiri E, Le K, Melendez CV, et al. 2020. Egg-size plasticity in Apis mellifera:honey bee queens alter egg size in response to both genetic and environmental factors[J]. Journal of Evolutionary Biology, 33(4): 534-543. |
Defoliart GR. 1989. The human use of insects as food and as animal feed[J]. American Entomologist, 35(1): 22-35. DOI:10.1093/besa/35.1.22 |
Donoughe S, Extavour CG. 2016. Embryonic development of the cricket Gryllus bimaculatus[J]. Developmental Biology, 411(1): 140-156. |
Jia D, Yuan XF, Liu YH, et al. 2020. Heat sensitivity of eggs attributes to the reduction in Agasicles hygrophila population[J]. Insect Science, 27(1): 159-169. |
Kight SL. 1997. Factors influencing maternal behaviour in a burrower bug, Sehirus cinctus (Heteroptera:Cydnidae)[J]. Animal Behaviour, 53(1): 105-112. |
Maclean HJ, Higgins JK, Buckley LB, et al. 2016. Geographic divergence in upper thermal limits across insect life stages:does behavior matter[J]. Oecologia, 181(1): 107-114. |
Nakagaki BJ, Defoliart GR. 1991. Comparison of diets for mass-rearing Acheta domesticus (Orthoptera:Gryllidae) as a novelty food, and comparison of food conversion efficiency with values reported for livestock[J]. Journal of Economic Entomology, 84(3): 891-896. |
Ross-Gillespie V, Picker MD, Dallas HF, et al. 2018. The role of temperature in egg development of three aquatic insects Lestagella penicillata (Ephemeroptera), Aphanicercella scutata (Plecoptera), Chimarra ambulans (Trichoptera) from South Africa[J]. Journal of Thermal Biology, 71: 158-170. |
 2020, Vol. 39
2020, Vol. 39




