扩展功能
文章信息
- 邵欢欢, 邓家波, 吴林峰, 牛李丽, 余建秋, 谭雪梅
- SHAO Huanhuan, DENG Jiabo, WU Linfeng, NIU Lili, YU Jianqiu, TAN Xuemei
- 豚鹿MHC-DOA基因克隆及其外显子2遗传多样性研究
- Cloning of Axis porcinus MHC-DOA Gene and the Genetic Diversity of Its Exon 2 Region
- 四川动物, 2020, 39(1): 81-87
- Sichuan Journal of Zoology, 2020, 39(1): 81-87
- 10.11984/j.issn.1000-7083.20190091
-
文章历史
- 收稿日期: 2019-03-14
- 接受日期: 2019-10-08
2. 四川师范大学生命科学学院, 成都 610101;
3. 成都动物园, 成都 610081
2. College of Life Sciences, Sichuan Normal University, Chengdu 610101, China;
3. Chengdu Zoo, Chengdu 610081, China
豚鹿Axis porcinus隶属于偶蹄目Artiodactyla鹿科Cervidae斑鹿属Axis(Maxwell et al., 2006),多栖息于草地平原、沿海草地、白茅丛、森林、山地等地带(Abbas et al., 2016)。世界自然保护联盟(IUCN)濒危物种红色名录将豚鹿列为濒危(EN)等级(Timmins et al., 2015)。豚鹿主要分为2个亚种:豚鹿印支亚种A. p. annamiticus和豚鹿指名亚种A. p. porcinus,分布于中国的主要是印支亚种(Maxwell et al., 2006)。目前国内仅成都动物园、北京动物园和上海动物园有圈养的豚鹿,其中,成都动物园有71头(截至2019年6月),数量占我国圈养豚鹿总数的80%以上。因此,复壮豚鹿种群是当前最紧迫的事情。但圈养豚鹿的幼仔存活率很低,2006—2011年成都动物园的豚鹿一共产仔51胎,存活20胎,存活率仅39%,天气寒冷及母鹿的弃仔行为是引起幼仔死亡的一个重要因素,肺炎是导致豚鹿幼体死亡的直接原因(邓家波等,2011)。疾病已经严重影响豚鹿幼仔的存活,进而严重影响豚鹿种群的发展。
主要组织相容性复合体(major histocompatibility complex,MHC)基因是与动物对疾病抗性或易感性密切相关的多基因家族,在脊椎动物的免疫系统中起核心作用(Kelley et al., 2005)。MHC分子决定了机体对病原体(抗原分子)的识别,从而影响机体对疾病的易感性以及自身免疫性(Stewart et al., 2004)。MHC多样性水平的降低可导致种群内个体对突发性传染性病原体的易感性增高,导致种群抗病能力单一、生存力下降(O'brien & Yuhki,1999)。研究结果表明,MHC的多态性主要集中在编码多肽结合区的第2个外显子上,该外显子可能通过与外来抗原的互作,影响抗原递呈过程的识别与被识别的特异性。有关MHC基因外显子2的多态性研究主要集中在DQB、DRB基因等(Nikbakht et al., 2012;He et al., 2014;Amaike et al., 2018)。MHC-DOA基因是MHC Ⅱ类区域内的非经典基因,主要参与外源性抗原的加工及MHC Ⅱ类分子的折叠(Gelhaus & Förster,2001)。
对中国豚鹿MHC-DOA基因外显子2的遗传多态性的研究迄今尚未见报道。本研究采用PCR和克隆测序技术,对成都动物园圈养的38头豚鹿的MHC-DOA基因外显子2进行了检测,并评估其遗传多样性,以期保护与开发利用豚鹿遗传资源。
1 材料与方法 1.1 材料 1.1.1 样品使用成都动物园圈养的1头成年豚鹿的抗凝血提取总RNA。另取22头豚鹿的抗凝血,4头豚鹿的冻存血液和12头死亡豚鹿的肌肉组织样品(冻存于液氮),提取DNA。
1.1.2 主要试剂总RNA提取试剂盒Trizol购自美国Invitrogen;DNA快速提取试剂盒TIANcombi DNA Lyse & Det PCR Kit购自天根生化科技(北京)有限公司;PCR酶和M-MLV反转录酶购自TaKaRa;限制性内切酶购自Fermentas;所有抗生素均购于青岛生工生物科技有限公司;大肠杆菌Escherichia coli JM109(本实验室保存),基因型:endA1 glnV44 thi-1 relA1 gyrA96 recA1 mcrB+Δ(lac-proAB) e14-[F' traD36 proAB+ lacIq lacZΔM15]hsdR17(rK-mK+),用于DNA克隆。PCR克隆用pMD18-T载体,购自宝生物工程(大连)有限公司。
1.2 方法 1.2.1 豚鹿MHC-DOA基因克隆引物设计与合成:参照豚鹿血液转录组数据库(GenBank登录号:SAMN12097782)中MHC-DOA基因序列,利用Primer Premier 6.0设计1对引物:5’-GTGCCTGTATTTCTCTGGAGGCTC-3’和5’-TGCAGGGGCTGGGTCTTTG-3’。根据豚鹿MHC-DOA基因序列,设计外显子2的引物:5’-TCCTACGGACCAGCCTTCTACC-3’和5’-GTGCGGTTGGAGCGCTTC-3’,均由北京擎科新业生物技术有限公司合成。血液总RNA的提取:利用Trizol法提取总RNA,提取和纯化按照Invitrogen试剂盒推荐方法进行。反转录得到cDNA:cDNA第一链的合成使用M-MLV反转录酶,以豚鹿血液的总RNA为模板进行反转录操作,cDNA第一链反转录体系中加入RNase OUTTM核酸酶抑制剂(40 U/μL)1 μL,轻轻将各成分混合,37 ℃ 2 min;加入1 μL(200 U)M-MLV逆转录酶;37 ℃ 50 min;70 ℃ 15 min。然后冰上冷却,得到的cDNA溶液可直接用于第二链cDNA的合成或者PCR扩增等。MHC-DOA基因扩增:以第一链合成产物cDNA为模板,使用KOD FX高保真酶扩增MHC-DOA基因,PCR反应条件为:94 ℃ 2 min;98 ℃ 10 s,61 ℃ 30 s,68 ℃ 1 min 30 s,共30个循环。PCR产物使用rTag酶在72 ℃反应30 min进行加A反应,片段纯化后在18 ℃过夜连接T载体并转化大肠杆菌,挑取阳性克隆送至深圳华大基因公司进行序列测定。
1.2.2 豚鹿MHC-DOA基因序列分析根据测序得到的豚鹿MHC-DOA基因序列,使用NCBI数据库中的BLAST进行基因及蛋白序列同源比对,使用DNAMAN将13种动物,包括白尾鹿Odocoileus virginianus texanus、东欧马鹿Cervus elaphus hippelaphus、山羊Capra hircus、野羊Ovis aries musimon、绵羊Ovis aries、羊驼Vicugna pacos、美洲草原野牛Bison bison bison、印度牛Bos indicus、野牦牛Bos mutus、抹香鲸Physeter catodon、印度水牛Bubalus bubalis、长江江豚Neophocaena asiaeorientalis asiaeorientalis、西亚骆驼Camelus bactrianus的MHC-DOA蛋白序列与豚鹿比对,分别使用ProtParam、NPS@和Swiss-model进行MHC-DOA蛋白的一级、二级、三级蛋白结构分析;利用Clustal W比较13个物种的MHC-DOA蛋白序列。系统进化树利用MEGA 5.0构建;信号肽使用Signal IP 4.1 Server进行预测;跨膜结构分析使用TMpred;磷酸化位点预测使用NetPhos 3.1。
1.2.3 豚鹿MHC-DOA外显子2克隆DNA提取及电泳检测:取不少于25 mg豚鹿肌肉组织,用液氮研磨成粉末状。使用TIANcombi DNA Lyse & Det PCR Kit提取总DNA,使用0.8%琼脂糖凝胶电泳检测。MHC-DOA外显子2扩增:以提取的豚鹿DNA样品为模板,使用rTag酶扩增DOA基因的外显子2序列,PCR反应条件为:94 ℃ 2 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 90 s,30个循环;72 ℃ 10 min。PCR产物与T载体连接,挑选阳性克隆,送至深圳华大基因公司测序。总共挑选120个阳性克隆进行测序分析。每条序列在2个或2个以上克隆序列完全一致时才被认为是可靠的,可用于后续的结果分析。
1.2.4 豚鹿MHC-DOA基因外显子2多态性分析将测序得到的DOA外显子2的核酸序列使用DNAMAN和Multalin(http://multalin.toulouse.inra.fr/multalin/)进行比对分析,检测核苷酸变异位点,使用DNAMAN和ExPASy的Translate tool(https://web.expasy.org/translate/)统计分析核苷酸序列,同时辅以人工统计及校对。将发生变异的核苷酸序列和蛋白序列与豚鹿种群的生存状态数据进行相关性分析,使用GraphPad Prism 6进行统计学分析。
2 结果 2.1 豚鹿MHC-DOA基因序列分析对MHC-DOA基因进行扩增,电泳检测在750 bp左右有明显条带,与预期大小一致。结果表明,豚鹿的MHC-DOA基因有2种单倍型,一种单倍型在295 bp发生了碱基的改变。MHC-DOA基因长度为753 bp,编码250个氨基酸残基(GenBank登录号:MN125544)。豚鹿DOA序列与其他13种动物的同源性为84.4%~98.4%,其中,与东欧马鹿的最高(98.4%)(图 1)。
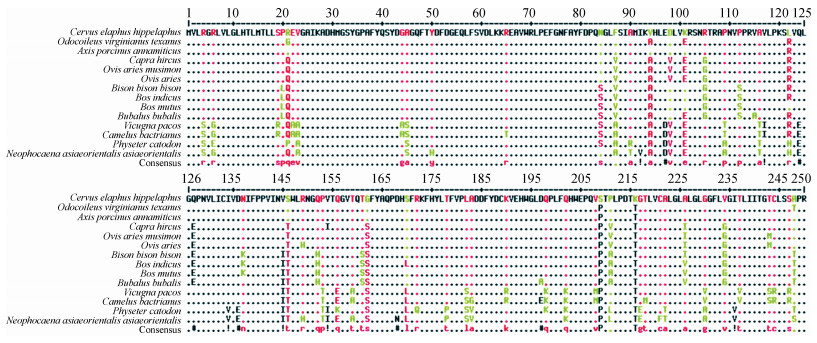
|
| 图 1 豚鹿与其他物种MHC-DOA蛋白序列的比对 Fig. 1 Alignment of deduced amino acids sequences of Axis porcinus MHC-DOA gene with other species 东欧马鹿Cervus elaphus hippelaphus (OWK06998.1)、白尾鹿Odocoileus virginianus texanus (XP_020763773.1)、豚鹿印支亚种Axis porcinus annamiticus、山羊Capra hircus (XP_013829269.1)、野羊Ovis aries musimon (XP_011967514.1)、绵羊Ovis aries (XP_004018791.1)、羊驼Vicugna pacos (XP_006202267.2)、美洲草原野牛Bison bison bison (XP_010846888.1)、抹香鲸Physeter catodon (XP_007107928.1)、印度牛Bos indicus (XP_019840798.1)、野牦牛Bos mutus (XP_005891446.1)、印度水牛Bubalus bubalis (XP_006050360.1)、长江江豚Neophocaena asiaeorientalis asiaeorientalis (ALB25551.1)、西亚骆驼Camelus bactrianus (XP_010947407.1) |
| |
MHC-DOA蛋白分子量为27.84 kD,理论等电点7.04,脂肪系数为93.52,亲水性值为0.023,因此DOA是一个疏水性蛋白。二级结构和三级结构分析结果表明,MHC-DOA蛋白包含α螺旋7个氨基酸,占2.8%;β折叠77个氨基酸,占30.8%;无规则卷曲166个氨基酸,占66.4%。磷酸化位点分析结果表明MHC-DOA蛋白可能具有26个磷酸化位点,这表明MHC-DOA蛋白可能参与了多种信号传递过程。信号肽预测分析发现,MHC-DOA蛋白在1~25 bp有明显的信号肽,这也与MHC-DOA蛋白作为分泌蛋白在血液中发挥免疫功能相一致。跨膜结构分析发现MHC-DOA具有2个由外到内跨膜结构区域:128~148和225~242。
2.3 MHC-DOA蛋白进化树分析MHC-DOA蛋白进化树分析结果表明,豚鹿MHC-DOA蛋白与东欧马鹿的亲缘关系最近(图 2),该结果与同源性比对结果一致。
38头豚鹿MHC-DOA基因外显子2测序结果显示,豚鹿MHC-DOA外显子2全长221 bp,其中,T为24.9%,C为25.3%,A为21.3%,G为28.5%。共有10种等位基因,其中,DOA1等6个克隆为c.306 C>G,DOA4和DOA43为c.295 T>A,DOA2等18个克隆没有发生改变,DOA9等5个克隆为c.306 C>T,DOA62为c.305-307delC,DOA64和DOA68为c.304-306delG,DOA13为c.163 G>C;164 A>C;181-182insC,DOA5为c.165 A>T;167 A>G;224-226delC,DOA39为c.163 G>A;167 A>G;170 T>C;188 A>T;188- 190delG;231 G>C,DOA7为c.163 G>A;c.164 A>G;c.166 C>T;c.167 G>A;c.169 C>T;c.171 T> C;c.173 C>G;188 A>T;188-190delG;190 A>T;203 T>A;212 C>A;224-226delC;226 T>G;229 G>A;230 C>G;232 C>T;243 G>C;244 C>T;246 G>T;249 C>T;299 A>g;303 C>T;307 A>T;308 A>T。以上10种单倍型分别用HT01~HT10表示,其中DOA5、DOA39、DOA62、DOA64、DOA68缺失了1个核苷酸,DOA7缺失了3个核苷酸,DOA13插入了1个核苷酸(图 3)。这些核苷酸的插入或缺失引起DOA蛋白序列提前终止,导致氨基酸序列发生改变。

|
| 图 3 豚鹿MHC-DOA外显子2的多态性 Fig. 3 Polymorphism of DOA exon 2 in Axis porcinus |
| |
对38头MHC-DOA基因对应的豚鹿个体的谱系进行分析,结果发现,发生缺失1个核苷酸,导致移码突变及翻译提前终止的5头个体中,有4头豚鹿早死或幼年病死,这表明MHC-DOA基因核苷酸缺失造成的蛋白质序列改变或功能缺失,可能会引起豚鹿个体的死亡;而缺失3个核苷酸的1头豚鹿则正常生长,这可能因其虽然发生了核苷酸缺失,但是并未引起后续蛋白的移码突变;有1头豚鹿的MHC-DOA基因插入了1个核苷酸,但是仍正常生存;有2头豚鹿的MHC-DOA蛋白在第98位氨基酸发生了改变,从赖氨酸变为甲硫氨酸,但是这2头豚鹿都没有出现早死或者病死的情况,这表明第98位氨基酸的改变可能对豚鹿的影响不大。对该豚鹿群体的MHC-DOA基因的10个单倍型频数与其致死性进行相关性分析,结果显示,致病性与单倍型频率间的t检验双尾P值为0.624 8,差异无统计学意义。而相关性单尾P值为0.092 4,这说明豚鹿MHC-DOA的致病性与其单倍型之间无显著相关性(表 1)。
| 编号 | 频数 | 单倍型频率 | |||
| 死胚死胎数 (n=16) |
存活数 (n=22) |
死胚死幼 | 存活 | ||
| HT01 | 5 | 1 | 0.312 5 | 0.045 5 | |
| HT02 | 0 | 2 | 0 | 0.090 9 | |
| HT03 | 4 | 14 | 0.250 0 | 0.636 4 | |
| HT04 | 3 | 2 | 0.187 5 | 0.090 9 | |
| HT05 | 1 | 0 | 0.062 5 | 0 | |
| HT06 | 2 | 0 | 0.125 0 | 0 | |
| HT07 | 0 | 1 | 0 | 0.045 5 | |
| HT08 | 0 | 1 | 0 | 0.045 5 | |
| HT09 | 1 | 0 | 0.062 5 | 0 | |
| HT10 | 0 | 1 | 0 | 0.045 5 | |
MHC基因的多态性水平被认为与种群抗病能力和生存力密切相关(Danchin et al., 2004)。目前,已经有许多研究报道证明了人类、山羊、绵羊、牛等的MHC-DQA、MHC-DQB等基因的外显子2的多态性及其与疾病的关联性(Li et al., 2011;Nikbakht et al., 2012;Xi et al., 2014)。
MHC-DOA基因是MHC Ⅱ家族中的一个重要基因,MHC-DOA蛋白由4条肽链组成:2条α肽链和2条β肽链(Soll et al., 2010)。MHC-DOA和MHC-DM在B细胞中参与抗原的递呈,因此推测MHC-DOA蛋白在抗原识别和免疫中发挥重要的作用(Hedrick,2002;Ballingall et al., 2010;Xiang et al., 2013)。
38头豚鹿的MHC-DOA外显子2序列包含了30多个变异位点及10种单倍型,推测成都动物园圈养的豚鹿整体遗传多样性水平中等。其中,有6头豚鹿的MHC-DOA外显子2的单倍型发生单核苷酸缺失、插入移码突变。有1种单倍型发生3个单核苷酸缺失,导致MHC-DOA外显子2发生20个氨基酸残基的改变。推测豚鹿MHC-DOA的致病性与其单倍型之间存在较显著的相关性。但结果显示各单倍型频率与致病性之间的差异不显著,这可能与本研究所取动物样品数量少有关,且含有多种单倍型的豚鹿仅1~2头。
根据实验结果,有6头豚鹿的MHC-DOA外显子2单倍型发生单核苷酸缺失或插入移码突变,这可以确定为有害单倍型。在圈养豚鹿的繁殖中,建议将携带有害单倍型的个体从繁殖体系中剔除。通过建立DOA基因的分子标签,对豚鹿进行分子体检,提前对其进行保护和疾病预防。本研究为豚鹿的种群遗传结构调查、疾病关联分析和遗传平衡保护提供一定的帮助。
邓家波, 余建秋, 牛李丽, 等. 2011. 圈养豚鹿繁殖成活率低的病因学调查研究[J]. 野生动物, 32(3): 120-122. DOI:10.3969/j.issn.1000-0127.2011.03.003 |
Abbas G, Nadeem A, Babar ME, et al. 2016. Molecular phylogeny and diversity analysis of hog deer (Axis porcinus) in Pakistan[J]. Pakistan Journal of Zoology, 49(5): 1701-1712. |
Amaike Y, Nishita Y, Uraguchi K, et al. 2018. Genetic diversity of MHC class Ⅱ DRB1 exon 2 in the red fox (Vulpes vulpes) on Hokkaido, Japan[J]. Zoological Science, 35(5): 402-410. DOI:10.2108/zs170211 |
Ballingall KT, Rocchi MS, Mckeever DJ, et al. 2010. Trans-species polymorphism and selection in the MHC class Ⅱ DRA genes of domestic sheep[J]. PLoS ONE, 5(6): e11402[2019-01-10]. https://doi.org/10.1371/journal.pone.0011402.
|
Danchin E, Vitiello V, Vienne A, et al. 2004. The major histocompatibility complex origin[J]. Immunological Reviews, 198(1): 216-232. |
Gelhaus A, Förster B. 2001. Cattle MHC genes DOA and DOB:sequence polymorphisms and assignments to the class Ⅱb region[J]. European Journal of Immunogenetics, 28(3): 429-433. DOI:10.1046/j.1365-2370.2001.00236.x |
He Y, Xi D, Leng J, et al. 2014. Genetic variability of MHC class Ⅱ DQB exon 2 alleles in yak (Bos grunniens)[J]. Molecular Biology Reports, 41(4): 2199-2206. DOI:10.1007/s11033-014-3071-3 |
Hedrick PW. 2002. Pathogen resistance and genetic variation at MHC loci[J]. Evolution, 56(10): 1902-1908. DOI:10.1111/j.0014-3820.2002.tb00116.x |
Kelley J, Walter L, Trowsdale J. 2005. Comparative genomics of major histocompatibility complexes[J]. Immunogenetics, 56(10): 683-695. DOI:10.1007/s00251-004-0717-7 |
Li RY, Hui WQ, Jia B, et al. 2011. The relationship between MHC-DRB1 gene second exon polymorphism and hydatidosis resistance of Chinese merino (Sinkiang Junken type), Kazakh and Duolang sheep[J]. Parasite, 18(2): 163-169. DOI:10.1051/parasite/2011182163 |
Maxwell A, Nareth C, Kong D, et al. 2006. Hog deer (Axis porcinus) confirmed in the wild in eastern Cambodia[J]. Natural History Bulletin of the Siam Society, 54(2): 227-237. |
Nikbakht G, Rezaii H, Stear MJ, et al. 2012. Allelic polymorphism in the second exon of Ovar-DRB1 in fat-tailed sheep[J]. The Veterinary Journal, 192(3): 547-549. DOI:10.1016/j.tvjl.2011.08.025 |
O'brien SJ, Yuhki N. 1999. Comparative genome organization of the major histocompatibility complex:lessons from the Felidae[J]. Immunological Reviews, 167(1): 133-144. DOI:10.1111/j.1600-065X.1999.tb01387.x |
Soll SJ, Stewart BS, Lehman N. 2010. Conservation of MHC class Ⅱ DOA sequences among carnivores[J]. Tissue Antigens, 65(3): 283-286. |
Stewart CA, Horton R, Allcock RJ, et al. 2004. Complete MHC haplotype sequencing for common disease gene mapping[J]. Genome Research, 14(6): 1176-1187. DOI:10.1101/gr.2188104 |
Timmins R, Duckworth JW, Samba K, et al. 2015. Axis porcinus[DB/OL].[2019-02-20]. The IUCN Red List of Threatened Species.e.T41784A22157664.
|
Xi D, Hao T, He Y, et al. 2014. Nucleotide sequence and polymorphism of MHC class Ⅱ DQB exon 2 alleles in Chinese yakow (Bos grunniens×Bos taurus)[J]. International Journal of Immunogenetics, 41(3): 269-275. DOI:10.1111/iji.12109 |
Xiang R, Zhang H, Deng Q, et al. 2013. Comprehensive identification of high-frequency and co-occurring Mafa-DPA1, Mafa-DQA1, Mafa-DRA, and Mafa-DOA alleles in Vietnamese cynomolgus macaques[J]. Immunogenetics, 65(9): 667-674. DOI:10.1007/s00251-013-0713-x |
 2020, Vol. 39
2020, Vol. 39





