扩展功能
文章信息
- 韦世元, 唐放, 彭旭, 何学令, 尹海林
- WEI Shiyuan, TANG Fang, PENG Xu, HE Xueling, YIN Hailin
- 单基因和双基因联合治疗对小鼠B16-F10黑色素瘤生长抑制作用研究
- Inhibitory Effect of Single Gene and Double Gene Combined Therapy Drugs on the Growth of B16-F10 Melanoma in Mice
- 四川动物, 2020, 39(1): 34-40
- Sichuan Journal of Zoology, 2020, 39(1): 34-40
- 10.11984/j.issn.1000-7083.20190170
-
文章历史
- 收稿日期: 2019-05-16
- 接受日期: 2019-08-08
2. 四川大学实验动物中心, 成都 610041
2. Experimental Animal Center, Sichuan University, Chengdu 610041, China
黑色素瘤起源于黑色素细胞,转移性较强,并且通常在发现时恶性程度较高。每年约有80%的皮肤肿瘤患者死于黑色素瘤,其5年生存期不到15%。恶性黑色素瘤对放化疗不敏感,对于那些失去早期手术切除治疗机会的患者,通过基因靶向治疗来延长生存期和改善生活质量是一个重要的研究方向(Bartolom et al., 2017;田萍,郑玲,2017)。粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)是一种主要由免疫细胞、上皮细胞以及一些肿瘤细胞分泌的造血细胞因子,可以促进树突状细胞、巨噬细胞等抗原呈递细胞的增殖分化,可以作为疫苗佐剂强化以树突状细胞为基础的免疫作用(张佳奇等,2018)。血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)可以与血管内皮生长因子结合促进血管内皮细胞增长,目前常见的主要有5种:VEGFR1(Flt-1)、VEGFR2(KDR/Klt-1)、VEGFR3(Flt-4)、免疫防御素神经纤毛蛋白(NRP-1)和NRP-2,其中,Flt-1、Flt-4和KDR/Klt-1均是蛋白络氨酸激酶(protein tyrosine kinase,PTK)受体,Flt-1和KDR/Klt-1主要在血管内皮细胞上表达,而Flt-4则主要分布在淋巴管内皮细胞(马锐,夏海滨,2017)。目前利用GM-CSF和Flt-kdr3单基因治疗肿瘤的研究已有多篇文章,Sallinen等(2009)在sVEGFR-1(sFlt-1)、sVEGFR-2(sFlk-1/KDR)、sVEGFR-3(sFlt-4)基因转移及其组合在异种移植小鼠腹腔内的抗血管生成和抗淋巴管生成作用的实验中发现,可溶性VEGFRs的抗血管生成基因治疗可降低异种卵巢癌移植的肿瘤生长、肿瘤血管供应和腹水形成;Yu等(2016)通过coton优化的GM-CSF基因显著提高了所有细胞中蛋白表达水平,有助于产生对HIV-1 Gag和HPV相关癌症的强大免疫应答。但这2个基因联合进行基因治疗的研究工作未见报道,为了进一步探讨2种基因对肿瘤治疗的协同作用,本研究通过阳离子脂质体介导的mGM-csf和mFlt-kdr3基因药物治疗黑色素肺转移瘤和腋下实体瘤,探讨其对肿瘤生长抑制的作用。
1 材料和方法 1.1 材料 1.1.1 实验动物5~6周龄BALB/c小鼠购自四川省医学科学院·四川省人民医院实验动物研究所[实验动物生产许可证号:SCXK(川)2013-15],饲养于四川大学实验动物中心[实验动物使用许可证号:SYXK(川)2016-9],动物实验均遵循四川大学实验动物中心实验动物保护福利和使用相关制度。
1.1.2 细胞株鼠源黑色素瘤B16-F10细胞株(四川大学生物治疗国家重点实验室)。采用DMEM高糖培养液(含10%胎牛血清)在5%CO2、37 ℃恒温培养箱中培养,隔天更换培养液,0.25%胰酶消化传代。
1.1.3 主要试剂DMEM培养基、胎牛血清、胰蛋白酶、磷酸盐缓冲液(PBS)均购自美国Gibco,青霉素-链霉素双抗购自Hy-clone;基因药物D1:H1299+ pNE-5(mFlt-kdr3)、D2:H1299+pNE-6(mGM-csf)由成都诺恩生物科技有限公司提供(批号分别为2018081302、2018081301),4 ℃保存。
1.2 方法 1.2.1 B16-F10肺转移模型建立收集对数生长期、生长状态良好(可见明显梭形结构和黑色颗粒状)的B16-F10细胞,用无血清无抗生素的DMEM培养基1 000 r·min-1离心3 min,洗涤1次后PBS重悬,接着用0.04%台盼蓝染液染色,显微镜下计数检测细胞活力(细胞活力=活细胞数量/总细胞数量×100%),待细胞活力达到90%以上时,调整细胞浓度为5×105/mL。冰袋保温将细胞送到无菌动物实验室,在35只小鼠尾部近末端1/3处用尾静脉注射法缓慢注射0.2 mL细胞悬液。
1.2.2 腋下实体瘤模型建立收集对数生长期、生长状态良好(可见明显梭形结构和黑色颗粒状)的B16-F10细胞,用无血清无抗生素的DMEM培养基1 000 r·min-1离心3 min,洗涤1次后PBS重悬,接着用0.04%台盼蓝染液染色,显微镜下计数检测细胞活力,待细胞活力达到90%以上时,调整细胞浓度为1×107/mL。冰袋保温将细胞送到无菌动物实验室,在35只小鼠左腋下方用皮下注射法注射0.1 mL细胞悬液。
1.2.3 肺转移模型分组及处理接种后21 d将小鼠随机分成5组:mFlt-kdr3治疗组、mGM-csf治疗组、联合治疗组(1次mFlt-kdr3,2次mGM-csf)、H1299脂质体质粒对照组和生理盐水对照组,每组6只。所有小鼠均采用尾静脉注射法注射对应基因药物。注射剂量为80 μL/只,隔天治疗,总计3次。
1.2.4 实体瘤模型分组处理接种后7 d将小鼠随机分成5组:mFlt-kdr3治疗组、mGM-csf治疗组、联合治疗组(1次mFlt-kdr3,2次mGM-csf)、H1299脂质体质粒对照组和生理盐水对照组,每组6只。所有小鼠均采用瘤体穿刺给药法注射对应基因药物,注射剂量为25 μL/只,隔天治疗,总计9次。
1.2.5 疗效观察肺转移模型小鼠治疗结束后3 d,即第30天时,用断颈法处死全部小鼠,并解剖剥离小鼠肺组织,同时对各组小鼠肺部黑色素瘤转移灶进行拍照和计数。实体瘤模型小鼠每次注射给药前用游标卡尺测量小鼠肿瘤长径(a)、短径(b),肿瘤平均体积=1/2ab2;相对肿瘤体积(RTV)=Vt/V0,式中,V0为给药前肿瘤体积,Vt为各个时间段肿瘤体积;肿瘤相对生长速度=TRTV/TCTV,式中,TRTV为治疗组某一时间点的肿瘤体积变化率,即肿瘤体积与给药前肿瘤体积的比值,TCTV为生理盐水对照组在同一时间点的肿瘤体积变化率;疗效价值=TRTV/TCTV×100%,若疗效价值≤60%时,表明该药物治疗有效。
1.2.6 苏木精-伊红(HE)染色肺转移模型小鼠肺组织用10%中性福尔马林固定,石蜡包埋、组织切片按照常规方法进行HE染色,电镜下观察肺组织病理变化。
1.2.7 毒副作用观察试验期间观察小鼠的一般情况,包括饮食、活动、体质量变化以及有无意外死亡等。
1.2.8 统计学分析采用SPSS 20进行组间t检验,P<0.05表示差异具有统计学意义。
2 结果 2.1 mGM-csf、mFlt-kdr3和双基因联合治疗组对小鼠黑色素瘤肺转移灶形成的抑制作用mGM-csf治疗组、mFlt-kdr3治疗组和联合治疗组的肿瘤数目分别为2.00个±1.29个、5.33个±1.20个和1.17个±0.98个,均与生理盐水对照组(12.83个±6.10个)之间的差异有统计学意义(P<0.05),但H1299脂质体质粒对照组(10.83个± 5.17个)和生理盐水对照组之间的差异无统计学意义(P>0.05)(图 1)。

|
| 图 1 各组小鼠的肺部结构 Fig. 1 Lung structure of the mice in different groups |
| |
mGM-csf治疗组、mFlt-kdr3治疗组和联合治疗组小鼠的肺部结构相对完整,可见比较完整的肺泡结构,而H1299脂质体质粒对照组和生理盐水对照组的肺部结构遭到破坏,肺泡间隙增厚,癌细胞排列紧密,核大深染,周围有大量炎细胞浸润(图 2)。
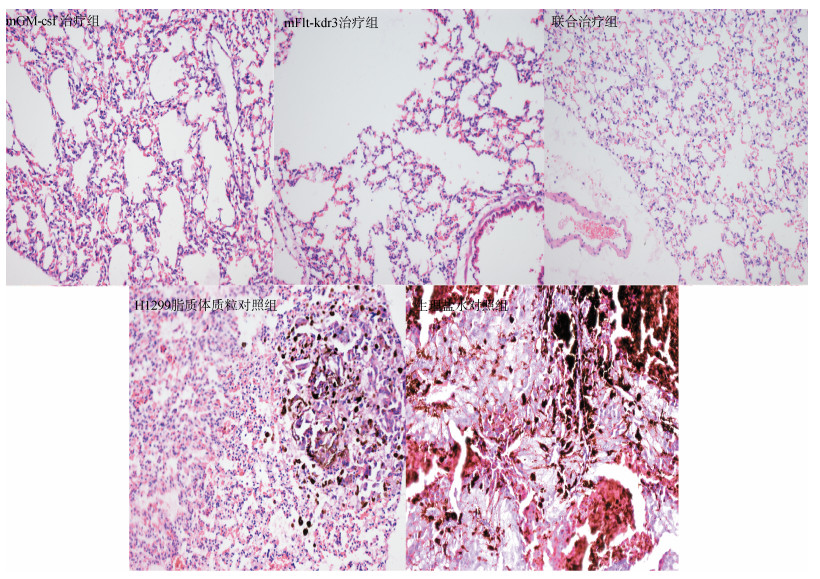
|
| 图 2 各组小鼠的肺组织切片(×200) Fig. 2 Lung tissue slice of the mice in different groups (×200) |
| |
实体瘤治疗实验中,mGM-csf治疗组、mFlt-kdr3治疗组和联合治疗组小鼠的黑色素瘤体积在18 d时分别为388.44 mm3±168.84 mm3、66.39 mm3±22.81 mm3和96.09 mm3±33.66 mm3,均显著小于生理盐水对照组(944.16 mm3±463.06 mm3;P<0.05);而H1299脂质体质粒对照组(915.81 mm3±437.33 mm3)与生理盐水对照组之间的差异无统计学意义(P>0.05;表 1)。mGM-csf治疗组小鼠在6 d之前的肿瘤相对生长速度高于生理盐水对照组,而联合治疗组肿瘤的平均体积在观察时间段内一直呈现明显的下降趋势。联合治疗组肿瘤相对生长速度在给药后2 d的疗效价值已经达到60%的有效值,而mGM-csf治疗组和mFlt-kdr3治疗组的疗效价值分别在4 d和10 d达到60%(图 3)。且在实验过程中各组小鼠的饮食、皮毛、活动以及精神状况未出现异常,也未出现异常死亡。
| 组别 | 平均肿瘤体积(x±SD)/mm3 | |||||||
| 0 d | 2 d | 4 d | 6 d | 8 d | 10 d | 16 d | 18 d | |
| mGM-csf治疗组 | 33.16± 3.14 | 84.19± 2.83 | 227.49± 47.82 | 247.24± 45.12 | 287.99± 77.85 | 296.45± 95.64 | 378.39± 149.61 | 388.44± 168.84* |
| mFlt-kdr3治疗组 | 31.41± 6.32 | 53.29± 10.95 | 108.25± 31.20 | 110.40± 33.29 | 111.36± 34.56 | 91.97± 30.39 | 78.88± 26.24 | 66.39± 22.81* |
| 联合治疗组 | 175.22± 65.59 | 223.65± 79.62 | 194.08± 81.80 | 128.67± 56.43 | 119.62± 46.44 | 100.40± 44.51 | 101.25± 34.72 | 96.09± 33.66* |
| H1299脂质体质粒对照组 | 33.27± 8.43 | 91.88± 33.21 | 283.24± 116.21 | 403.43± 150.67 | 497.80± 213.94 | 678.88± 311.61 | 818.73± 384.72 | 915.81± 437.33 |
| 生理盐水对照组 | 21.72± 5.93 | 60.20± 16.12 | 221.63± 84.97 | 317.40± 125.07 | 421.19± 173.09 | 589.70± 240.31 | 851.83± 412.22 | 944.16± 463.06 |
| 注:与生理盐水对照组相比,* P<0.05 Note:compared with normal saline control group,* P<0.05 | ||||||||
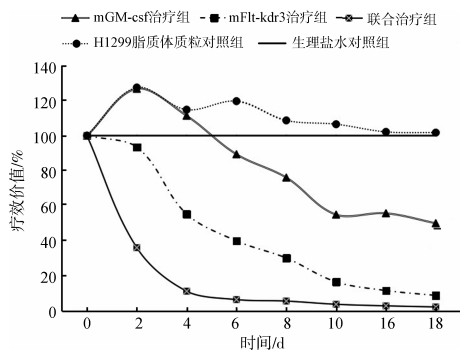
|
| 图 3 各组疗效价值 Fig. 3 Therapeutic value of different groups |
| |
黑色素瘤是一种高度恶性的肿瘤,具有侵袭组织、持续增殖的能力,能够逃避宿主细胞免疫监视和免疫检查,其在增殖转移过程中伴随着大量VEGF的分泌作用,VEGF与VEGFR结合后促进内皮细胞增殖,增加血管通透性以及内皮细胞迁移,诱导肿瘤生长转移。因此,通过抑制VEGF与受体结合是抑制肿瘤生长的一种重要方法。如Davidoff等(2002)通过腺联病毒载体构建的VEGFR-2,经门静脉注射后在小鼠体内产生稳定的高表达,在2种肾肿瘤模型中观察到显著的抗肿瘤效果;Zhang等(2018)构建了一种具有VEGF和CD 47双特异性的融合蛋白-VEGFR1D2-SIRPαD1,通过抑制VEGF诱导的血管生成和激活巨噬细胞介导的吞噬功能,在胶质母细胞瘤治疗中发挥了较强的抗肿瘤作用。另一方面,GM-CSF能够促进机体相关抗原的呈递、增殖和分化,增强胞毒细胞活性,提高机体的免疫能力(张佳奇等,2018)。Tada等(2012)在体外将未成熟的树突状细胞与自体肿瘤抗原及GM-CSF、IL24共培养后皮内注射治疗2例原发性肝癌患者,结果有1例患者出现肿瘤生长减慢现象。RaziSoofiyani等(2017)在研究GM-CSF基因治疗对小鼠纤维肉瘤模型肿瘤消退的影响实验中发现,经过基因治疗的模型小鼠的肿瘤体积极显著缩小。
非病毒载体中的脂质体载体具有包含量大、免疫原性小、成本效益高、易于生产和保护作用强的特点(Brenner et al., 1978),而且Templeton等(1997)对脂质体质粒复合物表达效应的研究发现,脂质体质粒复合物经尾静脉注射进入机体后会在肺部大量分布,因此,利用阳离子脂质体构建质粒基因复合物能更加有效地将治疗基因传递到靶细胞发挥抗肿瘤作用。
本实验采用阳离子脂质体包裹DNA的方法,构建mGM-csf以及mFlt-kdr3脂质体质粒基因复合物,用来治疗小鼠B16-F10黑色素瘤肺转移以及实体瘤,结果显示生理盐水对照组小鼠肺部结构遭到严重破坏,而mGM-csf治疗组、mFlt-kdr3治疗组和联合治疗组小鼠肺部结构相对完整,仅见散在肿瘤灶,并且联合治疗组的肿瘤平均数目最少、治疗效果最好。HE染色后在显微镜下可观察到相对完整的肺泡结构。实体瘤模型小鼠在给药治疗后,mGM-csf治疗组、mFlt-kdr3治疗组和联合治疗组肿瘤的相对生长速度显著低于H1299脂质体质粒对照组和生理盐水对照组,且联合治疗组的肿瘤平均体积呈现明显的下降趋势,药物疗效为:联合治疗组>mFlt-kdr3治疗组>mGM-csf治疗组。即联合基因药物疗效大于单一基因药物,可能是2种基因在靶细胞内同时表达,一方面能够抑制肿瘤血管的生成,抑制肿瘤的转移;另一方面靶细胞内表达的GM-CSF能够促进淋巴细胞在肿瘤部位的浸润,增强细胞毒性作用,从而增强机体的抗肿瘤能力。
mGM-csf治疗组在最开始给药的6 d表现出反常现象,其肿瘤平均体积增长相对速度高于生理盐水对照组,直到第10天左右才达到60%的治疗有效标准。推测原因是药物注射后免疫作用尚未启动;还有可能是在免疫治疗后激活免疫反应的过程中,由于有淋巴细胞浸润,导致肿瘤负荷暂时性增加。因此,这种短期肿瘤负荷的增加不一定是由于肿瘤生长所致的(Hodi et al., 2008)。
利用阳离子脂质体介导的mGM-csf以及mFlt-kdr3治疗黑色素瘤肺转移以及实体瘤,结果表明:2种单一基因药物均对肺部转移肿瘤灶的形成以及实体瘤的生长有一定的抑制作用,并且联合治疗组抑制作用更加明显。这为今后的肿瘤临床治疗和药物开发提供了一个新思路,同时也为后续的协同机理探讨奠定了一些基础。
马锐, 夏海滨. 2017. 针对抗肿瘤血管生成的分子靶向治疗进展[J]. 细胞与分子免疫学杂志, 33(3): 423-427. |
田萍, 郑玲. 2017. 恶性黑色素瘤的基因靶向治疗及生物免疫治疗的研究现状[J]. 实用药物与临床, 20(5): 593-597. |
张佳奇, 赵路军, 刘宁波, 等. 2018. 粒细胞-巨噬细胞集落刺激因子联合放疗研究进展[J]. 中国肿瘤临床, 45(9): 468-471. DOI:10.3969/j.issn.1000-8179.2018.09.294 |
Bartolom RA, Torres S, de Val SI, et al. 2017. VE-cadherin RGD motifs promote metastasis and constitute a potential therapeutic target in melanoma and breast cancers[J]. Oncotarget, 8(1): 215-227. |
Brenner BM, Hostetter TH, Humes HD. 1978. Glomerular permselectivity:barrier function based on discrimination of molecular size and charge[J]. The American Journal of Physiology, 234(6): 455-460. |
Davidoff AM, Nathwani AC, Spurbeck WW, et al. 2002. rAAV-mediated long-term liver-generated expression of an angiogenesis inhibitor can restrict renal tumor growth in mice[J]. Cancer Research, 62(11): 3077-3083. |
Hodi FS, Butler M, Oble DA, et al. 2008. Immunologic and clinical effects of antibody blockade of cytotoxic t lymphocyte-associated antigen 4 in previously vaccinated cancer patients[J]. Proceedings of the National Academy of Sciences of the United States of America, 105(8): 3005-3010. DOI:10.1073/pnas.0712237105 |
RaziSoofiyani S, Kazemi T, Lotfipour F, et al. 2017. The effects of gene therapy with granulocyte-macrophage colony-stimulating factor in the regression of tumor masses in fibrosarcoma mouse model[J]. Journal of Cancer Research & Therapeutics, 13(2): 362-366. |
Sallinen H, Anttila M, Narvainen J, et al. 2009. Antiangiogenic gene therapy with soluble VEGFR-1, -2, and -3 reduces the growth of solid human ovarian carcinoma in mice[J]. Molecular Therapy, 17(2): 278-284. DOI:10.1038/mt.2008.258 |
Tada F, Abe M, Hirooka M, et al. 2012. Phase Ⅰ/Ⅱ study of immunotherapy using tumor antigen-pulsed dendritic cells in patients with hepatocellular carcinoma[J]. International Journal of Oncology, 41(5): 1601-1609. DOI:10.3892/ijo.2012.1626 |
Templeton NS, Lasic DD, Frederik PM, et al. 1997. Improved DNA:liposome complexes for increased systemic delivery and gene expression[J]. Nature Biotechnology, 15(7): 647-652. DOI:10.1038/nbt0797-647 |
Yu TW, Chueh HY, Tsai CC, et al. 2016. Novel GM-CSF-based vaccines:one small step in GM-CSF gene optimization, one giant leap for human vaccines[J]. Human Vaccines & Immunotherapeutics, 12(1): 3020-3028. |
Zhang X, Wang S, Nan Y, et al. 2018. Inhibition of autophagy potentiated the anti-tumor effects of VEGF and CD47 bispecific therapy in glioblastoma[J]. Applied Microbiology and Biotechnology, 102(15): 6503-6513. DOI:10.1007/s00253-018-9069-3 |
 2020, Vol. 39
2020, Vol. 39




