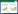扩展功能
文章信息
- 暴克尧, 周小慧, 孙溢泽, 马吉英, 党凯, 常惠, 王慧平
- BAO Keyao, ZHOU Xiaohui, SUN Yize, MA Jiying, DANG Kai, CHANG Hui, WANG Huiping
- 结合模拟失重, 改进大学生理学骨骼肌收缩实验
- Improving the Skeletal Muscle Contraction Experiment in Physiology Course by Using Simulated Weightless Mice
- 四川动物, 2019, 38(5): 594-599
- Sichuan Journal of Zoology, 2019, 38(5): 594-599
- 10.11984/j.issn.1000-7083.20190069
-
文章历史
- 收稿日期: 2019-02-24
- 接受日期: 2019-07-04
2. 西北工业大学生命学院, 西安 710072
2. School of Life Sciences, Northwestern Polytechnical University, Xi'an 710072, China
生理学是一门以实验为基础的学科,实验在生理学的科研和教学中有着不可替代的作用,其中教学实验既是教师讲授生理学的重要内容和载体,也是学生学习生理学的重要环节和手段。近年来,随着各高校教学目标和实验条件的不断提升,对生理学实验教学(在高等医学院校里,囊括在机能学实验中)的教学内容和实验方法也提出了新的要求,开设综合性强、技术性高、更能培养学生能力的实验项目成为实验教学的发展趋势(司道文等,2013;罗继景,2014;李鹏等,2017)。
电刺激骨骼肌,观察骨骼肌的收缩是生理学传统实验教学项目,包括改变电刺激强度观察骨骼肌收缩张力的变化,改变电刺激频率观察骨骼肌收缩形式的变化等。这一系列实验可直观地体现骨骼肌的收缩特点及其与刺激之间的关系,且实验条件和技术较简单,易于施行,因此在各实验指导教材及各高校的教学实践中普遍存在。传统骨骼肌收缩实验使用普通蛙类动物(多用物种为蛙或蟾蜍)作为实验材料(莫书荣,2003;裴建明,2011;栾新红等,2012;解景田等,2016)。但普通蛙类动物并非标准实验动物,在体质量、肌重,甚至品种等方面存在着较大的个体差异,使得不同个体之间的结果难以对比。同时,实验中需要制备离体坐骨神经-腓肠肌标本,该标本制作过程包括双毁髓、股部坐骨神经分离、脊柱纵向剪开等步骤,这些步骤要求学生精确实施,操作失误会使标本受到不可逆损伤,无法用于后续实验,这对初学者有一定难度。蛙类动物体表的毒腺及黏液也会使初学者产生一定的排斥心理。蛙类动物的肌肉亦不能完全体现哺乳动物肌肉的收缩特点,如哺乳动物骨骼肌分快缩型和慢缩型,二者收缩速率不同,蛙类动物骨骼肌无快慢之分。另外,在各地的教学实践中,尚有使用野生蛙类动物作为实验动物的情况,长期大量使用野生动物会对当地的生物资源产生影响,也不利于学生生态保护意识的培养。
针对以上使用蛙类动物的不足,我们曾提出使用SD大鼠进行此实验(王慧平等,2019)。但在实际教学过程中发现抓取和麻醉大鼠对初次接触大鼠的学生来讲有一定的困难和危险。另外,本教研室近年来致力于模拟失重致骨骼肌废用性萎缩的研究,对模拟失重动物模型的制备方法及骨骼肌的收缩功能进行了深入研究,研究表明将大鼠体轴与地面呈30°尾部悬吊2周以上,其后肢比目鱼肌(抗重力肌,SOL)可出现严重的萎缩,表现为肌重减少、收缩力下降、肌纤维横截面积减小、慢缩型肌纤维向快缩型肌纤维转化等现象(Du et al., 2011;冯斑等,2011;Li et al., 2012;Zhang et al., 2017;Gao et al., 2018)。因此,我们提出在本实验中使用模拟失重KM小鼠为实验动物,并在实验中加入模拟失重小鼠与正常小鼠骨骼肌收缩功能的对比,以丰富实验内容。
1 实验目的及原理通过此实验,使学生学习肌肉实验的电刺激方法及肌肉收缩的记录方法,观察不同刺激强度及刺激频率引起的骨骼肌收缩形式的改变,同时了解模拟失重对骨骼肌收缩功能的影响。实验原理包括了刺激强度与骨骼肌收缩反应的关系,骨骼肌收缩的总和,不同刺激频率引起的骨骼肌收缩形式的改变,及模拟失重致骨骼肌发生废用性萎缩时收缩功能的变化等相关生理学知识。
2 材料和方法 2.1 实验动物成年雌性KM小鼠随机分为模拟失重组(SWL组)和正常对照组(CON组),每组8只。动物饲养和实验过程符合西北大学动物伦理委员会要求。
2.2 实验步骤 2.2.1 模拟失重小鼠模型制备参照Du等(2011)的方法,小鼠尾部悬吊,保持后肢悬空,前肢正常活动,小鼠体轴与地面呈30°,连续21 d。在此期间,小鼠常规饲养,自由饮食饮水。
2.2.2 手术处理25%乌拉坦(5 mL·kg-1体质量)腹腔注射麻醉小鼠。将小鼠侧卧位固定于恒温手术台上,剪去一侧后肢胫部外侧被毛。剪开皮肤,暴露胫部肌肉,于胫骨与腓肠肌间找到SOL。将SOL与周边组织分离后完全暴露,避免周边组织的附着粘连对SOL收缩过程的影响。SOL下端肌腱处穿线结扎,并于扎线下方剪断肌腱,使其下端游离,SOL上端仍与胫部相连,SOL处于半游离状态。
2.2.3 生理信号采集系统连接将扎线与张力换能器连接,调整张力换能器方位使SOL、扎线、张力换能器处于同一水平面上,SOL与扎线在同一直线上,并同张力换能器呈90°,SOL的初始长度与其在体内的自然长度一致。电子刺激器的双针式刺激电极轻置于SOL的上半部分,输出电刺激引发SOL收缩。收缩张力信号经张力换能器由Powerlab生理信号采集系统(ADInstruments,上海)采集并记录。实验过程中,不时在SOL及创口表面滴加K-H液(单位:mmol·L-1,NaCl 118,KCl 4.75,MgSO4 1.18,NaHCO3 24.8,KH2PO4 1.18,CaCl2 2.54,葡萄糖10,pH7.4)以保持湿润。
2.2.4 收缩活动记录单收缩:手动发出刺激,刺激幅度从0 V开始,逐渐增大刺激强度,每次刺激间隔大于10 s,以避免频繁刺激引起肌肉疲劳。观察收缩张力曲线变化,直至出现最大收缩张力曲线。利用信号采集系统配套软件Chart 5.0在最大收缩张力曲线上测量以下单收缩的功能指标:单收缩最大张力(P0)、从收缩开始达到最大张力所需时间(TPT)、从舒张开始至舒张结束所需时间(RT)和单收缩所做的功,为单收缩张力曲线与横轴所围成的面积,即积分(P0-Output)。强直收缩:固定一个阈上刺激强度,以一个较低的刺激频率连续刺激肌肉,出现连续的多个单收缩曲线。逐渐增大刺激频率,单收缩逐渐融合,出现不完全强直收缩曲线。继续增大刺激频率直至出现完全强直收缩曲线。疲劳性:固定一个能引发正常对照小鼠与模拟失重小鼠的SOL均发生完全强直收缩的阈上刺激强度和刺激频率(通过实践,刺激强度设为3 V,刺激频率设为50 Hz),持续刺激5 s为一次,连续刺激12次,每次中间停歇5 s,得到连续12个完全强直收缩曲线。在每个完全强直收缩曲线上测量Pt(完全强直收缩最大张力)和Pt-Output(完全强直收缩所做的功)。
2.3 数据分析将各数据结果以Mean±SD表示,使用独立样本t检验进行显著性检验,显著性水平设为0.05。
3 实验结果 3.1 单收缩功能分析逐渐增加刺激强度,CON组与SWL组SOL的单收缩张力均逐渐增加,但CON组增加幅度大,SWL组增加幅度较小(图 1)。与CON组相比,SWL组最大单收缩的P0、P0-Output、TPT和RT均显著减少。表明模拟失重后,SOL单收缩张力显著降低,做功显著减少,收缩与舒张时间明显缩短(表 1)。
|
| 图 1 比目鱼肌单收缩 Fig. 1 The twitch contraction of soleus muscle A.逐渐增加刺激强度引发的单收缩,B.最大单收缩 A. the twitch contraction induced by increasing intensity stimulus, B. the maximal twitch contraction |
| |
| 组别 | P0/g | P0-Output/(g·s) | TPT/ms | RT/ms |
| CON | 0.47± 0.10 | 0.33± 0.04 | 134.17± 20.97 | 261.67± 58.93 |
| SWL | 0.12± 0.02*** | 0.13± 0.08* | 86.00± 4.94* | 144.17± 45.00** |
| 注Notes:与对照组相比compared with CON group,*P<0.05,**P<0.01,***P<0.001;下同the same below | ||||
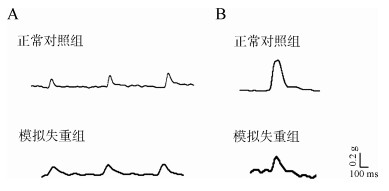
逐渐增加刺激频率,CON组、SWL组的SOL均出现不完全强直收缩和完全强直收缩(图 2)。
|
| 图 2 逐渐增加刺激频率引发的强直收缩 Fig. 2 The tetanic contraction induced by increasing frequency stimulus |
| |
SWL组Pt和Pt-Output与CON组相比均显著性减少。表明模拟失重后,SOL完全强直收缩的张力显著降低,做功显著减少(表 2)。
| 组别 | Pt/g | Pt-Output/(g·s) |
| 正常对照组 | 3.54±0.59 | 9.88±2.00 |
| 模拟失重组 | 1.26±0.26** | 3.56±0.58** |
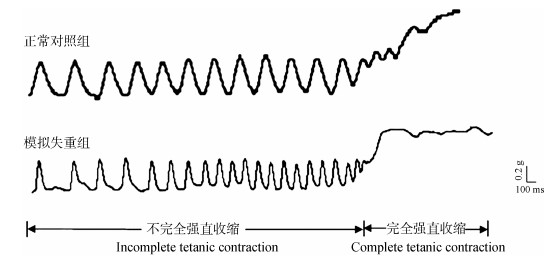
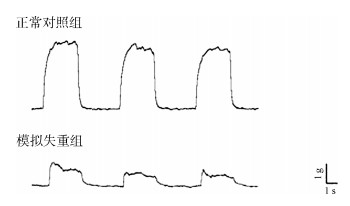
随着连续完全强直收缩的进行,CON组与SWL组完全强直收缩张力和做功均下降,但SWL组降低的速度更快,幅度更大(图 3,图 4)。
|
| 图 3 连续完全强直收缩 Fig. 3 The continuous complete tetanic contraction |
| |
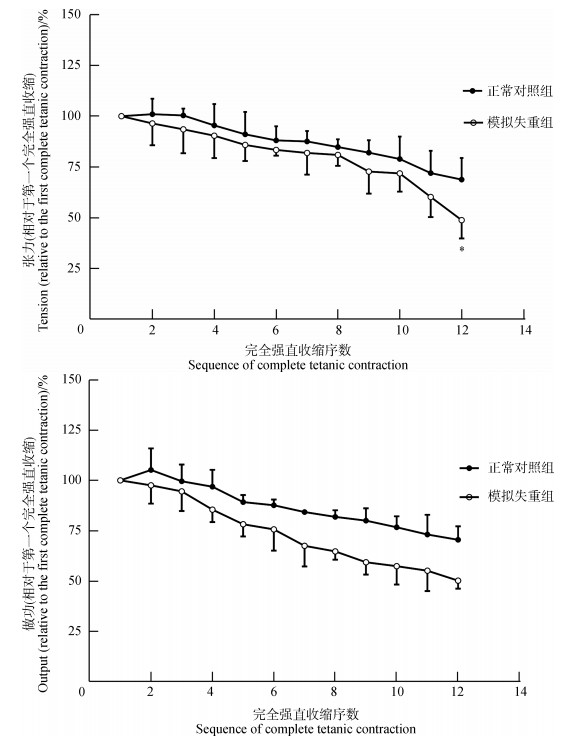
|
| 图 4 连续完全强直收缩张力与做功的变化 Fig. 4 The changes of tension and output in continuous complete tetanic contraction |
| |
骨骼肌收缩实验是生理学中的传统经典教学实验,在各高校多年的教学实践中,已有学者针对使用普通蛙类动物的不足,使用牛蛙Lithobates catesbeiana、小鼠、SD大鼠等均能很好地完成此实验(刘紫荆,陈筱春,2008;沙爱龙等,2017;王慧平等,2019)。用模拟失重小鼠的SOL进行此实验,发现随着刺激强度的增大,其收缩强度增大;随着刺激频率的增大,其收缩形式由一连串的单收缩逐步融合成不完全强直收缩,乃至完全强直收缩,这些实验结果与实验原理预期完全吻合。可见,使用模拟失重小鼠替代普通蛙类动物,亦能完成传统骨骼肌收缩实验的内容。
使用模拟失重小鼠,在完成传统实验的同时,还能观察中长期失重状态对骨骼肌收缩功能的影响。我们让学生同时测定模拟失重小鼠和正常小鼠的收缩功能,结果显示,模拟失重小鼠SOL单收缩张力与做功能力降低,收缩与舒张时间均快于正常小鼠,完全强直收缩张力与做功能力减弱,肌肉抗疲劳能力下降,在连续收缩过程中更易疲劳。这些结果与我们的科研结果一致,体现了骨骼肌在长期模拟失重状态下发生了一定程度的萎缩,从而导致收缩功能下降。通过这个实验,就可以向学生直接展示失重状态对骨骼肌收缩功能的影响,在传统骨骼肌收缩实验中引入了航天生理学的研究方法,增加了实验内容,使学生对航天生理学有了一个初步的了解。目前,我国载人航天事业正在蓬勃发展,在生理学教学中适机加入航天生理学的内容,不但能拓宽学生的知识领域,更能激发学生学习本课程的兴趣,激发学生的爱国情怀。另外,实验结束后,SOL或机体的其他组织器官还可用于其他实验,可使实验动物得到充分利用,节约实验经费,提高教学投入效益。
本实验简单易行,所用动物为常规标准实验动物,各实验动物中心均可提供。除小鼠吊尾外,其余均为常规实验方法。小鼠吊尾方法可参照文献进行(Morey-Holton & Ruth,2002;Du et al., 2011;林煜等,2012)。2018年,将这一新的教学实验引入我校本科生理学实验教学中,约150名学生分组进行了该实验,共测定了20只正常小鼠和20只模拟失重小鼠SOL的收缩功能。实验总体成功率84%,平均耗时3 h。此次实践表明本实验适合作为教学实验项目。经过实践,我们认为本实验过程中有两点需要注意:第一,多数学生实验前不知道SOL的解剖位置。我们运用解剖图谱和事先拍好的照片,明确清晰地展示了SOL的具体位置,有助于学生在进行实验时迅速准确确定SOL。第二,小鼠的体质量较轻,实验中可以在小鼠身上放置1、2把手术器械,如剪刀、止血钳等,这样的增重可以使SOL近心端更易固定,以免收缩时近心端移动影响张力数值。
目前国内流行的生理学实验指导教材,其内容多是经典传统的生理学实验。虽然这些实验在几十年的教学实践中已被证明其理论原理清晰、步骤设计合理、结果直观可靠,但在当今,却显得内容相对陈旧、缺乏时代气息,与现代生物科学、医学的发展相距甚远,不能很好地调动学生学习的兴趣和积极性。大多数高校教师都承担有科研任务,拥有一定的科研技术和成果。如能将自身的科研技术或成果与实验教学结合起来,将可极大提升实验教学的前沿性和挑战性,激发学生的学习兴趣,这也是目前教学改革提倡的方式之一(卜迟武等,2010;房伟等,2013;林跃强等,2015;赵永军等,2016;周智华等,2017)。本实验将科研中模拟失重动物骨骼肌收缩功能的测定方法和结果引入教学,从而丰富了传统骨骼肌收缩实验的内容,提升了实验教学水平,在实践中收到了良好的教学效果。
| 卜迟武, 杨绮云, 徐克非, 等. 2010. 结合科研项目提高实验教学质量[J]. 实验室研究与探索, 29(7): 270–271. |
| 房伟, 袁璟, 肖亚中. 2013. "科研项目"引导的《基因工程》课程教学改革初探[J]. 生物学杂志, 30(3): 112–113, 108. DOI:10.3969/j.issn.2095-1736.2013.03.112 |
| 冯斑, 王慧平, 党凯, 等. 2011. 脾虚对小鼠比目鱼肌形态和功能的影响[J]. 西北大学学报(自然科学版), 41(4): 645–649. |
| 解景田, 刘燕强, 崔庚寅. 2016. 生理学实验[M]. 北京: 高等教育出版社: 40-43. |
| 李鹏, 赵梦飞, 韩笑, 等. 2017. 高校动物学实验课程教学改革调查与实践探索[J]. 四川动物, 36(5): 593–600. |
| 林煜, 刘宗琳, 骞爱荣, 等. 2012. 一种模拟失重性骨丢失小鼠尾悬吊模型的建立[J]. 航天医学与医学工程, 25(4): 239–242. |
| 林跃强, 刘晓东, 李建. 2015. 科研成果转化为实验教学内容之探索[J]. 实验室研究与探索, 34(5): 144–146, 181. DOI:10.3969/j.issn.1006-7167.2015.05.039 |
| 刘紫荆, 陈筱春. 2008. 骨骼肌收缩实验的改进尝试[J]. 太原师范学院学报(自然科学版), 7(2): 171–173. DOI:10.3969/j.issn.1672-2027.2008.02.049 |
| 栾新红, 李士泽, 张富梅, 等. 2012. 动物生理学实验指导[M]. 北京: 高等教育出版社: 63-65. |
| 罗继景. 2014. 基础生物学实验教学改革的构想与实践[J]. 生物学杂志, 31(1): 108–110. DOI:10.3969/j.issn.2095-1736.2014.01.027 |
| 莫书荣. 2003. 实验生理科学[M]. 北京: 科学出版社: 70-74. |
| 裴建明. 2011. 生理学实验指导(双语版)[M]. 西安: 第四军医大学出版社: 9-12. |
| 沙爱龙, 赵春玲, 冉兵, 等. 2017. 骨骼肌收缩实验材料及方法的改进[J]. 卫生职业教育, 35(11): 76–77. |
| 司道文, 张宇新, 高俊玲, 等. 2013. 高校人体解剖学实验教学改革与创新[J]. 实验技术与管理, 30(6): 143–145. DOI:10.3969/j.issn.1002-4956.2013.06.041 |
| 王慧平, 姚国虎, 马吉英, 等. 2019. 大学生理学实验教学中新的骨骼肌收缩实验的创立[J]. 生物学杂志, 36(3): 115–117. DOI:10.3969/j.issn.2095-1736.2019.03.115 |
| 赵永军, 冯德明, 李俊峰, 等. 2016. 基于科研反哺教学的生物分离工程实验教学改革研究[J]. 微生物学通报, 43(4): 849–854. |
| 周智华, 李国斌, 唐安平, 等. 2017. 高校教师科研成果转化为本科教学资源的形式[J]. 当代教育理论与实践, 9(1): 65–67. |
| Du FY, Wang J, Gao YF, et al. 2011. A hind limb disuse model inducing extensor digitorum longus atrophy in rats:tail suspension-immobilization[J]. Aviation, Space, and Environmental Medicine, 82(7): 689–693. DOI:10.3357/ASEM.2984.2011 |
| Gao YF, Arfat Y, Wang HP, et al. 2018. Muscle atrophy induced by mechanical unloading:mechanisms and potential counter measures[J]. Frontiers in Physiology, 9: 235. DOI:10.3389/fphys.2018.00235 |
| Li SY, Yang Z, Gao YF, et al. 2012. Ligustrazine and the contractile properties of soleus muscle in hindlimb-unloaded rats[J]. Aviation, Space, and Environmental Medicine, 83(11): 1049–1054. DOI:10.3357/ASEM.3249.2012 |
| Morey-Holton ER, Ruth KG. 2002. Hindlimb unloading rodent model:technical aspects[J]. Journal of Applied Physiology, 92: 1367–1377. |
| Zhang J, Li Y, Li GY, et al. 2017. Identification of the optimal dose and calpain system regulation of tetramethylpyrazine on the prevention of skeletal muscle atrophy in hindlimb unloading rats[J]. Biomedicine & Pharmacotherapy, 96: 513–523. |
 2019, Vol. 38
2019, Vol. 38