扩展功能
文章信息
- 孙晓红, 李萍, 景洁, 高洁, 杨振, 沈咏梅, 张修月, 岳碧松, 孟杨
- SUN Xiaohong, LI Ping, JING Jie, GAO Jie, YANG Zhen, SHEN Yongmei, ZHANG Xiuyue, YUE Bisong, MENG Yang
- 美洲大蠊胸腺素THY3的表达模式分析
- Analysis of Thymosin THY3 Expression Patterns in Periplaneta americana
- 四川动物, 2019, 38(4): 415-419
- Sichuan Journal of Zoology, 2019, 38(4): 415-419
- 10.11984/j.issn.1000-7083.20190026
-
文章历史
- 收稿日期: 2019-01-16
- 接受日期: 2019-05-16
2. 西南大学动物科学学院, 重庆 402460;
3. 药用美洲大蠊四川省重点实验室, 成都 610031;
4. 四川大学自然博物馆, 成都 610065
2. College of Animal Science, Southwest University, Chongqing 402460, China;
3. Sichuan Key Laboratory for Medicinal American Cockroach, Chengdu 610031, China;
4. Museum of Natural History, Sichuan University, Chengdu 610065, China
胸腺素最初是由Goldstein等(1966)发现并命名的一种促淋巴细胞生成因子, 其序列在进化过程中高度保守(刘羽佳, 李集临, 2010)。根据等电点的不同, 可以将胸腺素分为3类:α、β和γ。在β族胸腺素中Tβ4被研究得最多, 其含有一个功能域, 具有促进伤口愈合(Huff et al., 2001)、促毛发生长(Philp et al., 2004)、加速组织和器官再生(Cha et al., 2010)、增强免疫(Saelee et al., 2013)等功能。而昆虫胸腺素通常具有多个功能域, 能赋予它们更复杂的功能(Hertzog et al., 2002; Irobi et al., 2014)。例如黑腹果蝇Drosophila melanogaster胸腺素Ciboulot能与体内的G-actin偶联而发挥作用(Boquet et al., 2000; Troys et al., 2007), 白蚁Hodotermopsis sjostedti胸腺素参与脑部神经发育(Koshikawa et al., 2005), 棉铃虫Helicoverpa armigera胸腺素可能参与机体的免疫反应和变态发育(Zhang et al., 2011), 家蚕Bombyx mori胸腺素可显著提高被BmNPV病毒感染细胞的存活率(周鑫鑫等, 2018)。
美洲大蠊Periplaneta americana属昆虫纲Inseeta蜚蠊目Blattaria蜚蠊科Blattaria, 又称蟑螂, 原产于非洲北部, 现为分布广泛的世界性卫生害虫, 也是一种重要的药用昆虫。目前, 美洲大蠊研究主要集中在药用价值、化学成分分析等方面(郭昕等, 2018)。研究表明, 美洲大蠊有抗菌、抗病毒、消肿止痛、促进伤口愈合和抗肿瘤等功效, 由其制成的康复新液、心脉隆等药物已在临床上广泛应用(刘玉媛, 2006; 肖小芹等, 2007; 高洁等, 2018)。但美洲大蠊中的有效药用成分并未得到确定, 很大程度上阻碍了其在医药领域的进一步开发和利用。晋家正等(2018)采用生物信息学的方法在基因组数据库中注释得到美洲大蠊胸腺素3个剪接体THY1 (MK573540)、THY2(MK573541)和THY3(MK573542), 其中, THY3序列最长(621 bp), 含有5个外显子, 而THY1(507 bp)、THY2(393 bp)分别含有4个、3个外显子。本研究采用real-time PCR(qPCR)技术对美洲大蠊不同性别、不同龄期及雌性成虫不同组织中THY3表达水平进行检测分析, 为进一步研究美洲大蠊胸腺素的功能奠定基础和今后的临床应用提供科学依据。
1 材料与方法 1.1 样品来源及制备美洲大蠊样品均由好医生药业集团有限公司西昌养殖基地提供, 选择同一批次生长状况良好的成虫、新羽化成虫、8龄若虫雌雄各5只, 3龄若虫(不分雌雄)5只, 卵荚10颗为1组, 共5组; 活虫经消毒清洗后去除肠道和翅, 立即放入液氮中速冻研磨, 提取总RNA, -80 ℃保存待用。为了避免美洲大蠊雌雄差异对胸腺素表达模式结果的影响, 本实验中体壁、脂肪体、头部、血淋巴、肌肉5种组织均取自美洲大蠊雌性成虫。血淋巴的收集是从虫体胫节处将足剪去, 挤压后用移液枪吸取20 μL血淋巴打入细胞裂解液中, 样品根据成都福际公司总RNA提取试剂盒说明书提取RNA。
1.2 大肠杆菌Escherichia coli刺激美洲大蠊虫体选择生长状况良好、大小相近、羽化1周的雌性美洲大蠊成虫150只, 随机分为空白组、大肠杆菌诱导组及磷酸盐缓冲液(PBS)对照组, 各50只, 常规方法饲养。诱导组体腔注射大肠杆菌菌液10 μL(1×105个细菌), 对照组腹部注射10 μL 1×PBS, 空白组不做处理。在空白组中随机取5只美洲大蠊收集血淋巴和脂肪体, 提取RNA。诱导组、对照组的美洲大蠊集体给CO2 5 min使之昏迷, 然后注射大肠杆菌菌液和PBS, 饲养3 h、6 h、12 h、18 h和24 h后, 各组随机取出5只美洲大蠊收集血淋巴和脂肪体, 提取RNA。
1.3 总RNA的提取及cDNA第1链的合成从美洲大蠊活体中收集血淋巴、脂肪体并立即放入到细胞裂解液中, 充分震荡、裂解。其他美洲大蠊虫体及组织样品在液氮中快速研磨, 取适量粉末放入细胞裂解液中震荡混匀, 提取总RNA。取1 μL RNA样品进行琼脂糖凝胶电泳质量检测, 用分光光度计检测RNA浓度及纯度。
以上述提取的RNA为模板, 根据诺唯赞生物公司去DNA反转录试剂盒提供的方法合成cDNA。
1.4 qPCR分析胸腺素THY3的表达根据美洲大蠊胸腺素THY3的特异序列, 用Primer Premier 5设计特异性引物, 以β-actin作为内参基因。THY3F:5'-CGAGCTTATTCAAGGTGTC-3', THY3R:5'-TCAATGGCTTCTGGGTCTG-3', β-actin F:5'-AGAGGGAAATCGTGCGTGAC-3', β-actin R:5'-GCCTTCCTTCTTGGGTATGG-3'。引物合成和产物测序均由擎科生物公司完成。qPCR反应程序为:94 ℃ 3 min; 40个循环:94 ℃ 10 s, 60 ℃ 30 s。结果采用2-△△Ct法计算THY3的相对表达量。
1.5 数据处理以上各组数据采用GraphPad Prism 7中的单因素方差分析进行差异比较。
2 结果 2.1 THY3在美洲大蠊不同性别、不同发育阶段的表达差异采用qPCR检测THY3在美洲大蠊不同性别、不同虫期的表达模式, 结果表明, THY3在成虫、若虫及卵期都有表达, 成虫表达量显著高于若虫, 雌虫表达量显著高于雄虫(P < 0.05), 且新羽化雌性成虫的表达量最高(图 1)。

|
| 图 1 不同性别、不同龄期美洲大蠊中THY3的表达差异 Fig. 1 Different expression of THY3 in Periplaneta americana of different sexes and ages 不同字母表示组间差异有统计学意义(P < 0.05);下同 Different letters indicate there is a significant difference between groups (P < 0.05); the same below |
| |
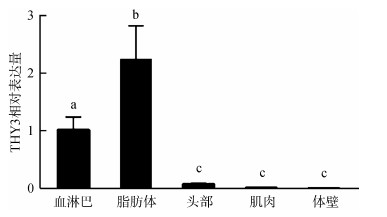
采用qPCR法检测雌性美洲大蠊成虫血淋巴、脂肪体、头部、肌肉和体壁5种组织中THY3的表达水平, 结果显示:THY3在脂肪体中的表达量最高, 其次是血淋巴, 均极显著高于其他组织(P < 0.01), 而在头部、体壁和肌肉中的表达量极低(图 2)。
|
| 图 2 美洲大蠊不同组织中THY3的表达差异 Fig. 2 Different expression of THY3 in different tissues of Periplaneta americana |
| |
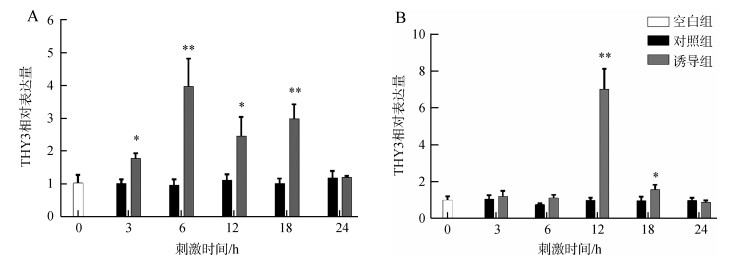
采用在雌性成虫体腔注射大肠杆菌的方法, 检测血淋巴和脂肪体中胸腺素THY3的表达, 结果表明, 注射3 h后即可检测到血淋巴中THY3表达量明显升高, 6 h达到最高, 随后下降, 24 h后与对照组和空白组之间的差异无统计学意义, 即恢复到正常水平(图 3:A)。而注射12 h后脂肪体中THY3的表达水平明显升高, 随后下降, 24 h恢复正常水平(图 3:B)。对照组THY3表达水平与空白组之间的差异没有统计学意义。
|
| 图 3 大肠杆菌刺激对雌性美洲大蠊成虫血淋巴(A)和脂肪体(B)中THY3表达量的影响 Fig. 3 Effect of Escherichia coli stimulation on the expression of THY3 in hemolymph (A) and fat (B) of female Periplaneta americana adult * P < 0.05, ** P < 0.01 |
| |
羽化是昆虫变态发育的关键时期, 此时虫体的退化组织细胞正发生高水平的自噬及凋亡(史艳霞等, 2009)。而Freeman等(2011)早期研究证明, 胸腺素可以调控与抗氧化有关的酶来降低体内活性氧簇, 进而调节机体的细胞凋亡反应。本研究结果显示, THY3表达量在新羽化成虫中最高, 且显著高于8龄若虫, 在羽化1周的成虫中又明显下降, 推测胸腺素在羽化期的高表达可能参与细胞凋亡, 或加快清除和降解退化的组织。在棉铃虫的研究中发现, 用20-羟基蜕皮激素刺激机体1 h后, 胸腺素基因HaTHY1的表达显著上调, 并且羽化期的HaTHY1和HaTHY2都高表达(Zhang et al., 2011), 相似研究成果在合浦珠母贝Pinctada fucata中也得到验证, Pfthymosin β4在变态期的相对表达量最高(何文耀等, 2018)。说明THY3很可能也促进美洲大蠊的变态发育。结果还显示, 雌虫中THY3的表达水平高于雄虫, 尤其羽化1周的成虫雌雄表达差异显著, 美洲大蠊经过羽化变为成虫, 生殖器官成熟, 由此推测THY3可能参与雌性美洲大蠊生殖器官的发育。早期有报道胸腺素与无脊椎动物的生殖相关, 线虫Caenorhgbditis elegans体内由于Tetrathymosin基因突变, 使卵缺乏肌动蛋白结构而丧失生殖能力(康志琼等, 2015)。
胸腺素在脊椎动物体内是一种重要的抗菌肽(Irobi et al., 2014)和抗炎剂(Girardi et al., 2003), 研究表明, 人胸腺素β4可以减少伤口部位炎症因子的产生, 促进胶原纤维的形成(赵双, 2012), 也可增强小鼠脾脏淋巴细胞的免疫活性(何娟娟, 马列婷, 2012)。本研究显示, THY3在美洲大蠊血淋巴和脂肪体中高表达, 且显著高于其他组织。而脂肪体和血细胞是昆虫重要的免疫场所(Lemaitre & Hoffmann, 2007), 因此, 推测美洲大蠊胸腺素可能参与其自身免疫反应。在美洲大蠊体内注射大肠杆菌后发现, THY3表达量在血淋巴中变化比较明显, 刺激后3~12 h维持较高水平, 并且在6 h达到最高, 而脂肪体中THY3的表达水平在12 h后才显著升高, 说明美洲大蠊与合浦珠母贝类似, 机体发挥免疫功能主要依赖血细胞。血淋巴介导完成的免疫反应主要为吞噬作用、成瘤作用及包囊作用, 而脂肪体的免疫反应主要依赖于解毒作用及合成一些抗菌肽并释放到血液中发挥作用(耿华等, 2004; 史艳霞等, 2009; 初源等, 2013)。胸腺素也是一类抗菌肽物质, 因此, 菌液刺激后THY3可能主要通过血淋巴参与免疫反应, 之后脂肪体迅速合成THY3等抗菌肽物质来阻断病菌的继续侵染, 并参与解毒作用来保证昆虫体内环境的稳定。与其类似的还有中华绒螯蟹Eriocheir sinensis受细菌刺激3 h后, EsTRP1在血淋巴中高表达, 24 h后EsTRP2在血淋巴中的表达显著上升(Gai et al., 2009); 同样, 日本囊对虾Marsupenaeus japonicas受细菌刺激后, 血细胞中Mjthymosin3的表达水平明显上调(Feng et al., 2018); 棉铃虫受细菌刺激3 h后, 脂肪体中HaTHY1和HaTHY2的表达水平也明显上调(Zhang et al., 2011)。细菌刺激后胸腺素表达量上调的行为可能是虫体受到细菌等异物刺激后做出的免疫应答反应, 以增强机体的免疫防卫, 这进一步证实了胸腺素THY3参与机体的免疫反应, 但其作用机制有待进一步研究。
| 初源, 周帆, 张明明, 等. 2013. 昆虫天然免疫反应研究前沿[J]. 应用昆虫学报, 50(2): 311–320. |
| 高洁, 刘瑾华, 孙晓 红., 等. 2018. 美洲大蠊精粉对小鼠血糖和肌酐的影响[J]. 四川动物, 37(6): 667–671. |
| 耿华, 安春菊, 郝友进, 等. 2004. 昆虫抗菌肽的结构和功能研究现状[J]. 生物学通报, 39(10): 1–4. DOI:10.3969/j.issn.0006-3193.2004.10.001 |
| 郭昕, 巩荣艳, 朱娟娟, 等. 2018. 美洲大蠊乙醇提取物中原儿茶酸超高效液相色谱定量分析方法的建立[J]. 四川动物, 37(2): 185–190. |
| 何娟娟, 马列婷. 2012. 胸腺素β4研究进展[J]. 现代检验医学杂志, 27(1): 1–4. DOI:10.3969/j.issn.1671-7414.2012.01.001 |
| 何文耀, 范嗣刚, 刘宝锁, 等. 2018. 合浦珠母贝胸腺素β4插核损伤和发育时期的表达研究[J]. 南方水产科学, 14: 66–74. |
| 晋家正, 李午佼, 牟必琴, 等. 2018. 药用美洲大蠊全基因组测序分析[J]. 四川动物, 37(2): 121–126. |
| 康志琼, 郝丽娟, 马上上, 等. 2015. 无脊椎动物β-胸腺素的功能研究进展[J]. 生物学杂志, 32(2): 76–79. |
| 刘羽佳, 李集临. 2010. 胸腺素β4研究进展[J]. 安徽农学通报, 16: 38–44. |
| 刘玉媛. 2006. 天然药物康复新液的临床应用[J]. 天津药学, 18(3): 55–57. DOI:10.3969/j.issn.1006-5687.2006.03.029 |
| 史艳霞, 李庆荣, 黄志君, 等. 2009. 昆虫变态发育过程中的细胞自噬和凋亡[J]. 昆虫学报, 52(1): 84–94. DOI:10.3321/j.issn:0454-6296.2009.01.012 |
| 肖小芹, 汪世平, 徐绍锐, 等. 2007. 美洲大蠊提取物抗炎、镇痛作用的实验研究[J]. 中国病原生物学杂志, 2(2): 140–143. |
| 赵双. 2012.重组人胸腺素β4的表达纯化及生物学活性检测[D].北京: 北京协和医学院. http://cdmd.cnki.com.cn/Article/CDMD-10730-1015567942.htm |
| 周鑫鑫, 王永娣, 廖金旭, 等. 2018. 家蚕胸腺素对蚕体抗核型多角体病毒感染能力的影响[J]. 蚕业科学, 44(1): 66–69. |
| Boquet I, Boujemaa R, Carlier MF, et al. 2000. Ciboulot regulates actin assembly during Drosophila brain metamorphosis[J]. Cell, 102: 797–808. DOI:10.1016/S0092-8674(00)00068-4 |
| Cha H, Philp D, Lee SH, et al. 2010. Over-expression of thymosin beta 4 promotes abnormal tooth development and stimulation of hair growth[J]. International Journal of Developmental Biology, 54: 135–140. DOI:10.1387/ijdb.082735hc |
| Irobi E, Aguda AH, Larsson M, et al. 2004. Structural basis of actin sequestration by thymosin-β4:implications for WH2 proteins[J]. EMBO Journal, 23(18): 3599–3608. DOI:10.1038/sj.emboj.7600372 |
| Feng XW, Huo LJ, Yang MC, et al. 2019. Thymosins participate in antibacterial immunity of kuruma shrimp, Marsupenaeus japonicas[J]. Fish & Shellfish Immunology, 84: 244–251. |
| Freeman KW, Bowman BR, Zetter BR. 2011. Regenerative protein thymosin beta-4 is a novel regulator of purinergic signaling[J]. FASEB Journal, 25: 907–915. DOI:10.1096/fj.10-169417 |
| Gai Y, Zhao J, Song L, et al. 2009. Two thymosin-repeated molecules with structural and functional diversity coexist in Chinese mitten crab Eriocheir sinensis[J]. Developmental & Comparative Immunology, 33: 867–876. |
| Girardi M, Sherling MA, Filler RB, et al. 2003. Anti-inflammatory effects in the skin of thymosin-beta4 splice-variants[J]. Immunology, 109: 1–7. DOI:10.1046/j.1365-2567.2003.01616.x |
| Goldstein AL, Slater FD, White A. 1966. Preparation, assay, and partial purification of a thymic lymphocytopoietic factor (thymosin)[J]. Proceedings of the National Academy of Sciences of the United States of America, 56: 1010–1017. DOI:10.1073/pnas.56.3.1010 |
| Hertzog M, Yarmola EG, Didry D, et al. 2002. Control of actin dynamics by proteins made of beta-thymosin repeats:the actobindin family[J]. Journal of Biological Chemistry, 277: 14786–14792. DOI:10.1074/jbc.M112064200 |
| Huff T, Mller CS, Otto AM, et al. 2001. Beta-thymosins, small acidic peptides with multiple functions[J]. International Journal of Biochemistry & Cell Biology, 33: 205–220. |
| Koshikawa S, Cornette R, Hojo M, et al. 2005. Screening of genes expressed in developing mandibles during soldier differentiation in the termite Hodotermopsis sjostedti[J]. FEBS Letters, 579(6): 1365–1370. DOI:10.1016/j.febslet.2005.01.031 |
| Lemaitre B, Hoffmann J. 2007. The host defense of Drosophila melanogaster[J]. Annual Review of Immunology, 25: 697–743. DOI:10.1146/annurev.immunol.25.022106.141615 |
| Philp D, Goldstein AL, Kleinman HK. 2004. Thymosin β4 promotes angiogenesis, wound healing, and hair follicle development[J]. Mechanisms of Ageing & Development, 125: 113–115. |
| Saelee N, Noonin C, Nupan B, et al. 2013. β-thymosins and hemocyte homeostasis in a crustacean[J]. PLoS ONE, 8: e60974. DOI:10.1371/journal.pone.0060974 |
| Troys MV, Dhaese S, Vandekerckhove J, et al. 2007. Multirepeat β-Thymosins[M]. New York: Springer. |
| Zhang FX, Shao HL, Wang JX, et al. 2011. β-thymosin is upregulated by the steroid hormone 20-hydroxyecdysone and microorganisms[J]. Insect Molecular Biology, 20: 519–527. DOI:10.1111/j.1365-2583.2011.01082.x |
 2019, Vol. 38
2019, Vol. 38




