扩展功能
文章信息
- 孜拉吉古丽·西克然木, 马纪, 库尔班·吐松, 刘小宁
- XIKERANMU Zilajiguli, MA Ji, TUSONG Kuerban, LIU Xiaoning
- 小胸鳖甲胞外铜锌超氧化物歧化酶重组蛋白的原核表达及多克隆抗体制备
- Prokaryotic Expression and Polyclonal Antibody Preparation of Extracellular Copper Zinc Superoxide Dismutase from Micordera punctipennis
- 四川动物, 2019, 38(4): 387-393
- Sichuan Journal of Zoology, 2019, 38(4): 387-393
- 10.11984/j.issn.1000-7083.20190013
-
文章历史
- 收稿日期: 2019-01-09
- 接受日期: 2019-05-16
昆虫的分布、生长与其生存环境紧密相关。对许多生物体来说,温度是最重要的环境因素,它通过诱导许多生理反应来影响生物生长繁殖、分布和丰度(Parmesan,2006;Angilletta et al., 2010;Jia et al., 2011)。任何环境温度的变化均会引起昆虫体内一系列的生理响应,包括低温胁迫(史亮等,2013)。当昆虫处于低温胁迫时,细胞内的酶促反应速率下降,呼吸链某些点的三磷酸腺苷(ATP)需求和电子积累减少,这种情况促使一些活性氧(ROS)突然增加,引起机体内ROS的积累而导致氧化应激(Chattopadhyay,2002)。超氧阴离子自由基(O2·-)通常是第一个产生的ROS。O2·-的产生可能引发更多反应性ROS(OH-、ONO2-、HOO·)的形成,这些反应性ROS可能对生物大分子,包括膜脂、蛋白质、核酸和其他细胞成分造成潜在的破坏(Gill & Tuteja,2010)。荒漠昆虫经常遭受恶劣环境的影响,如寒冷的气候(Sømme,1995)。因此昆虫在适应环境的自我保护调节中,为抵御自由基的伤害,形成了一整套高效的抗氧化系统,以清除和解毒累积的氧自由基(冯从经等,2002;Hermeslima & Zentenosavín,2002;杜尧,2007)。
超氧化物歧化酶(SOD)是生物体中的主要抗氧化酶家族,被认为是抗氧化防御系统的第一道防线,通过将超氧化物转化为H2O2和水来抵抗氧化应激(Ackerman & Brinkley,1966;Mccord & Fridovich,1988)。SOD的独特之处在于其活性决定了2种Haber-Weiss反应底物O2和H2O2的浓度,因此它是防御机制的核心(Gill & Tuteja,2010)。在真核生物中,SOD有3种清楚的亚型:一种是定位于细胞质中的Cu/Zn-SOD,即SOD1,一种是定位于细胞外的EC-SOD,即SOD3,还有一种以Mn为辅助因子的SOD,即Mn-SOD,也被称为SOD2(Zelko et al., 2002)。
小胸鳖甲Micordera punctipennis隶属于鞘翅目Coleoptera拟步甲科Tenebrionidae,为生活在中国西北部新疆古尔班通古特沙漠的一种特有种,该地区1月土壤表面和土壤下5 cm的平均温度分别为-12 ℃和5 ℃,因此其成虫具有很强的耐寒性,且存在冷驯化机制(黄人鑫等,2005)。小胸鳖甲在低温冷驯化过程中可能会受到自由基的伤害,从而导致氧化应激。课题组前期对小胸鳖甲低温转录组数据进行GO分析,结果表明SOD是相应低温胁迫反应的8个显著上调的基因之一(库尔班·吐松等,2016)。因此,抗氧化应激是小胸鳖甲对冷应激反应的一个重要方面。本研究将小胸鳖甲胞外Cu/Zn-SOD基因与pET-32a表达载体连接,在大肠杆菌Escherichia coli中诱导表达出目的蛋白Trx-His-MpecCu/Zn-SOD,重组蛋白分子量约为42 kDa。利用Ni2+亲和纯化获得了这种重组蛋白Trx-His-MpecCu/Zn-SOD,并对纯化的重组蛋白的酶学性质进行了分析。同时制备了该重组蛋白的多克隆抗体。本研究结果为进一步研究ecCu/Zn-SOD的功能及其在昆虫中的耐寒性机制提供了有效的检测工具。
1 材料与方法 1.1 材料及试剂小胸鳖甲收集于新疆维吾尔自治区阜康市222团(87°51′E,44°24′N)的准噶尔盆地古尔班通古特沙漠南缘地带。将样品带回实验室并在30 ℃± 0.5 ℃、16 h: 8 h(光照:黑暗)光周期、相对湿度为30%±6%条件下用麦麸和新鲜卷心菜叶饲养。黄粉虫Tenebrio molitor在饲养室进行人工饲养。KM小鼠购于新疆医科大学动物中心[实验动物生产许可证号:SCXK(新)2018-0002,实验动物使用许可证号:SYXK(新)2018-0003]。蛋白质相对分子质量Marker和BCA蛋白浓度定量试剂盒购自Thermo Fisher Scientific。小鼠抗His-tag抗体(TA-02,IgG1)、辣根过氧化物(HRP)酶标记的山羊抗小鼠IgG抗体[ZB-2305,IgG(H+L)]和二氨基联苯胺(DAB)显色试剂盒均购自北京中杉金桥生物技术有限公司。四甲基联苯胺(TMB)溶液购于Life Technologies;Ni2+亲和层析系统为Novagene产品;ELISA板购自广州洁特生物过滤制品有限公司,其余化学试剂均为国产分析纯。
1.2 方法 1.2.1 重组蛋白Trx-His-MpecCu/Zn-SOD的诱导表达与纯化前期构建并鉴定正确的pET32a-MpecCu/Zn-SOD重组质粒转入大肠杆菌BL21(DE3),保存于30%甘油中。挑取重组子于含有氨苄的LB液体培养基中,37 ℃ 220 r·min-1震荡过夜培养。次日以1: 100转接于新鲜LB(含氨苄)液体培养基中培养,至OD600为0.5时,加入终浓度为0.3 mmol·L-1的异丙基-β-D-硫代半乳糖苷(IPTG),22 ℃ 100 r·min-1 6 h。同时设pET32a(+)空载体菌为诱导对照。取1 mL上述诱导的大肠杆菌经磷酸盐缓冲液(PBS)洗涤后,超声裂解,12 000 r·min-1 5 min。分别收获上清和沉淀,等量上样,观察上清液和细胞沉淀的含量,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),考马斯亮蓝R250染色2 h后脱色过夜,检测重组蛋白的可溶性表达。
将含有重组质粒pET32a-MpecCu/Zn-SOD的BL21(DE3)菌株接种于含有氨苄(50 μg·mL-1)的LB液体培养基中,37 ℃ 220 r·min-1震荡培养至OD600=0.5时加入终浓度为0.3 mmol·L-1的IPTG于22 ℃ 100 r·min-1 6 h,12 000 r·min-1 10 min,收集菌体,以PBS洗涤2次并重悬沉淀,超声破碎菌体,12 000 r·min-1 10 min,收集沉淀。在8 mol·L-1尿素中4 ℃过夜变性。次日,将总蛋白吸附到5 mmol·L-1咪唑(pH8.0)平衡柱子上3 h,然后分别用20 mmol·L-1咪唑(pH8.0)洗3次后,再用50 mmol·L-1、75 mmol·L-1、100 mmol·L-1、120 mmol·L-1、200 mmol·L-1咪唑(pH8.0)通过His-Trap亲和柱进行洗脱纯化。含6 mol·L-1尿素的PBS 4 ℃透析过夜。接着分别用含4.0 mol·L-1、3.0 mol·L-1、2.0 mol·L-1、1.0 mol·L-1、0 mol·L-1梯度浓度的尿素1×PBS透析各4 h,12 000 r·min-1 5 min,上清即为可溶性的复性蛋白。用聚乙二醇超滤浓缩,小管分装,-80 ℃保存。SDS-PAGE检测蛋白质纯化情况并确定最佳洗脱浓度。然后用BCA蛋白浓度定量试剂盒进行定量。
将20 μL纯化的重组蛋白Trx-His-MpecCu/Zn-SOD进行12%SDS-PAGE后,在50 mA下电泳转移到聚偏二氟乙烯(PVDF)膜上,然后用5%脱脂奶粉在4 ℃下封闭过夜。次日将封闭的膜在磷酸盐吐温缓冲液(PBST)中洗涤3次,每次5 min,并以小鼠抗His IgG1(1: 1 000稀释)作为一抗,以带辣根过氧化物酶(HRP)标记的羊抗鼠IgG(稀释度为1: 5 000)作为二抗,于DAB中显色并拍照。
1.2.2 重组蛋白Trx-His-MpecCu/Zn-SOD的部分酶学性质分析采用BCA蛋白定量试剂盒测定纯化后的Trx-His-MpecCu/Zn-SOD浓度,重复取样测定3次,最后根据所得标准曲线计算目的蛋白浓度。参照SOD试剂盒(测分型)说明书(南京建成生物科技有限公司),采用黄嘌呤氧化酶法测定纯化后的Trx-His-MpecCu/Zn-SOD的酶活性。
取纯化好的Trx-His-MpecCu/Zn-SOD,检测温度、pH对该蛋白酶活性的影响,为减少误差,每个实验设置3个平行组,并重复测定3次。温度处理组中,取等体积纯化后的Trx-His-MpecCu/Zn-SOD溶液于试管中,分别置于15 ℃、25 ℃、35 ℃、45 ℃、55 ℃、65 ℃水浴锅中,保温20 min,再用酶标仪分别测定各组的吸光值,计算酶活性。在pH处理组中,将等体积SOD纯化酶液分别加入pH5、6、7、8、9、10、11、12的缓冲液体系中,室温孵育30 min后测定酶活性。缓冲体系的配置分别为0.2 mol·L-1 Citrate Buffer(pH2、3、4、5和6),0.2 mol·L-1 Tris-HCl Buffer(pH7、8和9)以及0.2 mol·L-1 Glycine/NaOH Buffer(pH10、11、12)。
1.2.3 多克隆抗体的制备及特异性分析免疫前,用眼眶采血法收集5只小鼠血液,每只300 μL,37 ℃ 30 min,4 ℃ 1 h,3 500 r·min-1 10 min,上层血清-80 ℃保存,作为阴性对照。纯化的重组蛋白Trx-His-MpecCu/Zn-SOD作为抗原免疫小鼠:每只小鼠用50 μg重组蛋白与等体积的弗氏完全佐剂乳化,足垫和皮下注射;14 d后,50 μg重组蛋白与等体积的弗氏不完全佐剂乳化,足垫和皮下注射免疫;之后每隔15~20 d加强免疫1次,共2次。免疫后分别收集血清,-80 ℃保存。
纯化的重组蛋白经包被液稀释,抗原终浓度为5 μg·mL-1,96孔板每孔加入150 μL稀释的抗原包被酶标反应板,4 ℃过夜。次日用PBST洗涤3次,每次5 min;每孔加入200 μL含有质量分数为5%脱脂奶粉的PBST封闭,37 ℃ 2 h,洗涤同上;每孔加入150 μL按比例稀释的抗血清(用2.5%脱脂奶粉稀释),37 ℃ 1 h,洗涤3次。每孔加入100 μL HRP标记的羊抗鼠IgG二抗(封闭液为1: 5 000),37 ℃ 1 h,洗涤同上;加入100 μL TMB显色液显色10 min,最后每孔加入100 μL 2 mol·L-1终止液H2SO4,终止反应。酶标仪在450 nm波长下立即测定吸光值(OD)。
参照杨颖等(2011)的方法配制水溶性蛋白裂解液(100 mmol·L-1 Tris,7 mol·L-1尿素,0.02 mol·L-1乙二胺四乙酸,65 mmol·L-1二硫苏糖醇),冰浴30 min。用灭菌的H2O冲洗干净小胸鳖甲7龄幼虫(末期幼虫),用液氮研磨后溶于抽提液中冰浴30 min。4 ℃ 12 000 r·min-1 20 min,上清液即为小胸鳖甲总蛋白。将小胸鳖甲的天然总蛋白和黄粉虫天然总蛋白在SDS-PAGE分离,转移到PVDF膜上,经过一抗(MpecCu/Zn-SOD抗血清)和二抗(HRP)处理后于DAB中显色,显色时间约为2 min,并拍照。
2 结果与分析 2.1 重组蛋白Trx-His-MpecCu/Zn-SOD的纯化经SDS-PAGE检测,沉淀中包含大量重组蛋白,以不溶于水的包涵体形式存在(图 1:A)。将含有pET32a-MpecCu/Zn-SOD表达质粒的BL21(DE3)菌体超声破碎,将上清加载到亲和柱上,以不同浓度咪唑洗脱,SDS-PAGE检测结果显示,Trx-His-MpecCu/Zn-SOD能被20 mmol·L-1、50 mmol·L-1、75 mmol·L-1、100 mmol·L-1、120 mmol·L-1浓度咪唑的洗脱液洗脱,其中120 mmol·L-1为最佳洗脱浓度(图 1:A)。以Anti-his抗体作为一抗,用HRP标记的羊抗鼠IgG作为二抗,鉴定纯化的重组蛋白Trx-His-MpecCu/Zn-SOD,结果显示,杂交出的条带大小与预计的42 kDa相符合(图 1:B),进一步说明诱导及纯化的重组蛋白是目的重组蛋白。

|
| 图 1 重组蛋白Trx-His-MpecCu/Zn-SOD的诱导表达与纯化 Fig. 1 Induced expression and purification of fusion Trx-His-MpecCu/Zn-SOD protein M.蛋白Marker;A. SDS-PAGE分析结果: 1.未诱导的细菌总蛋白,2.诱导的Trx-His-MpecCu/Zn-SOD总蛋白,3. Trx-His-MpecCu/Zn-SOD裂解上清,4. Trx-His-MpecCu/Zn-SOD裂解沉淀,5~9. 20 mmol·L-1、50 mmol·L-1、75 mmol·L-1、100 mmol·L-1和120 mmol·L-1咪唑浓度洗脱液洗脱的蛋白条带;B. Western blot分析结果: 1.未诱导的细菌总蛋白,2.诱导的Trx-His-MpecCu/Zn-SOD总蛋白 M. protein Marker; A. result of SDS-PAGE analysis: 1.uninduced bacterial total protein, 2. induced Trx-His-MpecCu/Zn-SOD total protein, 3. Trx-His-MpecCu/Zn-SOD lysis supernatant, 4. Trx-His-MpecCu/Zn-SOD lysis deposit, 5-9. protein strip eluted by 20 mmol·L-1, 50 mmol·L-1, 75 mmol·L-1, 100 mmol·L-1和120 mmol·L-1 imidazole concentration eluent, respectively; B. result of Western blot: 1. uninduced bacterial total protein, 2. induced Trx-His-MpecCu/Zn-SOD bacterial total protein |
| |
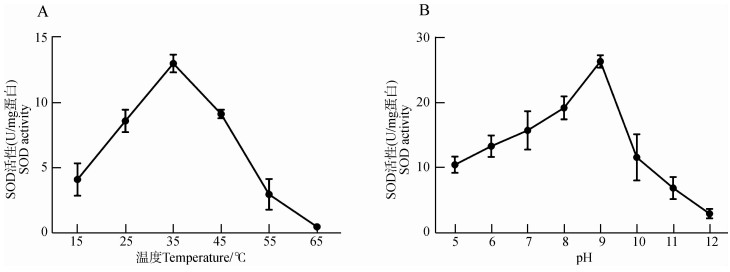
纯化后的Trx-His-MpecCu/Zn-SOD浓度为1.33 mg·mL-1,酶活性为27.52 U·mg-1。在不同温度下处理30 min后,重组Trx-His-MpecCu/Zn-SOD的活性在35 ℃最高,为13.05 U·mg-1;与其他温度下测得的酶活性比较,在25~45 ℃保温30 min后的MpecCu/Zn-SOD的酶活性稳定,相对酶活性保持在65%以上;低温和高温处理均会导致该酶活性的减弱,在65 ℃高温处理后,相对酶活性迅速降至几乎为0(图 2:A)。pH值为5.0~9.0时,Trx-His-MpecCu/Zn-SOD的酶活性随着pH值升高逐渐升高,pH为9时的酶活性最高;当pH>9时,酶活性则随着pH值升高迅速降低(图 2:B)。
|
| 图 2 温度(A)和pH(B)对重组蛋白Trx-His-MpecCu/Zn-SOD酶活力的影响 Fig. 2 Effect of temperature (A) and pH (B) on the activity of fusion Trx-His-MpecCu/Zn-SOD protein |
| |
用重组蛋白Trx-His-MpecCu/Zn-SOD免疫小鼠3次后,ELISA方法测定抗血清效价(图 3)。当血清稀释819 200倍时,样品在450 nm的光吸收值大于阴性对照的2.1倍,即抗血清的滴度约为819 200。

|
| 图 3 ELISA测定Trx-His-MpecCu/Zn-SOD抗血清效价 Fig. 3 ELISA assay for Trx-His-MpecCu/Zn-SOD antiserum titer |
| |
以制备的抗Trx-His-MpecCu/Zn-SOD抗血清作为一抗,以羊抗鼠IgG-HRP作为二抗,以大肠杆菌DH5α菌体重组蛋白Trx-His-MpecCu/Zn-SOD、小胸鳖甲总蛋白和黄粉虫总蛋白作为抗原进行Western blot分析。结果显示,所制备的抗血清能够与重组蛋白结合且与预期条带大小相符(42 kDa)(图 4:A),也能与小胸鳖甲体内天然的MpecCu/Zn-SOD结合,条带大小与理论大小相符(23 kDa),而与黄粉虫的总蛋白无杂交条带(图 4:B)。表明制备的抗Trx-His-MpecCu/Zn-SOD的抗血清对小胸鳖甲体内的MpecCu/Zn-SOD具有较好的免疫特异性。

|
| 图 4 Trx-His-MpecCu/Zn-SOD抗血清的免疫特异性检测 Fig. 4 Immunospecific detection of Trx-His-MpecCu/Zn-SOD antiserum M.蛋白Marker;A. Western blot分析结果: 1.未诱导细菌的总蛋白重组蛋白,2. Trx-His-MpecCu/Zn-SOD;B. SDS-PAGE分析结果: 1.黄粉虫总蛋白,2.小胸鳖甲总蛋白;C. Western blot分析结果: 1.黄粉虫总蛋白,2.小胸鳖甲总蛋白 M. protein Marker; A. result of Western blot: 1.uninduced bacterial total protein, 2. fusion protein Trx-His-MpecCu/Zn-SOD; B. result of SDS-PAGE analysis: 1. Tenebrio molitor total protein, 2. Micordera punctipennis total protein; C. result of Western blot: 1. T. molitor total protein, 2. M. punctipennis total protein |
| |
SOD作为生物体内抗氧化系统的重要防线,在昆虫等节肢动物适应环境胁迫过程中发挥着至关重要的作用(Yang et al., 2010)。研究表明,当各种环境胁迫,包括低温使昆虫体内电子传递链受到损伤,产生大量的O2·-时,其体内的胞外Cu/Zn-SOD(ecCu/Zn-SOD)发挥着重要的抗氧化防御功能(岳宗豪等,2014;刘云财等,2018)。目前有关昆虫的研究主要集中在icCu/Zn-SOD,而对ecCu/Zn-SOD的作用机制研究较少(刘云财等,2018)。小胸鳖甲作为古尔班通古特沙漠的特有种,体内的ecCu/Zn-SOD是否能在抵抗外界寒冷的环境中发挥作用需要进一步通过分子生物学的手段来证明,而制备特异性强、高效价的ecCu/Zn-SOD抗体是深入开展相关研究的基础之一。本文将小胸鳖甲ecCu/Zn-SOD构建至pET-32a表达质粒上,在大肠杆菌中成功诱导出重组蛋白Trx-His-MpecCu/Zn-SOD。诱导出的重组蛋白在大肠杆菌主要以包涵体的形式存在于沉淀中,通过Ni2+亲和层析纯化得到比较单一的重组蛋白Trx-His-MpecCu/Zn-SOD,用尿素复性后,测得的蛋白浓度为1.33 mg·mL-1,活力为27.3 U·mg-1,Western blot的结果验证该重组蛋白的正确性。
Cu/Zn-SOD是一种金属蛋白酶,酶活性受到pH、温度等因素的影响(田春美,钟秋平,2005)。柑桔全爪螨Panonychus citri重组蛋白ecCu/Zn-SOD在25~70 ℃表现出广泛的温度耐受性(Feng et al., 2015)。翘嘴鳜Siniperca chuatsi重组蛋白Cu/Zn-SOD在25~60 ℃保持75%以上的酶活性(肖俊等,2017)。本研究中小胸鳖甲ecCu/Zn-SOD在25~45 ℃具有比较稳定的酶活性,低温和高温处理能够减弱该酶活性,可能是因为纯化获得的重组蛋白是以包涵体的形式存在,需要进行变性和复性。有研究表明,通过生物提取的icCu/Zn-SOD和ecCu/Zn-SOD相比,复性的ecCu/Zn-SOD热稳定性显著降低(朱希强,袁勤生,2005)。尤其是大肠杆菌表达及纯化并变性复性后的MpecCu/Zn-SOD仅在10~50 ℃有酶活性。温度高于60 ℃,其稳定性开始迅速降低。这与本研究结果一致。
天然形式Cu/Zn-SOD酶结构在pH5.3~9.5保持不变,显示出极强的稳定性(Salin & Oesterhelt,1988)。大多数重组蛋白Cu/Zn-SOD在pH2.0~10.5均具有很高的酶活性(刘建荣等,2007;Bao et al., 2009;Xu et al., 2010;肖俊等,2017)。另外斑马鱼Danio rerio的重组蛋白Cu/Zn-SOD在pH7.5~11均具有很高的酶活性(Ken et al., 2003)。本研究中MpecCu/Zn-SOD也表现出比较广泛的酸碱耐受性,表明其酶活性相对稳定。另一方面,以纯化的重组蛋白Trx-His-MpecCu/Zn-SOD作为抗原,通过3次免疫小鼠,最终获得滴度高于1: 819 200的抗血清,且特异性较好。Western blot结果显示,制备的Trx-His-MpecCu/Zn-SOD抗血清对大肠杆菌总蛋白中的重组蛋白体进行抗体特异性检测时,出现一些杂带,但目的条带相对明显。Trx-His-MpecCu/Zn-SOD的抗血清能与小胸鳖甲的天然ecCu/Zn-SOD免疫特异性结合,但不能与黄粉虫的蛋白结合,表明抗血清具有免疫特异性,为后期进行昆虫耐寒性机制和蛋白功能研究提供重要的免疫检测工具。
| 杜尧, 马春森, 赵清华, 等. 2007. 高温对昆虫影响的生理生化作用机理研究进展[J]. 生态学报, 27(4): 1565–1572. DOI:10.3321/j.issn:1000-0933.2007.04.037 |
| 冯从经, 戴华国, 符文俊. 2002. 腰带长体茧蜂寄生后亚洲玉米螟体内抗氧化酶活性及组织特异性[J]. 南京农业大学学报, 25(3): 31–35. |
| 黄人鑫, 胡红英, 吴卫, 等. 2005. 新疆及其毗邻地区荒漠昆虫区系的形成与演变[J]. 干旱区地理(汉文版), 28(1): 38–44. |
| 库尔班·吐松, 陆雪莹, 马纪, 等. 2016. 准噶尔小胸鳖甲短时低温胁迫响应的转录组分析[J]. 昆虫学报, 59(6): 581–591. |
| 刘建荣, 赵晓瑜, 宋小青, 等. 2007. 重组人Cu/Zn-SOD包含体的复性、纯化及复性蛋白稳定性研究[J]. 中国药学杂志, 42(13): 969–974. DOI:10.3321/j.issn:1001-2494.2007.13.003 |
| 刘云财, 苏航, 王沛城. 2018. 桑螟胞外铜锌超氧化物歧化酶基因的克隆与融合表达及重组蛋白酶活性检测[J]. 蚕业科学, 44(2): 188–195. |
| 史亮, 李鸿波, 金学柱, 等. 2013. 低温胁迫对西花蓟马抗氧化酶活性的影响[J]. 应用昆虫学报, 50(4): 1062–1067. |
| 田春美, 钟秋平. 2005. 超氧化物歧化酶的现状研究进展[J]. 中国热带医学, 5(8): 1730–1732. DOI:10.3969/j.issn.1009-9727.2005.08.072 |
| 肖俊, 许亮清, 胡向萍, 等. 2017. 翘嘴鳜铜锌超氧化物歧化酶重组蛋白表达、纯化及特性分析[J]. 淡水渔业, 47(2): 11–17. DOI:10.3969/j.issn.1000-6907.2017.02.002 |
| 杨颖, 徐代勋, 曲勃, 等. 2011. 梅花鹿鹿茸总蛋白的提取方法比较[J]. 特产研究, 2: 11–12. |
| 岳宗豪, 樊鑫, 赵欢, 等. 2014. 双齿围沙蚕Cu/Zn-SOD cDNA基因的克隆及序列分析[J]. 大连海洋大学学报, 29(4): 354–359. DOI:10.3969/J.ISSN.2095-1388.2014.04.006 |
| 朱希强, 袁勤生. 2005. EC-SOD包涵体的柱上复性、纯化及稳定性研究[J]. 微生物学通报, 32(4): 101–106. DOI:10.3969/j.issn.0253-2654.2005.04.020 |
| Ackerman NB, Brinkley FB. 1966. Oxygen tensions in normal and ischemic tissues during hyperbaric therapy[J]. Journal of the American Medical Association, 198(12): 1280–1283. DOI:10.1001/jama.1966.03110250094027 |
| Angilletta MJ Jr., Cooper BS, Schuler MS, et al. 2010. The evolution of thermal physiology in ectotherms[J]. Frontiers in Bioscience, 2(4): 861–881. |
| Bao YB, Li L, Xu F, et al. 2009. Intracellular copper/zinc superoxide dismutase from bay scallop Argopecten irradians:its gene structure, mRNA expression and recombinant protein[J]. Fish & Shellfish Immunology, 27(2): 210–220. |
| Chattopadhyay MK. 2002. Low temperature and oxidative stress[J]. Current Science, 83(2): 109. |
| Feng YC, Liao CY, Xia WK, et al. 2015. Regulation of three isoforms of SOD gene by environmental stresses in citrus red mite, Panonychus citri[J]. Experimental and Applied Acarology, 67(1): 1–15. DOI:10.1007/s10493-015-9940-1 |
| Gill SS, Tuteja N. 2010. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry, 48(12): 909–930. DOI:10.1016/j.plaphy.2010.08.016 |
| Hermeslima M, Zentenosavín T. 2002. Animal response to drastic changes in oxygen availability and physiological oxidative stress[J]. Comparative Biochemistry & Physiology Part C Toxicology & Pharmacology, 133(4): 537–556. |
| Jia FX, Dou W, Hu F, et al. 2011. Effects of thermal stress on lipid peroxidation and antioxidant enzyme activities of oriental fruit fly, Bactrocera dorsalis (Diptera:Tephritidae)[J]. Florida Entomologist, 94(4): 956–963. DOI:10.1653/024.094.0432 |
| Ken CF, Lin CT, Shaw JF, et al. 2003. Characterization of fish Cu/Zn-superoxide dismutase and its protection from oxidative stress[J]. Marine Biotechnology, 5(2): 167–173. |
| Mccord JM, Fridovich I. 1988. Superoxide dismutase:the first twenty years (1968-1988)[J]. Free Radical Biology and Medicine, 5(5): 363–369. |
| Parmesan C. 2006. Ecological and evolutionary responses to recent climate change[J]. Annual Review of Ecology Evolution & Systematics, 37(1): 637–669. |
| Salin ML, Oesterhelt D. 1988. Purification of a manganese-containing superoxide dismutase from Halobacterium halobium[J]. Archives of Biochemistry and Biophysics, 260(2): 806–810. DOI:10.1016/0003-9861(88)90511-5 |
| Sømme L. 1995. Invertebrates in hot and cold arid environments[M]. Berlin, Heidelberg: Springer. |
| Xu HH, Ma H, Hu BQ, et al. 2010. Molecular cloning, identification and functional characterization of a novel intracellular Cu-Zn superoxide dismutase from the freshwater mussel Cristaria plicata[J]. Fish & Shellfish Immunology, 29(4): 615–622. |
| Yang LH, Huang H, Wang JJ. 2010. Antioxidant responses of citrus red mite, Panonychus citri (McGregor)(Acari:Tetranychidae), exposed to thermal stress[J]. Journal of Insect Physiology, 56(12): 1871–1876. DOI:10.1016/j.jinsphys.2010.08.006 |
| Zelko IN, Mariani TJ, Folz RJ. 2002. Superoxide dismutase multigene family:a comparison of the CuZn-SOD (SOD1), Mn-SOD (SOD2), and EC-SOD (SOD3) gene structures, evolution, and expression[J]. Free Radical Biology and Medicine, 33(3): 337–349. DOI:10.1016/S0891-5849(02)00905-X |
 2019, Vol. 38
2019, Vol. 38




