扩展功能
文章信息
- 鲁艳, 李茂华, 甘维熊, 曾如奎, 宋昭彬
- LU Yan, LI Maohua, GAN Weixiong, ZENG Rukui, SONG Zhaobin
- 运动训练和停训对鲈鲤幼鱼游泳能力的影响
- Effect of Exercise Training and Detraining on Swimming Performance of Juvenile Percocypris pingi
- 四川动物, 2019, 38(4): 361-367
- Sichuan Journal of Zoology, 2019, 38(4): 361-367
- 10.11984/j.issn.1000-7083.20190057
-
文章历史
- 收稿日期: 2019-02-12
- 接受日期: 2019-04-11
2. 雅砻江流域水电开发有限公司, 成都 610015;
3. 四川大学生命科学学院, 生物资源与生态环境教育部重点实验室, 成都 610065
2. Yalong River Hydropower Development Company, Ltd., Chengdu 610015, China;
3. Key Laboratory of Bio-Resource and Eco-Environment of Ministry of Education, College of Life Sciences, Sichuan University, Chengdu 610065, China
游泳运动是鱼类洄游迁移、捕食逃逸和繁殖求偶等行为实现的主要方式,为其生存、生长等正常生命活动提供了基本保障(Reidy et al., 2000;Plaut,2001;Fu et al., 2013)。按照对氧的需求可将鱼类游泳运动分为有氧运动和无氧运动,前者主要由红肌有氧代谢供能,持续时间长、耐疲劳,通常与鱼类洄游、食物搜寻及求偶展示等生命活动密切相关,是鱼类适合度的重要影响因子之一(Plaut,2001);后者主要由白肌无氧代谢供能,持续时间短、易疲劳,通常是捕食逃逸、穿越激流和快速转弯等生命活动的基础(鲜雪梅等,2010)。有氧运动能力可通过测定临界游泳速度(Ucrit)来评估(Brett,1964;Li et al., 2017),而无氧运动能力可通过测定固定流速下的耐受时间来衡量(Zeng et al., 2009;鲜雪梅等,2010)。
鲈鲤Percocypris pingi隶属于鲤形目Cypriniformes鲤科Cyprinidae鲃亚科Barbinae鲈鲤属Percocypris,主要分布于金沙江、雅砻江及大渡河等长江上游水系(丁瑞华,1994)。受水电梯级开发、过度捕捞等影响,野生鲈鲤资源量急剧下降,目前已被列为中国脊椎动物红色名录濒危(EN)物种和世界自然保护联盟(IUCN)濒危物种红色名录近危(NT)物种(Zhao,2011;蒋志刚等,2016)。为减缓人为干扰对鱼类资源的影响,实施人工增殖放流被视为一项重要的鱼类保护措施并受到前所未有的关注,鲈鲤正是雅砻江流域开展的人工增殖放流鱼类之一(Li et al., 2016)。尽管人工增殖放流在鱼类的可持续发展过程中发挥了重要作用,但人工饲养个体放流到野外后存活率不高,其主要原因是人工繁育的鱼类与野生个体相比运动能力和摄食-反捕食能力较低,竞争力不足(McNeil,1991;石小涛等,2012)。因此,如何提高鱼类的运动能力,进而提高其在放流后的存活率,是一个亟待解决且具重要应用价值的问题。
放流前进行适当的运动训练能提高鱼类的运动能力,有利于其成功捕食、逃避捕食者追赶和不利生境,进而提高其存活率(Young & Cech,1994;孔彬等,2008),而停训会导致运动训练的效果消失或恢复到训练前水平(Castro et al., 2011)。研究表明,中华倒刺鲃Spinibarbus sinensis在60%Ucrit(34 cm·s-1)的水流速度下每天训练6 h,训练14 d后的Ucrit显著高于对照组(Zhao et al., 2012)。鲤Cyprinus carpio在60%Ucrit(36 cm·s-1)的水流速度下每天训练6 h,4周后训练组的Ucrit明显高于对照组(He et al., 2013)。经14 d力竭追赶训练后,瓦氏黄颡鱼Peltebagrus vachelli的Ucrit显著提高,但停训7 d后,其提升的运动能力消失(Liu et al., 2009)。目前,运动训练对鱼类运动能力影响的相关研究较多,而关于停训后的研究较少,也未得出一致性的结论。因此,本研究主要探讨不同运动制度和停训对鲈鲤幼鱼运动能力的影响,旨在为鱼类运动训练研究提供基础资料,并为鲈鲤的养殖及增殖放流提供一定的实践指导。
1 材料与方法 1.1 实验鱼的来源与驯养实验鱼为雅砻江锦屏·官地水电站鱼类增殖放流站人工繁殖的鲈鲤幼鱼(1龄)。选取身体健康、大小相当的幼鱼600尾,暂养于室内循环水槽中(直径1 m,体积628 L),水深1 m,每天以凤凰牌浮性配合饲料(粗蛋白质≥36.0%,粗脂肪≥4.0%,粗纤维≤8.0%,粗灰分≤17.0%,总磷≥1.2%,赖氨酸≥1.75%,水≤12.5%)饱足投喂2次(09: 00和18: 00),投喂1 h后清除水槽内的粪便及残饵,日换水量约为驯养水体的1/3。饲养期间水温为15 ℃±2 ℃,溶解氧含量≥8 mg·L-1,光照周期为12 h光照: 12 h黑暗。
1.2 运动训练实验方案与操作暂养4周后,随机选取480尾鲈鲤幼鱼[体质量(BM):2.18 g±0.12 g,体长(BL):5.33 cm±0.09 cm]分为4组(每组120尾):对照组(C组)、无氧训练组(An组)、4 BL·s-1组(H组)和2 BL·s-1组(L组),每组实验鱼分别转入3个相同的室内运动训练水槽中[图 1;改自宋波澜等(2012)的运动训练装置],每个水槽40尾。H组和L组每天均训练8 h。An组每天15: 00用手抄网以固定速度于环形水道内(宽0.3 m,高0.5 m)追赶实验鱼直至力竭(Li et al., 2017),判断力竭的标准为鱼体失去平衡或对刺激无明显反应。各组训练时间均为30 d,训练期间水深0.3 m。H组和L组第1天在初始流速为1 BL·s-1下训练8 h,再按1 BL·s-1·d-1增加训练流速,直至分别达到4 BL·s-1和2 BL·s-1后并一直保持该流速训练30 d(Li et al., 2017)。30 d训练结束后,An组、H组和L组均停训。在训练前(T0)、训练30 d后(T30)、停训20 d后(DT20)和停训50 d后(DT50)测定鲈鲤幼鱼的Ucrit,以及1.5Ucrit(1.5Ucrit=80 cm·s-1,Ucrit值为预实验测定)下的耐受时间、BM和BL等参数。实验期间,鲈鲤幼鱼饲养条件与暂养期一致。
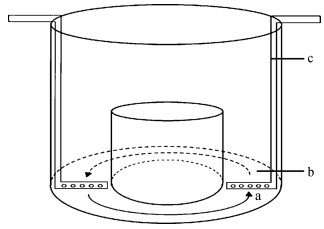
|
| 图 1 运动训练装置 Fig. 1 Exercise training device a.水流方向,b.运动训练区域(宽0.3 m),c.喷水管 a. direction of water flow, b. exercise training area (0.3 m wide), c. water outlet |
| |
Ucrit采用重庆师范大学进化生理与行为学实验室改装设计的游泳测定仪(图 2)进行测定,原理参照Brett(1964)。该仪器主要由方形水槽(长2.0 m×宽0.6 m×高0.6 m)、前后含导流筛板的游泳管(长0.8 m,内直径7 cm)、变频器和水泵等构成。参照鲜雪梅等(2010)的方法,实验前通过质心标记建立变频器输出频率(f)与游泳管中产生水流速度(V)的关系,经0点矫正后得到关系式:V=1.229 1f-5.268 5。正式实验前,先进行预实验测定实验鱼的Ucrit,从而确定测定Ucrit的初始速度(V0)、速度增量(△V)及1.5Ucrit的水流速度。实验时,每次随机选取1尾禁食48 h后的实验鱼转入游泳管中,在1 BL·s-1流速下适应1 h以消除新环境对鱼体的影响。随后以50%Ucrit为V0,△V为1 BL·s-1,实验鱼在每个速度下持续逆流游泳15 min(△T),测试速度持续增加直至实验鱼力竭,力竭状态的判定标准是实验鱼停靠在游泳管末端的导流筛板上持续20 s以上(Lee et al., 2003)。测试完毕后将实验鱼用浓度为50 mg·L-1的MS222麻醉,测定其BM、BL等参数,并计算每条鱼的肥满度(K=BM/BL3)(Nash et al., 2006)。实测Ucrit记为绝对临界游泳速度(Ua-crit):Ua-crit=V+(t/△T)△V,式中,V是能够顺利完成持续时间(15 min)的最大游泳速度,t是未能完成设定历时的实际持续游泳时间(0 min<t<15 min)。为消除体长对Ucrit的影响,采用相对临界游泳速度(Ur-crit): Ur-crit=Ua-crit/BL,因实验鱼身体的横截面积未超过游泳管截面积的10%,所以不需再对Ur-crit进行校正。

|
| 图 2 游泳测定仪 Fig. 2 Brett-type swimming apparatus a.变频器,b.水泵,c.蜂窝导流装置,d.游泳管 a. motor with frequency converter, b. pump, c. honeycomb diversion devices, d. swimming tunnel |
| |
测定装置同上,将禁食48 h后的实验鱼单尾放入游泳管中,1 BL·s-1下适应1 h以消除新环境对鱼体的影响,再将流速3 min内增至测试流速(1.5Ucrit=80 cm·s-1)并开始计时,直至实验鱼达力竭状态,该阶段所耗时间即为该固定流速下的耐受时间(Zeng et al., 2009)。测试完毕后将实验鱼用浓度为50 mg·L-1的MS222麻醉,测定其体质量、体长等参数,并计算每条鱼的肥满度。
2 数据分析实验数据用Excel 2003进行常规计算后,用SPSS 20.0进行统计分析。各组数据的差异用单因素方差分析(One-Way ANOVA)并进行LSD多重比较,显著性水平为α=0.05,统计值用平均值±标准误(Mean±SE)表示。以体长作协方差,采用双因素协方差分析(ANCOVA)检测训练制度(C组、An组、L组、H组)和测定时期(T0、T30、DT20、DT50)对Ucrit和1.5Ucrit条件下鲈鲤幼鱼耐受时间的影响。
3 结果 3.1 有氧运动能力训练制度(F3,176=7.592,P<0.001)和测定时期(F3,176=13.719,P<0.001)均对鲈鲤幼鱼的Ua-crit产生了显著影响。持续运动训练显著提高了鲈鲤幼鱼的Ua-crit(P<0.05),H组和L组分别提高了23.84%± 4.01%和26.97%±2.21%,而力竭运动训练对鲈鲤幼鱼的Ua-crit无明显影响。停训20 d后,H组的Ua-crit显著高于An组、L组和C组(P<0.05),而An组、L组和C组间Ua-crit的差异无统计学意义。停训50 d后,L组的Ua-crit显著高于对照组,而An组、H组和C组间Ua-crit的差异无统计学意义(图 3:a)。训练制度(F3,176=6.791,P<0.001)和测定时期(F3,176=17.072,P<0.001)均显著影响了鲈鲤幼鱼的Ur-crit。持续运动训练显著提高了鲈鲤幼鱼的Ur-crit(P<0.05),H组和L组分别提高了27.20%±3.56%和30.31%±3.57%,而力竭运动训练对鲈鲤幼鱼的Ur-crit无明显影响。停训20 d后,L组的Ur-crit仍显著高于An组和C组(P<0.05),而An组、H组和C组间Ur-crit的差异无统计学意义。停训50 d后,实验组与C组间Ur-crit的差异无统计学意义(图 3:b)。

|
| 图 3 不同训练制度及停训对鲈鲤幼鱼游泳能力的影响 Fig. 3 Effects of exercise training under different modes and detraining on swimming performance of juvenile Percocypris pingi *P<0.05 |
| |
训练制度(F3,176=7.177,P=0.008)和测定时期(F3,176=30.146,P<0.001)均显著影响鲈鲤幼鱼在1.5Ucrit条件下的耐受时间。持续运动训练和力竭运动训练均显著增加了鲈鲤幼鱼在1.5Ucrit条件下的耐受时间(P<0.05),An组、H组和L组分别增加了92.79%±28.00%、132.56%±29.56%和124.56%± 22.48%。停训20 d后,An组、H组和L组的耐受时间均有不同程度的减少,但An组和L组仍显著多于C组(P<0.05),而H组和C组的差异无统计学意义。停训50 d后,实验组与C组的差异无统计学意义(图 3:c)。
3.3 体质量、体长及肥满度运动训练30 d后,L组的BM和BL显著低于H组和C组(P<0.05),An组和H组与C组的差异无统计学意义。停训20 d后,L组的BM显著低于An组和H组,而4组间BL的差异无统计学意义。停训50 d后,实验组与C组间BM和BL的差异无统计学意义。此外,在运动训练和停训的整个阶段,实验组与C组间肥满度的差异无统计学意义(表 1)。
| 参数 Parameter |
测定时期 Time point for measurement of swimming performance |
对照组 Control group (C) |
无氧训练组 Anaerobic training group (An) |
4 BL·s-1组 4 BL·s-1 group (H) |
2 BL·s-1组 2 BL·s-1 group (L) |
| 体质量/g | T30 | 4.72±0.23a | 4.31±0.20ab | 4.60±0.19a | 4.00±0.24b |
| DT20 | 4.56±0.23ab | 4.64±0.18a | 4.66±0.25a | 4.12±0.21b | |
| DT50 | 4.91±0.30a | 5.19±0.25a | 5.24±0.25a | 5.36±0.27a | |
| 体长/cm | T30 | 6.67±0.11a | 6.49±0.11ab | 6.55±0.11a | 6.22±0.14b |
| DT20 | 6.63±0.12a | 6.62±0.24a | 6.68±0.12a | 6.45±0.08a | |
| DT50 | 6.79±0.14a | 6.96±0.11a | 6.93±0.11a | 7.00±0.13a | |
| 肥满度 | T30 | 1.57±0.21a | 1.56±0.33a | 1.63±0.34a | 1.63±0.33a |
| DT20 | 1.55±0.31a | 1.60±0.32a | 1.53±0.26a | 1.56±0.32a | |
| DT50 | 1.53±0.24a | 1.51±0.33a | 1.56±0.23a | 1.54±0.32a | |
| 注:同一行不同上标字母表示数据间差异有统计学意义(P<0.05) Note: different superscripts indicate there is a significant difference between the data within the same row (P<0.05) |
|||||
运动训练作为提高鱼类摄食生长、疾病免疫和捕食逃逸等能力的方法之一,受到了广泛的关注。运动训练的效果与训练制度、鱼类种类和大小有关。持续运动训练显著提高了鲤、宽鳍Zacco platypus、厚颌鲂Megalobrama pellegrini和青鱼Mylopharyngodon piceus等鲤科鱼类的Ucrit(He et al., 2013;刘海生等,2015;Li et al., 2017, 2018)。但也有研究显示,持续运动训练对鱼类的运动能力无明显影响,甚至对运动能力存在不利影响,如半带皱唇鲨Triakis semifasciata在35 cm·s-1(60%~65%Ucrit)的水流速度下持续训练6周后,其运动能力无明显改变(Gruber & Dickson,1997)。持续运动训练显著提高了鲈鲤幼鱼的Ucrit,有氧运动能力的提高可能与其训练后有氧代谢能力、游泳效率、线粒体密度和心血管功能的提高有关,从而有利于实验鱼的有氧运动供能(Davison,1997;Gallaugher et al., 2001;Davie et al., 2010)。力竭运动训练对鲈鲤幼鱼的Ucrit无明显影响,这与对瓦氏黄颡鱼和南方鲇Silurus meridionalis的研究结果不同(Liu et al., 2009;Li et al., 2010),这可能和鱼类种类、训练制度及温度等条件有关。
无氧运动是鱼类穿越激流、伏击捕食或逃避不利生境等行为的实现方式,也是生存生长的关键因子。持续运动训练和力竭运动训练均显著增加了鲈鲤幼鱼在1.5Ucrit条件下的耐受时间,提高了其无氧运动能力。这可能与运动训练促进了鲈鲤幼鱼无氧代谢供能、提高了无氧代谢底物(肌糖原、三磷酸腺苷、磷酸肌酸等)的水平、增强了乳酸脱氢酶活性及加快了乳酸清除速率等有关(He et al., 2013;Zhang et al., 2016, 2018)。相关研究表明,无论是持续运动训练还是力竭运动训练均有利于鱼类的无氧代谢供能,如运动训练后虹鳟Salmo gairdneri的急加速游泳能力显著增强(Gamperl et al., 1991),鲤鱼在力竭运动后的乳酸清除率更快(He et al., 2013)。刘明镜等(2013)对斑马鱼Danio rerio的研究表明,4周无氧运动训练显著提高了其无氧运动、无氧代谢能力。不过,运动训练对中华倒刺鲃和瓦氏黄颡鱼的最大无氧代谢能力无显著改变(Liu et al., 2009;Zhao et al., 2012)。这些差异可能与鱼类大小、种类、训练制度和训练流速等条件密切相关。
鱼类运动训练提高的能力、持续时间对放流后的扩散分布和存活有重要的影响。本研究显示,停训20 d后,H组鲈鲤幼鱼的有氧运动能力降至与C组差异无统计学意义,可能是因为高流速的运动训练改善了H组的各项生理功能(如心-鳃呼吸系统),而维持更高的生理功能需要更高的基础代谢耗能(刘海生等,2015)。停训后,H组的基础代谢耗能仍保持较高水平,进而减少了用于游泳运动的供能。相反,停训20 d后,H组的无氧运动能力仍显著高于C组,而L组与C组的差异无统计学意义。可能原因有以下两点:(1)停训20 d后,H组的体质量较L组高,Goolish(2010)认为在一定体质量范围内,鱼类的无氧运动能力会随着体质量的增加而增加,故此时H组的无氧运动能力仍能保持较高水平;(2)停训20 d后,L组的有氧运动能力相对较高,由于生物体内能量分配存在权衡(Langerhans,2009),有氧运动供能增加,则分配给无氧运动的能量减少,故L组的无氧运动能力降低,停训50 d后,L组提升的有氧运动能力和H组提升的无氧运动能力均降低至与C组的差异无统计学意义,说明运动训练提升的能力一段时间后会消失。持续运动训练显著提高了大西洋鲑Salmo salar的游泳效率,但这种效果在停训11周后消失(Castro et al., 2011),在瓦氏黄颡鱼中也发现相似结果(Liu et al., 2009)。可见,运动训练对鱼类有氧和无氧运动能力的影响效果及其持续时间与鱼类种类、训练制度有关。
近年来,鱼类的人工增殖放流被国内外学者视为恢复渔业资源的重要方法之一。由于人工养殖的鱼类存在种质资源下降、野外环境适应能力差、疾病免疫和捕食能力低下等弊端,放流后的存活率较低。运动训练作为提高鱼类游泳能力、改善其生理机能、减少斗争行为、提高鱼类摄食生长和食物转化效率的方法(付世建等,2014),受到了许多学者的关注。但是,在实践中针对不同种类、大小和放流生境的鱼类需要不同的训练制度。因此,开展系列的鱼类运动训练相关研究,进而寻求一套科学高效的鱼类运动训练方法尤为重要。总体来看,持续运动训练30 d后,鲈鲤幼鱼的有氧和无氧运动能力均显著提高,而力竭运动训练仅提高了鲈鲤幼鱼的无氧运动能力,故持续运动训练对提高鲈鲤幼鱼运动能力的效果更明显。由于鲈鲤幼鱼运动训练的效果在停训50 d后全部消失,故放流前对其进行运动训练时还需考虑到训练效果的维持时长。
致谢: 感谢杨坤和王小东在实验方案设计和论文修改过程中给予的帮助!| 丁瑞华. 1994. 四川鱼类志[M]. 成都: 四川科学技术出版社: 319-321. |
| 付世建, 曹振东, 曾令清, 等. 2014. 鱼类游泳运动——策略与适应性进化[M]. 北京: 科学出版社: 204-212. |
| 蒋志刚, 江建平, 王跃招, 等. 2016. 中国脊椎动物红色名录[J]. 生物多样性, 24(5): 500–551. |
| 孔彬, 林岗, 李秀珍, 等. 2008. 赤眼鳟江河人工放流前适应性驯养试验[J]. 广西农业科学, 39(1): 541–543. |
| 刘海生, 曹振东, 付世建. 2015. 水流刺激对宽鳍幼鱼的游泳和代谢的影响[J]. 重庆师范大学学报(自然科学版), 32(1): 35–40. |
| 刘明镜, 王志坚. 2013. 斑马鱼对无氧运动训练的适应性变化[J]. 动物学研究, 34(3): 190–195. |
| 石小涛, 陈求稳, 庄平, 等. 2012. 提高摄食-反捕食能力导向的鱼类野化训练方法述评[J]. 生态学杂志, 31(12): 3235–3240. |
| 宋波澜, 林小涛, 许忠能. 2012. 逆流运动训练对多鳞四须鲃摄食、生长和体营养成分的影响[J]. 水产学报, 36(1): 106–114. |
| 鲜雪梅, 曹振东, 付世建. 2010. 4种幼鱼临界游泳速度和运动耐受时间的比较[J]. 重庆师范大学学报(自然科学版), 27(4): 16–20. DOI:10.3969/J.ISSN.1672-6693.2010.04.005 |
| Brett JR. 1964. The respiratory metabolism and swimming performance of young sockeye salmon[J]. Journal of the Fisheries Board of Canada, 21(5): 1183–1226. DOI:10.1139/f64-103 |
| Castro V, Grisdale-Helland B, Helland SJ, et al. 2011. Aerobic training stimulates growth and promotes disease resistance in Atlantic salmon (Salmo salar)[J]. Comparative Biochemistry and Physiology, 160(2): 278–290. DOI:10.1016/j.cbpa.2011.06.013 |
| Davie PS, Wells RM, Tetens V. 2010. Effects of sustained swimming on rainbow trout muscle structure, blood oxygen transport, and lactate dehydrogenase isozymes: evidence for increased aerobic capacity of white muscle[J]. Journal of Experimental Zoology, 237(2): 159–171. |
| Davison W. 1997. The effects of exercise training on teleost fish, a review of recent literature[J]. Comparative Biochemistry and Physiology, 117(1): 67–75. DOI:10.1016/S0300-9629(96)00284-8 |
| Fu SJ, Cao ZD, Yan GJ, et al. 2013. Integrating environmental variation, predation pressure, phenotypic plasticity and locomotor performance[J]. Oecologia, 173(2): 343–354. DOI:10.1007/s00442-013-2626-7 |
| Gallaugher PE, Thorarensen H, Kiessling A, et al. 2001. Effects of high intensity exercise training on cardiovascular function, oxygen uptake, internal oxygen transport and osmotic balance in chinook salmon (Oncorhynchus tshawytscha) during critical speed swimming[J]. Journal of Experimental Biology, 204: 2861–2872. |
| Gamperl AK, Schnurr DL, Stevens ED. 1991. Effect of a sprint-training protocol on acceleration performance in rainbow trout (Salmo gairdneri)[J]. Canadian Journal of Zoology, 69(3): 578–582. DOI:10.1139/z91-087 |
| Goolish EM. 2010. Aerobic and anaerobic scaling in fish[J]. Biological Reviews, 66(1): 33–56. |
| Gruber SJ, Dickson KA. 1997. Effects of endurance training in the leopard shark, Triakis semifasciata[J]. Physiological Zoology, 70(4): 481–492. DOI:10.1086/515851 |
| He W, Xia W, Cao ZD, et al. 2013. The effect of prolonged exercise training on swimming performance and the underlying biochemical mechanisms in juvenile common carp (Cyprinus carpio)[J]. Comparative Biochemistry and Physiology, Part A, 166(2): 308–315. DOI:10.1016/j.cbpa.2013.07.003 |
| Langerhans RB. 2009. Trade-off between steady and unsteady swimming underlies predator-driven divergence in Gambusia affinis[J]. Journal of Evolutionary Biology, 22: 1057–1075. DOI:10.1111/j.1420-9101.2009.01716.x |
| Lee GC, Farrell AP, Lotto A, et al. 2003. The effect of temperature on swimming performance and oxygen consumption in adult sockeye (Oncorhynchus nerka) and coho (O. kisutch) salmon stocks[J]. Journal of Experimental Biology, 206(18): 3239–3251. DOI:10.1242/jeb.00547 |
| Li XM, Cao ZD, Fu SJ. 2010. The effect of exercise training on the metabolic interaction between feeding and locomotion in the juvenile southern catfish (Silurus meridionalis Chen)[J]. Journal of Experimental Zoology Part A: Ecological Genetics & Physiology, 313: 557–563. |
| Li XM, Pang X, Zheng H, et al. 2017. Effects of prolonged exercise training and exhaustive chasing training on the swimming performance of an endangered bream (Megalobrama pellegrini)[J]. Aquatic Biology, 26: 125–135. DOI:10.3354/ab00681 |
| Li XM, Zhang YG, Li XJ, et al. 2018. Sustained exercise-trained juvenile black carp (Mylopharyngodon piceus) at a moderate water velocity exhibit improved aerobic swimming performance and increased postprandial metabolic responses[J]. Biology Open, 7(2): 1–8. |
| Li XY, Deng YP, Yang K, et al. 2016. Genetic diversity and structure analysis of Percocypris pingi (Cypriniformes: cyprinidae): implications for conservation and hatchery release in the Yalong River[J]. PLoS ONE, 11(12): e0166769. DOI:10.1371/journal.pone.0166769 |
| Liu Y, Cao ZD, Fu SJ, et al. 2009. The effect of exhaustive chasing training and detraining on swimming performance in juvenile darkbarbel catfish (Peltebagrus vachelli)[J]. Journal of Comparative Physiology B: Biochemical Systemic & Environmental Physiology, 179(7): 847–855. |
| McNeil WJ. 1991. Expansion of cultured pacific salmon into marine ecosystems[J]. Aquaculture, 98(1-3): 173–183. DOI:10.1016/0044-8486(91)90382-H |
| Nash RDM, Valencia AH, Geffen AJ. 2006. The origin of fulton's condition factor-setting the record straight[J]. Fisheries, 31: 236–238. |
| Plaut I. 2001. Critical swimming speed: its ecological relevance[J]. Comparative Biochemistry and Physiology, 131(1): 41–50. DOI:10.1016/S1095-6433(01)00462-7 |
| Reidy SP, Kerr SR, Nelson JA. 2000. Aerobic and anaerobic swimming performance of individual Atlantic cod[J]. The Journal of Experimental Biology, 203(2): 347–357. |
| Young PS, Cech JJ. 1994. Optimum exercise conditioning velocity for growth, muscular development, and swimming performance in young-of-the-year striped bass (Morone saxatilis)[J]. Canadian Journal of Fisheries & Aquatic Sciences, 51(7): 1519–1527. |
| Zeng LQ, Cao ZD, Fu SJ, et al. 2009. Effect of temperature on swimming performance in juvenile southern catfish (Silurus meridionalis)[J]. Comparative Biochemistry and Physiology, 153(2): 125–130. DOI:10.1016/j.cbpa.2009.01.013 |
| Zhang Y, Claireaux G, Takle H, et al. 2018. A three-phase excess post-exercise oxygen consumption in Atlantic salmonr Salmo salar and its response to exercise training[J]. Journal of Fish Biology, 92: 1385–1403. DOI:10.1111/jfb.13593 |
| Zhang Y, Timmerhaus G, Anttila K, et al. 2016. Domestication compromises athleticism and respiratory plasticity in response to aerobic exercise training in Atlantic salmon (Salmo salar)[J]. Aquaculture, 463: 79–88. DOI:10.1016/j.aquaculture.2016.05.015 |
| Zhao HH. 2011. Percocypris pingi[EB/OL]. [2018-12-20]. http://dx.doi.org/10.2305/IUCN.UK.2011-2.RLTS.T1662-09A6190712.en. |
| Zhao WW, Pang X, Peng JL, et al. 2012. The effects of hypoxia acclimation, exercise training and fasting on swimming performance in juvenile qingbo (Spinibarbus sinensis)[J]. Fish Physiology and Biochemistry, 38(5): 1367–1377. DOI:10.1007/s10695-012-9624-2 |
 2019, Vol. 38
2019, Vol. 38




