扩展功能
文章信息
- 陈斯侃, 晏玉莹, 曾亚军
- CHEN Sikan, YAN Yuying, ZENG Yajun
- 贵阳阿哈湖国家湿地公园优势鸟类共存机制
- Coexistence Mechanism of Dominant Birds in the Guiyang Ahahu National Wetland Park
- 四川动物, 2019, 38(3): 340-348
- Sichuan Journal of Zoology, 2019, 38(3): 340-348
- 10.11984/j.issn.1000-7083.20180385
-
文章历史
- 收稿日期: 2018-12-11
- 接受日期: 2019-04-08
2. 贵州省林业科学研究院, 贵阳 550000
2. Guizhou Academy of Forestry, Guiyang 550000, China
城市化是生物多样性丧失的主要原因之一(Nancy et al., 2008)。鸟类是城市生态系统健康水平的重要指示类群(Roberge & Angelstam,2006),公园已成为城市鸟类的“避难所”(Davis & Glick,1978),城市湿地公园的建立对于维护城市生态系统健康至关重要(陆健健等,2006)。
生态位是物种在群落中的功能作用和地位(陈玉凯等,2014),城市环境中鸟类群落的组成出现了同质化倾向(Wang et al., 2013),优势种在一个维度上有较大重叠,在其他维度上重叠减小或分离,以生态要求差异来减缓生态要求相同所带来的激烈竞争(Bolnick et al., 2007)。生态位宽度通常用来评价物种对生境变化的敏感性(Torrenta et al., 2018),对生境变化敏感的物种,其生态位宽度往往较窄(Zurita et al., 2017),而时空生态位宽度值是反映物种对环境适应性及资源利用广泛性的度量值(李凡等,2018)。对于鸟类生态位,以往研究常通过对鸟类的栖息地利用、取食行为等多种时空维度的测度,来反映生态位的重叠与分离(朱磊等,2010;张航等,2014)。贵阳阿哈湖国家湿地公园位于贵州省贵阳市中心城区西南部,为城市提供森林和湿地生态系统,生态功能和位置极其重要,研究公园内鸟类优势种生态位可为贵阳市城市湿地修复提供相关依据。
1 研究区域概况贵阳阿哈湖国家湿地公园位于贵州省贵阳市中心城区西南部(106°36′59″~106°40′44″E,26°30′40″~26°33′55″N,海拔1 100~1 350 m),总面积1 218 hm2,湿地面积473 hm2,包含河流湿地、沼泽湿地、人工湿地3大湿地类和永久性河流、喀斯特溶洞湿地、草本沼泽、库塘湿地、稻田湿地5个湿地型,是我国西南喀斯特地区湿地的典型代表。地带性植被为亚热带常绿阔叶林,但原生植被已被破坏,现存植被主要是次生阔叶林、针叶林、灌丛草坡以及人工植被,现已记录维管束植物137科345属582种,其中蕨类植物15科18属25种,裸子植物4科9属12种,被子植物118科318属545种(邓立斌等,2014)。
2 研究方法 2.1 调查样线样点设置根据贵阳阿哈湖国家湿地公园地形地貌和生境类型,选择公园内已有道路作为调查样线,共2条,分别为2.8 km和2.6 km;在水库周围选择地势平坦、视野开阔区域设置调查样点,共8个,涵盖湿地公园各类生境类型和大部分范围(图 1)。
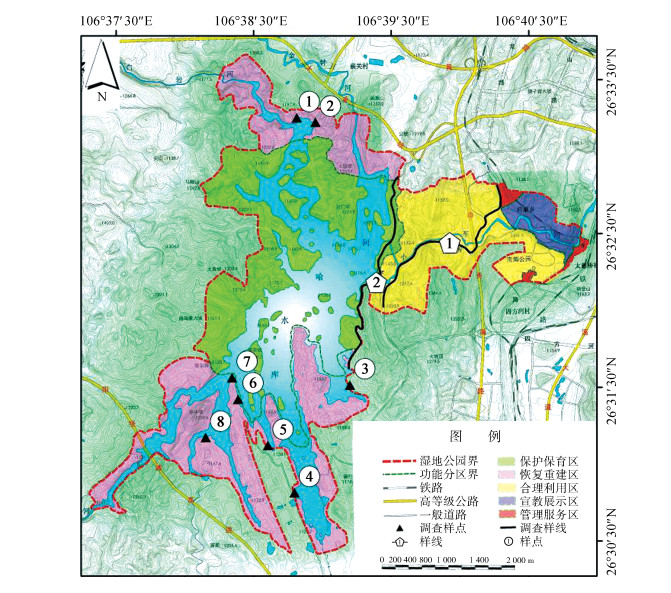
|
| 图 1 调查样线样点分布 Fig. 1 Distribution of sampling lines and plots |
| |
2016年9月—2017年2月、2018年4—8月,选择无风晴朗天气,于06: 30—10: 30采用可变距离样线法和样点法开展鸟类调查,调查频率为冬季(12月至翌年2月)每月1次,春季(3—5月)、夏季(6—8月)、秋季(9—11月)每个季节2次。样线调查时以1.5~2 km·h-1匀速前进,样点调查时每个样点30 min。使用双筒望远镜(OLYMPUS)观察,记录鸟类物种、数量、行为、分布生境,与行进同方向飞行的鸟类不重复记录(Bibby et al., 2000)。参考杨刚等(2015)方法,将鸟类行为划分为栖息、运动、取食3种。
2.3 生境类型划分湿地公园主体为阿哈水库和小车河城市湿地公园,依据植被类型划分为:水域,指开阔水面,即阿哈水库,平均水深13 m,不利于湿地植物生长,生境类型单一;水陆过渡区,指水域与陆地的交错区域,包含浅水区、滩涂、水岸,主要分布于小车河及入库支流、沟渠及沼泽区域,以水生植物及湿生植物为主;自然植被生境,主要为次生林,包含草地、灌丛、乔木、灌丛+草地、乔木+灌丛、乔木+草丛、乔木+灌木+草丛7种类型,主要分布在园内山体及水库中央岛屿内,以常绿落叶阔叶混交次生林和针叶次生林为主;人工生境,包含人工单层群落结构植被、人工复层群落结构植被、建筑和设施,主要分布在公园合理利用区及水库周边的村庄、农地及丘陵地带,植被以园林绿化植物以及经济林为主。
2.4 数据分析采用卡方检验分析不同生境各优势鸟类行为频次的差异。
采用频率指数估计法分析鸟类的优势种(赵正阶,1995):r=(100×d/D×100%)(N/D),式中,r代表某种鸟类频率指数,d为遇见某鸟种的天数,D为调查总天数,N为遇见该鸟种的总数量;r≥500为优势种,200≤r<500为常见种,r<200为稀有种。
生态位的定量测度主要包括生态位宽度和生态位重叠,可以反映出群落中各个物种对空间、食物及其他资源的利用程度与关系(李显森等,2013;张晶等,2018)。采用Hurlbert(1978)的方法计算生态位宽度(Bi),计算公式为:
采用Morisita-Horn指数计算不同鸟类间的空间生态位重叠度(杨刚等,2015;Horn,1966),计算公式为:
根据实际调查和数据收集,贵阳阿哈湖国家湿地公园共记录鸟类17目52科161种(郑光美,2017),其中,102种为实地调查记录(附录)。通过鸟类频率指数分析,湿地公园优势种为黄臀鹎Pycnonotus xanthorrhous(r=1 065.63)、麻雀Passer mon-tanus(r=947.46)和白颊噪鹛Garrulax sannio(r=560.16),3种鸟类见于水陆过渡区、自然植被生境和人工生境,在水域未发现。
|
(从左至右依次为物种名、居留类型、区系、红色名录、保护等级、CITES、收录来源) (Species,resident type,fauna,Redlist,protection level,CITES,record resources) |
| Ⅰ 鸡形目GALLIFORMES |
| (一)雉科Phasianidae |
| 1.灰胸竹鸡Bambusicola thoracicus* R,O,LC,—,—,F |
| 2.环颈雉Phasianus colchicus R,W,LC,—,—,F |
| 3.红腹锦鸡Chrysolophus pictus* R,O,NT,—,—,D |
| Ⅱ 雁形目ANSERIFORMES |
| (二)鸭科Anatidae |
| 4.赤麻鸭Tadorna ferruginea W,P,LC,—,—,D |
| 5.赤膀鸭Mareca strepera W,P,LC,—,—,D |
| 6.斑嘴鸭Anas zonorhyncha W,W,LC,—,—,D |
| 7.绿翅鸭Anas crecca W,P,LC,—,—,D |
| 8.白眼潜鸭Aythya nyroca W,P,NT,—,—,F |
| 9.凤头潜鸭Aythya fuligula W,P,LC,—,—,D |
| Ⅲ 目PODICIPEDIFORMES |
| (三)科Podicipedidae |
| 10.小 Tachybaptus ruficollis R,W,LC,—,—,F |
| Ⅳ 鸽形目COLUMBIFORMES |
| (四)鸠鸽科Columbidae |
| 11.山斑鸠Streptopelia orientalis R,W,LC,—,—,F |
| 12.珠颈斑鸠Streptopelia chinensis R,O,LC,—,—,F |
| Ⅴ 夜鹰目CAPRIMULGIFORMES |
| (五)夜鹰科Caprimulgidae |
| 13.普通夜鹰Caprimulgus indicus S,W,LC,—,—,F |
| (六)雨燕科Apodidae |
| 14.白腰雨燕Apus pacificus S,W,LC,—,—,F |
| 15.小白腰雨燕Apus nipalensis S,O,LC,—,—,F |
| Ⅵ 鹃形目CUCULIFORMES |
| (七)杜鹃科Cuculidae |
| 16.噪鹃Eudynamys scolopaceus R,O,LC,—,—,F |
| 17.大鹰鹃Hierococcyx sparverioides R,O,LC,—,—,F |
| 18.小杜鹃Cuculus poliocephalus S,W,LC,—,—,F |
| 19.四声杜鹃Cuculus micropterus S,W,LC,—,—,F |
| 20.大杜鹃Cuculus canorus S,W,LC,—,—,F |
| Ⅶ 鹤形目GRUIFORMES |
| (八)秧鸡科Rallidae |
| 21.红脚田鸡Zapornia akool R,O,LC,—,—,F |
| 22.红胸田鸡Zapornia fusca S,P,NT,—,—,D |
| 23.白胸苦恶鸟Amaurornis phoenicurus S,O,LC,—,—,F |
| 24.黑水鸡Gallinula chloropus S,W,LC,—,—,F |
| 25.白骨顶Fulica atra W,P,LC,—,—,D |
| Ⅷ 鸻形目CHARADRIIFORMES |
| (九)鸻科Charadriidae |
| 26.凤头麦鸡Vanellus vanellus W,P,LC,—,—,D |
| 27.灰头麦鸡Vanellus cinereus S,P,LC,—,—,D |
| 28.长嘴剑鸻Charadrius placidus P,P,NT,—,—,D |
| 29.金眶鸻Charadrius dubius S,W,LC,—,—,D |
| (十)水雉科Jacanidae |
| 30.水雉Hydrophasianus chirurgus S,O,NT,—,—,D |
| (十一)鹬科Scolopacidae |
| 31.丘鹬Scolopax rusticola W,P,LC,—,—,D |
| 32.扇尾沙锥Gallinago gallinago W,P,LC,—,—,F |
| 33.青脚鹬Tringa nebularia W,P,LC,—,—,D |
| 34.白腰草鹬Tringa ochropus W,P,LC,—,—,F |
| 35.林鹬Tringa glareola P,P,LC,—,—,D |
| 36.矶鹬Actitis hypoleucos W,P,LC,—,—,F |
| (十二)鸥科Laridae |
| 37.红嘴鸥Chroicocephalus ridibundus W,P,LC,—,—,D |
| 38.白翅浮鸥Chlidonias leucopterus V,P,LC,—,—,D |
| Ⅸ 鲣鸟目SULIFORMES |
| (十三)鸬鹚科Phalacrocoracidae |
| 39.普通鸬鹚Phalacrocorax carbo W,W,LC,—,—,D |
| Ⅹ 鹈形目PELECANIFORMES |
| (十四)鹭科Ardeidae |
40.黄斑苇 Ixobrychus sinensis S,W,LC,—,—,D Ixobrychus sinensis S,W,LC,—,—,D |
41.栗苇 Ixobrychus cinnamomeus S,W,LC,—,—,D Ixobrychus cinnamomeus S,W,LC,—,—,D |
42.大麻 Botaurus stellaris W,P,LC,—,—,D Botaurus stellaris W,P,LC,—,—,D |
| 43.夜鹭Nycticorax nycticorax R,W,LC,—,—,F |
| 44.绿鹭Butorides striata R,W,LC,—,—,F |
| 45.池鹭Ardeola bacchus R,O,LC,—,—,F |
| 46.牛背鹭Bubulcus ibis R,O,LC,—,—,F |
| 47.苍鹭Ardea cinerea R,P,LC,—,—,F |
| 48.草鹭Ardea purpurea S,W,LC,—,—,D |
| 49.白鹭Egretta garzetta S,O,LC,—,—,F |
| Ⅺ 鹰形目ACCIPITRIFORMES |
| (十五)鹰科Accipitridae |
| 50.黑冠鹃隼Aviceda leuphotes R,O,LC,Ⅱ,附录Ⅱ,D |
| 51.雀鹰Accipiter nisus R,W,LC,Ⅱ,附录Ⅱ,D |
| 52.白尾鹞Circus cyaneus W,P,NT,Ⅱ,附录Ⅱ,D |
| 53.黑鸢Milvus migrans R,W,LC,Ⅱ,附录Ⅱ,F |
54.普通 Buteo japonicus W,P,LC,Ⅱ,附录Ⅱ,F Buteo japonicus W,P,LC,Ⅱ,附录Ⅱ,F |
| Ⅻ 鸮形目STRIGIFORMES |
| (十六)鸱鸮科Strigidae |
| 55.领角鸮Otus lettia R,W,LC,Ⅱ,附录Ⅱ,D |
| 56.斑头鸺鹠Glaucidium cuculoides R,O,LC,Ⅱ,附录Ⅱ,D |
| 57.短耳鸮Asio flammeus W,P,NT,Ⅱ,附录Ⅱ,D |
| ⅫⅠ 犀鸟目BUCEROTIFORMES |
| (十七)戴胜科Upupidae |
| 58.戴胜Upupa epops W,W,LC,—,—,D |
| ⅪⅤ 佛法僧目CORACIIFORMES |
| (十八)翠鸟科Alcedinidae |
| 59.白胸翡翠Halcyon smyrnensis R,O,LC,—,—,D |
| 60.蓝翡翠Halcyon pileata S,W,LC,—,—,D |
| 61.普通翠鸟Alcedo atthis R,W,LC,—,—,F |
| ⅩⅤ 啄木鸟目PICIFORMES |
| (十九)拟啄木鸟科Capitonidae |
| 62.大拟啄木鸟Psilopogon virens R,O,LC,—,—,F |
| (二十)啄木鸟科Picidae |
| 63.蚁鴷Jynx torquilla W,P,LC,—,—,D |
| 64.斑姬啄木鸟Picumnus innominatus R,O,LC,—,—,F |
| 65.大斑啄木鸟Dendrocopos major R,W,LC,—,—,F |
| 66.灰头绿啄木鸟Picus canus R,W,LC,—,—,D |
| ⅩⅥ 隼形目FALCONIFORMES |
| (二十一)隼科Falconidae |
| 67.红隼Falco tinnunculus R,W,LC,Ⅱ,附录Ⅱ,F |
| 68.游隼Falco peregrinus W,P,NT,Ⅱ,附录Ⅰ,F |
| ⅩⅦ 雀形目PASSERIFORMES |
| (二十二)黄鹂科Oriolidae |
| 69.黑枕黄鹂Oriolus chinensis S,W,LC,—,—,D |
| (二十三)山椒鸟科Campephagidae |
| 70.粉红山椒鸟Pericrocotus roseus S,O,LC,—,—,F, |
| 71.小灰山椒鸟Pericrocotus cantonensis S,O,LC,—,—,F |
| 72.灰山椒鸟Pericrocotus divaricatus P,O,LC,—,—,F |
| (二十四)卷尾科Dicruridae |
| 73.黑卷尾Dicrurus macrocercus S,W,LC,—,—,F |
| 74.灰卷尾Dicrurus leucophaeus S,W,LC,—,—,D |
| (二十五)伯劳科Laniidae |
| 75.虎纹伯劳Lanius tigrinus S,W,LC,—,—,D |
| 76.红尾伯劳Lanius cristatus P,P,LC,—,—,F |
| 77.棕背伯劳Lanius schach R,O,LC,—,—,F |
| (二十六)鸦科Corvidae |
| 78.松鸦Garrulus glandarius R,W,LC,—,—,F |
| 79.红嘴蓝鹊Urocissa erythrorhyncha R,O,LC,—,—,F |
| 80.喜鹊Pica pica R,W,LC,—,—,F |
| (二十七)玉鹟科Stenostiridae |
| 81.方尾鹟Culicicapa ceylonensis S,O,LC,F |
| (二十八)山雀科Paridae |
| 82.黄腹山雀Pardaliparus venustulus R,W,LC,—,—,D |
| 83.大山雀Parus cinereus R,W,LC,—,—,F |
| 84.绿背山雀Parus monticolus R,O,LC,—,—,D |
| (二十九)百灵科Alaudidae |
| 85.小云雀Alauda gulgula R,O,LC,—,—,D |
| (三十)扇尾莺科Cisticolidae |
| 86.棕扇尾莺Cisticola juncidis R,O,LC,—,—,F |
| 87.山鹪莺Prinia crinigera R,O,LC,—,—,F |
| 88.纯色山鹪莺Prinia inornata R,O,LC,—,—,F |
| (三十一)苇莺科Acrocephalidae |
| 89.东方大苇莺Acrocephalus orientalis S,O,LC,—,—,F |
| (三十二)燕科Hirundinidae |
| 90.家燕Hirundo rustica S,W,LC,—,—,F |
| 91.烟腹毛脚燕Delichon dasypus S,W,LC,—,—,F |
| 92.金腰燕Cecropis daurica S,W,LC,—,—,F |
| (三十三)鹎科Pycnonotidae |
| 93.领雀嘴鹎Spizixos semitorques R,O,LC,—,—,F |
| 94.黄臀鹎Pycnonotus xanthorrhous R,O,LC,—,—,F |
| 95.白头鹎Pycnonotus sinensis R,W,LC,—,—,D |
| 96.绿翅短脚鹎Ixos mcclellandii R,O,LC,—,—,F |
| 97.栗背短脚鹎Hemixos castanonotus R,O,LC,—,—,F |
| (三十四)柳莺科Phylloscopidae |
| 98.褐柳莺Phylloscopus fuscatus W,W,LC,—,—,F |
| 99.黄腰柳莺Phylloscopus proregulus W,W,LC,—,—,F |
| 100.黄眉柳莺Phylloscopus inornatus P,W,LC,—,—,F |
| 101.冠纹柳莺Phylloscopus claudiae W,O,LC,—,—,F |
| (三十五)树莺科Cettiidae |
| 102.棕脸鹟莺Abroscopus albogularis R,O,LC,—,—,F |
| 103.强脚树莺Horornis fortipes R,O,LC,—,—,F |
| (三十六)长尾山雀科Aegithalidae |
| 104.红头长尾山雀Aegithalos concinnus R,O,LC,—,—,F |
| (三十七)莺鹛科Sylviidae |
| 105.棕头鸦雀Sinosuthora webbiana R,O,LC,—,—,F |
| 106.灰喉鸦雀Sinosuthora alphonsiana R,O,LC,—,—,F |
| (三十八)绣眼鸟科Zosteropidae |
| 107.红胁绣眼鸟Zosterops erythropleurus S,O,LC,—,—,F |
| 108.暗绿绣眼鸟Zosterops japonicus R,O,LC,—,—,F |
| (三十九)林鹛科Timaliidae |
| 109.斑胸钩嘴鹛Erythrogeny graviox R,O,LC,—,—,D |
| 110.棕颈钩嘴鹛Pomatorhinus ruficollis R,O,LC,—,—,F |
| 111.红头穗鹛Cyanoderma ruficeps R,O,LC,—,—,F |
| (四十)幽鹛科Pellorneidae |
| 112.褐胁雀鹛Schoeniparus dubius R,O,LC,—,—,F |
| 113.灰眶雀鹛Alcippe morrisonia R,O,LC,—,—,F |
| (四十一)噪鹛科Leiothrichidae |
| 114.矛纹草鹛Babax lanceolatus R,O,LC,—,—,D |
| 115.白颊噪鹛Garrulax sannio R,O,LC,—,—,F |
| 116.蓝翅希鹛Siva cyanouroptera R,O,LC,—,—,F |
| 117.红嘴相思鸟Leiothrix lutea R,O,LC,—,附录Ⅱ,F |
| (四十二)河乌科Cinclidae |
| 118.褐河乌Cinclus pallasii R,W,LC,—,—,F |
| (四十三)椋鸟科Sturnidae |
| 119.八哥Acridotheres cristatellus R,O,LC —,—,F |
| 120.丝光椋鸟Spodiopsar sericeus R,O,LC,—,—,D |
| 121.灰椋鸟Spodiopsar cineraceus W,P,LC,—,—,D |
| 122.黑领椋鸟Gracupica nigricollis R,O,LC,—,—,F |
| (四十四)鸫科Turdidae |
| 123.虎斑地鸫Zoothera aurea P,O,LC,—,—,D |
| 124.黑胸鸫Turdus dissimilis R,O,NT,—,—,F |
| 125.乌灰鸫Turdus cardis P,W,LC,—,—,F |
| 126.乌鸫Turdus mandarinus R,W,LC,—,—,F |
| 127.斑鸫Turdus eunomus P,P,LC,—,—,D |
| 128.宝兴歌鸫Turdus mupinensis R,O,LC,—,—,D |
| (四十五)鹟科Muscicapidae |
| 129.红胁蓝尾鸲Tarsiger cyanurus W,W,LC,—,—,D |
| 130.鹊鸲Copsychus saularis R,O,LC,—,—,F |
| 131.北红尾鸲Phoenicurus auroreus W、S,W,LC,—,—,F |
| 132.红尾水鸲Rhyacornis fuliginosa R,W,LC,—,—,F |
| 133.白顶溪鸲Chaimarrornis leucocephalus R,O,LC,—,—,F |
| 134.紫啸鸫Myophonus caeruleus S,O,LC,—,—,F |
| 135.白额燕尾Enicurus leschenaulti R,O,LC —,—,F |
136.黑喉石 Saxicola maurus R,W,LC,—,—,D Saxicola maurus R,W,LC,—,—,D |
137.灰林 Saxicola ferreus R,O,LC,—,—,F Saxicola ferreus R,O,LC,—,—,F |
| 138.白眉姬鹟Ficedula zanthopygia S,W,LC,—,—,F |
| 139.红喉姬鹟Ficedula albicilla R,W,LC,—,—,F |
| 140.北灰鹟Muscicapa dauurica P,P,LC,—,—,D |
| 141.铜蓝鹟Eumyias thalassinus S,O,LC,—,—,F |
| (四十六)叶鹎科Chloropseidae |
| 142.橙腹叶鹎Chloropsis hardwickii R,O,LC,—,—,F |
| (四十七)花蜜鸟科Nectariniidae |
| 143.蓝喉太阳鸟Aethopyga gouldiae R,O,LC,—,—,D |
| (四十八)梅花雀科Estrildidae |
| 144.白腰文鸟Lonchura striata R,O,LC,—,—,F |
| 145.斑文鸟Lonchura punctulata R,O,LC,—,—,F |
| (四十九)雀科Passeridae |
| 146.山麻雀Passer cinnamomeus R,W,LC,—,—,F |
| 147.麻雀Passer montanus R,W,LC,—,—,F |
| (五十)鹡鸰科Motacillidae |
| 148.山鹡鸰Dendronanthus indicus S,W,LC,—,—,F |
| 149.黄鹡鸰Motacilla tschutschensis P,P,LC,—,—,D |
| 150.灰鹡鸰Motacilla cinerea W,W,LC,—,—,F |
| 151.白鹡鸰Motacilla alba R,W,LC,—,—,F |
| 152.粉红胸鹨Anthus roseatus R,W,LC,—,—,D |
| 153.树鹨Anthus hodgsoni W,W,LC,—,—,F |
| (五十一)燕雀科Fringillidae |
| 154.燕雀Fringilla montifringilla W,P,LC,—,—,D |
| 155.黑头蜡嘴雀Eophona personata W,P,NT,—,—,D |
| 156.金翅雀Chloris sinica R,W,LC,—,—,F |
| (五十二)鹀科Emberizidae |
| 157.灰眉岩鹀Emberiza godlewskii R,W,LC,—,—,D |
| 158.三道眉草鹀Emberiza cioides R,W,LC,—,—,D |
| 159.栗耳鹀Emberiza fucata W,P,LC,—,—,D |
| 160.小鹀Emberiza pusilla W,P,LC,—,—,F |
| 161.黄喉鹀Emberiza elegans S,W,LC,—,—,F |
| 注:*中国特有种;居留类型:R.留鸟,S.夏候鸟,W.冬候鸟,P.旅鸟,V.迷鸟;区系:东.东洋界,古.古北界,广.广布种;红色名录:参考《中国生物多样性红色名录》(蒋志刚等,2016),NT.近危,LC.无危;保护级别:Ⅱ.国家Ⅱ级重点保护野生动物;资料来源:D.资料,F.野外调查 Notes:* Chinese endemic species;Resident type:R. resident,S. summer visitor,W. winter visitor,P. passage migrant,V. vagrant visitor;Fauna:O. Oriental,P. Palaearctic,W. widespread;Redlist:Redlist of China's Biodiversity (Jiang et al., 2016),NT. near threatened,LC. least concern;Protection level:Ⅱ. Class Ⅱ nationally key protected bird;Record resources:D. data & literature,F. field survey |
共记录黄臀鹎行为341次,其中,栖息行为95次,运动行为242次,取食行为4次;麻雀行为462次,其中,栖息行为33次,运动行为360次,取食行为69次;白颊噪鹛行为239次,其中,栖息行为7次,运动行为210次,取食行为22次。黄臀鹎在人工生境中的栖息和运动行为频次显著多于水陆过渡区和自然植被生境(栖息行为:χ2=42.779,P<0.001;运动行为:χ2=81.975,P<0.001)。麻雀在各生境类型中的行为频次差异有统计学意义(χ2=69.068,P<0.001),栖息行为全部发生在人工生境中;在人工生境的运动行为和取食行为频次显著多于自然植被生境和水陆过渡区(运动行为:χ2=274.20,P<0.001;取食行为:χ2=12.78,P<0.001)。白颊噪鹛在各生境类型中的行为频次差异有统计学意义(χ2=4.221,P=0.040),在自然植被生境的运动行为频次显著多于水陆过渡区和人工生境(χ2=274.20,P<0.001)(图 2)。

|
| 图 2 贵阳阿哈湖国家湿地公园优势鸟类行为频次在不同生境类型中的分布 Fig. 2 Behavior frequency distribution of dominant birds in different habitats in the Guiyang Ahahu National Wetland Park 不同大写字母表示不同行为之间的差异有统计学意义(P<0.05),不同数字表示行为频次之间的差异有统计学意义(P<0.05) Different capital letters indicate there is a significant difference between different behaviors (P < 0.05), different numbers indicate there is a significant difference between behavior frequencies (P < 0.05) |
| |
从生境的生态位宽度来看,黄臀鹎(0.604 9)>白颊噪鹛(0.387 6)>麻雀(0.215 8),3种鸟类在人工生境中的生态位宽度均最大:黄臀鹎在各类生境中都较为适应;麻雀在人工生境中适应性最强,在水陆过渡区和自然植被生境中相对较差;白颊噪鹛在人工生境和自然植被生境中适应较好,在水陆过渡区仅秋季有记录。从时间的生态位宽度来看,黄臀鹎、麻雀、白颊噪鹛相近,分别为0.862 1、0.793 7和0.866 7,但不同物种的四季波动不同:黄臀鹎各季节都较平稳,表现出较强的适应能力;麻雀在夏季最宽、冬季最窄;白颊噪鹛夏季最窄、秋季最宽(图 3)。
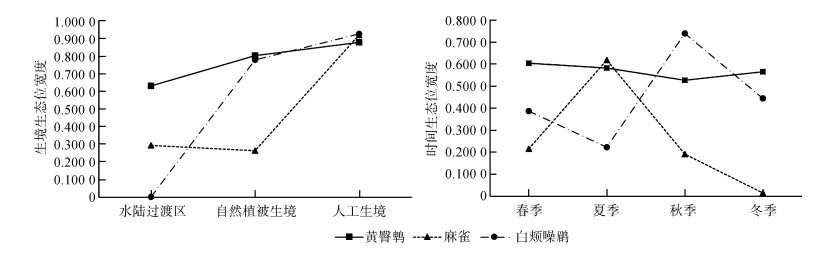
|
| 图 3 贵阳阿哈湖国家湿地公园鸟类优势种生态位宽度 Fig. 3 The niche breadth of dominant birds in the Guiyang National Wetland Park |
| |
从时间上看,3种鸟类相互重叠度均很高,最高为白颊噪鹛和麻雀,达到了0.985 3。从空间上看,黄臀鹎和麻雀重叠度最高(0.873 2),其次为黄臀鹎和白颊噪鹛(0.831 6),最低的为麻雀和白颊噪鹛(0.481 1)。
在春、夏季,黄臀鹎和麻雀重叠度最高,分别为0.919 2和0.819 9,麻雀和白颊噪鹛重叠度最低,分别0.546 3和0.383 5;在秋、冬季,黄臀鹎和白颊噪鹛重叠度最高,分别为0.910 8和0.854 2,麻雀和白颊噪鹛重叠度最低,分别为0.530 2和0.511 8。
在栖息空间上,黄臀鹎和麻雀的重叠度最高(0.833 9),麻雀和白颊噪鹛的重叠度最低(0.522 1);在运动空间上,3种鸟类的重叠度均很高,最高为麻雀和白颊噪鹛(0.990 8);在取食空间上,3种鸟类的重叠度相对较低,最高的为麻雀和白颊噪鹛(0.657 0),最低的为黄臀鹎和麻雀(0.507 2)。
在水陆过渡区,3种鸟类生态位重叠度均较低,黄臀鹎和麻雀最高(0.432 0),黄臀鹎和白颊噪鹛最低(0.099 1);在自然植被生境,黄臀鹎和白颊噪鹛生态位重叠度最高(0.980 3),麻雀和白颊噪鹛最低(0.849 8);在人工生境,3种鸟类生态位重叠度均较高,麻雀和白颊噪鹛最高(0.969 8),黄臀鹎和白颊噪鹛最低(0.902 0)。
4 讨论鸟类的生态位宽度与鸟类习性、适宜栖息地的分布密切联系。研究结果表明,3种鸟类在时间和空间上的生态位重叠度均较高,然而,生态位理论表明生态位完全重叠的物种不能共存,物种为获取最大的适合度,在与同域分布物种间势必存在不同维度的生态位分离,同样也是鸟类维持群落结构稳定状态的重要原因之一(Novcic,2016)。这表现为时间和空间等多维度的物种间行为习性与栖息地利用的比较。
4.1 时间上的生态位重叠与分离黄臀鹎、白颊噪鹛和麻雀在贵阳均属留鸟(郑光美,2017),与研究结果中3种鸟类的时间生态位重叠度高相吻合。物种在面对环境压力时会缓和对栖息地的要求,扩大或缩小生态位以达到物种共存进而维持群落稳定(Broennimann et al., 2007)。首先,从繁殖期鸟类的行为分析,湿地公园内黄臀鹎与麻雀共栖现象明显,考虑到繁殖期雀形目Passeriformes鸟类育雏的需求,亲鸟通常不会远离巢址觅食,因此,春、夏季黄臀鹎与麻雀的栖息行为生态位重叠度最高;其次,广泛的食性特征更能适应城市生态环境(Jokimäki & Suhonen,1998),然而食物组成结构的相似性必然导致生态位的高度重叠(郑光美,2008),繁殖期3种鸟类均以昆虫及其幼虫为食,但夏季植物生长茂盛,昆虫活动加强,食物资源丰富,黄臀鹎和麻雀生态位宽度最接近,白颊噪鹛则通过缩小生态位来减少竞争,因此,繁殖期黄臀鹎与麻雀的生态位重叠度最高,与白颊噪鹛存在一定程度分离。秋、冬季,3种鸟类的栖息地利用范围扩大,从食性需求来看,越冬期黄臀鹎和白颊噪鹛均偏好取食植物果实和种子,而麻雀多以草籽和谷物为食(赵正阶,2001),秋季公园以人工种植水稻作为景观,麻雀食物丰富,表现出较窄的生态位宽度,减少了与其他2种鸟类的竞争,冬季公园内部分植物,尤其是经济树种以及为满足景观需求人工种植的落叶树种凋零,3种鸟类生态位宽度整体达到最小,麻雀常于公园内小吃店附近聚集,食用人类食物垃圾,而自然生境中灌丛植被的浆果和种子更易吸引黄臀鹎和白颊噪鹛,因此,黄臀鹎和白颊噪鹛的生态位重叠度最高,与麻雀存在较大的生态位分离,与研究结果相符。
4.2 空间上的生态位重叠与分离优势种通过巢址选择、行为、生境垂直和水平分布分离生境生态位,以满足物种充分利用资源的需求(王维奎等,2008)。群落物种组成情况反映了鸟类对生境的适应性,生境复杂程度越高,能够提供的生态位分离程度越高(李凡等,2018)。在生境生态位上,分离比较明显的是水陆过渡区,这与3种鸟类均属林鸟有关,在此区域更多的表现为运动和取食行为。在自然植被生境和人工生境,黄臀鹎、白颊噪鹛和麻雀生态位重叠度均较高,从繁殖期鸟类对栖息地利用分析,黄臀鹎和白颊噪鹛均选择在灌丛中营巢,麻雀则更多选择在人工建筑中营巢,白颊噪鹛的巢址多选择自然生境,黄臀鹎可以在近水域的绿化树种或灌木丛内营巢,3种鸟类在巢址选择上从水平生境分离生态位以维持群落稳定。从行为空间分析,3种鸟类的栖息和运动空间重叠度较高,取食空间重叠度相对较低,黄臀鹎和麻雀偏向在人工生境中栖息、运动和取食,白颊噪鹛则在自然植被生境中运动,无论自然植被生境还是人工生境,黄臀鹎和白颊噪鹛偏向乔灌草复层植被结构生境(70.38%和69.04%),黄臀鹎常活动于乔木中上层(49.36%),白颊噪鹛则偏向乔木下层和灌草丛(52.78%),2种鸟类通过垂直生境分离生态位,麻雀则偏向人工生境中的建筑和人工设施(48.27%),从水平分布差异来减少种间竞争。
本研究中3种优势鸟类的时空生态位重叠度较高,在一定程度上反映了湿地公园优势鸟类生境同质化程度较高,湿地公园位于贵阳市中心城区,城市化程度高,鸟类必须对城市环境利用并产生适应性变化才能生存,3种鸟类均为城市适应种,在不同维度的生态位重叠上,分离方式交错相互影响,从而产生多重效应,形成系统的生态位分离,增强群落的稳定性以达到共存目的。对于湿地公园管理部门,一方面应关注鸟类群落中物种对自然生境的需求,另一方面可以通过人工营造不同生态位需求物种的生境,营造多样化的鸟类栖息生境,以吸引更多的鸟类资源。
致谢: 中南林业科技大学张志强老师、杨道德教授对本论文进行了指导和修改,贵阳阿哈湖国家湿地公园管理处、贵阳两湖一库管理局提供了宝贵资料,在此一并致谢。| 陈玉凯, 杨琦, 莫燕妮, 等. 2014. 海南岛霸王岭国家重点保护植物的生态位研究[J]. 植物生态学报, 38(6): 576–584. |
| 邓立斌, 颜伟, 汪贵庆. 2014. 贵州贵阳阿哈湖国家湿地公园维管植物区系初步研究[J]. 贵州师范大学学报(自然科学版), 32(1): 6–9. DOI:10.3969/j.issn.1004-5570.2014.01.002 |
| 李凡, 徐炳庆, 吕振波, 等. 2018. 莱州湾鱼类群落优势种生态位[J]. 生态学报, 38(14): 5195–5205. |
| 李显森, 于振海, 孙珊, 等. 2013. 长江口及其毗邻海域鱼类群落优势种的生态位宽度与重叠[J]. 应用生态学报, 24(8): 2353–2359. |
| 陆健健, 何文珊, 童春富, 等. 2006. 湿地生态学[M]. 北京: 高等教育出版社. |
| 杨刚, 许洁, 王勇, 等. 2015. 城市公园植被特征对陆生鸟类集团的影响[J]. 生态学报, 35(14): 4824–4835. |
| 王维奎, 周材权, 龙帅, 等. 2008. 四川南充太和鹭科鸟类群落空间生态位和种间关系[J]. 四川动物, 27(2): 178–182. |
| 张航, 丁虎林, 刘伟, 等. 2014. 天童20 hm2常绿阔叶林样地优势鸟类时空多维度生态位分析[J]. 华东师范大学学报(自然科学版), 3: 125–133. DOI:10.3969/j.issn.1000-5641.2014.03.014 |
| 张晶, 赵成章, 任悦, 等. 2018. 张掖国家湿地公园优势鸟类种群生态位研究[J]. 生态学报, 38(6): 2213–2220. |
| 赵正阶. 1995. 中国鸟类手册(上卷)非雀形目[M]. 长春: 吉林科学技术出版社. |
| 赵正阶. 2001. 中国鸟类志(下卷)[M]. 长春: 吉林科学技术出版社. |
| 郑光美. 2017. 中国鸟类分类与分布名录(第三版)[M]. 北京: 科学出版社. |
| 郑光美. 2008. 鸟类学(第四版)[M]. 北京: 北京师范大学出版社. |
| 朱磊, 丁伟, 唐利洲, 等. 2010. 黄臀鹎秋冬季食性及取食生态位的初步观察[J]. 四川动物, 29(6): 981–983. |
| Bibby CJ, Bugess ND, Hill DA, et al. 2000. Bird census techniques(second edition)[M]. London: Academic Press. |
| Bolnick DI, Svanbäck R, Araújo MS, et al. 2007. Comparative support for the niche variation hypothesis that more generalized populations also are more heterogeneous[J]. Proceedings of the National Academy of Sciences of the United States of America, 104(24): 10075–10079. DOI:10.1073/pnas.0703743104 |
| Broennimann O, Treier UA, Miiller SH, et al. 2007. Evidence of climatic niche shift during biological invasion[J]. Ecology Letters, 10: 701–709. DOI:10.1111/ele.2007.10.issue-8 |
| Davis AM, Glick TF. 1978. Urban ecosystems and island biogeography[J]. Environmental Conservation(5): 299–304. |
| Hurlbert SH. 1978. The measurement of niche overlap and some relatives[J]. Ecology, 59(1): 67–77. DOI:10.2307/1936632 |
| Horn HS. 1966. Measurement of "overlap" in comparative ecological studies[J]. American Naturalist, 100(914): 419–424. DOI:10.1086/282436 |
| Jokimäki J, Suhonen J. 1998. Distribution and habitat selection of wintering birds in urban environments[J]. Landscape & Urban Planning, 39: 253–263. |
| Nancy BG, Stanley HF, Nancy EG, et al. 2008. Global change and the ecology of cities[J]. Science, 319(5864): 756–760. DOI:10.1126/science.1150195 |
| Novcic I. 2016. Niche dynamics of shorebirds in Delaware Bay:foraging behavior, habitat choice and migration timing[J]. Acta Oecologica, 75: 68–76. DOI:10.1016/j.actao.2016.07.002 |
| Roberge JM, Angelstam P. 2006. Indicator species among resident forest birds-a cross-regional evaluation in northern Europe[J]. Biological Conservation, 130(1): 134–147. DOI:10.1016/j.biocon.2005.12.008 |
| Torrenta R, Lacoste F, Villard MA. 2018. Loss and fragmentation of mature woodland reduce the habitat niche breadth of forest birds[J]. Landscape Ecology, 33(11): 1865–1879. DOI:10.1007/s10980-018-0718-9 |
| Wang Y, Ding P, Chen S, et al. 2013. Nestedness of bird assemblages on urban woodlots:implications for conservation[J]. Landscape & Urban Planning, 111(1): 59–67. |
| Zurita GA, Pe'Er G, Bellocq MI. 2017. Bird responses to forest loss are influence by habitat specialization[J]. Diversity & Distributions, 23(6): 650–655. |
 2019, Vol. 38
2019, Vol. 38




