扩展功能
文章信息
- 谢昕宏, 刘芹, 崔亮伟, 郭鹏
- XIE Xinhong, LIU Qin, CUI Liangwei, GUO Peng
- 颈槽蛇的地理变异
- Geographic Variation of Snake Rhabdophis nuchalis (Squamata: Colubridae) in China
- 四川动物, 2019, 38(2): 165-171
- Sichuan Journal of Zoology, 2019, 38(2): 165-171
- 10.11984/j.issn.1000-7083.20180279
-
文章历史
- 收稿日期: 2018-09-17
- 接受日期: 2018-12-21
2. 宜宾学院生命科学与食品工程学院, 四川宜宾 644007
2. College of Life Sciences and Food Engineering, Yibin University, Yibin, Sichuan Province 644007, China
Fitzinger(1843)通过描述物种Tropidonotus subminiatus Schlegel,1837(现名为Rhabdophis subminiatus)建立颈槽蛇属Rhabdophis。但该属一直未被承认,属内物种被置于游蛇属Natrix sensu lato(赵尔宓等,1998)。Malnate(1960)基于鼻间鳞和半阴茎形态、上颌齿结构、鼻孔位置、颈背纵沟、有无颈腺以及背鳞有无端窝等形态特征将原隶属于游蛇属Natrix sensu lato的部分物种分离,恢复了Fitzinger(1843)所建立的颈槽蛇属Rhabdophis。目前颈槽蛇属有21种(Wallach et al., 2014),其中,中国分布有10种(Zhu et al., 2014)。
Boulenger(1893)依据湖北省宜昌市样本描记了颈槽蛇Rhabdophis nuchalis。江耀明和赵尔宓(1983)依据四川九龙的样本描记了颈槽蛇九龙亚种R. nuchalis pentasupralabialis。赵尔宓(1995)基于形态特征比较认为颈槽蛇九龙亚种与指名亚种在形态上的分化已经达到了种级水平,于是将九龙亚种提升为种,称为九龙颈槽蛇R. pentasupralabralis。目前颈槽蛇无亚种分化。
对地理分布广泛的蛇类进行形态学研究,可为探索其生物多样性提供有效的依据(Pearson et al., 2002;Manier,2004;Devitt et al., 2008;Zhong et al., 2017)。颈槽蛇广泛分布于我国的重庆、湖北、湖南、甘肃、广西、贵州、河南、陕西、四川和云南(赵尔宓等,1998;康祖杰等,2009;雷隽,丁利,2013);国外分布于越南(Le et al., 2015)。该种常见于海拔620~1 860 m的马路边、草丛和农田(赵尔宓等,1998)。这为研究其地理变异模式提供了理想的条件。本文通过对我国的颈槽蛇标本进行形态观察、测量和统计分析,探索该物种的地理变异模式以及是否存在隐存种。谢昕宏等:颈槽蛇的地理变异
1 材料和方法共观察并测量来自重庆、湖北、湖南、甘肃、广西、贵州、河南、陕西、四川和云南等地的61号馆藏标本(附录Ⅰ)的吻腹长、尾长、鳞片数、色斑等44个特征(附录Ⅱ)。吻腹长和尾长用直尺测量,精确到1 cm;其他数量特征使用游标卡尺测量,精确到0.1 cm。腹鳞数参考Dowling(1951)的方法;为方便测量,将尾背鳞的变化位置规定为其垂直对应的尾下鳞位置。对称的测量型特征(如鼻鳞长)左右两边均测量,取其平均值;对称的计数型特征(如上唇鳞数)左右两侧均计数,但独立分析、比较。为避免测量误差,所有数据均由本文第一作者独自完成。
| 省 | 标本信息 |
| 河南 | 栾川: CIB94009(M) |
| 湖北 | 利川: CIB10523~24(M)、CIB10525(F)、CIB10530(M)、CIB10532 ~33(M)、CIB10536~38(M)、CIB1054~43(M)、CIB545(M)、CIB10547(M)、CIB10549~51(M)、CIB10556(M)、CIB10559(M) |
| 湖南 | 常德壶瓶山: YBU071031(M) |
| 甘肃 | 文县: CIB10644~10646(M) |
| 广西 | 柳州: CIB10581(M) |
| 贵州 | 兴义: CIB10607(F)、CIB10600(M) |
| 陕西 | 周至: CIB10648(F) |
| 重庆 | 奉节: CIB10614(F) |
| 洪雅: CIB83673(M) | |
| 四川 | 安县: YBU071013(F)、YBU061034(M) |
| 巴中: YBU15109(M)、YBU15102(F)、YBU15104(M) | |
| 茂汶: KIZ84092~93(M)、KIZ84096~97(F) | |
| 云南 | 绿春: KIZ85Ⅱ003(F) |
| 德钦: KIZ80Ⅰ365(F)、KIZ80Ⅰ367(F)、K1Z80Ⅰ 366(M) | |
| 景东: KIZ75Ⅱ0188(F) | |
| 於水: KIZⅡ0396(F)、KIZⅡ0474(F)、KIZⅡ0385 (M)、KIZⅡ0481 (F)、KIZⅡ0499(M)、KIZ730103 (F) | |
| 高黎贡山: KIZ057456(F)、KIZ057461(F)、KIZ057448 ~49(M)、KIZ057451(M)、KIZ057453(M)、KIZ057454~5(M)、KIZ057458(M) KIZ057460(M), KIZ057462(M), KIZ730023(M) | |
| 注:CIB.中国科学院成都生物研究所,KIZ.中国科学院昆明动物研究所,YBU.宜宾学院;F.雌性,M.雄性 Notes:CIB. Chengdu Institute of Biology, Chinese Academy of Sciences, KIZ. Kunming Institute of Zoology, Chinese Academy of Sciences, YBU. Yibin University;F. female, M. male |
|
| 特征缩写 | 特征 |
| SC | 尾下鳞数 |
| INTNAS | 鼻间鳞数 |
| DIAE | 眼径 |
| DISN | 鼻间距 |
| NUSBPCH | 后额片间是否有小鳞 |
| NUNTFD | 颈槽结束于第几枚背鳞 |
| NUBSSUP | 上唇鳞黑纹的数量 |
| LSUBLAB | 头左部下唇鳞数 |
| RSUBLAB | 头右部下唇鳞数 |
| LSUPLAB | 头左部上唇鳞数 |
| RSUPLAB | 头右部上唇鳞数 |
| RPREOC | 头右部眶前鳞数 |
| LPREOC | 头左部眶前鳞数 |
| RPOSTOC | 头右部眶后鳞数 |
| LPOSTOC | 头左部眶后鱗数 |
| RNUTCHI | 头右部下唇鳞切颔片数 |
| LNUTCHI | 头左部下唇鳞切颔片数 |
| WITNAS | 鼻间鳞宽 |
| LTTNAS | 鼻间鳞长 |
| WPREFR | 前额鱗宽 |
| LPREFR | 前额鳞长 |
| WR0S | 吻鳞宽 |
| LR0S | 吻鳞长 |
| WTVfAS | 鼻鳞宽 |
| LNAS | 鼻鳞长 |
| WTR | 额鳞宽 |
| LFR | 额鳞长 |
| WPAR | 顶鳞宽 |
| LPAR | 顶鱗长 |
| WANAL | 肛鱗宽 |
| LANAL | 肛鱗长 |
| WACS | 前颔片宽 |
| LACS | 前颔片长 |
| WPCS | 后颔片宽 |
| LPCS | 后颔片长 |
| VS | 腹鳞数[依据Dowling(1951)提出的由第一枚两边都接触到背鳞鳞片算起,不包括肛鳞] |
| SVL | 吻腹长(吻端到泄殖腔的距离) |
| TAIL | 尾长(泄殖腔到尾巴末端的距离) |
| LHEAD | 头长(吻端到顶鳞末端的距离) |
| WHEAD | 头宽(左右两边下唇结束位置间的距离) |
| RSC8to6 | 尾背鳞右部8枚至6枚的变化位置 |
| I5C8to6 | 尾背鱗左部8枚至6枚的变化位置 |
| RSC6to4 | 尾背鳞右部6枚至4枚的变化位置 |
| ISC6to4 | 尾背鳞左部6枚至4枚的变化位置 |
为排除异速生长对后续分析的影响,测量型特征通过其在各分组间的回归系数与吻腹长按一定方式调整(Guo et al., 2009;Malhotra & Thorpe,2015)后用于后续分析。大多数蛇类都存在两性异形(Krause et al., 2003;Gregory,2004;Vincent et al., 2004;Zhong et al., 2017),所有特征通过单因素方差分析(One-Way ANOVA)确定雌雄间形态差异是否存在统计学意义,若存在则按性别分析。
依据样本的采集地进行分组(图 1,附录Ⅰ)。利用单因素方差分析和单因素协方差分析(ANCOVA)筛选各组间具有显著差异的特征;当这些显著差异的特征之间的相关性r>0.7时,为避免在进行主成分分析(principal component analysis,PCA)的过程中被加权,仅选取其中一个特征(Thorpe,1976)。典型变量分析(canonical variate analysis,CVA)是用于识别能够区分各簇的形态特征的一种重要的分析方法。CVA需要1个先研分组,但是这在不确定各样本间的亲缘关系的情况下是不适用的,因此把PCA结果形成的簇作为CVA的先研分组。为排除潜在的异方差性,叙述型特征使用该特征在PCA中的得分进行CVA(Guo et al., 2009)。所有分析都在SPSS 17.0中进行,P≤0.05时差异有统计学意义。
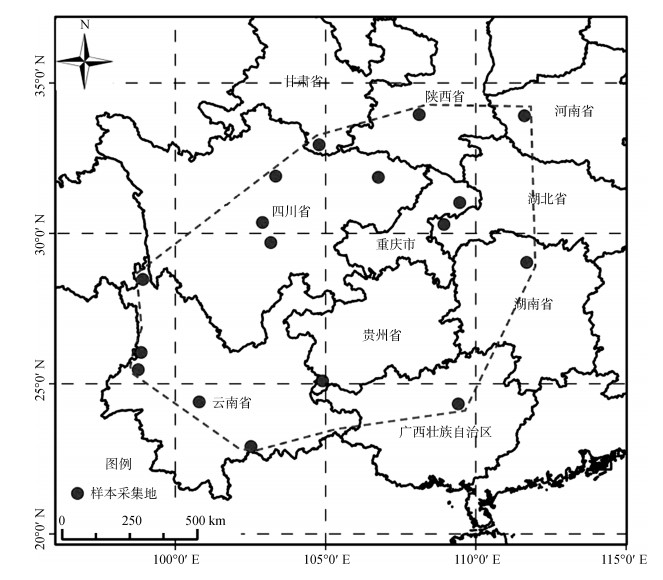
|
| 图 1 颈槽蛇地理分布及样本采集地 Fig. 1 Geographical distribution of Rhabdophis nuchalis and the localities of the specimens |
| |
所有测量和记录样本均具有15行中段背鳞和6枚上唇鳞(2-2-2)等特征,据此可以与相近物种区别,如缅甸颈槽蛇R. leonardi(17行中段背鳞)和九龙颈槽蛇(5枚上唇鳞2-2-1)等,确认本研究所用标本为颈槽蛇。
2.1 两性异形单因素方差分析结果显示,雌性和雄性颈槽蛇在尾长、前颔片宽、头左部下唇鳞数、颈槽结束于第几枚背鳞、尾背鳞左部8枚至6枚的变化位置、尾背鳞右部8枚至6枚的变化位置、尾背鳞左部6枚至4枚的变化位置和尾背鳞右部6枚至4枚的变化位置等特征上的差异有统计学意义(表 1)。雄性样本具有更多的尾下鳞、更长的尾,颈槽结束的背鳞位置更靠近头部;雌性样本则具有更多的下唇鳞和更宽的前颔片,尾背鳞的变化位置更靠近泄殖腔。
| 特征 Characters |
样本数 Number | 最小值 Minimum | 最大值 Maximum | 平均值±标准差 Mean±SD |
F | P |
| TAIL/mm(M/F) | 43/18 | 92.74/76.86 | 237.50/203.18 | 127.00±3.27/102.11±6.55 | 14.322 | < 0.001 |
| WACS/mm(M/F) | 43/18 | 3.59/4.07 | 4.87/5.43 | 4.19±0.05/4.43±0.08 | 5.603 | 0.021 |
| LSUBLAB/枚(M/F) | 43/18 | 6/7 | 8/9 | 7.42±0.08/7.78±0.13 | 5.495 | 0.022 |
| NUNTFD/枚(M/F) | 43/18 | 8/9 | 17/18 | 12.05±0.37/13.72±0.57 | 5.980 | 0.017 |
| SC/枚(M/F) | 43/18 | 41/41 | 66/56 | 56.67±0.73/48.00±0.91 | 46.346 | < 0.001 |
| LSC8to6/枚(M/F) | 43/18 | 7/5 | 26/17 | 17.77±0.73/10.50±0.85 | 33.333 | < 0.001 |
| RSC8to6/枚(M/F) | 43/18 | 7/5 | 26/15 | 16.88±0.72/9.72±0.71 | 34.903 | < 0.001 |
| LSC6to4/枚(M/F) | 43/18 | 21/19 | 39/38 | 33.16±0.68/26.94±1.27 | 21.590 | < 0.001 |
| RSC6to4/枚(M/F) | 43/18 | 17/19 | 39/38 | 33.07±0.75/27.44±1.34 | 15.174 | < 0.001 |
| 注:测量型特征(尾长和前颔片宽)已根据吻腹长的总均值(469.70 mm)进行调整,形态特征及其缩写见附录Ⅱ Note:Size-related characters (TAIL and WACS) were adjusted to a grand mean size of SVL (469.70 mm),see appendix Ⅱ for the morphological characters and their abbreviations |
||||||
颈槽蛇存在两性异形,雌性样本和雄性样本分别分析。单因素方差分析和单因素协方差分析结果显示,雄性样本只有头左部眶后鳞数、头右部眶后鳞数、腹鳞数、尾下鳞数、上唇鳞黑纹的数量、后颔片间是否有小鳞和尾背鳞左部8枚至6枚的变化位置在地理组之间的差异有统计学意义并用于后续分析。
PCA结果表明,雄性样本形成2个独立的簇:其中一簇由10个来自云南高黎贡山的样本组成,另一簇由其他地区的样本组成(图 2,A);前2个主成分的贡献值57.664%(表 2)。主成分1解释为后颔片间是否有小鳞、上唇鳞黑纹的数量、头右部眶后鳞数、头左部眶后鳞数和腹鳞数5个特征,主成分2主要解释为尾下鳞数和尾背鳞左部8枚至6枚的变化位置。由于18个雌性样本中只有2个样本来自高黎贡山,仅筛选出头左部眶后鳞数和头右部眶后鳞数这2个特征用于PCA。结果显示,主成分1的贡献值88.730%(表 2)与雄性样本不同,高黎贡山的样本与2条来自四川巴中和甘肃文县的聚成一簇,四川茂汶与云南德钦独立于其他地方,其他地方聚成一簇。
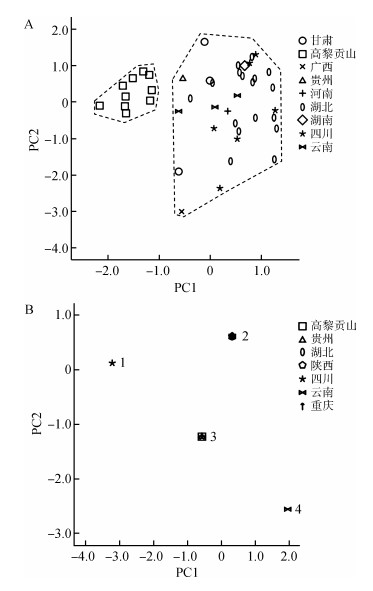
|
| 图 2 颈槽蛇雄性(A)和雌性(B)的前2个主成分得分散点图 Fig. 2 Plots of the first two principal components for male (A) and female (B) Rhabdophis nuchalis 1. KIZ84097,2. KIZ(7301030、75Ⅱ0188、80Ⅰ367、84096、85Ⅱ003、Ⅱ0396、Ⅱ0474、Ⅱ0481),YBU(071013),CIB(10525、10614、10648),3. KIZ(057456、057461),CIB10607,YBU15102,4. KIZ80Ⅰ365 |
| |
| 性别 Sex |
主成分 Principal component |
方差载荷 Loading coeffecients/% |
累计方差 Cumulative coeffecients/% |
| 雄性 | 1 | 38.600 | 39.600 |
| 2 | 18.064 | 57.664 | |
| 雌性 | 1 | 88.730 | 88.730 |
| 2 | 100.000 | 100.000 |
颈槽蛇雄性样本的CVA与PCA结果相似(图 3:A),高黎贡山的雌性样本未从其他地区的样本中分离出来。
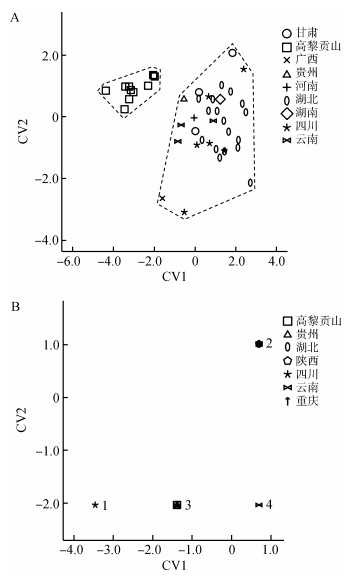
|
| 图 3 颈槽蛇雄性(A)和雌性(B)前2个典型变量得分散点图 Fig. 3 Plots of the first two canonical variates for Rhabdophis nuchalis in males (A) and females (B) 1. KIZ84097,2. KIZ(7301030、75Ⅱ0188、80Ⅰ367、84096、85Ⅱ003、Ⅱ0396、Ⅱ0474、Ⅱ0481),YBU(071013),CIB(10525、10614、10648),3. KIZ(057456、057461),CIB10607,YBU15102,4. KIZ80Ⅰ365 |
| |
颈槽蛇在尾长、尾下鳞变化位置等的两性异形模式与其他蛇类相似(Krause et al., 2003;雷焕宗,2005;Zhong et al., 2017),即雄性尾长长于雌性,雌性尾下鳞的变化位置较雄性更靠近泄殖腔。解释蛇类两性异形现象的观点有性选择(Darwin,1871)、自然选择(Shine & Shetty,2001;González-Gómez & Estades,2009)和形态约束假说(King,1989)。形态约束假说主张雄性拥有更大的头,主要与捕食的数量有关(Forsman & Lindell,1993)。Shine(1999)提出尾长与半阴茎长正相关,并通过比较正常雄性个体与损失部分尾巴的雄性个体,发现尾长影响雄性交配的成功率,这可能是性选择和自然选择的共同结果。
3.2 地理变异PCA和CVA的结果均表明雄性颈槽蛇在高黎贡山种群和其他种群间存在显著差异,主要体现在头左部眶后鳞数、头右部眶后鳞数、腹鳞数、上唇鳞黑纹的数量和后颔片间是否有小鳞。PCA和CVA结果雌雄样本略不一致,可能是雌性样本太少导致了结果偏差。形态比较结果显示:高黎贡山种群83%的样本具有2枚眶后鳞(雄性80%,雌性100%),而其他种群90%的样本具有3枚眶后鳞(雄性91%,雌性81%);高黎贡山种群83%的样本的后颔片间无小鳞(雄性80%,雌性100%),然而其他种群73%的样本后颔片间有小鳞(雄性76%,雌性69%);此外高黎贡山种群16%的样本上唇鳞间有黑纹,而其他种群73%的样本上唇鳞间有黑纹(表 3)。
| 特征 Characters |
高黎贡山种群12 Gaoligong Mountains population12 |
其他种群49 Other population49 |
F | P | |||
| 雄性10 Males10 |
雌性2 Females2 |
雄性33 Males33 |
雌性16 Females16 |
||||
| LPOSTOC/枚 | 2.20(1~3) | 2(2) | 2.79(1~3) | 2.75(1~3) | 11.930 | 0.001 | |
| RPOSTOC/枚 | 1.90(1~2) | 2(2) | 2.79(2~3) | 2.75(2~3) | 38.666 | < 0.001 | |
| VS/枚 | 145.70(142~151) | 151.00(150~152) | 156.21(148~166) | 154.38(145~165) | 49.277 | < 0.001 | |
| NUBSSUP/条 | 09,11 | 01,11 | 06,114,213 | 07,16,23 | 21.133 | < 0.001 | |
| NUSBPCH/(有/无) | 有2,无8 | 有0,无2 | 有25,无8 | 有11,无5 | 6.484 | 0.015 | |
| 注:括号中的值表示范围,上标表示样本数量,F和P值来自雄性样本,形态特征及其缩写见附录Ⅱ Note:The values in parentheses indicate the range,the superscript indicates the numbers of specimens examined,F and P were from males,the morphological characters recorded and their abbreviations see appendix Ⅱ |
|||||||
地理隔离对物种形成至关重要,通过对物种地理变异的研究,为确定其分类地位提供了重要的依据(Thalmann & Geissmann,2000;Gergely,2003;Manier,2004;Moratelli et al., 2011)。高黎贡山属于横断山脉,拥有丰富的生物多样性,是中国最具生物多样性的温带地区,不断有新物种被发现,说明其特有的环境对物种的进化有较大的影响(杨大同等,1979;Vogel & Luo,2011)。本次对颈槽蛇的地理变异模式的研究,丰富了对高黎贡山生物多样性的认识。我们认为,来自高黎贡山种群与其他种群之间显著的形态差异可能暗示它代表一个不同的种或者亚种。由于获取的样本为无法获得分子遗传数据样本,所以高黎贡山种群与其他地区的种群间是否存在遗传差异以及差异的大小,还需要以后利用分子遗传资料来解决。
致谢: 感谢中国科学院成都生物研究所、中国科学院昆明动物研究所惠允查看标本;感谢李家堂博士、任金龙、苏思博、王平、谢雨林等在标本测量和数据分析上的帮助;感谢高颖对文中地图制作的帮助。| 江耀明, 赵尔宓. 1983. 贡嘎山区两栖爬行动物研究3. Rhabdophis属nuchalis种组的研究[J]. 两栖爬行动物学报, 2(1): 59–62. |
| 康祖杰, 杨道德, 廖庆义. 2009. 壶瓶山发现湖南蛇类新纪录二种——双全白环蛇和颈槽蛇[J]. 动物学杂志, 44(1): 145–147. DOI:10.3969/j.issn.0250-3263.2009.01.023 |
| 雷焕宗, 林植华, 华和亮. 2005. 六种游蛇属蛇尾长的两性异形和种间差异[J]. 河南科学, 23(2): 211–213. DOI:10.3969/j.issn.1004-3918.2005.02.016 |
| 雷隽, 丁利. 2013. 河南省蛇类新纪录——颈槽蛇[J]. 四川动物, 32(3): 437. |
| 杨大同, 苏承业, 利思敏. 1979. 高黎贡山两栖爬行动物新种和新亚种[J]. 动物分类学报, 4(2): 89–100. |
| 赵尔宓. 1995. 我国蛇类几个种与亚种的讨论[J]. 苏州科技大学学报(自然科学版)(2): 36–39. |
| 赵尔宓, 黄美华, 宗愉. 1998. 中国动物志爬行纲第三卷有鳞目蛇亚目[M]. 北京: 科学出版社. |
| Boulenger GA. 1893. Catalogue of the snakes in the British Museum (Natural History)[M]. London: Taylor and Francis. |
| Darwin C. 1871. The descent of man, and selection in relation to sex[M]. London: John Murray. |
| Devitt TJ, Laduc TJ, Mcguire JA. 2008. The Trimorphodon biscutatus (Squamata:Colubridae) species complex revisited:a multivariate statistical analysis of geographic variation[J]. Copeia(2): 370–387. |
| Dowling HG. 1951. A proposed standard system of counting ventrals in snakes[J]. British Journal of Herpetology, 1: 97–99. |
| Forsman A, Lindell LE. 1993. The advantage of a big head:swallowing performance in adders, Vipera berus[J]. Functional Ecology, 7: 183–189. DOI:10.2307/2389885 |
| Gergely B. 2003. Geographic variation in Echis coloratus (Viperidae, Ophidia) in the Levant with the description of a new subspecies[J]. Zoology in the Middle East, 29(1): 13–32. DOI:10.1080/09397140.2003.10637966 |
| González-Gómez PL, Estades CF. 2009. Is natural selection promoting sexual dimorphism in the green-backed firecrown hummingbird (Sephanoides sephaniodes)?[J]. Journal of Ornithology, 150(2): 351–356. DOI:10.1007/s10336-008-0356-0 |
| Gregory PT. 2004. Sexual dimorphism and allometric size variation in a population of grass snakes (Natrix natrix) in southern England[J]. Journal of Herpetology, 38(2): 231–240. DOI:10.1670/122-03A |
| Guo P, Malhotra A, Thorpe RS, et al. 2009. Comments on the systematic status of specimens belonging to the genus Viridovipera (Serpentes:Viperidae:Crotalinae) from Sichuan and Yunnan provinces of southwestern China, with a redescription of V. yunnanensis[J]. Herpetological Journal, 19(3): 151–162. |
| King RB. 1989. Sexual dimorphism in snake tail length:sexual selection, natural selection, or morphological constraint?[J]. Biological Journal of the Linnean Society, 38: 133–154. DOI:10.1111/bij.1989.38.issue-2 |
| Krause MA, Burghardt GM, Gillingham JC. 2003. Body size plasticity and local variation of relative sexual size dimorphism in garter snakes (Thamnophis sirtalis)[J]. Journal of Zoology, 261(4): 399–407. DOI:10.1017/S0952836903004321 |
| Le TD, Son NLH, Cuong PT, et al. 2015. New records of snakes (Squamata:Serpentes) from Dien Bien province[J]. Academia Journal of Biology, 36(4): 460–470. |
| Malhotra A, Thorpe RS. 2015. Maximizing information in systematic revisions:a combined molecular and morphological analysis of a cryptic green pitviper complex (Trimeresurus stejnegeri)[J]. Biological Journal of the Linnean Society, 82(2): 219–235. |
| Malnate EV. 1960. Systematic division and evolution of the colubrid snake genus Natrix, with comments on the subfamily Natricinae[J]. Proceeding of the Academy of Natural Sciences of Philadelphia, 114(8): 151–199. |
| Manier MK. 2004. Geographic variation in the long-nosed snake, Rhinocheilus lecontei (Colubridae):beyond the subspecies debate[J]. Biological Journal of the Linnean Society, 83(1): 65–85. DOI:10.1111/j.1095-8312.2004.00373.x |
| Moratelli R, Peracchi AL, Dias D, et al. 2011. Geographic variation in south American populations of Myotis nigricans (Schinz, 1821) (Chiroptera, Vespertilionidae), with the description of two new species[J]. Mammalian Biology, 76(5): 592–607. DOI:10.1016/j.mambio.2011.01.003 |
| Pearson D, Shine R, Williams A. 2002. Geographic variation in sexual size dimorphism within a single snake species (Morelia spilota, Pythonidae)[J]. Oecologia, 131(3): 418–426. DOI:10.1007/s00442-002-0917-5 |
| Shine R, Olsson MM, Moore IT, et al. 1999. Why do male snakes have longer tails than females?[J]. Proceedings of the Royal Seciety B:Biological Sciences, 266: 2147–2151. DOI:10.1098/rspb.1999.0901 |
| Shine R, Shetty S. 2001. The influence of natural selection and sexual selection on the tails of sea-snakes (Laticauda colubrina)[J]. Biological Journal of the Linnean Society, 74(1): 121–129. DOI:10.1111/j.1095-8312.2001.tb01381.x |
| Thalmann U, Geissmann T. 2000. Distribution and geographic variation in the western woolly lemur (Avahi occidentalis) with description of a new species (A. unicolor)[J]. International Journal of Primatology, 21(6): 915–941. DOI:10.1023/A:1005507028567 |
| Thorpe RS. 1976. Biometric analysis of geographic variation and racial affinities[J]. Biological Reviews, 51: 407–452. |
| Vincent SE, Herrel A, Irschick DJ. 2004. Sexual dimorphism in head shape and diet in the cottonmouth snake (Agkistrodon piscivorus)[J]. Proceedings of the Zoological Society of London, 264(1): 53–59. DOI:10.1017/S0952836904005503 |
| Vogel G, Luo J. 2011. A new species of the genus Lycodon (Boie, 1826) from the southwestern mountains of China (Squamata:Colubridae)[J]. Zootaxa, 2807: 29–40. DOI:10.11646/zootaxa.2807.1 |
| Wallach V, Williams KL, Boundy J. 2014. Snakes of the world. A catalogue of living and extinct species[M]. Boca Raton, Florida: CRC Press. |
| Zhong GH, Liu Q, Li C, et al. 2017. Sexual dimorphism and geographic variation in the Asian lance-headed pitviper Protobothrops mucrosquamatus in the mainland China[J]. Asian Herpetological Research, 8(2): 118–122. |
| Zhu GX, Wang YY, Takeuchi H, et al. 2014. A new species of the genus Rhabdophis Fitzinger, 1843 (Squamata:Colubridae) from Guangdong province, southern China[J]. Zootaxa, 3765(5): 469–480. DOI:10.11646/zootaxa.3765.5 |
 2019, Vol. 38
2019, Vol. 38




