扩展功能
文章信息
- 方超, 张剑南, 李枭虓, 陈军安, 李娟, 王亚军
- FANG Chao, ZHANG Jiannan, LI Xiaoxiao, CHEN Jun'an, LI Juan, WANG Yajun
- 家鸡GPR15基因的克隆、功能探究及组织表达分析
- Characterization of GPR15 Gene in Chicken: Cloning, Functional Analysis and Tissue Distribution
- 四川动物, 2019, 38(2): 130-138
- Sichuan Journal of Zoology, 2019, 38(2): 130-138
- 10.11984/j.issn.1000-7083.20180146
-
文章历史
- 收稿日期: 2018-05-03
- 接受日期: 2018-06-10
人Homo sapiens的G蛋白偶联受体15(G protein-coupling receptor 15,GPR15)于1996年被首次克隆(Heiber et al., 1996),研究表明GPR15在哺乳动物中调节多种生理功能:在小鼠Mus musculus大肠T细胞中,GPR15通过介导上皮中T细胞归巢调节免疫反应,参与调控调节性T细胞(Treg cells)抑制非感染性炎症,对预防大肠病理性炎症至关重要(Kim et al., 2013;Nguyen et al., 2015);在小鼠皮肤淋巴细胞归巢中,GPR15有助于淋巴细胞靶向不同的上皮部位(Lahl et al., 2014);GPR15还参与先天性免疫调节,并与多种疾病存在密切关联,如克罗恩病和类风湿性关节炎(Cartwright et al., 2014);GPR15在吸烟者体内高表达亦暗示其可能参与调控吸烟引起的疾病(Koks & Koks,2017)。除了炎症反应之外,肠道微生物菌群可以影响小鼠GPR15的表达水平,暗示GPR15可能参与调控肠道的微生物菌群稳态平衡(Kim et al., 2013)。GPR15调节的生理功能与其在组织中的特异性表达图谱密切相关,人类组织转录组测序数据表明GPR15在淋巴细胞中具有最高的表达丰度,表明其在免疫反应中的重要作用,其次高表达于结肠和小肠中,表明GPR15可参与调节肠道稳态(Koks & Koks,2017)。
因为GPR15是孤儿受体,故人们致力于寻找其内源性配体。最新研究报道人类C10ORF99基因编码GPR15的内源性配体蛋白GPR15L,可以激活GPR15并抑制毛喉素(forskolin)诱导的环腺苷酸(cAMP)产生(Suply et al., 2017)。Ocon等(2017)的研究表明人类C10ORF99基因和小鼠2610528A11Rik基因可编码GPR15L,并鉴定其可作为一种淋巴细胞趋化因子,通过激活GPR15发挥功能。但我们发现GPR15L基因在非哺乳类脊椎动物中消失,因此,在鸟类等非哺乳动物类群中,GPR15的配体仍待鉴定。因GPR15与爱帕琳肽受体(APLNR)和GPR25具有较高的结构相似性(Lee et al., 2001),提示APLNR (Chng et al., 2013;Pauli et al., 2014)和GPR25 (Zhang et al., 2018)的配体Apelin和Apela也可能会作为GPR15的潜在配体,但该假设有待验证。
目前,关于GPR15的研究主要集中在哺乳动物中,在其他脊椎动物类群中的研究几属空白。鉴于GPR15在哺乳动物炎症反应和肠道稳态中的重要调控作用(Kim et al., 2013;Koks & Koks,2017),本研究以家鸡Gallus gallus domesticus为模型,首次针对GPR15的基因结构、功能和表达特征进行了探究,以期为探究GPR15在非哺乳类脊椎动物中的功能奠定基础。
1 材料与方法 1.1 材料与试剂罗曼粉蛋鸡购于成都牧星种鸡场,本实验室提供大肠杆菌Escherichia coli DH5α感受态细胞。真核表达载体pcDNA3.1(+)购于美国Invitrogen公司,斑马鱼Danio rerio GPR25真核表达质粒保存于本实验室(Zhang et al., 2018)。RNAzol购于美国Molecular Research Center公司;限制性内切酶、RNA反转录酶M-MLV及其配用体系购于TaKaRa公司;高保真聚合酶KOD及其配用体系购于日本TOYOBO公司;Easy Taq酶及其配用体系购于全式金公司;引物合成及后续测序工作由成都擎科生物技术有限公司完成;DMEM低糖培养基购于GIBCO公司;转染试剂JetPEI购于Polyplus-transfection公司;5×细胞裂解液(5×Passive Lysis Buffer)和荧光素酶报告系统购于Promega公司。家鸡Apelin多肽(TPLRQNPARAGRSQRPAGWRRRRPRPRLSHKGPMPF)和Apela多肽(LVRPRGARRGNVRRPGGWRRLRRP-RPRLSHKGPMPF)由上海吉尔生化公司合成。
1.2 方法 1.2.1 家鸡组织总RNA的提取分别取家鸡不同组织样品(盲肠、心脏、肝脏、脾脏、肺、肾脏、卵巢、精巢、大脑、小脑)于液氮中充分研磨至粉末,将60 mg磨碎组织加入到600 μL RNAzol中涡旋混匀;加入240 μL焦碳酸二乙酯(DEPC)灭菌水后涡旋混匀,于4 ℃、12 000 r·min-1离心15 min;取上清,加入3 μL阿司咪唑(BAN)后涡旋混匀,于4 ℃、12 000 r·min-1离心10 min;吸取上清液,加入等体积的异丙醇,涡旋混匀后于-20 ℃静置20 min,于4 ℃、12 000 r·min-1离心15 min;吸弃上清,用70%乙醇漂洗沉淀,于4 ℃、12 000 r·min-1离心3 min,重复该操作一次,吸弃上清;用20 μL DEPC-H2O溶解RNA沉淀,并储存于-80 ℃冰箱中。
1.2.2 cDNA模板制备以家鸡组织总RNA为模板,按照逆转录试剂盒说明书操作。配制混合液1:RNA 2 μg和Olig-dT 1 μL,加入DEPC-H2O补足5 μL,于PCR仪中70 ℃反应10 min,取出静置于冰上10 min。配制混合液2:5×Buffer 2 μL、dNTP 1 μL和M-MLV反转录酶0.5 μL,加入DEPC-H2O补足5 μL;将混合液1与混合液2混匀,然后放入PCR仪中,42 ℃反应1.5 h,70 ℃反应10 min,取终产物加入70 μL灭菌水后存于-20 ℃中,即为cDNA模板。
1.2.3 家鸡GPR15的引物设计及扩增根据Ensembl数据库(http://www.ensembl.org)中检索得到的家鸡GPR15的预测序列(登录号:XM_004938212),设计了用于克隆其cDNA序列的引物GPR15 F1/GPR15 R1,并且设计用于检测GPR15在组织表达图谱的实时定量PCR引物(表 1)。
| 基因 Gene |
引物序列 Primer sequence |
退火温度、延伸时间 Tm,extension time |
大小 Size/bp |
|
| 表达载体构建 | GPR15 | F1:5’-CCGGAATTCAAGATGAGGACAGCTGGGCC-3’ R1:5’-CCGGAATTCTTCCTCTGTGGTCCTGGCTC-3’ |
60 ℃,90 s | 1 149 |
| 实时定量PCR | GPR15 | F1:5’-GTGTTCTTGGTGGGCATTCT-3’ R1:5’-GCGAGGTTGATGATGAAGAT-3’ |
60 ℃,15 s | 102 |
| β-actin | F1:5’-CCCAGACATCAGGGTGTGATG-3’ R1:5’-GTTGGTGACAATACCGTGTTCAAT-3’ |
60 ℃,15 s | 123 | |
| 注:下划线表示引物设计时添加的限制性内切酶酶切位点 Note:Restriction sites at the 5’ -end of the primers are underlined |
||||
PCR反应以家鸡盲肠来源的cDNA为模板。PCR反应体系按照KOD酶说明书配制,体系如下:5 μL 2×KOD缓冲液,2 μL盲肠cDNA模板,2 μL dNTPs,上、下游引物各0.1 μL,0.5 μL KOD-Fx聚合酶,0.3 μL去离子灭菌水。PCR反应程序为:94 ℃2 min;98 ℃10 s,60 ℃30 s,68 ℃90 s,35个循环;72 ℃20 min,12 ℃保存。经1%琼脂糖凝胶电泳检测后,纯化后的PCR产物连接至pcDNA3.1(+)载体,通过序列测定,确定GPR15的cDNA序列。
1.2.4 细胞转染及荧光素酶活性测定待培养细胞密度至60%左右进行质粒转染。转染体系为:受体基因表达载体或pcDNA3.1(+)空载体200 ng/孔;荧光素酶报告质粒800 ng/孔;转染试剂JetPEI 2 μL/孔;用转染缓冲液配成总体系为100 μL的混合液,室温放置10 min后,将转染混合液加入到6孔板中,4 h后更换培养基。配体(多肽或药物)处理前,用胰蛋白酶液消化细胞,再将HEK293细胞传代至96孔板中,置于5%浓度CO2的37 ℃恒温培养箱培养24 h后进行配体处理。配体处理时,按照10-12~10-5 mol·L-1配制,处理6 h后,使用1×Passive Lysis Buffer充分裂解细胞,加入Luciferase底物后,在酶标仪中测定荧光素酶活性。具体方法参见Mo等(2017)和Zhang等(2018),实验数据使用GraphPad Prism 7进行分析处理。
1.2.5 GPR15表达图谱分析通过实时定量PCR(qPCR)技术,以家鸡不同组织(盲肠、心脏、肝脏、脾脏、肺、肾脏、卵巢、精巢、大脑、小脑)的cDNA为模板,检测GPR15基因的表达水平。PCR反应程序为:94 ℃2 min;98 ℃10 s,60 ℃20 s,68 ℃15 s,40个循环;72 ℃20 min,PCR产物由成都擎科梓熙生物技术有限公司进行测序,具体方法参见祝国强等(2017)和邓秋洋等(2018)。同时利用转录组数据分析GPR15基因的组织表达。RNA-seq数据下载于NCBI数据库(登录号:PRJEB4677),该实验在1只雄性和1只雌性成年红原鸡Gallus gallus中共取得27个组织,包括脂肪、肾上腺、胸肌、小脑、大脑、心脏、下丘脑、肾脏、肝脏、肺、卵巢、腺胃、坐骨神经、脾脏和精巢等,之后利用Salmon(v0.82)对RNA-seq数据进行转录本的定量(Patro et al., 2017)分析,TPM(transcripts per million)值表示转录本丰度,使用GraphPad Prism 7绘制图片。
1.2.6 生物信息学分析采用SeqMan和EditSeq进行测序结果序列拼接,用DNAMAN进行DNA和蛋白质序列比对,使用CFX Manager进行qPCR数据定量分析;通过SWISS-MODEL(https://www.swissmodel.expasy.org/)网站进行蛋白三维结构同源建模,使用MEGA 7进行系统发育分析,采用邻接法(neighbor-joining method),重复计算引导值(bootstrap values)达1 000次。
2 结果与分析 2.1 家鸡GPR15基因的克隆及序列分析根据家鸡GPR15的预测序列(登录号:XM_004938212),设计引物GPR15 F1/R1。以家鸡盲肠cDNA为模板进行PCR扩增,测序获得家鸡GPR15基因的cDNA序列(登录号:MH293603)。序列分析表明:家鸡GPR15基因编码区cDNA序列长度为1 107 bp,含1个外显子,编码含368个氨基酸的受体蛋白(图 1:A)。家鸡GPR15是具有7次跨膜结构的G蛋白偶联受体(图 1:B、C)。家鸡GPR15具有保守的GPCR结构特征:包括维持GPR15三维结构的二硫键(Cys113~Cys190)、参与受体激活和G蛋白偶联信号转导的保守“DRY”基序(位于第二胞内域)以及“NP(XX)Y”基序(位于第七跨膜区)。通过同源建模方法,本研究模拟了家鸡GPR15的三维结构,可观察到经典的7次跨膜结构域,并预测其在C端具有1个α-螺旋结构(图 1:C)。
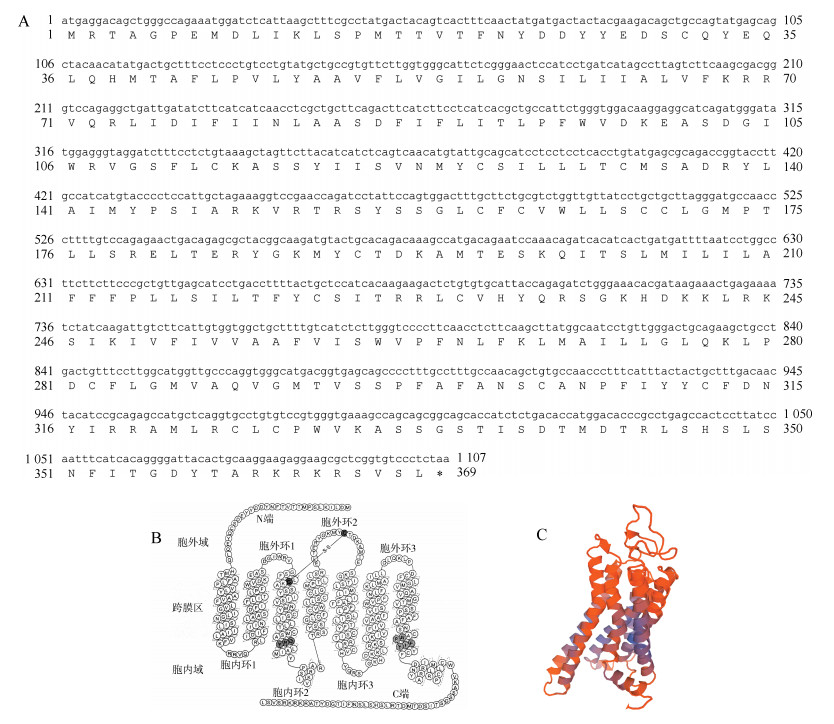
|
| 图 1 家鸡Gallus gallus domesticus GPR15基因的序列分析及结构解析 Fig. 1 Protein sequence and structure analysis of Gallus gallus domesticus GPR15 gene A.家鸡GPR15基因的cDNA及编码的氨基酸序列,B.家鸡GPR15二级结构简图[彩色字母标示GPCR家族中保守的二硫键、DRY基序以及NP(XX)Y基序],C.家鸡GPR15的三维结构模式 A. cDNA sequence and amino acid sequence of chicken GPR15, B. Secondary structure of chicken GPR15 protein [the conserved disulfide bond, DRY motif, and the NP(XX)Y motif in the GPCR family were shaded with purple, red, and green color, respectively], C. 3D structure of chicken GPR15 |
| |
多物种氨基酸序列比对表明(图 2):家鸡GPR15分别与人、北美绿蜥蜴Anolis carolinensis、小鼠GPR15具有中度的氨基酸序列一致性,分别为56.2%、55.9%、55.7%;与斑点雀鳝Lepisosteus oculatus GPR15的氨基酸序列相似度相对较低,为35.2%。

|
| 图 2 家鸡Gallus gallus domesticus GPR15与人Homo sapiens、北美绿蜥蜴Anolis carolinensis、小鼠Mus musculus、斑点雀鳝Lepisosteus oculatus GPR15的氨基酸比对 Fig. 2 Amino acid sequence alignment of Gallus gallus domesticus GPR15 with that of Homo sapiens, Anolis carolinensis, Mus musculus, and Lepisosteus oculatus 阴影部分示跨膜区(TM1~7),保守的DRY基序和NP(XX)Y基序用▼标注 The seven transmembrane domains (TM1-7)are shaded, the conserved DRY and NP(XX)Y motif of GPCR family are marked with ▼ |
| |
GPR15基因位于家鸡1号染色体上。选取斑胸草雀Taeniopygia guttata、中华草龟Chinemys reevesii、北美绿蜥蜴、人和家鸡的GPR15基因进行共线性分析。结果表明,家鸡GPR15基因与斑胸草雀、中华草龟、北美绿蜥蜴、人的GPR15基因为直系同源基因(图 3)。
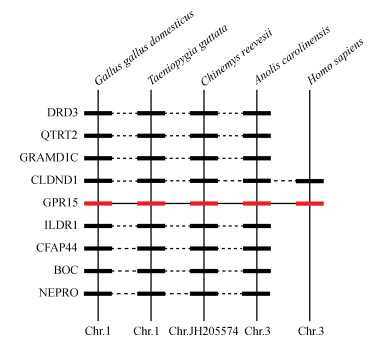
|
| 图 3 家鸡Gallus gallus domesticus、斑胸草雀Taeniopygia guttata、中华草龟Chinemys reevesii、北美绿蜥蜴Anolis carolinensis和人Homo sapiens GPR15基因的共线性分析 Fig. 3 Synteny analysis of GPR15 gene among Gallus gallus domesticus, Taeniopygia guttata, Chinemys reevesii, Anolis carolinensis and Homo sapiens Chr.染色体chromosome |
| |
由于有研究报道GPR15与GPR25、APLNR受体有序列相似性,因此,本研究对GPR15、GPR25、APLNR、AGTR1、AGTR2等基因进行系统进化分析。聚类分析表明(图 4),多个脊椎动物的GPR15、GPR25和APLNR基因可形成一个大的分支,并且GPR15还与GPR25形成一个小分支。这些结果提示GPR15与GPR25有较近的进化关系。在近期研究中,发现孤儿受体GPR25可被APLNR的配体Apelin和Apela多肽激活(Zhang et al., 2018)。据此,假设“Apelin和Apela或是GPR15的潜在配体”。

|
| 图 4 脊椎动物中G蛋白偶联受体A家族的系统进化分析 Fig. 4 Phylogenetic analysis of class A GPCR family among vertebrates 系统进化树分析使用的氨基酸序列包含人和其他脊椎动物中隶属G蛋白偶联受体A家族的多个基因,包括GPR15、GPR25、APLNR、AGTR1、AGTR1a、AGTR1b、AGTR2、BDKRB1和BDKRB2 Phylogenetic analysis was performed using the amino acid sequences of GPR15, GPR25, APLNR, AGTR1, AGTR1a, AGTR1b, AGTR2, BDKRB1 and BDKRB2 from vertebrate species, including human and other vertebrate species indicated |
| |
为验证上述假设,本研究采用了pGL3-CRE-luciferase报告系统(Mo et al., 2017;Zhang et al., 2018),探究Apelin和Apela多肽(10-12~10-5 mol·L-1,6 h)对表达于HEK293细胞中的家鸡GPR15(cGPR15)的激活效应。家鸡Apelin和Apela多肽不能激活家鸡GPR15受体,从而无法影响forskolin(5 μmol·L-1)刺激的HEK293细胞的荧光素酶活性(图 5:A)。相反,在相同实验条件下,家鸡Apelin和Apela多肽可以剂量依赖地激活斑马鱼GPR25(zfGPR25),抑制forskolin刺激的荧光素酶活性(图 5:B)(Zhang et al., 2018)。采用pGL4-SRE-luciferase报告系统(Mo et al., 2017)也发现家鸡Apelin和Apela多肽不能激活家鸡GPR15(图 5:C)。上述结果暗示,与GPR25和APLNR不同(Chng et al., 2013;Pauli et al., 2014;Zhang et al., 2018),GPR15不能被Apelin和Apela肽激活。
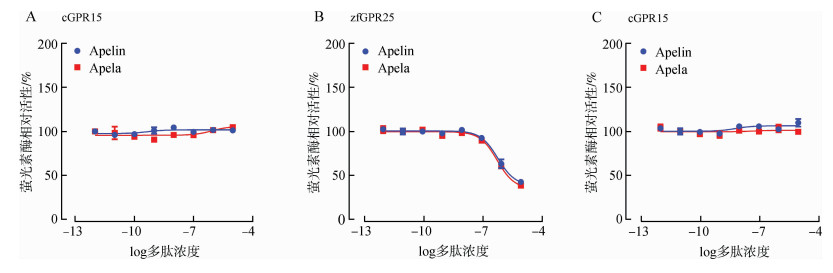
|
| 图 5 家鸡Gallus gallus domesticus GPR15的功能分析 Fig. 5 Functional analysis of Gallus gallus domesticus GPR15 in cultured HEK293 cells by cell-based luciferase reporter system A.采用pGL3-CRE-luciferase系统检测鸡Apelin和Apela对表达于HEK293细胞的cGPR15的激活效应,B.采用pGL3-CRE-luciferase系统检测鸡Apelin和Apela对表达于HEK293细胞的斑马鱼GPR25(zfGPR25)的激活效应,C.采用pGL4-SRE-luciferase报告系统检测家鸡Apelin和Apela对表达于HEK293细胞中的家鸡GPR15的激活效应;每个点数据均有3个重复 A. Effects of Apelin and Apela on forskolin (5 μmol·L-1)-stimulated luciferase activity of HEK293 cells expressing chicken GPR15, as determiend by a pGL3-CRE-luciferase reporter system (Zhang et al., 2018); B. Effects of Apelin and Apela on forskolin (5 μmol·L-1)-stimulated luciferase activity of HEK293 cells expressing zebrafish GPR25, as determiend by a pGL3-CRE-luciferase reporter system; C. Effects of Apelin and Apela on luciferase activity of HEK293 cells expressing chicken GPR15 as determiend by a pGL4-SRE-luciferase reporter system (Mo et al., 2017); Data shown are mean ± SEM of three replicas |
| |
采用qPCR检测GPR15基因在家鸡盲肠、心脏、肝脏、脾脏、肺、肾脏、卵巢、精巢、大脑和小脑中的表达分布情况(图 6:A),以肺中的表达水平为参照,GPR15基因相对高表达于脾脏中,而在盲肠和肺中有中等水平表达,在心脏、肝脏、肾脏、卵巢、精巢、小脑和大脑中,仅检测到微弱表达。与qPCR结果高度类似,转录组数据分析(图 6:B)也揭示GPR15基因高表达于家鸡祖先红原鸡脾脏中,在肺中中等表达,而在卵巢、精巢、坐骨神经等组织中微弱表达。
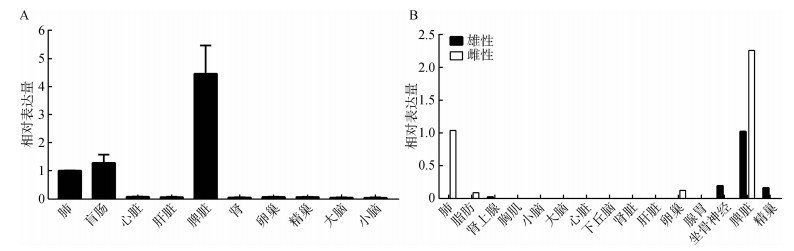
|
| 图 6 鸡GPR15基因的组织表达图谱分析 Fig. 6 Tissue expression of chicken GPR15 gene A.实时定量PCR技术检测GPR15 mRNA在家鸡Gallus gallus domesticus 10种组织中的表达,B.转录组数据分析GPR15在红原鸡G. gallus组织中的表达 A. qPCR assay of GPR15 mRNA express in 10 chicken tissues, B. RNA-seq analysis of GPR15 transcript in G. gallus |
| |
GPR15作为G蛋白偶联受体家族成员备受关注。已有研究表明在小鼠中,GPR15可介导肠道稳态并参与调控肠道炎症反应(Kim et al., 2013)。鉴于GPR15的重要生理功能,本研究首次从家鸡中成功克隆到GPR15基因,并尝试寻找其内源性配体,揭示其组织表达特征,为阐释GPR15在禽类免疫和肠道稳态中的生理作用奠定基础。
本研究首先克隆了家鸡GPR15基因,发现其编码区序列全长为1 107 bp,含1个外显子,编码含368个氨基酸的受体蛋白。家鸡GPR15也具7次跨膜结构域,其氨基酸序列与人、北美绿蜥蜴、小鼠具有约56%氨基酸序列一致性;共线性分析表明家鸡GPR15基因是人GPR15基因的直系同源基因。系统进化分析显示GPR15与GPR25和APLNR有较近的进化关系。尽管有研究发现小鼠和人GPR15L基因可以编码GPR15的配体(Suply et al., 2017),但是GPR15L基因在非哺乳类脊椎动物中似乎已消失,因此,在包括家鸡在内的非哺乳动物中,GPR15的配体仍待鉴定。同时,本研究小组最新研究结果表明,APLNR内源性配体Apelin和Apela肽可以激活GPR25(Zhang et al., 2018)。鉴于GPR15与GPR25具有较近的进化关系,亦初步探究了Apelin和Apela对家鸡GPR15的激活效应。结果表明Apelin和Apela不能激活表达于HEK293细胞中的家鸡GPR15,而在相同实验条件下,Apelin和Apela可以激活斑马鱼GPR25。因此,在非哺乳类脊椎动物中,GPR15的功能和内源性配体仍待鉴定。
qPCR分析发现,家鸡GPR15基因在脾脏中表达丰度最高,其次是盲肠、肺等。这与哺乳动物中的发现基本一致,如GPR15在人淋巴细胞中具有最高的表达水平,其次高表达于结肠和小肠等组织(Koks & Koks,2017),在脾脏亦能检测到较高的表达水平(Deng et al., 1997)。Western blot检测到GPR15蛋白可在人睾丸和肝脏中表达,而在大脑、胎盘、肺、子宫、心脏、胰腺或骨骼肌中无表达(Clayton et al., 2001)。在小鼠中,脾脏GPR15可与血栓调节素相互作用缓解败血症(Pan et al., 2017)。GPR15在家鸡脾脏中的高表达,提示其可能参与脾脏中的免疫反应。家鸡GPR15在盲肠组织中的表达结果与哺乳动物中的发现也一致(Deng et al., 1997)。在小鼠中,广谱抗生素治疗可降低肠道GPR15的表达量,推测GPR15可能在平衡肠道微生物菌群中发挥作用(Kim et al., 2013),至于GPR15是否在家鸡盲肠中发挥类似效应,值得关注和深入研究。
| 邓秋洋, 张剑南, 王亚军, 等. 2018. 家鸡似G蛋白偶联受体119基因的克隆与组织表达分析[J]. 四川动物, 37(1): 45–50. |
| 祝国强, 莫春横, 李正阳, 等. 2017. 家鸡G蛋白偶联受体161的基因克隆, 分子进化和组织表达[J]. 四川动物, 36(6): 632–638. |
| Cartwright A, Schmutz C, Askari A, et al. 2014. Orphan receptor GPR15/BOB is up-regulated in rheumatoid arthritis[J]. Cytokine, 67(2): 53–59. DOI:10.1016/j.cyto.2014.02.015 |
| Chng SC, Ho L, Tian J, et al. 2013. ELABELA:a hormone essential for heart development signals via the apelin receptor[J]. Developmental Cell, 27(6): 672–680. DOI:10.1016/j.devcel.2013.11.002 |
| Clayton F, Kotler DP, Kuwada SK, et al. 2001. Gp120-induced Bob/GPR15 activation:a possible cause of human immunodeficiency virus enteropathy[J]. American Journal of Pathology, 159(5): 1933–1939. DOI:10.1016/S0002-9440(10)63040-4 |
| Deng HK, Unutmaz D, KewalRamani VN, et al. 1997. Expression cloning of new receptors used by simian and human immunodeficiency viruses[J]. Nature, 388(6639): 296–300. DOI:10.1038/40894 |
| Heiber M, Marchese A, Nguyen T, et al. 1996. A novel human gene encoding a G-protein-coupled receptor (GPR15) is located on chromosome 3[J]. Genomics, 32(3): 462–465. DOI:10.1006/geno.1996.0143 |
| Kim SV, Xiang WV, Kwak C, et al. 2013. GPR15-mediated homing controls immune homeostasis in the large intestine mucosa[J]. Science, 340(6139): 1456–1459. DOI:10.1126/science.1237013 |
| Koks S, Koks G. 2017. Activation of GPR15 and its involvement in the biological effects of smoking[J]. Experimental Biology and Medicine (Maywood), 242(11): 1207–1212. DOI:10.1177/1535370217703977 |
| Lahl K, Sweere J, Pan J, et al. 2014. Orphan chemoattractant receptor GPR15 mediates dendritic epidermal T-cell recruitment to the skin[J]. European Journal of Immunology, 44(9): 2577–2581. DOI:10.1002/eji.201444628 |
| Lee DK, George SR, Evans JF, et al. 2001. Orphan G protein-coupled receptors in the CNS[J]. Current Opinion in Pharmacology, 1(1): 31–39. DOI:10.1016/S1471-4892(01)00003-0 |
| Mo CH, Huang L, Cui L, et al. 2017. Characterization of NMB, GRP and their receptors (BRS3, NMBR and GRPR) in chickens[J]. Journal of Molecular Endocrinology, 59(1): 61–79. DOI:10.1530/JME-17-0020 |
| Nguyen LP, Pan J, Dinh TT, et al. 2015. Role and species-specific expression of colon T cell homing receptor GPR15 in colitis[J]. Nature Immunology, 16(2): 207–213. DOI:10.1038/ni.3079 |
| Ocon B, Pan J, Dinh TT, et al. 2017. A mucosal and cutaneous chemokine ligand for the lymphocyte chemoattractant receptor GPR15[J]. Frontiers in Immunology, 8: 1111. DOI:10.3389/fimmu.2017.01111 |
| Pan B, Wang XM, Kojima S, et al. 2017. The fifth epidermal growth factor like region of thrombomodulin alleviates LPS-induced sepsis through interacting with GPR15[J]. Thrombosis and Haemostasis, 117(3): 570–579. DOI:10.1160/TH16-10-0762 |
| Patro R, Duggal G, Love MI, et al. 2017. Salmon provides fast and bias-aware quantification of transcript expression[J]. Nature Methods, 14(4): 417–419. DOI:10.1038/nmeth.4197 |
| Pauli A, Norris ML, Valen E, et al. 2014. Toddler:an embryonic signal that promotes cell movement via Apelin receptors[J]. Science, 343(6172): 1248636. DOI:10.1126/science.1248636 |
| Suply T, Hannedouche S, Carte N, et al. 2017. A natural ligand for the orphan receptor GPR15 modulates lymphocyte recruitment to epithelia[J]. Science Signaling, 10(496): eaal0180. DOI:10.1126/scisignal.aal0180 |
| Zhang J, Wan Y, Fang C, et al. 2018. The orphan G protein-coupled receptor 25 (GPR25) is activated by Apelin and Apela in non-mammalian vertebrates[J]. Biochemical and Biophysical Research Communications, 501(2): 408–414. DOI:10.1016/j.bbrc.2018.04.229 |
 2019, Vol. 38
2019, Vol. 38




