扩展功能
文章信息
- 李正阳, 张剑南, 陈军安, 李娟, 王亚军
- LI Zhengyang, ZHANG Jiannan, CHEN Jun'an, LI Juan, WANG Yajun
- 家鸡钠尿肽受体B基因的克隆和组织表达分析
- Molecular Cloning and Tissue Expression of Chicken Natriuretic Peptide Receptors B Gene
- 四川动物, 2018, 37(6): 653-659
- Sichuan Journal of Zoology, 2018, 37(6): 653-659
- 10.11984/j.issn.1000-7083.20180144
-
文章历史
- 收稿日期: 2018-05-03
- 接受日期: 2018-06-07
钠尿肽家族(natriuretic peptide system,NPs)是一类重要多肽家族,可参与调节神经传递、神经调节、免疫和生长等多种生理过程(Toop & Donald,2004),以及维持机体渗透稳态和心血管稳态。NPs由心房钠尿肽(atrial natriuretic peptide,ANP)、脑钠尿肽(brain natriuretic peptide,BNP)和C-型钠尿肽(C-type natriuretic peptide,CNP)3种结构相关多肽组成(Martinez-Rumayor et al., 2008;Nobata et al., 2010)。ANP和BNP主要在心肌细胞中合成,分泌进入血液循环发挥作用;而CNP则作为旁分泌或自分泌因子合成于大脑或其他外周组织,且具有远弱于ANP和BNP的利尿利钠作用(Takei,2000)。在哺乳动物中,CNP的生理功能包括调节长骨生长、促进软骨内骨化以及作用于血管平滑肌细胞发挥血管舒张作用等(Potter et al., 2006;Johnson & Olson,2008);此外,CNP可以作用于垂体细胞,促进胞内环磷酸腺苷(cGMP)的积累,抑制促性腺激素释放激素(GnRH)诱导的钙动员,抑制促肾上腺皮质激素释放激素(CRH)诱导的促肾上腺皮质激素(ACTH)释放等(Fowkes et al., 1999;Fowkes et al., 2000;Chatelain et al., 2003)。
NPs的生理功能依赖其特异性钠尿肽受体(natriuretic peptide receptors,NPRs)发挥效应。在哺乳动物中,NPRs可分为NPR-A、NPR-B和NPR-C 3种类型(Potter et al., 2006)。其中,不同于NPR-A(能够结合ANP和BNP)和NPR-C(能够结合3种类型的NPs),NPR-B只能选择性地结合CNP,并介导其生理功能,如,CNP或NPR-B敲除型小鼠由于软骨骨化功能受损,会表现出严重的侏儒症表型(Chusho et al., 2001;Tamura et al., 2004;Tsuji & Kunieda,2005)。NPR-B为单次跨膜受体,与NPR-A和NPR-C的氨基酸序列同源性分别为44%和30%,其N端的433个氨基酸位于细胞膜外,最初的22个氨基酸为信号肽序列。此外,N端还包含与CNP结合的重要位点Glu332以及参与形成3对二硫键的6个Cys残基和7个N糖基化位点(Ogawa et al., 2004)。C末端的252个氨基酸为鸟苷酸环化酶区域,该区域被认为具有鸟苷酸环化酶活性(Beavo & Brunton,2002),可以通过产生胞内第二信使cGMP从而介导CNP的生理效应(Pandey,2005;Sabbatini et al., 2005;Kobayashi et al., 2012)。
尽管在哺乳动物中,NPR-B的结构及其介导的生理功能已逐步明确,但在禽类中,有关NPR-B的研究几属空白。鉴于NPR-B介导的软骨骨化和垂体激素释放等生理功能与经济效益密切相关,本研究选择家鸡Gallus gallus domesticus为模型,首次从垂体组织中克隆得到了家鸡NPR-B基因,确定其氨基酸序列,在此基础上,利用实时荧光定量PCR(qPCR)技术首次探究NPR-B基因在成年家鸡中的组织表达图谱。本研究为探究家鸡NPR-B的胞内信号通路及其在家鸡中介导的生理功能奠定基础。
1 材料与方法 1.1 材料实验动物为罗曼粉成年家鸡,购自四川牧星养鸡场,共选取成年家鸡6只(3雄3雌);真核表达载体pcDNA3.1(+)购自Invitrogen;引物合成、DNA测序工作由成都擎科梓熙生物技术有限公司完成;RNAzol购自Molecular Research Center;KOD FX高保真DNA聚合酶购自TOYOBO;MMLV逆转录酶、dNTP、Easy-Taq酶、限制性内切酶和T4 DNA连接酶均购自TaKaRa;分子克隆宿主大肠杆菌Escherichia coli DH5α感受态细胞由本实验室制备保存;PCR仪(S1000 Thermal Cycler)、荧光定量PCR仪(CFX96)、荧光染料Eva Green、96孔板、塑料封膜均购自Bio-Rad。
1.2 方法 1.2.1 总RNA提取取家鸡组织,包括全脑、心脏、肾脏、肝脏、肌肉、卵巢、精巢、十二指肠、垂体、脾脏、脂肪、端脑、中脑、小脑、后脑和下丘脑等,迅速放入液氮并充分研磨成粉末。总RNA提取严格按照说明书操作:取约60 mg组织粉末与600 μL RNAzol混合;补充240 μL焦碳酸二乙酯(DEPC)灭菌水,用涡旋仪混匀约15 s;4 ℃、12 000 r·min-1离心15 min;取上清,加入3 μL阿司咪唑,涡旋15 s后于4 ℃、12 000 r·min-1离心10 min;取上清,加入等体积异丙醇,于4 ℃、12 000 r·min-1离心10 min;小心吸取上清并弃掉,加入75%乙醇漂洗总RNA沉淀,于4 ℃、8 000 r·min-1离心3 min;重复上一步,漂洗RNA沉淀;弃上清,用20 μL DEPC灭菌水溶解沉淀,及时构建cDNA模板或-80 ℃保存。
1.2.2 引物设计利用NCBI预测的家鸡NPR-B基因序列(GenBank登录号:XM_003642919)和家鸡的野生祖先红原鸡Gallus gallus基因组数据库信息(http://www.ensembl.org/Gallus_gallus),依据引物设计原则设计克隆家鸡NPR-B基因的编码区全长克隆引物和用于组织表达分析的qPCR引物(表 1)。
| 基因 Gene |
上游引物/下游引物 Sense/antisense |
序列5'-3' Sequences |
序列长度 Length/bp |
|
| 用于表达载体构建 | NPR-B | Sense | CCCAAGCTTAGGAGCCATCGCGGCCCATG | 3 235 |
| Antisense | CCGGAATTCCTCTTCTGGGCTCAGACAGCTT | |||
| 用于实时荧光定量PCR分析 | NPR-B | Sense | TACGCCATGGTGCTGAACG | 304 |
| Antisense | CATCCACATCAAAGACGCAG | |||
| β-actin | Sense | CCCAGACATCAGGGTGTGATG | 123 | |
| Antisense | GTTGGTGACAATACCGTGTTCAAT | |||
| 注:下划线表示引物设计时添加的限制性内切酶酶切位点 Note:Restriction sites added at the 5'-end of the primers are underlined | ||||
以各组织总RNA为模板进行逆转录构建cDNA模板。取2 μg总RNA样品,与1 μL Oligo-dT混合;补DEPC灭菌水至总体积5 μL(Oligo-dT终浓度为0.5 μg·μL-1),混匀;于PCR仪中70 ℃反应10 min后,立即取出放置于冰上10 min;加入2 μL5×RT buffer,0.5 μL MMLV逆转录酶,0.5 μL dNTPs,补充DEPC灭菌水至总体积10 μL,混匀后于PCR仪中42 ℃反应1.5 h,70 ℃反应10 min结束;取反应所得产物加入70 μL灭菌水,所得混合溶液即为cDNA模板。
1.2.4 载体构建以家鸡垂体组织cDNA为模板,使用引物对NPR-B基因的开放阅读框(ORF)进行扩增。PCR扩增体系:5 μL 2×KOD缓冲液,2 μL垂体组织cDNA模板,2 μL dNTPs,上、下游引物各0.1 μL,0.5 μL KOD-FX聚合酶,0.3 μL去离子灭菌水。PCR扩增条件:94 ℃预变性2 min;98 ℃变性10 s,62 ℃退火30 s,68 ℃延伸3 min,34个循环;68 ℃延伸10 min。取3 μL反应产物,用1%琼脂糖凝胶电泳检测PCR扩增结果。利用DNA纯化回收试剂盒回收PCR反应液,使用EcoR I 和Hind III 对pcDNA3.1质粒和纯化回收产物进行酶切,37 ℃过夜;纯化回收酶切产物,使用T4 DNA连接酶连接的pcDNA3.1和NPR-B片段;按常规方法转化感受态细胞,再涂于含氨苄青霉素、IPTG和X-Gal的LB培养基上37 ℃过夜培养,挑选阳性单克隆提取质粒,送成都擎科梓熙生物技术有限公司测序。
1.2.5 组织表达分析采用家鸡不同组织的cDNA模板,3只公鸡为雄性组,3只母鸡为雌性组,以qPCR方法检测NPR-B基因的表达水平,具体方法参考祝国强等(2017)和邓秋洋等(2018)。PCR扩增体系:0.4 μL二甲亚砜,2 μL 10×buffer,6 μL cDNA模板,0.4 μL dNTPs,上、下游引物各0.2 μL,1 μL荧光染料Eva Green,1 μL Easy-Taq酶,最后用去离子灭菌水补足总体积至20 μL。PCR扩增条件:94 ℃预变性2 min;94 ℃变性20 s,60 ℃退火15 s,72 ℃延伸20 s,39个循环,按照0.5 ℃/5 s的速度从70 ℃到95 ℃向上升温熔解,生成熔解曲线。荧光定量PCR的结果按照比较CT值法(2-ΔΔCT法)进行相对表达量数据处理。
1.2.6 生物信息学分析使用SnapGene、DNAStar和APE进行序列分析和蛋白质翻译,IBS 1.0绘制基因结构图,BioEdit和DNAMAN进行DNA和蛋白质序列比对,CFX Manager进行qPCR数据定量分析;序列分析使用的在线数据库包括GenBank(http://www.ncbi.nih.gov)、Ensembl(http://www.ensembl.org)和TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM)。
1.2.7 数据统计与分析实验数据用Graphpad Prism7进行分析,数据用平均值±标准差(Mean±SD)表示,相同组织在雄性组和雌性组之间的比较用t检验,P<0.05表示差异有统计学意义。
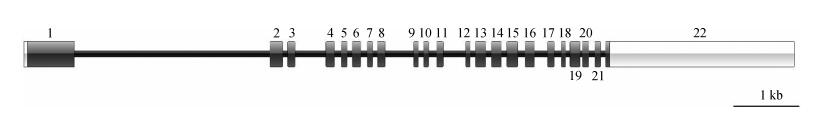
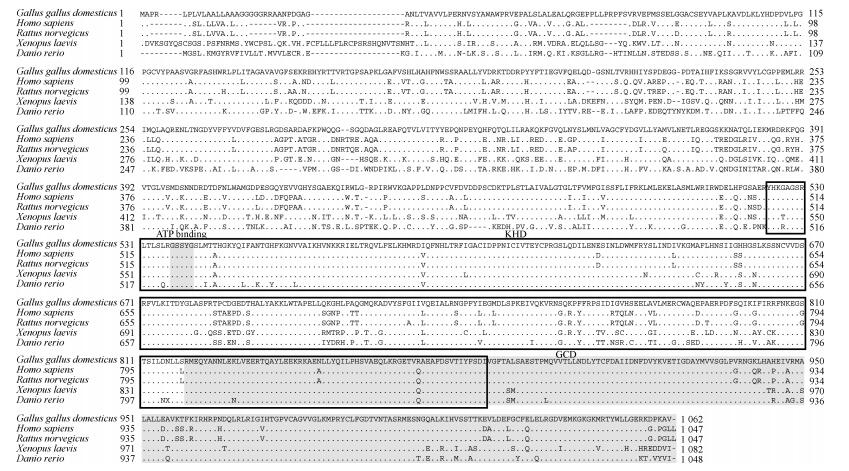
2 结果 2.1 家鸡NPR-B基因的克隆与序列分析实验成功扩增得到与预期大小一致的NPR-B基因条带(图 1)。将家鸡NPR-B基因的测序结果与红原鸡基因组序列进行比对,结果显示:家鸡NPR-B基因位于Z染色体上,包含22个外显子(图 2),编码区cDNA全长3 189 bp,编码1 062个氨基酸(GenBank登录号:MH271322)。家鸡的NPR-B与人Homo sapiens、大鼠Rattus norvegicus、非洲爪蟾Xenopus laevis和斑马鱼Danio rerio相比,氨基酸序列一致性分别达到了79%、78%、73%和67%。胞内区(intracellular domain,ICD)存在高度保守的结构域,包括无激酶活性的激酶同源区(kinase homology domain,KHD)和鸟苷酸环化酶区(guanylyl cyclase domain,GCD),且KHD中存在NPR-A和NPR-B均具有的保守的ATP结合元件Gly-X-X-X-Gly序列(图 3)。

|
| 图 1 家鸡NPR-B基因扩增 Fig. 1 PCR amplification of NPR-B gene from Gallus gallus domesticus |
| |
|
| 图 2 家鸡NPR-B基因结构 Fig. 2 Structure of NPR-B gene from Gallus gallus domesticus 方框代表外显子,黑色阴影部分代表编码区 Boxes indicate exons, black shaded parts indicate the coding regions |
| |
|
| 图 3 家鸡NPR-B的氨基酸序列与人、大鼠、非洲爪蟾和斑马鱼比对 Fig. 3 Amino acid sequence alignment of Gallus gallus domesticus NPR-B with that of Homo sapiens, Rattus norvegicus, Xenopus laevis and Danio rerio 方框内部分为激酶同源区,阴影部分为ATP结合位点和鸟苷酸环化酶区 Boxes indicate the kinase homology domain, shaded areas are ATP binding site and the guanylyl cyclase domain |
| |
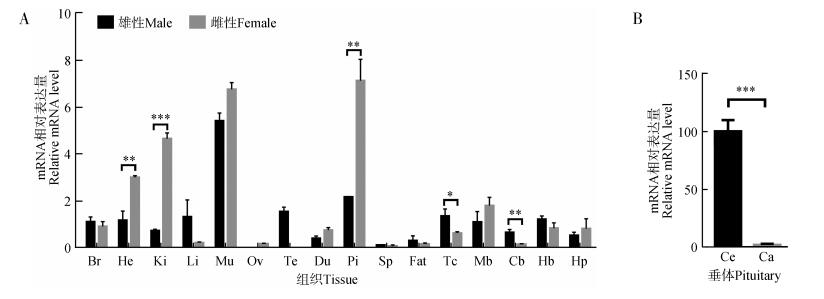
在外周组织中,NPR-B基因高表达于心脏、肌肉、肾脏和垂体,而在精巢、十二指肠的表达量相对较低,在脂肪、脾脏检测到微弱的表达信号;在中枢神经系统中,NPR-B基因高表达于中脑,在其他脑功能区的表达水平较低。
NPR-B基因位于家鸡Z染色体上,因此,基因组中雄、雌性的NPR-B基因拷贝数比例为2: 1。比较不同性别组中NPR-B基因的组织表达情况(图 4:A),结果显示,雄性个体NPR-B基因在端脑和小脑中具有更高的表达水平,而雌性个体NPR-B基因在心脏、肾脏和垂体组织中具有更高的表达水平。
NPR-B基因在垂体中具有较高的表达水平,检测其在垂体头部和尾部的表达,结果显示,NPR-B基因特异性高表达于垂体头部(图 4:B)。
|
| 图 4 家鸡NPR-B基因组织表达 Fig. 4 Expression of NPR-B gene in the tissues of Gallus gallus domesticus A. qPCR检测NPR-B基因mRNA在家鸡各组织中的表达(以β-actin基因作为内参,n=3),Br.全脑,He.心脏,Ki.肾脏,Li.肝脏,Mu.肌肉,Ov.卵巢,Te.精巢,Du.十二指肠,Pi.垂体,Sp.脾脏,Fat.脂肪,Tc.端脑,Mb.中脑,Cb.小脑,Hb.后脑,Hp.下丘脑;B. qPCR检测NPR-B基因在家鸡垂体头部(Ce)和尾部(Ca)的分布情况(以β-actin基因作为内参,n=6);*P<0.05,**P<0.01,***P<0.001 A. Expression of NPR-B gene in chicken tissues as determined by qPCR (the mRNA levels of NPR-B were normalized to those of β-actin, n=3), Br. whole brain, He. heart, Ki. kidney, Li. liver, Mu. muscle, Ov. ovary, Te. testis, Du. duodenum, Pi. pituitary, Sp. spleen, Fat. fat, Tc. telencephalon, Mb. midbrain, Cb. cerebellum, Hb. hindbrain, Hp. hypothalamus; B. qPCR detection of NPR-B mRNA distribution in cephalic lobe (Ce) and caudal lobe (Ca) of chicken pituitary (the mRNA levels of NPR-B were normalized to those of β-actin, n=6); *P < 0.05, **P < 0.01, ***P < 0.001 |
| |
在哺乳动物中,CNP作为旁分泌或自分泌因子,通过激活NPR-B参与调节神经系统功能、血管张力、成骨细胞分裂分化以及软骨骨化等功能(Potter et al., 2006),但其在禽类中的研究十分欠缺。本研究从家鸡垂体组织中克隆得到NPR-B基因,并首次报道其序列和组织表达图谱,研究结果为探究NPR-B受体及其配体CNP在家鸡中的生理功能奠定基础。
家鸡NPR-B基因的cDNA序列全长3 189 bp,由22个外显子组成,编码具1 062个氨基酸的蛋白。氨基酸序列比对显示,家鸡NPR-B与人、大鼠、非洲爪蟾和斑马鱼均具有较高的序列一致性,尤其是ICD的氨基酸序列高度保守,该区域包含的位点有助于NPR-B二聚化及结合配体后的空间构象改变。在受体激活后,ATP将结合到胞内KHD上的ATP结合位点,活化的KHD进一步激活下方的鸟苷酸环化酶,从而催化胞内cGMP的生成(Joubert et al., 2005),这预示着NPR-B在家鸡中具有与哺乳动物类似的信号通路。
本研究利用qPCR解析NPR-B基因在家鸡组织中的表达。结果显示,NPR-B基因在家鸡心脏、肾脏、肌肉、中脑和垂体中有较高表达水平,在精巢、十二指肠中表达量相对较低。此外,雌、雄性个体相同组织间NPR-B基因的表达水平有差异,这种差异是否与NPR-B基因位于Z染色体有关有待后续研究。NPR-B基因在心脏中的高表达预示其可能参与CNP调节血管张力的生理功能(Toop & Donald,2004);其在脑和垂体中的高表达与大鼠中的研究结果高度一致(Langub et al., 1995),暗示NPR-B在脑和垂体中具有保守的生理功能。同时,进一步检测了NPR-B基因在家鸡垂体头部和尾部的表达差异,发现NPR-B基因特异性高表达于家鸡垂体头部区域,该区域垂体细胞主要分泌2种关键垂体激素:ACTH和催乳素。在小鼠中的研究发现,CNP在生理浓度下可以抑制由CRH引起的垂体ACTH释放(Guild & Cramb,1999),结合NPR-B在家鸡垂体头部的特异性分布,本研究暗示家鸡CNP/NPR-B系统可能参与调控家鸡垂体激素(ACTH或催乳素)的释放,进而影响家鸡应激或繁殖,值得深入探究。
| 邓秋洋, 张剑南, 王亚军, 等. 2018. 家鸡似G蛋白偶联受体119基因的克隆与组织表达分析[J]. 四川动物, 37(1): 45–50. |
| 祝国强, 莫春横, 李正阳, 等. 2017. 家鸡G蛋白偶联受体161的基因克隆、分子进化和组织表达[J]. 四川动物, 36(6): 632–638. |
| Beavo JA, Brunton LL. 2002. Cyclic nucleotide research-still expanding after half a century[J]. Nature Reviews: Molecular Cell Biology, 3(9): 710–718. DOI:10.1038/nrm911 |
| Chatelain D, Lesage J, Montel V, et al. 2003. Effect of natriuretic peptides on in vitro stimulated adrenocorticotropic hormone release and pro-opiomelanocortin mRNA expression by the fetal rat pituitary gland in late gestation[J]. Hormone Research in Paediatrics, 59(3): 142–148. DOI:10.1159/000069068 |
| Chusho H, Tamura N, Ogawa Y, et al. 2001. Dwarfism and early death in mice lacking C-type natriuretic peptide[J]. Proceedings of the National Academy of Sciences of the United States of America, 98(7): 4016–4021. DOI:10.1073/pnas.071389098 |
| Fowkes RC, Forrest-Owen W, Williams B, et al. 1999. C-type natriuretic peptide (CNP) effects on intracellular calcium[Ca2+]i in mouse gonadotrope-derived αT3-1 cell line[J]. Regulatory Peptides, 84(1-3): 43–49. DOI:10.1016/S0167-0115(99)00066-X |
| Fowkes RC, Forrest-Owen W, Mcardle CA. 2000. C-type natriuretic peptide (CNP) effects in anterior pituitary cell lines: evidence for homologous desensitisation of CNP-stimulated cGMP accumulation in alpha T3-1 gonadotroph-derived cells[J]. Journal of Endocrinology, 166(1): 195–203. DOI:10.1677/joe.0.1660195 |
| Guild SB, Cramb G. 1999. Characterisation of the effects of natriuretic peptides upon ACTH secretion from the mouse pituitary[J]. Molecular and Cellular Endocrinology, 152(1-2): 11–19. DOI:10.1016/S0303-7207(99)00068-4 |
| Johnson KR, Olson KR. 2008. Comparative physiology of the piscine natriuretic peptide system[J]. General and Comparative Endocrinology, 157(1): 21–26. DOI:10.1016/j.ygcen.2008.03.026 |
| Joubert S, Jossart C, Mcnicoll N, et al. 2005. Atrial natriuretic peptide-dependent photolabeling of a regulatory ATP-binding site on the natriuretic peptide receptor-A[J]. FEBS Journal, 272(21): 5572–5583. DOI:10.1111/ejb.2005.272.issue-21 |
| Kobayashi D, Yamaguchi N, Takahashi O, et al. 2012. Human atrial natriuretic peptide treatment for acute heart failure: a systematic review of efficacy and mortality[J]. Canadian Journal of Cardiology, 28(1): 102–109. DOI:10.1016/j.cjca.2011.04.011 |
| Langub M, Dolgas C, Watson R, et al. 1995. The C-type natriuretic peptide receptor is the predominant natriuretic peptide receptor mRNA expressed in rat hypothalamus[J]. Journal of Neuroendocrinology, 7(4): 305–309. DOI:10.1111/jne.1995.7.issue-4 |
| Martinez-Rumayor A, Richards AM, Burnett JC, et al. 2008. Biology of the natriuretic peptides[J]. American Journal of Cardiology, 101(3A): 3–8. |
| Nobata S, Ventura A, Kaiya H, et al. 2010. Diversified cardiovascular actions of six homologous natriuretic peptides (ANP, BNP, VNP, CNP1, CNP3, and CNP4) in conscious eels[J]. American Journal of Physiology: Regulatory, Integrative and Comparative Physiology, 298(6): R1549–R1559. DOI:10.1152/ajpregu.00789.2009 |
| Ogawa H, Qiu Y, Ogata CM, et al. 2004. Crystal structure of hormone-bound atrial natriuretic peptide receptor extracellular domain: rotation mechanism for transmembrane signal transduction[J]. Journal of Biological Chemistry, 279(27): 28625–28631. DOI:10.1074/jbc.M313222200 |
| Pandey KN. 2005. Physiology of natriuretic peptides and their receptors[J]. Peptides, 26(6): 901–932. DOI:10.1016/j.peptides.2004.09.024 |
| Potter LR, Abbey-Hosch S, Dickey DM. 2006. Natriuretic peptides, their receptors, and cyclic guanosine monophosphate-dependent signaling functions[J]. Endocrine Reviews, 27(1): 47–72. |
| Sabbatini ME, Rodriguez MR, Corbo NS, et al. 2005. C-type natriuretic peptide applied to the brain enhances exocrine pancreatic secretion through a vagal pathway[J]. European Journal of Pharmacology, 524(1-3): 67–74. DOI:10.1016/j.ejphar.2005.09.015 |
| Takei Y. 2000. Structural and functional evolution of the natriuretic peptide system in vertebrates[J]. International Review of Cytology, 194(194): 1–66. |
| Tamura N, Doolittle LK, Hammer RE, et al. 2004. Critical roles of the guanylyl cyclase B receptor in endochondral ossification and development of female reproductive organs[J]. Proceedings of the National Academy of Sciences of the United States of America, 101(49): 17300–17305. DOI:10.1073/pnas.0407894101 |
| Toop T, Donald JA. 2004. Comparative aspects of natriuretic peptide physiology in non-mammalian vertebrates: a review[J]. Journal of Comparative Physiology B: Biochemical, Systemic, and Environmental Physiology, 174(3): 189–204. DOI:10.1007/s00360-003-0408-y |
| Tsuji T, Kunieda T. 2005. A loss-of-function mutation in natriuretic peptide receptor 2 (Npr2) gene is responsible for disproportionate dwarfism in cn/cn mouse[J]. Journal of Biological Chemistry, 280(14): 14288–14292. DOI:10.1074/jbc.C500024200 |
 2018, Vol. 37
2018, Vol. 37




