扩展功能
文章信息
- 张敬梅, 顾以韧, 李江淩, 陈晓晖, 曾凯, 吕学斌, 高荣
- ZHANG Jingmei, GU Yiren, LI Jiangling, CHEN Xiaohui, ZENG Kai, LYU Xuebin, GAO Rong
- 乌金猪、青峪猪和成华猪免疫器官与组织Toll样受体和抗菌肽基因表达比较研究
- Comparison of Gene Expression of Toll-Like Receptors and Antimicrobial Peptides in the Immune Organs and Tissues of Wujin Pig, Qingyu Pig and Chenghua Pig
- 四川动物, 2018, 37(5): 525-532
- Sichuan Journal of Zoology, 2018, 37(5): 525-532
- 10.11984/j.issn.1000-7083.20180086
-
文章历史
- 收稿日期: 2018-03-13
- 接受日期: 2018-07-04
2. 四川省畜牧科学研究院, 成都 610066
2. Sichuan Academy of Animal Science, Chengdu 610066, China
中国是世界上最大的猪肉生产国和消费国,随着养猪业规模化与集约化程度的不断提高,各种细菌和病毒传染性疾病经常发生和流行,不仅严重危害我国养猪业的可持续发展和经济效益,也威胁人民公共卫生和食品安全。猪Sus scrofa domesticus的病原微生物种类多、变异快,导致疫苗和新药研发成本高,防治效果受限。因此,培育抗病新猪种是目前解决猪病危害、提高养猪业经济效益和保障公共卫生与食品安全经济高效的新途径。
Toll样受体(toll-like receptors,TLRs)是1997年发现的介导天然免疫和获得性免疫的病原模式识别受体家族,通过启动天然免疫反应和激发适应性免疫反应的信号传导,在宿主防御微生物病原体感染过程中发挥作用(Shao et al., 2016)。TLRs属于病原相关分子模式(pattern-associated molecular patterns,PAMPs)的识别受体,通过与病原的固有分子结合、激发信号转导作用,诱导趋化因子和细胞因子的分泌,发挥先天免疫作用,并激活一系列适应性免疫反应(Kawai & Akira,2010;Zaidi et al., 2016)。研究表明,TLRs是机体天然免疫系统的重要组成部分,在机体抗感染免疫中起着非常重要的作用(何小兵等,2011;Thakur et al., 2015)。TLRs能识别不同的PAMPs,包括脂多糖、双链RNA病毒、脂蛋白、细菌CpG DNA及肽聚糖等(Leifer & Medvedev,2016;Lu et al., 2018)。根据TLRs在细胞内的定位分为2个亚家族:细胞膜表面的TLR1、TLR2、TLR4、TLR5、TLR6、TLR11和细胞内膜的TLR3、TLR7、TLR8、TLR9(Yu & Feng,2018)。不同的TLRs识别不同的配体:细胞膜表面的TLRs主要识别病原的膜成分;TLR2与TLR1或TLR6形成异源二聚体,识别革兰氏阳性菌的肽聚糖和磷壁酸;TLR4识别革兰氏阴性菌表面的脂多糖;TLR5识别细菌的鞭毛蛋白;TLR11识别一些尿道细菌;细胞内膜的TLR3、TLR7、TLR8、TLR9主要识别病毒核酸成分(Hajishengallis & Lambris,2016)。养猪业常见的病毒性疾病包括猪瘟、口蹄疫、蓝耳病等,这些病毒属于单链RNA病毒。
抗菌肽是生物体内诱导产生的一种具有生物活性的小分子多肽,是抵御外界有害微生物或病毒入侵的重要屏障,也是生物体先天性免疫系统的重要组成部分(Andreu & Rivas,2015;Bechinger & Gorr,2017),在哺乳动物体内主要有防御素和Cathelicidin两大抗菌肽家族(宴家友等,2013)。有关猪源抗菌肽的研究较全面:β-防御素1(poricine-β-defensin 1,pBD-1)是广泛分布于呼吸道、消化道、胸腺、脾脏等组织内的一类活性多肽(江学斌等,2016),通过作用于病原体的细胞膜发挥抗菌作用,不会诱发细菌耐药性,具有广谱抗细菌、抗真菌及抗病毒活性,参与组成机体的先天性免疫系统,在抗感染中发挥重要作用(Aono et al., 2006;Pruthviraj et al., 2016);PR-39是Cathecilidin家族中富含脯氨酸和精氨酸的小分子肽,具有较强的抗菌、抗病毒活性,对革兰氏阴性菌和部分革兰氏阳性菌具有很好抑菌效果,在动物机体先天免疫和抗感染免疫方面也发挥重要作用(Chen et al., 2015;卢顺等,2015)。
张敬梅等:乌金猪、青峪猪和成华猪免疫器官与组织Toll样受体和抗菌肽基因表达比较研究成华猪是四川省著名的地方优良猪种,是四川推广数量较多、覆盖地域较广的地方猪种,具有早熟易肥、肌纤维较短等优点,但也有生长周期长、养殖期耗料高等缺点。乌金猪具有耐粗饲、适应性强、肉质优良、抗逆性强及肌内脂肪丰富等优良性状,但繁殖力低、生长慢、瘦肉率低。青峪猪作为四川省通江县的地方猪种之一,具有耐粗性好、繁殖力强、适应性强、肉味香浓、口感细腻等优点。约克夏猪是我国引进的国外猪种,具有繁殖力高、生长快、瘦肉率高等优点,但抗病力和耐逆性较我国地方猪种弱(吴圣龙等,2008)。
虽有一些文献报道了不同猪种TLRs、pBD-1和PR-39的表达水平(安沙等,2011;高彦华,2014;Holani et al., 2016),但目前尚无成华猪、乌金猪和青峪猪先天免疫分子特征的研究报道,因此,本实验通过实时荧光定量PCR检测TLRs(TLR1、TLR2、TLR4、TLR7、TLR9)、pBD-1和PR-39 mRNA在成华猪、乌金猪、青峪猪和约克夏猪的5种免疫器官和组织(胸腺、脾脏为系统免疫器官,扁桃体、肠系膜淋巴结为消化道局部免疫组织,肺门淋巴结为呼吸道局部免疫组织)中的表达差异,旨在揭示这些地方猪种之间TLRs和抗菌肽基因表达水平与约克夏猪的差异及特点,有助于从先天免疫分子层面深入阐明地方猪种抗病力较强的分子基础,为今后利用地方猪种杂交培育抗病品系和筛选抗病分子标记提供科学依据和指导。
1 材料与方法 1.1 实验动物与采样实验用成华猪、乌金猪、青峪猪和约克夏猪来自四川省畜牧科学研究院简阳种猪场,同组实验猪均为同品种不同窝的母猪(非半同胞,父母不同),各组实验猪采用相同营养水平和饲喂方式,饲养管理条件相同,8月龄时地方猪种体质量75~90 kg,约克夏猪125~135 kg。每组随机选取5头健康个体屠宰,取胸腺、脾脏、扁桃体、肠系膜淋巴结和肺门淋巴结样品,无菌生理盐水漂洗,迅速剪切后于液氮中速冻,-80 ℃保存。
1.2 总RNA的提取及cDNA的合成RNA提取试剂用Trizol(TaKaRa),组织样品100 mg,剪碎,加1 mL 1×磷酸缓冲盐溶液(PBS)(成都奥克生物公司),使用TL2010S中通量组织研磨破碎仪(北京鼎昊源科技有限公司)研磨组织,12 000 r·min-14 ℃离心4 min;吸取上清0.2 mL,加入0.8 mL Trizol,剧烈震荡,静置10 min;加0.2 mL氯仿,剧烈振荡15 s,室温静置10 min,12 000 r·min-1 4 ℃离心15 min;吸取上清液0.4 mL转入新的EP管中,加入-20 ℃预冷15 min的异丙醇0.4 mL,混匀,室温静置10 min,12 000 r·min-1 4 ℃离心15 min;弃上清,加入1 mL 75%乙醇洗涤,7 500 r·min-1 4 ℃离心6 min,弃上清,干燥后加入30 μL无酶水溶解。用1%琼脂糖凝胶电泳检测总RNA的完整性,核酸分析仪NanoDrop2000(Thermo,美国)检测总RNA的浓度和纯度。第一链cDNA的合成参照反转录试剂盒TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix(TransGen Biotech,北京)说明书进行。
1.3 引物设计与合成根据GenBank中报道的基因序列,使用Primer Premier 5.0设计实时荧光定量PCR引物,其中,肽基脯氨酰异构酶A(peptidylprolyl isomer-ase A,PPIA)为内参基因,引物序列及退火温度见表 1。
| 基因 | GenBank登录号 | 引物序列(5’-3’) | 退火温度/℃ |
| PPIA | NM_214353 | F:AGACAGCAGAAAACTTCCGTG R:ACTTGCCACCAGTGCCATTA |
52.0 |
| TLR1 | NM_001031775 | F:TTAGGAGACTCTTACGGGGAA R:ATTTACTGCGGTGCTGACTGA |
58.8 |
| TLR2 | NM_213761 | F:TGCTGCAAGGTCAACTCTCT R:CAGCAGGGTCACAAGACAGA |
52.0 |
| TLR4 | NM_001113039 | F:ATATGGCAGAGGTGAAAGCAC R:GAAGGCAGAGATGAAAAGGGG |
59.1 |
| TLR7 | NM_001097434 | F:ATAGCGAGCATCACTCCAGCC R:TAATCTGCTGCCTTCTGGTGC |
62.5 |
| TLR9 | NM_213958 | F:ACAATGACATCCATAGCCGAGT R:CAGATCGTTGCCGCTAAAGT |
59.1 |
| pBD-1 | NM_213838 | F:CCTGTGCCAGGTCTACTAAAAAAC R:GCCGATCTGTTTCATCTTTGG |
64.0 |
| PR-39 | NM_214450.1 | F:CAAGGCCACCTCCGTTTT R:CCACTCCATCACCGTTTTCC |
54.8 |
以PPIA为内参基因,在Bio-Rad IQ5实时荧光定量PCR仪(Bio-Rad,美国)上进行实时荧光定量PCR。扩增体系如下:3 μL模板cDNA,上、下游引物各0.5 μL,7.5 μL 2×SsoAdvanced Universal SYBR Green Supermix,加水补至15 μL。反应条件:95 ℃预变性30 s;95 ℃变性5 s,按表 1中所列的退火温度退火/延伸30 s,读板收集荧光,共40个循环;最后从65 ℃开始以每秒0.5 ℃递增至95 ℃进行熔解曲线特异性分析。每个样品重复3次,同时设置无模板对照。
1.5 基因片段扩增效率的比较以PCR产物为模板进行10倍浓度梯度稀释(10-1~10-7),对所有引物进行实时定量PCR反应,输入浓度梯度的数值,由Bio-Rad IQ5根据反应所得数据作出标准曲线,并得到相应的扩增效率(E)和可信度(R2)。
1.6 数据处理与分析结果以PPIA为内参基因,以约克夏猪的组织作为对照组,用2-△△Ct法进行相对定量,数据用平均值±标准误(Mean±SE)表示。数据使用Grapad Prism 6.01,各组织间的基因表达采用Two-Way ANOVA分析,并用Tukey法进行多重比较,显著性水平设置为α=0.05。
2 结果 2.1 总RNA的纯度与完整性RNA纯度检测结果显示,样品的A260/280为1.9~2.1,A260/230为2.0~2.5,说明RNA提取的质量较高。提取的各组织总RNA经1%琼脂糖凝胶电泳,28S、18S和5.8S条带均清晰可见,说明提取的RNA完整性较好,符合实验要求。
2.2 实时荧光定量PCR引物特异性及扩增效率从实时荧光定量PCR产物熔解曲线可以看出,各基因的熔解曲线均为单峰,无引物二聚体及非特异性产物形成。标准曲线分析结果表明,所有引物对经优化退火温度后基因扩增效率均接近100%,可信度高(R2>0.98),表明该体系可用2-△△Ct法进行相对定量。
2.3 TLRs mRNA的表达比较由图 1可知,成华猪胸腺中TLR7,脾脏中TLR4、TLR7,肠系膜淋巴结中TLR4、TLR9,肺门淋巴结中TLR1、TLR4、TLR7、TLR9 mRNA表达水平显著高于其他猪种(P<0.05);乌金猪胸腺中TLR1、TLR9,扁桃体中TLR1、TLR2、TLR4、TLR7、TLR9和肠系膜淋巴结中TLR7 mRNA表达水平显著高于其他猪种(P<0.05)。

|
| 图 1 实验猪免疫器官组织中TLRs mRNA的表达水平比较 Fig. 1 Comparison of the mRNA expression levels of TLRs in the immune organs and tissues of experimental pigs 不同字母表示组间数据的差异有统计学意义(P<0.05);下图同 Different letters indicate there is a significant difference between groups (P < 0.05); the same below |
| |
由图 2可知,成华猪胸腺中PR-39 mRNA表达水平显著高于其他猪种(P<0.05);乌金猪扁桃体中pBD-1 mRNA表达水平显著高于其他猪种(P<0.05);青峪猪扁桃体、肠系膜淋巴结中PR-39 mRNA表达水平显著高于其他猪种(P<0.05);约克夏猪脾脏、肺门淋巴结中pBD-1和PR-39 mRNA表达水平显著高于其他猪种(P<0.05)。
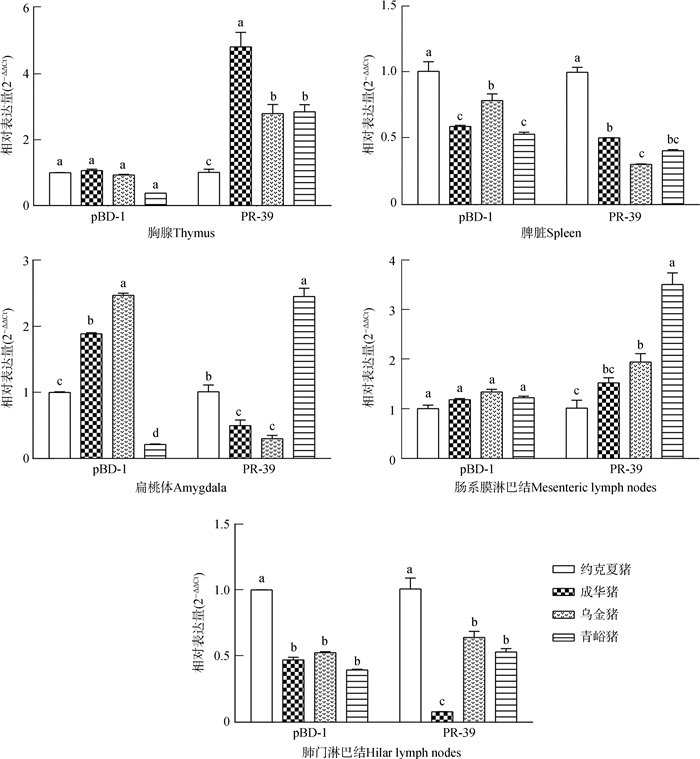
|
| 图 2 实验猪不同免疫器官组织中pBD-1和PR-39 mRNA的表达水平比较 Fig. 2 Comparison of the expression levels of pBD-1 and PR-39 mRNA in the immune organs and tissues of experimental pigs |
| |
先天性免疫系统是动物抵御病原入侵的第一道防线,PAMPs是先天性免疫的重要组成部分,在机体抵抗外界微生物入侵中起着重要的防御作用。TLR1、TLR2、TLR7、TLR9介导MyD88依赖性信号途径;TLR4既可介导MyD88依赖途径,也可介导TRIF依赖途径。TLR7识别人工合成核酸的类似物以及来自单链病毒的ssRNA和siRNA,当宿主受到病原菌侵袭时,通过激活MyD88依赖的信号转导通路产生Ⅰ型干扰素和炎症细胞因子发挥抗病毒效应(Du et al., 2016;Petes et al., 2017);抗菌肽作为动物先天性免疫系统的重要防御物质,具有广谱抗菌活性和抗肿瘤、抗病毒等生物活性。本文选择了成华猪、乌金猪、青峪猪和约克夏猪的5种免疫器官和组织(胸腺、脾脏、扁桃体、肠系膜淋巴结、肺门淋巴结)进行了TLRs和抗菌肽基因mRNA的表达研究。
动物胸腺是免疫系统的中枢器官,在机体免疫,特别是在细胞免疫的演化、成熟和功能调节中起决定性作用,是参与免疫系统调控的主要内分泌腺;在T细胞的分化、发育、选择和成熟过程中起关键作用,可促进T细胞发育成熟,表达不同的分化抗原,经胸腺选择后获得主要组织相容性复合体限制性(Sinkora & Butler,2009),维持机体正常的免疫平衡(龚非力,2000)。脾脏作为外周免疫器官,是机体最大的免疫器官,含有大量的淋巴细胞和巨噬细胞,是机体细胞免疫和体液免疫的中心(Cesta,2006)。本实验发现,成华猪胸腺TLR7、PR-39 mRNA,脾脏TLR4、TLR7 mRNA表达水平较高,说明成华猪免疫器官的先天免疫水平明显强于其他猪种;乌金猪胸腺中TLR1、TLR9 mRNA表达水平较高,表明乌金猪胸腺在先天免疫和抗感染免疫方面发挥重要作用。
扁桃体位于消化道和呼吸道入口的交会处,是机体第一道防线的重要组成部分,在抵御外界病原微生物的入侵中发挥着重要的作用。猪pBD-1 mRNA在舌和口腔黏膜高转录水平有利于黏膜和系统性防御(Qi et al., 2009;Jiao et al., 2017)。肠系膜淋巴结作为肠道相关淋巴组织中的一个重要组分,是机体免疫系统与外来抗原以及微生物较早接触的免疫器官,同时也是较早发生免疫反应的器官(Teixeira et al., 2013;张秀林等,2017)。PR-39 mRNA在肠系膜淋巴结中的表达差异可能与肠道内多种病原微生物的聚集有关。pBD-1不仅在模拟生理条件下抗菌效果明显,而且与PR-39等Cathelicidin家族抗菌肽协同抗菌和抗病毒的作用非常显著,在机体先天性免疫和获得性免疫中发挥一定的免疫调节作用(Yang et al., 2001;Sang et al., 2006)。有报道表明,咽鼓管扁桃体表达TLRs(Lesmeister et al., 2006),在天然免疫中发挥着重要作用(Mansson et al., 2006),同时在机体抵抗外界病原微生物的应答中也发挥着重要作用。乌金猪扁桃体中TLR1、TLR2、TLR4、TLR7、TLR9、pBD-1和肠系膜淋巴结中TLR7 mRNA表达水平均高于其他猪种,表明其消化道局部黏膜先天性免疫具有优势。TLRs可识别病原微生物模式分子,参与诱导调控哺乳动物上皮细胞分泌抗菌肽杀死入侵机体的有害微生物(全佳慧等,2016)。成华猪肠系膜淋巴结中TLR4、TLR9 mRNA有较高的表达水平,说明成华猪肠系膜淋巴结通过PAMPs识别特定的病原微生物发挥特定的先天性免疫水平较高。青峪猪扁桃体和肠系膜淋巴结中PR-39 mRNA有较高的表达水平,表明其在抗菌及抗病毒等方面具有优势。成华猪肺门淋巴结中TLR1、TLR4、TLR7、TLR9 mRNA有较高的表达水平,表明在成华猪肺门淋巴结中通过抗原递呈,借助TLRs识别PAMPs,激活宿主的先天性免疫应答反应,抵抗病原微生物的感染(Ignacio et al., 2005;Holt et al., 2008;Kuzemtseva et al., 2014)。
呼吸道和消化道是各种致病微生物进入机体的主要通道,很多病原微生物由此侵害宿主,导致机体发病(Kirstilä et al., 1996)。上述结果表明,地方猪种相关局部免疫器官组织中TLRs高表达有助于机体发挥较强的先天性免疫反应,抵抗入侵的病原微生物,这为不同品种猪对于同一病原表现出不同抵抗力或敏感性提供了理论依据。
综上所述,成华猪TLRs基因在系统免疫、消化道、呼吸道局部免疫组织以及PR-39基因在胸腺中高表达,表明成华猪在先天性免疫应答及抗病能力方面具有优势。乌金猪TLRs基因在系统免疫器官、消化道局部免疫组织和pBD-1基因在扁桃体中高表达,表明其消化道有较强的先天免疫抗感染机能。本实验揭示了地方猪种TLRs和抗菌肽基因在免疫器官组织中的表达水平及特点,可为利用地方猪种杂交选育抗病力强的新品种提供有益的线索和依据。
| 安沙, 韩菲菲, 高彦华, 等. 2011. β-防御素在金华猪和长白猪肠道中表达规律的研究[J]. 动物营养学报, 23(10): 1762–1768. DOI:10.3969/j.issn.1006-267x.2011.10.016 |
| 高彦华. 2014.猪抗菌肽PR-39的表达特性和调控及免疫调节机制研究[D].杭州: 浙江大学. http://cdmd.cnki.com.cn/Article/CDMD-10335-1014266819.htm |
| 龚非力. 2000. 医学免疫学[M]. 北京: 科学出版社: 4. |
| 何小兵, 房永祥, 贾怀杰, 等. 2011. Toll样受体介导的先天性抗病毒免疫反应研究进展[J]. 细胞与分子免疫学杂志, 27(6): 709–712. |
| 江学斌, 陈嘉蔚, 杨军, 等. 2016. 猪源抗菌肽PBD-1在毕赤酵母中的表达及鉴定[J]. 中国畜牧兽医, 43(3): 644–649. |
| 卢顺, 高其双, 刘武, 等. 2015. 猪PBD-1在4种器官组织中的表达[J]. 当代畜牧, 24: 63–65. |
| 全佳慧, 姜宁, 张爱忠, 等. 2016. Toll样受体及其对肠粘膜免疫的调节作用[J]. 动物营养学报, 28(1): 43–49. DOI:10.3969/j.issn.1006-267x.2016.01.007 |
| 吴圣龙, 包文斌, 鞠慧萍, 等. 2008. 野猪和16个国内外猪种Mx1基因第14外显子多态性分析[J]. 畜牧兽医学报, 39(3): 257–261. DOI:10.3321/j.issn:0366-6964.2008.03.001 |
| 宴家友, 张纯, 唐凌, 等. 2013. 抗菌肽PG的研究进展[J]. 中国畜牧兽医, 40(7): 195–197. DOI:10.3969/j.issn.1671-7236.2013.07.047 |
| 张秀林, 魏小兵, 欧长波, 等. 2017. 益生菌发酵饲料对仔猪生长和免疫功能影响的研究进展[J]. 中国畜牧兽医, 44(2): 476–481. |
| Andreu D, Rivas L. 2015. Animal antimicrobial peptides:an overview[J]. Biopolymers, 47(6): 415–433. |
| Aono S, Li C, Zhang G, et al. 2006. Molecular and function characterization of bovine β-defensin-1[J]. Veterinary Immunology & Immunopathology, 113(1-2): 181–190. |
| Bechinger B, Gorr SU. 2017. Antimicrobial peptides:mechanisms of action and resistance[J]. Journal of Dental Research, 96(3): 254–260. DOI:10.1177/0022034516679973 |
| Cesta MF. 2006. Normal structure, function, and histology of the spleen[J]. Toxicologic Pathology, 34(5): 409–424. DOI:10.1080/01926230600867727 |
| Chen Q, Zhou Z, Shan L, et al. 2015. The importance of Src signaling in sarcoma[J]. Oncology Letters, 10(1): 17–22. DOI:10.3892/ol.2015.3184 |
| Du Y, Du T, Shi Y, et al. 2016. Synthetic Toll-like receptor 7 ligand inhibits porcine reproductive and respiratory syndrome virus infection in primary porcine alveolar macrophages[J]. Antiviral Research, 131: 9–18. DOI:10.1016/j.antiviral.2016.04.005 |
| Hajishengallis G, Lambris JD. 2016. More than complementing Tolls:complement-Toll-like receptor synergy and crosstalk in innate immunity and inflammation[J]. Immunological Reviews, 274(1): 233–244. DOI:10.1111/imr.2016.274.issue-1 |
| Holani R, Shah C, Haji Q, et al. 2016. Proline-arginine rich (PR-39) cathelicidin:structure, expression and functional implication in intestinal health[J]. Comparative Immunology, Microbiology and Infectious Diseases, 49: 95–101. DOI:10.1016/j.cimid.2016.10.004 |
| Holt PG, Strickland DH, Wikstrom ME, et al. 2008. Regulation of immunological homeostasis in the respiratory tract[J]. Nature Reviews Immunology, 8(2): 142–152. DOI:10.1038/nri2236 |
| Ignacio G, Nordone S, Howard KE, et al. 2005. Toll-like receptor expression in feline lymphoid tissues[J]. Veterinary Immunology & Immunopathology, 106(3-4): 229–237. |
| Jiao W, Ma Q, Lv X, et al. 2017. Gene expression and tissue distribution of β-defensins in Chinese Min pigs and Landrace pigs[J]. Czech Journal of Animal Science, 62(4): 178–183. DOI:10.17221/CJAS |
| Kawai T, Akira S. 2010. The role of pattern-recognition receptors in innate immunity:update on Toll-like receptors[J]. Nature Immunology, 11(5): 373–384. DOI:10.1038/ni.1863 |
| Kirstilä V, Tenovuo J, Ruuskanen O, et al. 1996. Longitudinal analysis of human salivary immunoglobulins, nonimmune antimicrobial agents, and microflora after tonsillectomy[J]. Clinical Immunology & Immunopathology, 80(2): 110–115. |
| Kuzemtseva L, Mateu E, Darwich L. 2014. Expression of Toll-like receptor 9 (TLR9) in the lungs and lymphoid tissue of pigs[J]. Veterinary Journal, 203(2): 259–261. |
| Leifer CA, Medvedev AE. 2016. Molecular mechanisms of regulation of Toll-like receptor signaling[J]. Journal of Leukocyte Biology, 100(5): 927–941. DOI:10.1189/jlb.2MR0316-117RR |
| Lesmeister MJ, Bothwell MR, Misfeldt ML. 2006. Toll-like receptor expression in the human nasopharyngeal tonsil (adenoid) and palantine tonsils:a preliminary report[J]. International Journal of Pediatric Otorhinolaryngology, 70(6): 987–992. DOI:10.1016/j.ijporl.2005.10.009 |
| Lu Y, Li X, Liu S, et al. 2018. Toll-like receptors and inflammatory bowel disease[J]. Frontiers in Immunology, 9: 72. DOI:10.3389/fimmu.2018.00072 |
| Mansson A, Adner M, Cardell LO. 2006. Toll-like receptors in cellular subsets of human tonsil T cells:altered expression during recurrent tonsillitis[J]. Respiratory Research, 7(1): 1–10. DOI:10.1186/1465-9921-7-1 |
| Petes C, Odoardi N, Gee K. 2017. The Toll for trafficking:Toll-like receptor 7 delivery to the endosome[J]. Frontiers in Immunology, 8: 1075. DOI:10.3389/fimmu.2017.01075 |
| Pruthviraj DR, Usha AP, Venkatachalapathy RT. 2016. Identification of a novel single nucleotide polymorphism in porcine beta-defensin-1 gene[J]. Asian-Australasian Journal of Animal Sciences, 29(3): 315–320. DOI:10.5713/ajas.15.0638 |
| Qi S, Chen J, Guo R, et al. 2009. β-defensins gene expression in tissues of the crossbred and Tibetan pigs[J]. Livestock Science, 123(2-3): 161–168. DOI:10.1016/j.livsci.2008.11.009 |
| Sang Y, Patil AA, Zhang G, et al. 2006. Bioinformatic and expression analysis of novel porcine beta-defensins[J]. Mammalian Genome, 17(4): 332–339. DOI:10.1007/s00335-005-0158-0 |
| Shao LL, Fischer DD, Kandasamy S, et al. 2016. Tissue-specific mRNA expression profiles of porcine Toll-like receptors at different ages in germ-free and conventional pigs[J]. Veterinary Immunology & Immunopathology, 171: 7–16. |
| Sinkora M, Butler JE. 2009. The ontogeny of the porcine immune system[J]. Developmental and Comparative Immunology, 33(3): 273–283. DOI:10.1016/j.dci.2008.07.011 |
| Teixeira LD, Silva ON, Migliolo L, et al. 2013. In vivo antimicrobial evaluation of an alanine-rich peptide derived from Pleuronectes americanus[J]. Peptides, 42(4): 144–148. |
| Thakur KK, Bolshette NB, Trandafir C, et al. 2015. Role of Toll-like receptors in multiple myeloma and recent advances[J]. Experimental Hematology, 43(3): 158–167. DOI:10.1016/j.exphem.2014.11.003 |
| Yang D, Chertov O, Oppenheim JJ. 2001. Participation of mammalian defensins and cathelicidins in anti-microbial immunity:receptors and activities of human defensins and cathelicidin (LL-37)[J]. Journal of Leukocyte Biology, 69(5): 691–697. |
| Yu LL, Feng ZW. 2018. The role of Toll-like receptor signaling in the progression of heart failure[J]. Mediators of Inflammation(6): 1–11. |
| Zaidi AH, Kelly LA, Kreft RE, et al. 2016. Associations of microbiota and toll-like receptor signaling pathway in esophageal adenocarcinoma[J]. BMC Cancer, 16(1): 1–10. DOI:10.1186/s12885-015-2026-y |
 2018, Vol. 37
2018, Vol. 37




