扩展功能
文章信息
- 刘利, 刘云鹏, 张乐, 李东旭, 徐红英, 刘晓光
- LIU Li, LIU Yunpeng, ZHANG Le, LI Dongxu, XU Hongying, LIU Xiaoguang
- 包头南海湿地保护区赤膀鸭组织中重金属含量分析
- Analysis of Residue Heavy Metals in Mareca strepera Tissue in Nanhai Wetland Reserve, Baotou
- 四川动物, 2018, 37(4): 445-455
- Sichuan Journal of Zoology, 2018, 37(4): 445-455
- 10.11984/j.issn.1000-7083.20180077
-
文章历史
- 收稿日期: 2018-03-10
- 接受日期: 2018-05-15
湿地是地球上水陆相互作用形成的独特生态系统,因地势低洼,人类活动产生的重金属可通过地表径流、大气降尘等途径进入湿地,使其成为重金属的汇聚地(Ramos-Miras et al., 2011)。因毒性强、降解难、具有富集效应等特征,重金属对生物体具有严重的毒害作用,受污染环境中的重金属通过食物链传递最终会威胁人类健康,因此,重金属引起的环境污染问题倍受科学界和社会关注(Fu et al., 2014)。
内蒙古自治区包头市是我国北方重工业城市,拥有涵盖稀土、冶金、机械制造及军工等多项支柱产业。工业迅速发展的同时,企业产生的大量工业废水对周边环境造成了一定程度污染。如,Si等(2015)对包头黄河段水样、土壤及春小麦Triticum aestivum中7种重金属研究显示,黄河水和土壤中重金属的浓度呈现出随黄河水进入而升高,随黄河水离开而降低的规律,而且在工业废水排出集中地段的画匠营子区域,浓度达到峰值,表明污染与工业废水的排放存在密切关系;张连科等(2016)对包头铝厂周边土壤重金属的分布和来源的研究发现,被检测的Cu、Pd、Zn、Cr、Cd、Ni、Mn均超过自治区的背景值,且Cu、Zn、Cr、Mn主要源于周边工业活动;李卫平等(2017)研究南海湿地土壤重金属污染的来源时指出,重金属As、Cd、Cr、Cu、Ni、Mn、Pd、Zn普遍超标,其浓度主要受周边工业活动和道路交通的影响。南海湿地保护区是包头市黄河国家湿地公园的重要组成部分,在调节气候、涵养水源、维持区域生态平衡等方面发挥着重要作用(于玲红等,2017)。水鸟是湿地的重要组成部分,多数处于食物链顶端,对重金属有富集作用。作为湿地常见水鸟,鸭科Anatidae鸟类已被选为环境指示物,用于湿地的环境监测与评估(李峰,丁长青,2007;Mallory et al., 2014;Plessl et al., 2017)。我国研究人员已经通过研究雉科Phasianidae(郭东龙等,1997)、雀科Passeridae(潘超等,2001)、鹭科Ardeidae(刘利等,2017)等鸟类组织中的重金属含量及分布规律,对鸟类生存的潜在威胁进行了预警,同时也对其生存环境进行了科学评价。本研究通过对包头南海湿地保护区优势鸟种赤膀鸭Mareca strepera各组织中重金属含量的分析,以期阐明重金属在赤膀鸭体内的分布特征,并揭示湿地重金属污染物对鸭科鸟类健康的影响,为鸟类保护及当地环境质量评估提供科学依据。
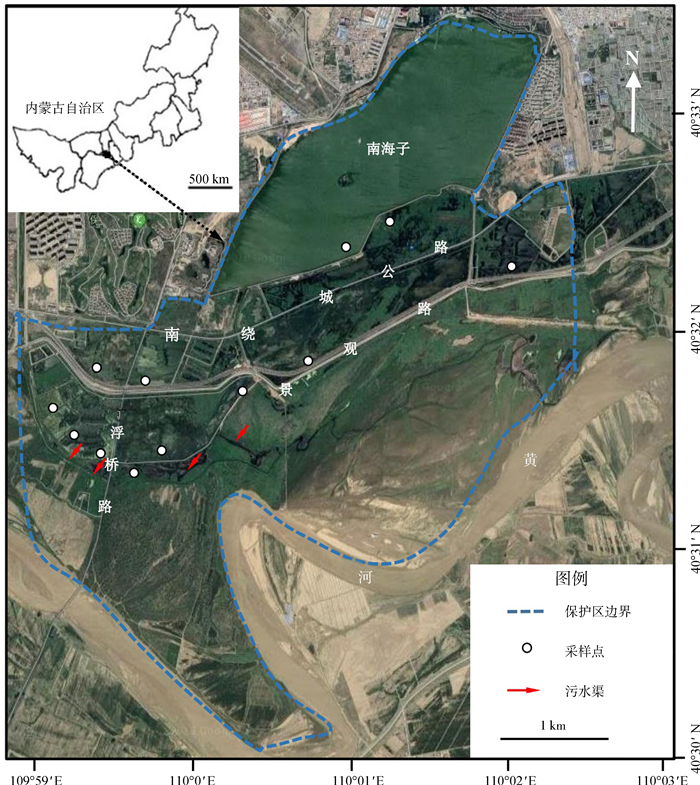
1 研究区域概况包头南海湿地保护区(109°59′02″~110°02′26″E,40°30′08″~40°33′32″N)位于内蒙古自治区包头市东河区南侧1.5 km处,是黄河改道后形成的湖泊和滩涂地,总面积1 664 hm2,包括水域、沼泽、灌丛和草地等类型,境内有333 hm2的湖泊(图 1)。2006—2007年共记录湿地水鸟128种(王红霞等,2009)。水鸟区系组成丰富,鸭科、鹬科Scolopacidae、鸥科Landae和鹭科鸟类的数量较多,其中,鸭科鸟类构成本区水鸟的主体。保护区年平均气温8.5 ℃,最低气温-34.4 ℃,最高气温38.4 ℃,年平均降水量307.4 mm。湿地被南绕城公路、景观路和浮桥路分隔成不同的功能区,其中,核心区位于保护区最南侧,水域面积较为宽阔,水深0.5~1.0 m,水域中分布有面积不等的12个岛屿,岛屿上的主要植物为灰菜Chenopodium album、酸模叶蓼Polygonum lapathifolium、扁杆藨草Scipus planiculmis、碱蓬Suaeda glauca、猪毛菜Salsola collina等。6月初赤膀鸭在核心区岛屿的草丛中筑巢,2016年6—7月调查结果显示,在岛屿繁殖的赤膀鸭有35巢,7月中旬赤膀鸭在核心区水面上育雏。核心区南侧有工业废水常年流经,每年赤膀鸭与绿头鸭Anas platyrhynchos、赤麻鸭Tadorna ferruginea在此混群越冬,栖息采食范围仅限于不封冻的工业污水区域,近3年的湿地越冬水鸟总数量为1 500~2 000只,其中,赤膀鸭约占越冬种群数量的20%。
|
| 图 1 包头南海湿地保护区的样品采集点 Fig. 1 Sampling sites in Nanhai Wetland Reserve, Baotou |
| |
2016年10月5日,采集保护区核心区东侧污水渠边死亡的新鲜赤膀鸭样本,塑料密封袋封装后带回实验室,采集基本数据后,-18 ℃保存。
解剖标本,取胸肌、心肌、肾脏、肝脏及胸骨后,用自来水、蒸馏水、去离子水依次充分洗涤,以除去各组织表面污血,吸干组织表面水分,为避免Fe等的污染,用干净的陶瓷剪刀剪碎组织,在鼓风干燥箱中90 ℃干燥24 h,研碎组织样品,再在同样的条件下干燥5 h至恒重,样品保存在干燥器中备用。雌雄成鸟及幼鸟的鉴定参照《中国动物志》(郑作新等,1979)、《内蒙古动物志》(旭日干,2006)。雄性幼鸭体色与雄性成鸭相似,胸褐色且有新月状白斑,中覆羽棕栗色,色斑带宽度约3 cm,较雄性成鸭(4 cm)窄,喙峰黑色,似成鸟,但边缘橙黄色,与成鸟区别明显。
水样:采集赤膀鸭栖息地附近表层水体共12个样本,采样点见图 1,现场过滤,加硝酸稀释至pH<2,用稀硝酸浸泡过夜的聚乙烯瓶保存水样并带回实验室,过0.5 μm孔径的滤膜,冰冻保存,解冻后直接上机测定。
土壤样品:采集地表 0~20 cm土壤样本12个,采集点为采集水样的附近(与水样同时采集),采样后装入自封袋,带回实验室自然风干,用研钵碾碎,称取0.5 g左右样品,采用微波消解仪(CEM Mars6,美国)消解,定容后待测。
2.2 样品测定与分析称取0.5 g左右样品放入100 mL三角瓶中,加入10 mL混酸(HClO4:HNO3=1: 4)消化后,用2%HNO3(优级纯)稀释定容至25 mL的消化管中,用电感耦合等离子体原子发射光谱仪(ICP-OES;PerkineElmer,USA)测定样本中重金属含量,目标元素的选择参考包头本地环境中重金属研究文献及国际鸭科鸟类组织中的相关资料(Kalisiúska et al., 2004;李卫平等,2017;Plessl et al., 2017)后确定。每个样品均设置2个平行,同时做3份试剂空白。检出限分别为:Cd(0.001 μg·g-1),Ni、Cr、Hg(0.1 μg·g-1),Zn、Mn、Cu、Fe(1.5 μg·g-1)。
用SPSS 17.0进行数据处理,单因素方差分析及Student-Newman-Keuls多重比较法和独立样本t检验分析不同年龄、性别、组织间重金属含量的差异,用Pearson Moment Correlation方法确定元素间的相关性。
3 结果 3.1 水和土壤中重金属的含量与《地表水环境质量标准(GB3838-2002)》(国家环境保护总局,国家质量监督检验检疫总局,2002)比较,保护区水样中的8种被检测重金属中,除Ni、Fe、Mn没有国家标准,另外5种不同程度超标,Hg、Cr、Zn、Cd和Cu分别超过国家Ⅰ类地表水标准值约500倍、375倍、166倍、38倍和15倍。与《土壤环境质量标准(GB15618-1995)》(国家环境保护局,国家技术监督局,1995)比较,除Fe和Mn没有国家标准外,保护区土壤样品中的Cd、Cr、Ni在土壤Ⅰ类范围内,Cu、Zn、Hg均超过土壤Ⅰ类国家标准值,分别约为其的9倍、3倍和4倍(表 1)。
| 重金属 Heavy metal |
含量 Content/(μg·g-1) | 国家标准 National standard content/(μg·g-1) | |||
| 水 Water |
土壤 Soil |
土壤Ⅰ类 Type Ⅰ soil |
地表水Ⅰ类 Type Ⅰ surface water |
||
| Cd | 0.038±0.008 | 0.157±0.041 | ≤0.20 | ≤0.001 | |
| Cr | 3.754±0.489 | 35.608±4.936 | ≤90.00 | ≤0.010 | |
| Cu | 0.154±0.030 | 320.463±49.626 | ≤35.00 | ≤0.010 | |
| Ni | 0.004±0.001 | 21.388±1.143 | ≤40.00 | — | |
| Zn | 8.281±0.652 | 252.639±10.773 | ≤100.00 | ≤0.050 | |
| Hg | 0.025±0.007 | 0.687±0.107 | ≤0.15 | ≤0.000 05 | |
| Fe | 1.709±0.204 | 965.105±272.410 | — | — | |
| Mn | 0.017±0.004 | 527.807±41.747 | — | — | |
赤膀鸭幼鸟胸肌中Cr、Cu、Ni、Hg含量最高,且前3种的含量极显著高于其他组织,Hg含量极显著高于肾脏、肝脏和胸骨。肾脏中Cd、Mn含量最高:Cd含量为0.39 μg·g-1,极显著高于心肌、肝脏和胸骨;Mn含量为12.03 μg·g-1,极显著高于胸骨、肝脏、胸肌和心肌。肝脏和胸骨组织中含量最高的分别为Fe(1 828.68 μg·g-1)和Zn(150.42 μg·g-1),且极显著高于其他组织(表 2)。
| 组织 Tissue |
含量 Content/(μg·g-1) | ||||||||
| Cr | Cd | Cu | Ni | Zn | Hg | Fe | Mn | ||
| 幼鸟 (雄) |
胸肌 | 11.33±6.53(A) | 0.33±0.10(A) | 25.89±3.62(A) | 3.94±0.80(A) | 75.79±4.57(D) | 4.69±0.63(A) | 243.58±50.85(CD) | 4.62±0.42(D) |
| 心肌 | 4.51±0.44(B) | 0.16±0.04(B) | 22.05±1.49(B) | 0.92±0.07(D) | 94.03±4.07(C) | 3.91±0.33(A) | 344.69±13.91(C) | 3.91±0.22(D) | |
| 肾脏 | 0.30±0.07(B) | 0.39±0.06(A) | 20.13±0.91(B) | 1.11±0.63(CD) | 79.02±2.73(D) | 2.49±0.31(B) | 587.84±12.64(B) | 12.03±0.13(A) | |
| 肝脏 | 0.17±0.03(B) | 0.18±0.09(B) | 19.59±3.46(B) | 1.73±0.37(BC) | 107.47±17.79(B) | 2.14±0.02(B) | 1 828.68±28.61(A) | 8.27±1.34(C) | |
| 胸骨 | 2.47±0.92(B) | 0.10±0.02(B) | 6.41±0.53(C) | 1.95±0.34(B) | 150.42±2.26(A) | 0.91±0.06(C) | 114.35±16.42(D) | 10.95±0.26(B) | |
| 成鸟 (雄) |
胸肌 | 4.81±0.26(A) | 0.21±0.03(B) | 30.01±1.09(B) | 3.81±1.08(A) | 81.32±15.59(B) | 1.56±0.09(B) | 327.41±9.89(C) | 4.18±0.98(C) |
| 心肌 | 5.04±1.75(A) | 0.10±0.02(B) | 21.08±0.30(C) | 1.29±0.09(B) | 80.13±1.98(B) | 1.71±0.62(B) | 311.62±20.83(C) | 3.82±0.24(C) | |
| 肾脏 | 0.38±0.05(B) | 2.13±0.45(A) | 23.80±3.82(C) | 0.71±0.04(B) | 84.05±8.33(B) | 3.83±1.13(A) | 622.31±61.76(B) | 8.43±0.85(B) | |
| 肝脏 | 0.60±0.03(B) | 0.34±0.07(B) | 168.06±3.34(A) | 0.87±0.03(B) | 146.67±4.01(A) | 2.80±0.83(AB) | 1 516.58±88.46(A) | 8.77±0.27(B) | |
| 胸骨 | 1.19±0.08(B) | 0.18±0.01(B) | 7.28±0.48(D) | 1.48±0.69(B) | 143.55±5.60(A) | 3.20±0.02(AB) | 102.56±2.61(D) | 15.26±0.44(A) | |
| 成鸟 (雌) |
胸肌 | 7.10±2.32(A) | 0.14±0.05(C) | 27.20±2.18(B) | 4.08±1.37(A) | 74.93±6.42(C) | 2.57±1.32(A) | 357.03±29.18(C) | 4.63±0.53(D) |
| 心肌 | 4.21±1.56(B) | 0.07±0.01(C) | 18.68±0.37(C) | 3.32±2.19(A) | 86.13±1.69(B) | 2.17±0.60(A) | 259.87±28.84(D) | 3.40±0.33(E) | |
| 肾脏 | 0.44±0.04(D) | 4.19±0.39(A) | 18.66±1.08(C) | 1.04±0.72 (B) | 85.74±2.58(B) | 2.36±0.65(A) | 810.24±26.70(B) | 6.88±0.55(C) | |
| 肝脏 | 0.72±0.35(D) | 1.25±0.14(B) | 73.29±2.78(A) | 1.16±0.20(B) | 143.65±6.26(A) | 3.02±0.99(A) | 3 380.13±172.66(A) | 10.07±0.70(B) | |
| 胸骨 | 2.41±0.77(C) | 0.23±0.01(C) | 6.39±0.89(D) | 1.50±0.61(B) | 143.89±1.27(A) | 2.36±0.21(A) | 84.70±2.64(E) | 17.55±0.87(A) | |
| 注:表中同列数据后不同大写字母(A,B,C,D,E)表示差异有高度统计学意义(P<0.01),加粗字体为最高含量 Notes:The same column of data with different capital letters (A,B,C,D,E) indicate that there is an extremely significant difference (P < 0.01),bold font indicates the highest content | |||||||||
雌雄成鸟各组织间重金属含量分布规律相似:Cr主要分布在肌肉中,雄性的最高含量为5.04 μg·g-1,出现在心肌中,且与胸肌间的差异无统计学意义,雌性的最高含量出现在胸肌中,为7.10 μg·g-1,且极显著高于其他组织;Cd、Cu、Ni的最高含量分别出现在肾脏、肝脏、胸肌中,且极显著高于其他组织;Zn主要分布在雄性的肝脏和雌性的胸骨中,两者间的差异无统计学意义;Hg的最高含量出现在雄性的肾脏中,与肝脏和胸骨的差异无统计学意义,极显著高于肌肉,雌性的出现在肝脏中,与其他组织的差异无统计学意义;Fe、Mn的最高含量分别出现在肝脏和胸骨中,极显著高于其他组织(表 2)。
3.2.2 组织间重金属的相关性8种重金属间的相关性分析表明,Zn、Fe、Cu两两显著正相关,Fe与Cu极显著正相关(r=0.551,P<0.01),Zn与Mn极显著正相关(r=0.721,P<0.01);Cr与Ni极显著正相关(r=0.684,P<0.01),Cr与Zn(r=-0.423,P=0.08)、Mn(r=-0.422,P=0.008)极显著负相关,Cr与Fe显著负相关(r=-0.334,P=0.04);Ni与Zn(r=-0.330,P=0.020)、Mn(r=-0.368,P=0.009)极显著负相关;Cd与Ni显著负相关(r=-0.300,P=0.048)(表 3)。
| Cr | Cd | Cu | Ni | Zn | Hg | Fe | Mn | |
| Cr | -0.243 | -0.126 | 0.684** | -0.423** | 0.116 | -0.334* | -0.422** | |
| Cd | 0.166 | -0.030 | -0.300* | -0.156 | 0.068 | 0.197 | -0.027 | |
| Cu | 0.452 | 0.844 | -0.163 | 0.322* | 0.127 | 0.551** | -0.063 | |
| Ni | <0.001 | 0.048 | 0.264 | -0.330* | -0.122 | -0.253 | -0.368* | |
| Zn | 0.008 | 0.308 | 0.019 | 0.020 | -0.028 | 0.346* | 0.721** | |
| Hg | 0.487 | 0.685 | 0.378 | 0.404 | 0.845 | 0.080 | 0.020 | |
| Fe | 0.040 | 0.196 | <0.001 | 0.080 | 0.014 | 0.579 | 0.064 | |
| Mn | 0.008 | 0.860 | 0.665 | 0.009 | <0.001 | 0.989 | 0.661 | |
| 注:表内对角线上方为相关系数(r),对角线下方为P值;*P<0.05,**P<0.01 Notes:Above the diagonal is the correlation coefficient (r),below is the P-value;*P < 0.05,**P < 0.01 | ||||||||
胸肌中,Cd的平均含量为雄鸟极显著高于雌鸟,而Fe的平均含量为雌鸟极显著高于雄鸟。雄鸟心肌中Cd、Cu、Fe和Mn的平均含量极显著高于雌鸟(P<0.01),而Ni的平均含量为雌鸟显著高于雄鸟(P<0.05)。肝脏和肾脏中多数重金属的平均含量为雌鸟较高,而肾脏中Cu和Mn的平均含量为雄鸟显著高于雌鸟(P<0.05)。胸骨中Fe的平均含量为雄鸟极显著高于雌鸟(P<0.01),而Mn的平均含量为雌鸟极显著高于雄鸟(P<0.01)(表 2,表 4)。
| 组织 Tissue | Cr | Cd | Cu | Ni | Zn | Hg | Fe | Mn | |
| 成鸟、幼鸟(雄性)vs.成鸟(雌性) | 胸肌 | 0.742 | 0.005 | 0.791 | 0.439 | 0.541 | 0.423 | 0.003 | 0.347 |
| 心肌 | 0.080 | 0.002 | <0.001 | 0.025 | 0.874 | 0.408 | <0.001 | 0.003 | |
| 肾脏 | 0.078 | <0.001 | 0.013 | 0.640 | 0.049 | 0.134 | <0.001 | 0.001 | |
| 肝脏 | <0.001 | <0.001 | 0.388 | 0.442 | 0.099 | 0.358 | <0.001 | 0.004 | |
| 胸骨 | 0.463 | 0.291 | 0.145 | 0.331 | 0.090 | 0.546 | <0.001 | <0.001 | |
| 幼鸟(雄性)vs.成鸟(雄性) | 胸肌 | 0.004 | 0.012 | 0.006 | 0.774 | 0.305 | <0.001 | 0.001 | 0.215 |
| 心肌 | 0.363 | 0.001 | 0.070 | 0.207 | <0.001 | <0.001 | 0.001 | 0.361 | |
| 肾脏 | 0.015 | <0.001 | 0.014 | 0.278 | 0.097 | 0.026 | 0.115 | <0.001 | |
| 肝脏 | 0.034 | 0.001 | <0.001 | <0.001 | <0.001 | 0.284 | 0.007 | 0.276 | |
| 胸骨 | 0.003 | 0.059 | 0.001 | 0.076 | 0.004 | 0.006 | 0.040 | <0.001 |
胸肌中,Cr、Cd和Hg的平均含量为雄性幼鸟显著或极显著高于雄性成鸟,而Cu和Fe的平均含量为雄性成鸟显著或极显著高于雄性幼鸟;心肌中各重金属的分布特征较一致,Cd、Zn、Hg、Fe的平均含量均为雄性幼鸟极显著高于雄性成鸟(P<0.01);肾脏中Cr、Cd、Cu和Hg的平均含量为雄性成鸟显著或极显著高于雄性幼鸟,但Mn的平均含量为雄性幼鸟极显著高于雄性成鸟(P<0.01);肝脏中Cr、Cd、Cu、Zn的平均含量均为雄性成鸟显著或极显著高于雄性幼鸟,而Ni和Fe的平均含量为雄性幼鸟极显著高于雄性成鸟(P<0.01);胸骨中Cu、Hg和Mn的平均含量为雄性成鸟极显著高于雄性幼鸟(P<0.01),而Cr、Zn和Fe的平均含量为雄性幼鸟显著或极显著高于雄性成鸟(表 2,表 4)。
3.4 污染物含量与距离的关系通过组间类平均法(between-groups average)进行变量标准化,距离测量采用平方欧氏距离(squared euclidean distance),最后得到赤膀鸭组织、水和土壤中重金属的聚类分析树形图。从图中可以看到这8种重金属的聚类过程,横坐标为样点间的距离,距离越近表明两者越相似。本研究选择25为组间距离标准。组织中得到差异明显的3组,即Ni、Hg、Cd、Cr为一类,Cu、Mn、Zn为一类,Fe为单独一类。水样中得到差异明显的4组,即Hg、Mn、Ni为一类,Cd、Cu、Fe为一类,Cr为一类,Zn为一类。土壤样中得到差异明显的4组,即Ni、Cd、Cr为一类,Mn、Cu、Zn为一类,Hg为一类,Fe为一类(图 2)

|
| 图 2 包头南海湿地保护区赤膀鸭组织间的重金属含量差异(n=10) Fig. 2 The differences of heavy metal contents in the tissues of Mareca strepera in Nanhai Wetland Reserve, Baotou (n=10) |
| |
8种被检测的重金属中,Fe在赤膀鸭各组织中的含量最高,尤其是在雌性成鸟的肝脏中,平均含量高达3 380.13 μg·g-1,极显著高于雄性成鸟和幼鸟,是波兰西北部地区绿头鸭肝脏中含量的3~4倍(Kalisińska et al., 2004)。赤膀鸭各组织间Fe的分布从高到低为肝脏、肾脏、肌肉、胸骨,而且雄性幼鸟肝脏组织中Fe的平均含量极显著高于雄性成鸟,这与目前报道的鸭科鸟类组织中Fe的分布规律一致(Kozulin & Pavluschick,1993;Kalisińska et al., 2004)。另外,相关性和聚类分析表明,Fe、Cu、Zn显著相关且距离较近。田慧娟等(2011)在研究包头南海湿地水环境中重金属时指出,水体环境中主要矿物成分为铁锰氧化物,而且Fe的含量是影响Cu、Zn、Pb等重金属沉积的主导因素,这些矿物质与工业废水有关。赤膀鸭经常在工业废水区域栖息,因此本研究认为,赤膀鸭组织中大量的Fe可能与当地工业生产有关。
4.2 Zn的分布规律Zn主要分布在鸭科鸟类的肝脏和肾脏组织中(Kalisińska et al., 2004;Binkowski et al., 2013;Plessl et al., 2017),但也有报道显示其主要累积在幼鸟骨骼中,主要原因为Zn是骨骼生长和骨化过程中的重要条件和关键因子(Underwood,1971)。本研究结果显示,Zn主要分布在赤膀鸭的胸骨和肝脏中,成鸟胸骨与肝脏间含量的差异不显著,而雄性幼鸟胸骨中的Zn极显著高于肝脏,也极显著高于雄性成鸟胸骨,这与上述研究报道结果类似,其原因可能与赤膀鸭的成长骨化过程有关。另外,Zn虽然是动物生长发育维持正常生理机能的必需微量元素,但摄入过量会导致肾毒性,使鸟类的生殖腺体积缩小,繁殖能力丧失(Gasaway & Buss,1972)。Carpenter等(2004)在研究黑嘴天鹅Cygnus buccinator Zn中毒时指出,死亡个体肝脏中Zn的含量为154 μg·g-1。本研究雄性和雌性成鸟肝脏中Zn的平均含量分别为146.67 μg·g-1和143.65 μg·g-1,均与黑嘴天鹅肝脏中的含量接近,这是否与赤膀鸭死亡有关有待进一步研究。另外,赤膀鸭组织中Zn的平均含量远高于美国(Di Giulio & Scanlon,1985)、西班牙(Mateo & Guitart,2003)、波兰(Kalisińska et al., 2004)、韩国(Kim & Oh,2012)、伊朗(Mallory et al., 2014)、奥地利(Plessl et al., 2017)等地鸭科鸟类的平均水平。研究区域水样和土壤中Zn的含量超过国家标准值,其中,土壤中Zn的平均含量是包头地区土壤环境背景值(56.47 μg·g-1)的4倍以上(冷福荣等,1999),说明当地Zn的污染较重。另外,水鸟组织中的重金属受环境和食物的影响,来源及代谢方式相同会使组织中某些重金属间表现出一定的相关性特点(周晓平等,2004;Kalisińska et al., 2004;Shahbaz et al., 2013)。张连科等(2016)在研究包头铝厂周边土壤中重金属的分布特征时指出,Zn、Cu、Mn两两显著相关,且主要来源于工业生产。本研究中土壤及赤膀鸭组织中这3种元素的分布特点及相关性与张连科等(2016)的报道结果类似,因此,本研究认为赤膀鸭组织中高含量的Zn可能与当地工业生产活动有关。
4.3 Cu的分布规律Cu大量存在于各种岩石和矿物中,是生物体内最基本的微量元素之一,参与氧代谢和呼吸链电子传递(李峰,丁长青,2007;Plessl et al., 2017),但过量的Cu会作用于靶器官(肝脏、肾脏、心脏、胃肠道)和免疫器官,使组织器官受损、功能发生障碍而导致鸟类死亡(崔恒敏等,2005)。目前关于鸭科鸟类Cu的组织分布特征显示,肝脏中的含量最高,是肌肉和肾脏平均含量的数倍,最低的为骨骼(Kalisińska et al., 2004)。本研究赤膀鸭成鸟组织中Cu的分布规律与上述结果一致,雄鸟肝脏中的平均含量达到168.06 mg·kg-1,是奥地利西北地区绿头鸭(37 μg·g-1)的4倍以上(Plessl et al., 2017),也远高于西班牙(35.2 μg·g-1)(Mateo & Guitart,2003)、日本(35.7 μg·g-1)(Nam et al., 2005)、波兰地区(39.48 μg·g-1)(Binkowski et al., 2013)等地鸭科鸟类肝脏平均含量。研究区域水样和土壤中Cu的含量超过国家标准值,其中土壤中的平均含量是包头地区土壤环境背景值(19.20 μg·g-1)的16倍以上(冷福荣等,1999),说明当地Cu的污染较重。Kalisińska等(2004)认为,水鸟比其他鸟类更容易累积Cu,而且组织中含量较高的Cu主要与当地的铜矿有关。郭伟等(2011)研究包头铁矿区重金属污染特征时指出,造成包头地区环境污染主要为Cu、Zn和Mn,其源于铁矿(方铅矿、闪锌矿、锰铌铁矿、钡铁锰矿、黄铜矿等)主要矿物成分。本研究赤膀鸭组织中Cu、Fe、Zn两两正相关,聚类分析中表明土壤和组织中Cu、Zn、Mn的距离较近,可能其来源相似,均与工业活动有关。
4.4 Mn的分布规律与Zn的作用类似,Mn是恒温脊椎动物骨骼骨化的重要条件和关键因子,并影响繁殖和神经系统(Underwood,1971;Sanstead,1986)。关于雁形目Anseriformes鸟类组织中Mn的研究报道相对较少,Mn主要分布在绿头鸭的肾脏和肝脏中,但在成长过程中绿头鸭的骨骼中含量也较高。Kalisińska等(2004)对波兰西北2个地点绿头鸭组织中Mn含量及其生存的环境比较后指出,邻近耕地区域栖息的绿头鸭组织中Mn含量较高,其原因可能与化肥和杀虫剂的使用有关。本研究结果与上述报道有所不同,赤膀鸭成鸟组织中Mn含量最高的为胸骨,幼鸟含量最高的为肾脏,含量低于波兰地区绿头鸭。目前没有关于水和土壤中Mn的国家标准,但包头南海湿地保护区土壤中Mn的含量已超过当地背景值(413 μg·g-1),说明有外源Mn的加入。关于Mn污染对赤膀鸭健康的潜在威胁还有待进一步研究。
4.5 Ni的分布规律关于鸟类组织中Ni的研究内容较少,通常其含量较低(Szefer & Falandysz,1986;Cohen et al., 2000),但有报道指出南非的白骨顶Fulica atra组织中含量较高,主要与当地有色金属加工有关(Van Eeden & Schoonbee,1992)。波兰西北地区绿头鸭的Ni主要分布在肌肉组织中,而且成鸟显著高于幼鸟。本研究赤膀鸭组织中Ni的分布与其类似,但远高于绿头鸭的平均含量,是Kozulin和Pavluschick(1993)报道的受污染地区鸭科鸟类平均含量的3~4倍。环境中Ni的检测结果显示,土壤中Ni的含量虽然没有超过国家标准,但已高于当地背景值(20.24 μg·g-1),说明湿地存在Ni的外源加入。另外,Fu等(2014)在研究江苏省重金属污染源时指出,Ni与Cr表现出较强的相关性,表明其来源于电镀行业和煤的燃烧。本研究中,赤膀鸭组织中Ni与Cr极显著正相关,保护区距离城区较近,周边分布各种金属冶炼加工厂,生产过程中消耗大量的煤炭,因此,赤膀鸭组织中较高含量的Ni可能与工业生产有关。
4.6 Hg的分布规律Hg是一种能够引发生物机体不可逆损伤的重金属,环境中的Hg主要以毒性较强的甲基汞存在。卵中的Hg含量超过1.5~1.8 mg·kg-1就足以导致卵质量下降、畸形、孵化率降低、生长率以及雏鸟成活率降低(Burger & Gochfeld,1997)。普通潜鸟Gavia immer羽毛中Hg含量超过0.04 μg·g-1时,其繁殖成功率会降低(Evers et al., 2008)。甲基汞还会导致绿头鸭雏鸟警戒反应减少(Heinz,1979)。Hg在鸟类体内的分布具有较强的选择性,主要蓄积于肝脏和肾脏(徐洪鑫,刘焕奇,2002),这与本研究赤膀鸭成鸟组织中的分布规律相似,但幼鸟组织中Hg的分布略有不同,其主要分布在肌肉中。一般鸭科鸟类肌肉中Hg的含量较低,如阿拉斯加绿头鸭为0.008 9 μg·g-1(Rothschild & Duffy,2005)、加利福尼亚琵嘴鸭A. clypeata 0.132 μg·g-1(Ruelas-Inzunza et al., 2009)、奥地利绿头鸭为0.049 μg·g-1(Plessl et al., 2017),本研究中幼鸟肌肉中Hg的含量远高于上述地区鸭科鸟类。保护区土壤和水中Hg的检测结果显示,其平均含量已远高于国家标准。土壤样本中Hg的平均含量也远高于当地环境背景值(24.45×10-9 μg·g-1),说明当地Hg污染较重,这与栗利曼等(2016)的研究结果类似,Hg污染应该引起关注。
4.7 Cd的分布规律Cd是重金属中除Pb和Hg外最具毒性的重金属之一,主要累积在肾脏中造成肾损伤,也称为“肾毒素”(Garcia-Fernandez et al., 1996)。White等(1978)用200 ppm的CdCl2注射绿头鸭后发现,Cd在肾脏中明显累积,其含量超过130 μg·g-1,同时睾丸中也表现明显分布。Cd除了造成肾损伤外,还会导致睾丸萎缩、精子发育受损,从而降低繁殖成功率(White et al., 1978)。另外,长期低剂量的Cd暴露,会使鸟类易感染其他疾病(Di Giulio & Scanlon,1985)。本研究中,Cd在赤膀鸭肾脏中的含量最高,而且与其他组织间的差异有统计学意义;不同年龄间的比较结果显示,雄性成鸟肾脏中的平均含量极显著高于雄性幼鸟,这与波兰西北地区绿头鸭组织中Cd的分布规律一致(Kalisińska et al., 2004)。另外,Cd主要源于当地的采矿和冶炼加工,而且也是波兰西北地区鸭科鸟类种群数量下降的决定因素(Kalisińska et al., 2004)。本研究中赤膀鸭肾脏中Cd的平均含量与波兰西北部地区绿头鸭相当。这是否与当地鸭科鸟类死亡有关,还有待进一步研究。另外,保护区水中Cd的平均含量已超过国家标准,土壤中的平均含量是当地背景值(0.083 μg·g-1)的2倍。另外,李玉梅等(2017)对包头土壤重金属污染及健康风险评价时指出,铝厂周边土壤中Cd已存在潜在致癌风险。保护区周边遍布各种金属加工厂,关于Cd对湿地环境及鸟类健康的影响问题应该引起重视。
4.8 Cr的分布规律Cr广泛存在于土壤、大气和水中,为机体必需微量元素,具有提高生长和免疫力的作用,但超过一定阈值的各种化合物的毒性强弱不一(Tsipoura et al., 2011)。本研究中Cr主要分布在赤膀鸭的胸肌和心肌中,其中,幼鸟胸肌中的平均含量最高为11.33 μg·g-1,极显著高于成鸟,也远高于日本(Nam et al., 2005)、奥地利(Plessl et al., 2017)等鸭科鸟类,但目前还没关于鸭科鸟类肌肉组织中Cr含量阈值相关文献报道。另外,本研究中不同性别赤膀鸭肝脏中Cr的平均含量比较表明,雌鸟显著高于雄鸟,但其平均含量低于奥地利绿头鸭,高于日本绿头鸭。水环境中Cr的平均含量已远高于国家标准,关于Cr污染问题有待进一步研究。
| 崔恒敏, 陈怀涛, 邓俊良, 等. 2005. 实验性雏鸭铜中毒症的病理学研究[J]. 畜牧兽医学报, 36(7): 715–721. |
| 郭东龙, 周梅素, 黄淑萍. 1997. Zn、Cd在太原工业区和紫金山非工业区环颈雉不同组织中的分布及比较研究[J]. 生态学报, 17(3): 272–276. |
| 郭伟, 赵仁鑫, 张君, 等. 2011. 内蒙古包头铁矿区土壤重金属污染特征及其评价[J]. 环境科学, 32(10): 3099–3105. |
| 国家环境保护局, 国家技术监督局. 1995. 中华人民共和国土壤环境质量标准[EB/OL]. [1995-07-13]. http://kjs.mep.gov.cn/hjbhbz/bzwb/trhj/trhjzlbz/199603/t19960301_82028.shtml. |
| 国家环境保护总局, 国家质量监督检验检疫总局. 2002. 中华人民共和国地表水环境质量标准[EB/OL]. [2002-04-28]. http://kjs.mep.gov.cn/hjbhbz/bzwb/shjbh/shjzlbz/200206/t20020601_66497.htm. |
| 冷福荣, 曹金虎, 丁天才. 1999. 包头地区土壤环境质量地球化学初步评价[J]. 内蒙古地质, 91(2): 27–39. |
| 李峰, 丁长青. 2007. 重金属污染对鸟类的影响[J]. 生态学报, 27(1): 296–303. |
| 李卫平, 王非, 杨文焕, 等. 2017. 包头市南海湿地土壤重金属污染评价及来源解析[J]. 生态环境学报, 26(11): 1977–1984. |
| 李玉梅, 李海鹏, 张连科, 等. 2017. 包头某铝厂周边土壤重金属污染及健康风险评价[J]. 中国环境监测, 33(1): 88–96. |
| 栗利曼, 刘菊梅, 沈渭寿, 等. 2016. 包头工业区蔬菜重金属富集及人群健康评价[J]. 中国蔬菜, 1(1): 54–59. |
| 刘利, 张乐, 孙艳, 等. 2017. 包头南海湿地夜鹭卵7种重金属含量分析[J]. 内蒙古大学学报(自然科学版), 48(6): 672–677. |
| 潘超, 郑光美, 张正旺, 等. 2001. 北京城区麻雀体内污染物的研究[J]. 北京师范大学学报(自然科学版), 37(6): 820–824. |
| 田慧娟, 何江, 吕昌伟, 等. 2011. 黄河包头段不同粒级沉积物中重金属形态分布特征[J]. 沉积学报, 29(4): 776–782. |
| 王红霞, 杨贵生, 徐英, 等. 2009. 内蒙古包头南海子湿地鸟类群落组成及多样性[J]. 动物学杂志, 44(2): 71–77. |
| 徐洪鑫, 刘焕奇. 2002. 雏鸡汞中毒血液及组织的残留分析[J]. 中国动物检疫, 19(6): 26–27. |
| 旭日干. 2006. 内蒙古动物志 鸟纲 非雀形目[M]. 呼和浩特: 内蒙古大学出版社. |
| 于玲红, 王晓云, 李卫平, 等. 2017. 包头市南海湿地水质现状分析与评价[J]. 环境化学, 36(2): 390–396. DOI:10.7524/j.issn.0254-6108.2017.02.2016050801 |
| 张连科, 李海鹏, 黄学敏, 等. 2016. 包头某铝厂周边土壤重金属的空间分布及来源解析[J]. 环境科学, 37(3): 1139–1146. |
| 郑作新, 张荫荪, 洗耀华, 等. 1979. 中国动物志 鸟纲 第二卷 雁形目[M]. 北京: 科学出版社: 78-79. |
| 周晓平, 陈小麟, 方文珍, 等. 2004. 厦门白鹭保护区白鹭体内重金属含量分析[J]. 厦门大学学报(自然科学版), 43(3): 412–415. |
| Binkowski ŁJ, Stawarz RM, Zakrzewski M. 2013. Concentrations of cadmium, copper and zinc in tissues of mallard and coot from southern Poland[J]. Journal of Environmental Science and Health Part B, Pesticides, Food Contaminants, and Agricultural Wastes, 48(5): 410–415. DOI:10.1080/03601234.2013.742725 |
| Burger J, Gochfeld M. 1997. Risk, mercury levels, and birds:relating adverse laboratory effects to field biomonitoring[J]. Environmental Research, 75(2): 160–172. DOI:10.1006/enrs.1997.3778 |
| Carpenter JW, Andrews GA, Beyer WN. 2004. Zinc toxicosis in a free-flying trumpeter swan (Cygnus buccinator)[J]. Journal of Wildlife Diseases, 40(4): 769–774. DOI:10.7589/0090-3558-40.4.769 |
| Cohen JB, Barclay JS, Major AR, et al. 2000. Wintering greater scaup as biomonitors of metal contamination in federal wildlife refuges in the Long Island region[J]. Archives of Environmental Contamination and Toxicology, 38(1): 83–92. DOI:10.1007/s002449910011 |
| Di Giulio RT, Scanlon PF. 1985. Effects of cadmium ingestion and food restriction on energy metabolism and tissue metal concentrations in mallard ducks (Anas platyrhynchos)[J]. Environmental Research, 37(2): 433–444. DOI:10.1016/0013-9351(85)90125-2 |
| Evers DC, Savoy LJ, DeSorbo CR, et al. 2008. Adverse effects from environmental mercury loads on breeding common loons[J]. Ecotoxicology, 17(2): 69–81. DOI:10.1007/s10646-007-0168-7 |
| Fu J, Wang Q, Wang H, et al. 2014. Monitoring of non-destructive sampling strategies to assess the exposure of avian species in Jiangsu province, China to heavy metals[J]. Environmental Science and Pollution Research International, 21(4): 2898–2906. DOI:10.1007/s11356-013-2242-4 |
| Garcia-Fernandez AJ, Sanchez-Garcia JA, Gomez-Zapata M, et al. 1996. Distribution of cadmium in blood and tissues of wild birds[J]. Archives of Environmental Contamination and Toxicology, 30(2): 252–258. DOI:10.1007/BF00215805 |
| Gasaway WC, Buss IO. 1972. Zinc toxicity in the mallard duck[J]. Journal of Wildlife Management, 36(4): 1107–1117. DOI:10.2307/3799239 |
| Heinz GH. 1979. Methylmercury:reproductive and behavioral effects on three generations of mallard ducks[J]. Journal of Wildlife Management, 43(2): 394–401. DOI:10.2307/3800348 |
| Kalisińska E, Salicki W, Mysłek P, et al. 2004. Using the mallard to biomonitor heavy metal contamination of wetlands in north-western Poland[J]. Science of the Total Environment, 320(2-3): 145–161. DOI:10.1016/j.scitotenv.2003.08.014 |
| Kim J, Oh JM. 2012. Metal levels in livers of waterfowl from Korea[J]. Ecotoxicology and Environmental Safety, 78(3): 162–169. |
| Kozulin A, Pavluschick T. 1993. Content of heavy metals in tissues of mallards Anas platyrhynchos wintering in polluted and unpolluted habitats[J]. Acta Ornithologica, 28(1): 55–61. |
| Mallory ML, Braune BM, Robertson G, et al. 2014. Increasing cadmium and zinc levels in wild common eiders breeding along Canada's remote northern coastline[J]. Science of the Total Environment, 1(476-477): 73–78. |
| Mateo R, Guitart R. 2003. Heavy metals in livers of waterbirds from Spain[J]. Archives of Environmental Contamination and Toxicology, 44(3): 398–404. DOI:10.1007/s00244-002-2040-3 |
| Nam DH, Anan Y, Ikemoto T, et al. 2005. Multielemental accumulation and its intracellular distribution in tissues of some aquatic birds[J]. Marine Pollution Bulletin, 50(11): 1347–1362. DOI:10.1016/j.marpolbul.2005.05.004 |
| Plessl C, Jandrisits P, Krachler R, et al. 2017. Heavy metals in the mallard Anas platyrhynchos from eastern Austria[J]. Science of the Total Environment, 580: 670–676. DOI:10.1016/j.scitotenv.2016.12.013 |
| Ramos-Miras JJ, Roca-Perez L, Guzmán-Palomino M, et al. 2011. Background levels and baseline values of available heavy metals in Mediterranean greenhouse soils (Spain)[J]. Journal of Geochemical Exploration, 110(2): 186–192. DOI:10.1016/j.gexplo.2011.05.009 |
| Rothschild RF, Duffy LK. 2005. Mercury concentrations in muscle, brain and bone of western Alaskan waterfowl[J]. Science of the Total Environment, 349(1-3): 277–283. DOI:10.1016/j.scitotenv.2005.05.021 |
| Ruelas-Inzunza J, Hernández-Osuna J, Páez-Osuna F. 2009. Organic and total mercury in muscle tissue of five aquatic birds with different feeding habits from the SE Gulf of California, Mexico[J]. Chemosphere, 76(3): 415–418. DOI:10.1016/j.chemosphere.2009.03.042 |
| Sanstead HH. 1986. A brief history of the influence of trace elements on brain function[J]. The American Journal of Clinical Nutrition, 43(2): 293–298. DOI:10.1093/ajcn/43.2.293 |
| Shahbaz M, Hashmi MZ, Malik RN, et al. 2013. Relationship between heavy metals concentrations in egret species, their environment and food chain differences from two headworks of Pakistan[J]. Chemosphere, 93(2): 274–282. DOI:10.1016/j.chemosphere.2013.04.078 |
| Si W, Liu J, Cai L, et al. 2015. Health risks of metals in contaminated farmland soils and spring wheat irrigated with Yellow River water in Baotou, China[J]. Bulletin of Environmental Contamination and Toxicology, 94: 214–219. DOI:10.1007/s00128-014-1435-y |
| Szefer P, Falandysz J. 1986. Trace metals in the bones of scaup ducks (Aythya marila L.) wintering in Gdańsk Bay, Baltic Sea, 1982-83 and 1983-84[J]. Science of the Total Environme, 53(3): 193–199. DOI:10.1016/0048-9697(86)90132-4 |
| Tsipoura N, Burger J, Newhouse M, et al. 2011. Lead, mercury, cadmium, chromium, and arsenic levels in eggs, feathers, and tissues of Canada geese of the New Jersey Meadowlands[J]. Environmental Research, 111(6): 775–784. DOI:10.1016/j.envres.2011.05.013 |
| Underwood EJ. 1971. Trace elements in human and animal nutrition[M]. New York: Academic Press: Inc:222. |
| Van Eeden PH, Schoonbee HJ. 1992. Concentrations of heavy metals in organs and tissues of the red-knobbed coot[J]. Ostrich, 63: 165–171. |
| White DH, Finley MT, Ferrell JF. 1978. Histopathologic effects of dietary cadmium on kidneys and testes of mallard ducks[J]. Journal of Toxicology and Environmental Health, 4(4): 551–558. DOI:10.1080/15287397809529678 |
 2018, Vol. 37
2018, Vol. 37




