扩展功能
文章信息
- 杨曈, 姜德纯, 党宁馨, 李家堂
- YANG Tong, JIANG Dechun, DANG Ningxin, LI Jiatang
- 蛙类前肢形态对树栖环境的适应性演化
- Morphological Evolution of the Forelimb of Frogs (Anura) in Adaption to Arboreal Environment
- 四川动物, 2018, 37(4): 400-405
- Sichuan Journal of Zoology, 2018, 37(4): 400-405
- 10.11984/j.issn.1000-7083.20180072
-
文章历史
- 收稿日期: 2018-03-05
- 接受日期: 2018-05-15
2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
无尾目Anura是现存两栖类中生物多样性最丰富的类群,约占两栖纲物种总数的88%,分布于森林、草地、河流、瀑布、沼泽、山地和沙漠等多种生态环境中(费梁等,2009;Frost,2018)。树栖性两栖类广泛分布于世界各地,但是分布在中国的仅有树蛙科Rhacophoridae的部分物种和雨蛙科Hylidae雨蛙属Hyla物种,雨蛙科物种在中国的种类较少,东亚地区是雨蛙科分布的北缘(费梁等,2009;Frost,2018)。树蛙科起源于非洲并向亚洲扩散(Bossuyt & Milinkovitch,2000),雨蛙科遍布于温带欧亚大陆的大部分地区(Smith et al., 2005),雨蛙属起源于北美,通过白令海峡的2次物种扩散事件扩散到欧亚大陆(Li et al., 2015)。虽然树蛙科和雨蛙科有不同的生物地理学起源,但是它们相似的树栖生活环境和生活方式使其具有相近的形态特征和行为模式(Li et al., 2013, 2015)。
此前的研究表明,蛙类的形态学和栖息地之间有直接的联系(Manzano et al., 2008;Guimarães et al., 2014),但是这些研究大多集中在功能形态方面,例如,Gray等(1997)关于无尾目前肢进化的研究提出,树栖蛙类的前肢在捕食过程中具有复杂的移动模式,这些行为至少由3次独立进化而来;Manzano等(2008)研究了2种树栖蛙类的前肢和手部肌肉组织的功能形态学。但是对蛙类运动模式的研究并没有明确涉及到树栖环境或系统发育的影响(Nauwelaerts & Aerts,2006)。本研究填补了无尾目形态、栖息地与系统发育关系三者之间研究的空白。
虽然一些研究采用了系统发育比较方法,但是有的只用了连续数据(Garland et al., 1992),有的只用了离散数据(Pagel,1994;Dang et al., 2017)。系统发育独立差(phylogenetically independent contrasts,PIC)是用来研究遗传自祖先特征相关进化的方法(Garland et al., 1992),可以用来分析连续数据。例如,Guimarã es等(2014)利用PIC方法对Chironius属的树栖生境和心脏位置的形态适应进行了分析。
Dang等(2017)提出,蛙类手的长度增加可能在对树栖环境的适应中发挥作用,但这只是推测,需要更大的样本量来验证。为了完善这一推测,本研究利用连续形态学数据和离散的生境特征,并结合系统发育关系,使用PIC方法探究无尾两栖类前肢形态和栖息地之间的关系,并探究不同的进化动力是否在不同的性状形成过程中起作用。
1 材料和方法 1.1 样本选择本研究选取隶属于无尾目7科31属629号保存完好的浸泡标本进行形态学测量。样品包括树栖蛙类2科(树蛙科和雨蛙科),非树栖蛙类5科(蟾蜍科Bufonidae、角蟾科Megophryidae、铃蟾科Bombinatoridae、叉舌蛙科Dicroglossidae和姬蛙科Microhylidae)。根据形态学描述和分布地数据鉴定物种,栖息地类型来源于Zhao和Adler(1993)、费梁等(2012)的研究结果。
1.2 样本测量使用精确度为0.1 mm的数显游标卡尺对标本进行测量(图 1):1)吻肛长(snout-vent length,SVL):吻端到泄殖腔孔后缘之间的长度,2)前臂长(桡尺骨长radio-ulna length,RL):桡尺骨远端到近端之间的长度,3)手长(hand length,HL):第三指的远端到近侧腕骨近端之间的长度。虽然有研究指出某些蛙类具有附生拇指(Masayoshi & Noriko,2009;Iwai,2013),但在本研究中,指的顺序参考费梁等(2009)(表 1)。每号标本测量3次取平均值以减少测量误差。同时,为了减小个体差异的影响,将相对前臂长(RL/SVL)和相对手长(HL/SVL)加入原始数据集(Zhao & Adler,1993;费梁等,2012)。

|
| 图 1 样本测量方法 Fig. 1 Samples measurement HL.手长hand length,RL.前臂长radio-ulna length,SVL.吻肛长snout-vent length |
| |
主成分分析(principal component analysis,PCA)是一种从复杂的数据集中提取主要信息的常用方法。使用PCA方法分析测量得到的形态学数据以了解各部分数据对整体数据的影响。然后利用Wilcoxon秩和检验探究前臂长、手长与生境之间的关系。用PIC方法将系统遗传信息纳入到连续性状相关进化的统计分析中,以此来评价在结合了系统发育关系后,Wilcoxon秩和检验的结果能否更好地解释数据。如果Wilcoxon秩和检验与PIC方法的结果具有统计学意义(显著性水平设置为α=0.05),那么假设数据相关性不受系统发育关系的影响(Guimarães et al., 2014)。从GenBank下载了31个无尾目物种的3个线粒体片段:12S rRNA(部分)、tRNA-Val(完整)和16S rRNA(部分)(表 2)构建系统进化树,为形态学数据提供拓扑结构。具体步骤如下:使用MEGA6(Tamura et al., 2013)对所下载的3个线粒体序列在默认参数下进行比对,利用最大似然法(Maximum-Likelihood,ML)重建系统发育树,利用RAxML GUI1.5b1(Silvestro & Michalak,2012)中的GTR+I模型重建ML树,以随机树为起始树进行快速自举分析(rapid bootstrap analysis),设置自举检验为1 000的非参数自举检验(nonparametric bootstrap,BSP)并单独运行搜索最佳ML树。对栖息地数据进行反正弦平方根转换(Zar,2007)。使用过原点线性回归评估形态学、生境和系统发育之间的关系(Garland et al., 1992)。利用R 3.4.1(R Core Team,2017)进行PIC分析,使用“ape”(Paradis et al., 2004)、“phytools”(Revell,2012)和“geiger”(Harmon et al., 2008)进行分析。
2 结果本研究使用RL、HL、RL/SVL和HL/SVL做PCA分析,提取出2个虚拟变量(PC1和PC2),其中PC1代表RL、HL和RL/SVL,PC2代表HL/SVL,这2个主成分共解释了整个数据集77%的方差。这一步的主要目的是为了了解所选择的特征值是否可以将蛙类的栖息地很好地分开,从分析结果来看,树栖蛙类和非树栖蛙类有明显区分,同时也揭示了基于RL和HL的清晰分组。这说明了RL和HL对整体数据结构的重要作用,以及这些变量在后续分析中的相关性(图 2)。
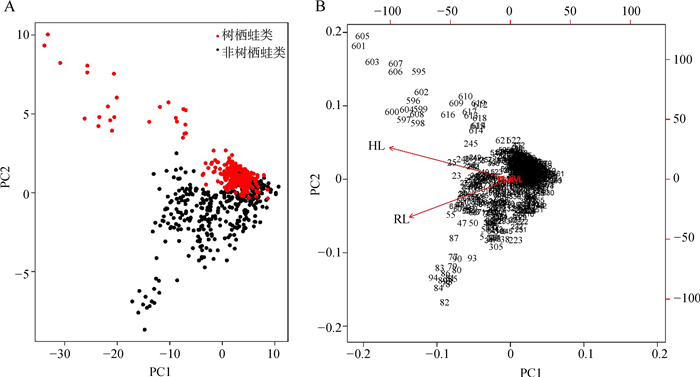
|
| 图 2 样品主成分分析散点分布 Fig. 2 Principal component analysis plot distribution of samples A.所有样本在虚拟变量下的分布状态,B.解释向量与变量(手长和前臂长)有关 A. Interpreting points of all samples, B. The interpreting vectors correlative to variables (hand length and radio-ulna length) |
| |
Wilcoxon秩和检验的结果显示,RL、RL/SVL、HL/SVL与栖息地之间的关系均有统计学意义(RL:P=1.16e-14,RL/SVL:P=1.77e-05,HL/SVL:P < 2.2e-16),但是HL与栖息地之间的关系无统计学意义(P=0.850 9)(表 1,图 3)。
| 前臂长RL | 相对前臂长RL/SVL | 手长HL | 相对手长HL/SVL | ||
| Wilcoxon秩和检验 | P | 1.16e-14 | 1.77e-05 | 0.850 9 | 2.20e-16 |
| PIC | P | 0.461 | 0.058 4 | 0.252 0 | 2.34e-05* |
| r2 | 0.018 9 | 0.118 1 | 0.044 9 | 0.465 8 |

|
| 图 3 树栖蛙类和非树栖蛙类前臂长和手长、相对前臂长和相对手长的比较结果 Fig. 3 Comparison of radio-ulna length (RL) and hand length (HL), RL/snout-vent length (SVL) and HL/SVL between arboreal and non-arboreal species |
| |
ML系统树的拓扑结构与此前对无尾目(Zhang et al., 2013)的研究结果一致(图 4),结果支持无尾目的单系结构,铃蟾科和角蟾科为早先分化的类群。蟾蜍科和雨蛙科为姐妹群关系(BSP=100),叉舌蛙科和树蛙科聚为一单系支(BSP=93),该单系与姬蛙科形成姐妹群关系(BSP=98)。树蛙科、叉舌蛙科和姬蛙科形成的单系支与蟾蜍科和雨蛙科一支为姐妹群关系。可见,基于目前取样数据,本研究涉及的雨蛙科和树蛙科的树栖生活类型为独立进化而来。在校正了系统发育的影响后,只有栖息地与HL/SVL之间的关系有统计学意义(r2=0.465 8,P=2.34e-05)(表 1)。
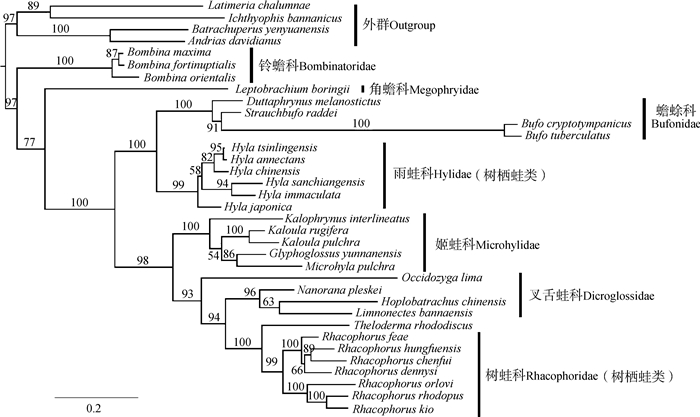
|
| 图 4 基于线粒体12S rRNA (部分)、tRNA-Val(完整)、16S rRNA(部分)基因序列构建的31种无尾两栖类的最大似然树 Fig. 4 Phylogenetic relationship (as shown by Maximum-Likelihood tree) of 31 anurans inferred from 12S rRNA (partial),tRNA-Val (complete) and 16S rRNA (partial) of mitochondrial genes |
| |
本研究将前肢分为前臂和手分开测量。在校正个体大小差异前,手长与栖息地之间的关系经过Wilcoxon秩和检验和PIC检验均无统计学意义,这个结果反映了树栖蛙类体型的广泛变化(Frost,2018)。校正个体大小差异后,相对手长的PIC和Wilcoxon秩和检验的结果显示差异均有统计学意义,这表明在树栖蛙类手长的进化中,树栖环境比系统发育关系起更重要的作用。Wilcoxon秩和检验结果显示,前臂长和相对前臂长与栖息地关系的差异均有统计学意义,但是使用PIC方法去除系统发育关系的影响后,其差异均无统计学意义,这表明即使去除了系统发育关系,前臂长本身就具有强烈的遗传信号,即前臂长主要受遗传的影响,受栖息地影响较弱。
综上所述,树栖蛙类的前肢相对于非树栖蛙类较长是一种对树栖环境的适应,这与Gray等(1997)和Manzano等(2008)的研究结果吻合,本研究在这一基础上进一步揭示了树栖蛙类前肢的延长主要是手在环境作用下的延长,在树栖环境下的蛙类使用手通过一系列复杂的动作进食(Gray et al., 1997),手部要做出复杂的动作,必然出现相应的形态学特化。而前臂长主要受遗传因素的影响,与生境的关系并不明显。灵长类在树枝间移动需要手的抓握能力来保持身体平衡(Isler,2005),Kirk等(2008)提出与非树栖哺乳类相比,树栖哺乳类有较长的手指。尽管本研究只测量了前臂长和手长,未将手长分为手掌和手指分别测量,但是树栖蛙类前肢相对较长主要是由于手部延长这一观点仍然与这个结论一致。本研究结果将有助于更好地了解前肢形态的进化与生境之间的关系,进而为无尾目物种的环境适应性进化研究提供支持。
| 费梁, 叶昌媛, 胡淑琴, 等. 2009. 中国动物志两栖纲(中卷)无尾目[M]. 北京: 科学出版社. |
| 费梁, 叶昌媛, 江建平. 2012. 中国两栖动物及其分布彩色图鉴[M]. 成都: 四川科学技术出版社. |
| Bossuyt F, Milinkovitch MC. 2000. Convergent adaptive radiations in Madagascan and Asian ranid frogs reveal covariation between larval and adult traits[J]. Proceedings of the National Academy of Sciences of the United States of America, 97: 6585–6590. DOI:10.1073/pnas.97.12.6585 |
| Dang NX, Wang JS, Liang J, et al. 2017. The specialisation of the third metacarpal and hand in arboreal frogs:adaptation for arboreal habitat?[J]. Acta Zoological: 1–11. |
| Frost DR. 2018. Amphibian species of the world: an online reference. Version 6. 0[EB/OL]. (2017-12-20). http://research.amnh.org/herpetology/amphibia/index.html. |
| Garland T, Harvey PH, Ives AR, et al. 1992. Procedures for the analysis of comparative data using phylogenetically independent contrasts[J]. Systematic Biology, 41(1): 18–32. DOI:10.1093/sysbio/41.1.18 |
| Gray LA, Oreilly JC, Nishikawa KC, et al. 1997. Evolution of forelimb movement patterns for prey manipulation in anurans[J]. Journal of Experimental Zoology, 277(6): 417–424. DOI:10.1002/(ISSN)1097-010X |
| Guimarães MD, Gaiarsa MP, Cavalheri HB, et al. 2014. Morphological adaptations to arboreal habitats and heart position in species of the neotropical whipsnakes genus Chironius[J]. Acta Zoologica, 95(3): 341–346. DOI:10.1111/azo.2014.95.issue-3 |
| Harmon LJ, Weir JT, Brock CD, et al. 2008. GEIGER:investigating evolutionary radiations[J]. Bioinformatics, 24(1): 129–131. DOI:10.1093/bioinformatics/btm538 |
| Isler K. 2005. 3D-kinematics of vertical climbing in hominoids[J]. American Journal of Physical Anthropology, 126(1): 66–81. DOI:10.1002/(ISSN)1096-8644 |
| Iwai N. 2013. Morphology, function and evolution of the pseudothumb in the Otton frog[J]. Journal of Zoology, 289(2): 127–133. DOI:10.1111/jzo.2013.289.issue-2 |
| Kirk EC, Lemelin P, Hamrick MW, et al. 2008. Intrinsic hand proportions of euarchontans and other mammals:implications for the locomotor behavior of plesiadapiforms[J]. Journal of Human Evolution, 55(2): 278–299. DOI:10.1016/j.jhevol.2008.02.008 |
| Li JT, Li Y, Klaus S, et al. 2013. Diversification of rhacophorid frogs provides evidence for accelerated faunal exchange between India and Eurasia during the Oligocene[J]. Proceedings of the National Academy of Sciences of the United States of America, 110(9): 3441–3446. DOI:10.1073/pnas.1300881110 |
| Li JT, Wang J, Nian H, et al. 2015. Amphibians crossing the Bering Land Bridge:evidence from Holarctic treefrogs (Hyla, Hylidae, Anura)[J]. Molecular Phylogenetics & Evolution, 87: 80–90. |
| Manzano AS, Abdala V, Herrel A, et al. 2008. Morphology and function of the forelimb in arboreal frogs:specializations for grasping ability[J]. Journal of Anatomy, 213(3): 296–307. DOI:10.1111/joa.2008.213.issue-3 |
| Nauwelaerts S, Aerts P. 2006. Take-off and landing forces in jumping frogs[J]. The Journal of Experimental Biology, 209(1): 66–77. DOI:10.1242/jeb.01969 |
| Pagel M. 1994. Detectingcorrelated evolution on phylogenies:a general method for the comparative analysis of discrete characters[J]. Proceedings of The Royal Society B:Biological Sciences, 255(1342): 37–45. DOI:10.1098/rspb.1994.0006 |
| Paradis E, Claude J, Strimmer K, et al. 2004. APE:analyses of phylogenetics and evolution in R language[J]. Bioinformatics, 20(2): 289–290. DOI:10.1093/bioinformatics/btg412 |
| R Core Team. 2017. R: a language and environment for statistical computing[CP/OL]. (2017-03-06)[2018-1-11]. https://www.R-project.org/. |
| Revell LJ. 2012. phytools:an R package for phylogenetic comparative biology (and other things)[J]. Methods in Ecology and Evolution, 3(2): 217–223. DOI:10.1111/j.2041-210X.2011.00169.x |
| Silvestro D, Michalak I. 2012. raxmlGUI:a graphical front-end for RAxML[J]. Organisms Diversity & Evolution, 12(4): 335–337. |
| Smith SA, Stephens PR, Wiens JJ, et al. 2005. Replicate patterns of species richness, historical biogeography, and phylogeny in Holarctic treefrogs[J]. Evolution, 59(11): 2433–2450. DOI:10.1111/evo.2005.59.issue-11 |
| Tamura K, Stecher G, Peterson D, et al. 2013. MEGA6:molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 30(12): 2725–2729. DOI:10.1093/molbev/mst197 |
| Zar JH. 2007. Biostatistical analysis 5th ed[M]. New Jersey: Pearson Prentice Hall. |
| Zhang P, Liang D, Mao R, et al. 2013. Efficient sequencing of Anuran mtDNAs and a mitogenomic exploration of the phylogeny and evolution of frogs[J]. Molecular Biology and Evolution, 30(8): 1899–1915. DOI:10.1093/molbev/mst091 |
| Zhao EM, Adler K. 1993. Herpetology of China[M]. Oxford: Society for the Study of Amphibians and Reptiles Press. |
 2018, Vol. 37
2018, Vol. 37




