扩展功能
文章信息
- 魏诗航, 彭旭, 韦世元, 施雪旎, 何学令, 刘艳, 尹海林
- WEI Shihang, PENG Xu, WEI Shiyuan, SHI Xueni, HE Xueling, LIU Yan, YIN Hailin
- 尾静脉注射EMT-6细胞建立转移性肺癌模型的研究
- Establishment of Metastasis Lung Cancer Model by Injection of EMT-6 Cells in BALB/c Mice
- 四川动物, 2018, 37(2): 191-196
- Sichuan Journal of Zoology, 2018, 37(2): 191-196
- 10.11984/j.issn.1000-7083.20170178
-
文章历史
- 收稿日期: 2017-06-06
- 接受日期: 2017-10-13
2. 四川大学实验动物中心, 成都 610041
2. Laboratory Animal Centre, Sichuan University, Chengdu 610041, China
目前,肺癌是世界范围内发病率和病死率最高的恶性肿瘤,在我国呈逐年上升的趋势(Kuper et al., 2002;中华人民共和国卫生部,2008;陈万青等,2010)。由于肺部毛细血管十分丰富,位于整个循环系统的中心,肺循环中因有双重动脉而易发生肺转移癌,因此,肺又是恶性肿瘤转移最常见器官。根据肺外恶性肿瘤患者尸检统计,其肺转移比例可达20%~54%(邵少等,2011),可见肺转移是多种肿瘤的致死原因,对于肺转移及肺癌的研究已成为肿瘤研究的一大热点(Jemal,2011)。而肺癌疗效得不到提高的主要原因在于其临床表现复杂,难以在早期发现,为制订更有效的肺癌治疗方法,模拟出与人类肺癌病因、发病机制、发展过程相似的动物模型,是肺癌研究的重点。因此,建立多个稳定性好、重复性高、临床特征明显、评价指标客观的实验动物模型是研究转移性肺癌的基础。可靠的实验动物模型可模拟体内过程,对于准确观察肿瘤生长特性、评估药物疗效至关重要,也能为进一步的临床治疗提供理论依据。由于小鼠肺组织在形态、分子特征上与人类相近,且人类所有基因几乎都可以在小鼠上找到同源基因(Gitton et al., 2002;Dragani,2003),而小鼠繁殖周期短、生长快,所以在肿瘤研究领域中被广泛使用(张永江等,2002)。随着肿瘤免疫治疗领域研究的兴起,越来越多的实验利用具有完整免疫功能的小鼠来建立符合研究需要的转移性肺癌模型。虽然通过小鼠尾静脉注射癌细胞建立转移性肺癌模型的方法常被采用,但在对此类肺癌模型的评价指标方面差异较多,对其适合实验的窗口期和模型的重复性无系统的探讨。目前,除了用黑色素瘤细胞(B16)尾静脉注射小鼠建立的肺癌模型特征稳定、应用较多外,规范化的免疫功能正常的转移性肺癌小鼠模型还比较少,采用EMT-6细胞建立转移性肺癌模型的报道也几乎没有。因此,构建更多免疫系统完整、功能正常、临床特征稳定、评价指标明确的转移性肺癌实验动物模型,是提高肺癌免疫治疗研究水平的基础,也是确定研究结果普遍性的保证。
本实验通过尾静脉注射高、中、低3个浓度的EMT-6细胞株建立稳定、可靠的转移性肺癌BALB/c小鼠模型,探索癌细胞注射浓度与肿瘤发展程度之间的关系,给出适合的研究时间窗口期;并通过3次重复性实验和细化临床观察指标,来评价EMT-6细胞转移性肺癌BALB/c小鼠模型的稳定性,提出规范化的模型评价指标体系。
1 材料与方法 1.1 材料 1.1.1 实验动物5~7周龄雌性BALB/c小鼠,体质量16~22 g,四川大学实验动物中心提供,生产许可证号:SCXK(川)2013-026。SPF条件下饲养,保持通风、温度、湿度等适宜,饮食正常,使用许可证号:SYXK(川)2013-185。所有动物实验程序都由四川大学实验动物中心动物实验伦理委员会评估批准。
1.1.2 细胞株鼠源乳腺癌EMT-6细胞株由四川大学华西医院卫生部移植工程和移植免疫重点实验室提供。
1.1.3 主要试剂RPMI 1640培养基、胎牛血清、胰蛋白酶和磷酸盐缓冲液(PBS)购于美国Gibco公司,青-链双抗购于美国Hy-clone公司。
1.2 方法 1.2.1 EMT-6细胞培养及悬浮液制备EMT-6细胞在RPMI 1640培养液(含10%胎牛血清、100 U·mL-1青链霉素)、5%CO2、37 ℃培养箱中培养。收集指数生长期的鼠源EMT-6细胞,先用PBS清洗2次,0.25%胰蛋白酶消化,1 000 r·min-1离心5 min去上清,再用RPMI 1640培养基清洗,1 000 r·min-1离心5 min去上清,计细胞数,用PBS稀释为1×106个/mL (高浓度)、5×105个/mL (中浓度)、1×105个/mL (低浓度)3个浓度,制备不同浓度EMT-6细胞悬浮液。
1.2.2 EMT-6细胞转移性肺癌BALB/c小鼠模型的建立将75只雌性BALB/c小鼠在SPF条件下饲养1周适应后,按尾静脉注射细胞悬液浓度分为3组,即高浓度组、中浓度组和低浓度组,每组25只小鼠,每只注射0.2 mL。在预设时间点(7 d、14 d、21 d、28 d、35 d)每组各解剖5只,取肺观察肺表面成瘤情况,并计算成瘤率;再将肺组织用10%多聚甲醛固定,苏木精-伊红(HE)染色,进行组织病理学分析。评价最佳注射细胞悬液浓度,以此浓度建立EMT-6细胞转移性肺癌BALB/c小鼠模型,然后重复实验3次。比较重复实验每个时间点的肿瘤灶个数和成瘤生存期数据,验证模型的重复性、成瘤情况和小鼠生存时间的一致性。
1.2.3 观察指标接种EMT-6细胞后的一般状况:小鼠的采食、外形和毛发,以及精神等临床症状的情况,并在预设时间点(实验前7 d、7 d、14 d、21 d、28 d、35 d)测量小鼠体质量。
肿瘤灶数:在预设时间点(7 d、14 d、21 d、28 d、35 d)随机取5只小鼠采血并解剖,肉眼观察肺表面肿瘤灶情况并计数。
1.2.4 组织病理学检测各组小鼠的肺组织用10%多聚甲醛固定,按照常规方法制成石蜡切片,HE染色后在光学显微镜下观察。
1.3 统计学分析使用SPSS 19.0分析,数据以平均数±标准差表示,采用单因素方差分析及t检验比较,P<0.05表示差异具有统计学意义。
2 结果与分析 2.1 不同浓度EMT-6细胞转移性肺癌BALB/c小鼠模型的生存期BALB/c小鼠尾静脉注射EMT-6细胞后,高浓度组10 d开始出现死亡,18 d内全部死亡;中浓度组11 d开始出现死亡,28 d内全部死亡;低浓度组24 d开始出现死亡,42 d内全部死亡;根据3组小鼠的生存情况,绘制KM生存曲线(图 1),小鼠的生存时间随着EMT-6细胞浓度的降低而延长。其中,高浓度组10 d、中浓度组11 d、低浓度组21 d后解剖小鼠发现,肺表面均有白色肿瘤灶,成瘤率为100%。因此,相比高浓度组和中浓度组,低浓度组高成瘤率、早期低死亡率、42 d的生存期为研究提供了实验窗口期适合的肺癌模型。
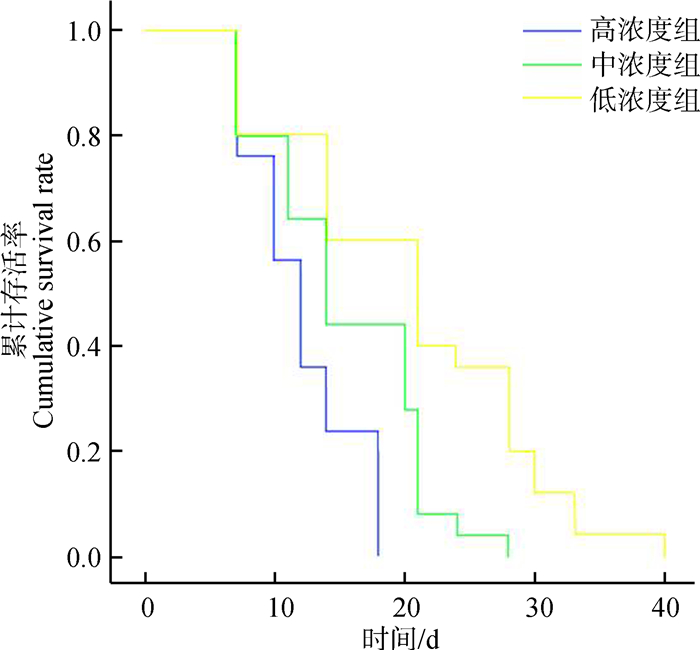
|
| 图 1 不同浓度EMT-6细胞转移性肺癌BALB/c小鼠模型生存期 Fig. 1 The lifetime of BALB/c mice with metastasis lung cancer by injection of EMT-6 cells at different concentrations |
| |
EMT-6细胞转移性肺癌BALB/c小鼠模型成瘤后体质量逐渐下降(图 2),临死前的临床症状主要表现为食欲不振、外形消瘦、毛发竖立、外表不整洁、有时弓背、对外界刺激反应迟钝、表现不活泼,以及目光呆滞、精神状态欠佳。最早死亡时间出现在接种癌细胞后21 d,42 d内小鼠全部死亡。注射癌细胞后14 d,解剖发现部分小鼠肺表面开始出现白色、类圆形的肿瘤灶,21 d解剖发现所有小鼠肺表面有数量不等的肿瘤灶,成瘤率为100%,28 d解剖发现肺部表面白色肿瘤灶明显增多(图 3),而其他脏器未发现肿瘤灶。接种EMT-6细胞后3周,小鼠开始出现取食下降;接种后4周,小鼠出现个体消瘦、毛发竖立、外表不整洁,死亡前还出现对外界刺激反应迟钝、不活跃以及目光呆滞、精神状态欠佳,甚至出现弓背状态(表 1)。其中,死亡与各观察指标的出现具有很强的相关性,可以在研究过程中将上述观察指标作为该肺癌模型的重要评价指标。
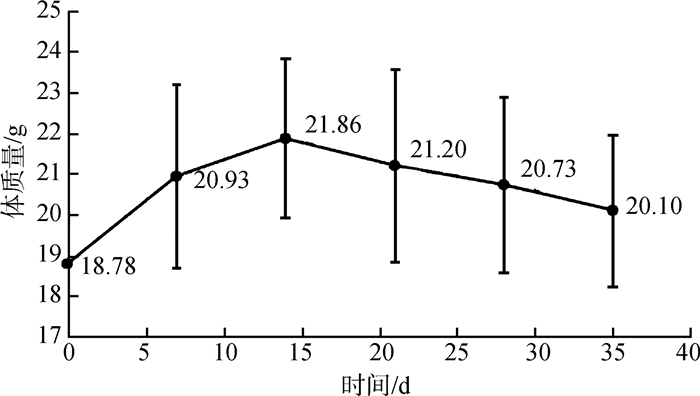
|
| 图 2 EMT-6细胞转移性肺癌BALB/c小鼠模型体质量变化(4次实验,每个时间点n=20) Fig. 2 Body mass change of metastasis lung cancer model byinjection of EMT-6 cells in BALB/c mice (4 experiments, n=20 at each time point) |
| |
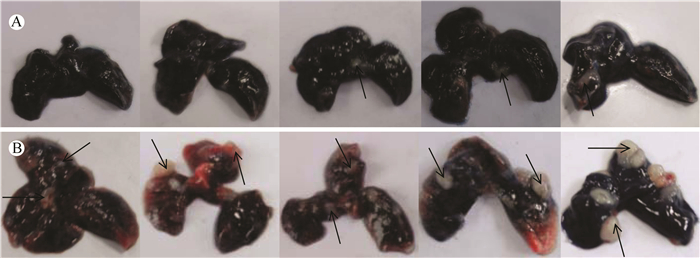
|
| 图 3 EMT-6细胞转移性肺癌BALB/c小鼠模型解剖后肺部情况 Fig. 3 Gross appearance of metastasis lung cancer model by injection of EMT-6 cells in BALB/c mice A. 14 d解剖发现,肺表面开始出现少量肿瘤灶(箭头处);B. 21 d解剖发现,肺表面肿瘤灶明显增多,且成瘤率为100% A. day 14, lung tissue (arrows mark the tumors); B. day 21, lung tissue, and the tumor formation rate is 100% |
| |
| 注射癌细胞后时间/d | 小鼠数量/只 | ||||
| 毛发竖立、外表不整洁 | 外形消瘦 | 反应迟钝、不活跃 | 目光呆滞、萎靡不振(弓背) | 死亡 | |
| 7(n=75) | 0 | 0 | 0 | 0 | 0 |
| 14(n=60) | 0 | 0 | 0 | 0 | 0 |
| 21(n=45) | 3 | 2 | 2 | 0 | 2 |
| 28(n=28) | 2 | 4 | 4 | 2 | 2 |
| 29~35(n=15) | 4 | 5 | 5 | 3 | 5 |
| 35~42(n=15) | 10 | 9 | 7 | 5 | 10 |
一般观察到毛发竖立、外表不整洁、外形消瘦,1周内小鼠便会死亡,观察到持续性的反应迟钝、不活跃和目光呆滞、萎靡不振,小鼠在2 d内便会死亡。
2.3 EMT-6细胞转移性肺癌BALB/c小鼠模型重复性实验第2次和第3次实验与第1次实验相比,每个时间点小鼠肺表面的肿瘤灶个数差异无统计学意义(P>0.05),小鼠生存时间基本一致,差异无统计学意义(P>0.05)(表 2)。
| 实验重复次数 | 预设时间/d | 小鼠数量/只 | 肺部肿瘤灶数量/个(与第1次比较的 P 值) | 死亡时间/d | 平均生存期/d(与第1次比较的 P 值) |
| 1 | 7 | 5 | 0.0±0.0 | 34~42 | 36±6.1 |
| 14 | 5 | 0.7±0.6 | |||
| 21 | 5 | 3.3±0.6 | |||
| 28 | 5 | 8.3±1.5 | |||
| 35 | 5 | 12.7±2.1 | |||
| 2 | 7 | 5 | 0.0±0.0 | 29~42 | 34±6.3(0.730) |
| 14 | 5 | 0.7±0.6(1) | |||
| 21 | 5 | 3.3±1.2(1) | |||
| 28 | 5 | 8.3±0.6(1) | |||
| 35 | 5 | 11.7±1.2(0.507) | |||
| 3 | 7 | 5 | 0.0±0.0 | 27~40 | 31±6.0(0.211) |
| 14 | 5 | 0.7±0.6(1) | |||
| 21 | 5 | 3.3±0.6(1) | |||
| 28 | 5 | 8.7±0.6(0.742) | |||
| 35 | 5 | 13.3±1.2(0.653) |
在EMT-6细胞转移性肺癌BALB/c小鼠模型中,肺表面的肿瘤灶明显,取肺组织用10%多聚甲醛固定,常规石蜡包埋切片,HE染色,400目光镜下观察可见肿瘤灶(图 4)。与7 d未见肿瘤灶的肺组织相比,21 d、28 d、35 d的癌细胞排列紧密,呈圆形或椭圆形,核大深染,质内见少量淋巴细胞浸润,周围有丰富的新生毛细血管;而其他脏器未见转移灶。
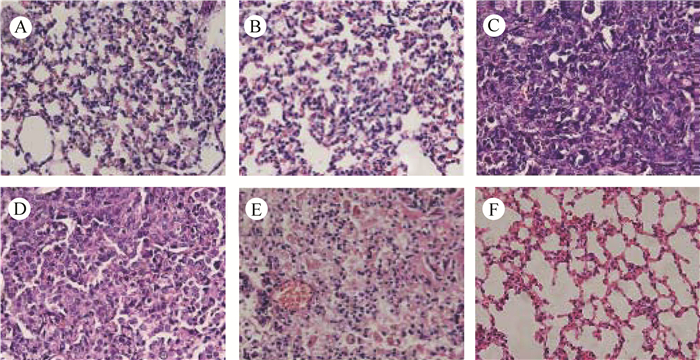
|
| 图 4 EMT-6细胞转移性肺癌BALB/c小鼠模型肺组织病理学检测(×400) Fig. 4 Histological analysis of metastasis lung cancer model by injection of EMT-6 cells in BALB/c mice (×400) A. 7 d,B. 14 d,C. 21 d,D. 28 d,E. 35 d,F.正常肺组织 A. 7 d, B. 14 d, C. 21 d, D. 28 d, E. 35 d, F. normal lung tissue |
| |
肿瘤实验动物模型是人类肿瘤疾病的复制和模拟,在肿瘤发病机制研究以及治疗药物筛选等领域发挥着重要作用。肿瘤转移是指恶性肿瘤细胞脱离原发肿瘤,转移达到继发组织或器官后得以继续增殖生长,形成与原发瘤病理组织学相同的继发性肿瘤的全过程(Chaffer & Weinberg,2010)。而肺转移动物模型分为自发性和实验性肺转移动物模型,将EMT-6细胞通过尾静脉注射到BALB/c小鼠体内而形成的肺转移为实验性肺转移(Price,1996)。实验性肺转移在尾静脉接种癌细胞后,癌细胞随血液循环能更快地在远端增殖,可在肺部形成明显的转移肿瘤灶(Rose & Connolly,1997)。
本研究通过常规建模的方法,选用BALB/c小鼠尾静脉分别注射0.2 mL高、中、低3个浓度的EMT-6细胞悬液,再根据模型成瘤时间、成瘤率以及生存期,最终选择0.2 mL细胞浓度1×105个/mL进行注射,建立一种符合研究时间窗口期要求,有适当时间处理、观察、评价的转移性肺癌动物模型。本研究进一步对该模型的临床症状、肺部肿瘤灶数量、肺组织病理学进行了研究,发现这种转移性肺癌BALB/c小鼠模型成瘤后,表现为食欲不振、体质量下降、外形消瘦、对外界刺激反应迟钝、活动减少、目光呆滞、萎靡不振直至死亡等临床症状,与临床上癌症病人相似;肺部瘤灶易于辨别计数,造模14 d后,部分小鼠肺表面开始出现肉眼可见的白色肿瘤灶,造模21 d后,全部小鼠肺表面均出现肉眼可见的白色肿瘤灶,成瘤率为100%;造模21 d后,小鼠开始出现死亡,且肺表面肿瘤灶增多、体积变大,造模42 d内小鼠全部死亡。本实验模型为研究转移性肺癌发展的各个阶段和实验用药治疗留下了时间长短适合的窗口期和明确简单的临床判定指标。病理学检测结果表明,模型的肺癌组织学特征典型明显。转移性肺癌BALB/c小鼠模型的3次重复性实验结果表明,该模型临床特征明显,病理符合肺癌的组织学特征,评价指标明确系统,而且模型的生物学特征稳定,重复性好,肺部肿瘤灶个数、生存时间一致,差异无统计学意义,也未出现其他脏器的转移,与肺原位接种方法建立的肺癌模型病理结果类似(刘馨等,2010),为转移性肺癌治疗药物的设计、给药方案的确定、评价体系规范的建立提供了可靠的实验研究基础。
致谢: 感谢尹海林老师、四川大学动物实验中心各位老师、师姐、师弟对实验的帮助与支持。| 陈万青, 张思维, 邹小农, 等. 2010. 中国肺癌发病死亡的估计和流行趋势研究[J]. 中国肺癌杂志, 13(5): 488–491. |
| 刘馨, 伍治平, 左曙光, 等. 2010. 小鼠Lewis肺癌原位模型的构建[J]. 中国肺癌杂志, 1(1): 42–47. |
| 邵少, 庄乾春, 单奔, 等. 2011. 食管癌肺转移42例X线及CT诊断[J]. 山西医药杂志, 40(1): 45–46. |
| 张永江, 陈洪岩, 夏友, 等. 2002. 实验研究中实验动物的选择及其相关干扰因素叨[J]. 中国实验动物学杂志, 12(5): 316–319. |
| 中华人民共和国卫生部. 2008. 第三次全国死因调查主要情况[J]. 中国肿瘤, 17(5): 344–345. |
| Chaffer CL, Weinberg RA. 2011. A perspective on cancer cell metastasis[J]. Science, 331(604): 1559–1564. |
| Dragani TA. 2003. 10 years of mouse cancer modifier loci:human-relevance[J]. Cancer Research, 63(12): 3011–3018. |
| Gitton Y, Dahmane N, Baid S, et al. 2002. A gene expression map of human chromosome 21 orthologues in the mouse[J]. Nature, 420(6915): 586–590. DOI:10.1038/nature01270 |
| Jemal A, Bray F, Center MM, et al. 2011. Global cancer statistics[J]. CA-A Cancer Journal for Clinicians, 61(2): 69–90. DOI:10.3322/caac.v61:2 |
| Kuper H, Adami HO, Boffetta P, et al. 2002. Tobacco use, cancer causation and public health impact[J]. Journal of International Medical Research, 251: 455–466. DOI:10.1046/j.1365-2796.2002.00993.x |
| Price JE. 1996. Metastasis from human breast cancer cell lines[J]. Breast Cancer Research and Treatment, 39(1): 93–102. DOI:10.1007/BF01806081 |
| Rose DP, Connolly JM. 1997. Dietary fat and breast cancer metastasis by human tumor xenografts[J]. Breast Cancer Research and Treatment, 46(2-3): 225–237. DOI:10.1023/A:1005971317978 |
 2018, Vol. 37
2018, Vol. 37




