扩展功能
文章信息
- 何文凤, 段振渊, 时磊
- HE Wenfeng, DUAN Zhenyuan, SHI Lei
- 吐鲁番沙虎对不同食物化合物的反应
- Response of Teratoscincus roborowskii to Major Food-chemical Categories
- 四川动物, 2018, 37(2): 179-184
- Sichuan Journal of Zoology, 2018, 37(2): 179-184
- 10.11984/j.issn.1000-7083.20170270
-
文章历史
- 收稿日期: 2017-08-31
- 接受日期: 2018-01-03
爬行动物的化学感受系统包括犁鼻器、味觉和鼻嗅觉等(Halpern,1992;Filoramo & Schwenk,2009)。化学信息在有鳞目 Squamata 动物的行为中发挥重要作用,如个体识别(Aragon et al., 2001)、配偶选择(Labra et al., 2001;Olsson et al., 2003)、捕食者识别(Dial & Schwenk,1996;Webb et al., 2009)以及防御性行为(Halpern,1992;Cabido et al., 2004)等。
蜥蜴主要通过犁鼻器识别化学线索来定位猎物,并对猎物作出反应(Cooper & Burghardt,1990;Besson et al., 2009)。蜥蜴通过舌头收集化学信息,进而用犁鼻器识别化学刺激发现和定位猎物(Cooper, 1995, 1997, 2007),这些化学信息对蜥蜴发现隐藏的猎物尤为重要(Auffenberg,1984)。弹舌(tongue-flick,TF)试验揭示了蜥蜴对食物的化学识别机制,蜥蜴通过弹舌来检测食物、配偶信息和捕食者(Baeckens et al., 2017)。棉签法常用于蜥蜴的化学信息识别研究,即用棉签浸渍化学物质,通过测量弹舌和咬的数量确定蜥蜴的响应程度,无弹舌表示其对化学信号无响应(Cooper, 1998, 1999;Cooper et al., 2001)。研究证实,犁鼻器化学感受对一些蜥蜴和蛇类的猎物化学识别是必需的(Cooper & Alberts,1991)。
国内已报道的动物的化学识别能力研究主要是小型节肢动物,涉及食物(汪波等,2014)和识别配偶(陈海锋,2017)等。目前关于吐鲁番沙虎 Teratoscincus roborowskii 的研究主要集中在幼体拟态(Autumn & Han,1989)、捕食模式(Werner et al., 1997)、活动节律(宋玉成等,2009)、年龄鉴定(李文蓉等,2010)、食性与两性异形(刘洋等,2010)、巢域面积(李文蓉等,2013)和洞穴结构(Song et al., 2017)等。吐鲁番沙虎在夏季摄食大量的刺山柑 Capparis spinosa 果实(刘洋等,2010),其消化道可以提高刺山柑种子吸水和萌发率(林英英等,2016)。夜行性哺乳动物主要通过气味识别和定位果实(Nevo et al., 2016)。然而,尚不清楚严格夜行性的吐鲁番沙虎(宋玉成等,2009)如何在黑夜中发现并定位刺山柑果实。通过人工模拟猎物刺激(棉签法)的试验研究表明,楔齿蜥 Sphenodon punctatus 和鳄蜥 Shinisaurus crocodilurus 使用犁鼻器定位食物(Cooper & Pérez-Mellado,2001;蒋洁等,2009)。因此,推测吐鲁番沙虎可能利用犁鼻器进行食物的化学识别并定位果实。本研究通过棉签法来检测吐鲁番沙虎食物化学识别能力,为检验其能否使用犁鼻器探测猎物提供试验证据。
1 材料和方法 1.1 试验动物以栖息于中国西北部吐鲁番地区的中国特有种吐鲁番沙虎(Macey et al., 1997;时磊等,2002)为试验动物,用数显游标卡尺(±0.01 mm)测量其吻肛长(snout-vent length,SVL):SVL≥75.52 mm的个体被判定为性成熟(宋玉成等,2009)。按性别和SVL将其分为3组:成体雌性(n=16)、成体雄性(n=8)、亚成体(n=21)。实验室暂养期间,每周投喂2次黄粉虫 Tenebrio molitor 和1次水;为了能更好地激发猎物识别能力,正式试验前禁食4 d;试验室内温度维持在野外吐鲁番沙虎活跃期的20~28 ℃(宋玉成等,2009)。
1.2 刺激物配制饱和蔗糖溶液(6.27 mol·L-1)作为碳水化合物、纯猪肉脂肪(主要是甘油三酯)作为脂类的复杂混合物、大豆蛋白粉溶液作为蛋白质。蒸馏水为对照组,饱和蔗糖溶液、脂肪和蛋白质溶液为试验组。
1.3 试验过程吐鲁番沙虎是严格夜行性动物,难以摄像观察其觅食过程。研究表明,红光对吐鲁番沙虎的行为没有影响(宋玉成等,2009),因此,用Sony HXR-MC1500C摄像机在低照度(红光补偿)下记录全部试验过程。将棉签缓慢移到距吐鲁番沙虎吻部1.0~1.5 cm的位置,观察其对不同化学信号的反应。将棉签浸入饱和蔗糖溶液、插入到纯猪肉脂肪和浸入蛋白质溶液作为3个化学信号刺激源。试验没有实施刺激性气味控制,因为研究表明,蜥蜴可以区分特异性的气味与生态无关的气味(Cooper & Pérez-Mellado,2002)。试验采用随机区组组合,每次试验间隔30 min。从吐鲁番沙虎第一次弹舌开始计时并持续60 s,如吐鲁番沙虎咬或舔棉签,则试验终止(Cooper,1999;Cooper et al., 2001)。每次试验中,试验者记录发生第一次弹舌的时间、弹舌数和到发生咬或舔的延迟时间(latency time of biting or licking,latency)。
1.4 参数定义咬或舔的延迟时间是吐鲁番沙虎第一次弹舌到发生咬或舔的间隔时间长度,单位为s;弹舌速率(tongue-flicks rate,TFR)是吐鲁番沙虎60 s内的弹舌速率;若吐鲁番沙虎咬或舔棉签,则弹舌速率的计算公式如下:
TFRi=TFi/latencyi×60(Halpern & Frumin,1979)。其中,i表示某组刺激物试验中的某个吐鲁番沙虎个体。
若吐鲁番沙虎不咬或不舔棉签,则TFRi=TFi。
弹舌攻击得分[tongue-flicks attack scores,TFAS(R)]是吐鲁番沙虎弹舌和咬或舔的综合评价指标;最大弹舌数(max tongue-flicks,TFmax)是某试验组内吐鲁番沙虎所有个体的最大弹舌数;若吐鲁番沙虎咬或舔棉签,则TFAS(R)由两部分组成,一个是咬或舔的延迟时间,另一个是最大弹舌数,计算公式:TFAS(R)i=TFmax+(60-latencyi)(Cooper & Burghardt,1990)。
若吐鲁番沙虎不咬或不舔棉签,则TFAS(R)等于60 s内的弹舌数,即TFAS(R)i=TFi(Cooper & Burghardt,1990)。该指标在延迟期较短时赋予咬或舔更大的权重,因为短暂延迟后的咬或舔表明食物的快速识别。
1.5 统计分析采用Excel 2007整理数据和制作图表,用SPSS 19.0处理数据。先用Kolmogorov-Smirnov和Levene's检验分别检验数据的正态性和方差同质性,吐鲁番沙虎对不同食物化合物的TFR和TFAS(R)均不满足方差齐性(P<0.05),故使用独立样本Kruskal-Wallis秩和检验组间差异。描述性统计值用平均值±标准误表示,显著性水平设置为α=0.05。
单因素方差分析结果发现,对照组与试验组内雌雄个体、成体及亚成体在TFR和TFAS(R)2个指标的差异无统计学意义(P>0.05)。因此,本文将雌雄个体、成体及亚成体数据合并分析。
2 结果 2.1 吐鲁番沙虎对不同食物化合物的响应吐鲁番沙虎对蒸馏水表现出最高的TFR、最大的TF数和最长的延迟时间,对脂肪表现出最高的TFAS(R)值(表 1)。
| 指标 Index |
平均值±标准误Mean±SE(范围Range) | |||
| 蒸馏水 Distilled water(n=39) |
脂肪 Lipid(n=20) |
蛋白质溶液 Protein solution(n=22) |
饱和蔗糖溶液 Saturated sugar solution(n=26) |
|
| 弹舌数 TF | 9.64±1.20(1~34) | 4.20±0.86(1~16) | 2.86±0.37(1~8) | 7.54±1.30(1~23) |
| 延迟时间 Latency/s | 57.90±1.34(12~60) | 48.55±2.33(23~60) | 55.14±1.79(24~60) | 57.31±1.54(32~60) |
| 弹舌速率 TFR | 12.11±1.98(1~65) | 6.39±2.02(1~42) | 3.14±0.38(1~8) | 8.80±1.39(1~23) |
| 弹舌攻击得分 TFAS(R) | 13.80±2.67(1~74) | 24.90±3.16(1~53) | 10.91±2.10(1~44) | 12.46±2.61(1~48) |
Kruskal-Wallis秩和检验的结果表明,吐鲁番沙虎对不同食物化合物TFR之间的总体差异有高度统计学意义(χ2=22.390,P<0.01)。组间TFR两两比较的结果表明,蒸馏水极显著高于脂肪(Z=2.816,P<0.01)和蛋白质溶液(Z=4.351,P<0.01),饱和蔗糖溶液显著高于脂肪(Z=-1.991,P=0.047)、极显著高于蛋白质溶液(Z=-3.356,P<0.01);而蒸馏水与饱和蔗糖溶液之间(Z=0.662,P= 0.508)、脂肪与蛋白质溶液之间(Z=1.269,P=0.204)的差异无统计学意义(图 1)。
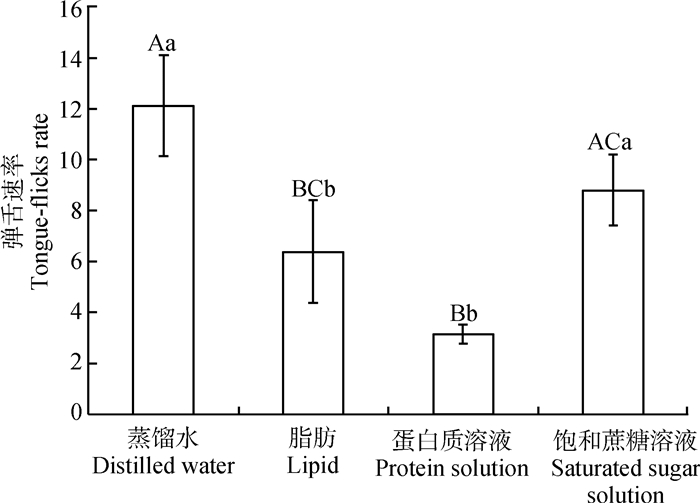
|
| 图 1 吐鲁番沙虎在60 s试验内对不同食物化合物的弹舌速率 Fig. 1 Tongue-flicks rate to different food chemicals byTeratoscincus roborowskii in 60-sec trials 无相同大写字母表示组间差异有高度统计学意义(P<0.01),不同小写字母表示组间差异有统计学意义(P<0.05);下同 The absence of the same capital letters indicate there is an extremely significant difference (P < 0.01), different lowercase letters indicate there is a significant difference between groups (P < 0.05); the same below |
| |
Kruskal-Wallis秩和检验的结果表明,吐鲁番沙虎对不同食物化合物TFAS(R)之间的总体差异有高度统计学意义(χ2=12.879,P<0.01)。组间TFAS(R)两两比较的结果表明,脂肪极显著高于蒸馏水(Z=-3.126,P<0.01)、蛋白质溶液(Z=2.970,P<0.01)和饱和蔗糖溶液(Z=3.043,P<0.01);而蒸馏水与蛋白质溶液(Z=0.218,P=0.828)、蒸馏水与饱和蔗糖溶液(Z=0.179,P=0.858)、饱和蔗糖溶液与蛋白质溶液之间(Z=-0.044,P=0.965)的差异无统计学意义(图 2)。

|
| 图 2 吐鲁番沙虎在60 s试验内对不同食物化合物的弹舌攻击得分 Fig. 2 Tongue-flicks attack scores to different food chemicalsby Teratoscincus roborowskii in 60-sec trials |
| |
TFR反映蜥蜴化学探索行为的强度,TFAS(R)是弹舌速率及探索后尝试摄食(舔或咬)的综合指标,反映蜥蜴对不同食物化学刺激物的综合响应强度(Cooper & Burg hardt,1990)。吐鲁番沙虎对蒸馏水表现出最高的弹舌速率,对脂肪表现出最高的弹舌攻击得分;而对蒸馏水、饱和蔗糖溶液的TFR显著大于脂肪;对脂肪的TFAS(R)却显著大于蒸馏水与饱和蔗糖溶液。TFAS(R)较大的原因是吐鲁番沙虎在面对脂肪刺激物时,多在弹舌之后伴随了咬或舔等尝试摄食的行为。这一结果表明,吐鲁番沙虎对脂肪刺激物产生了尝试摄食的反应。此外,吐鲁番沙虎在面对浸润饱和蔗糖溶液的棉签时,从弹舌迅速切换到舔,用含有味蕾的舌背面与棉签接触。舔可能是对具有甜味的碳水化合物的特异性反应(Cooper & Pérez-Mellado,2002)。上述结果说明,吐鲁番沙虎能够识别蛋白质溶液、脂肪、饱和蔗糖溶液,并表现出不同的进食反应和弹舌攻击得分。蛋白质、脂质和糖类引起强烈的反应是适应性的,因为三者都与食物的营养成分密切相关(Cooper & Albert,1991)。吐鲁番沙虎先用舌头抽取化学线索,引起犁鼻器响应,继而发生舔或咬的行为。舔或咬是一种尝试进食的反应,表明吐鲁番沙虎通过犁鼻器的响应来识别食物。
蜥蜴对食物的化学识别主要是通过犁鼻器、嗅觉和味觉。不同于嗅觉系统,犁鼻器系统通过舌头采集化学物质继而刺激化学感觉器官的活性(Daghfous et al., 2012),以增强觅食期间猎物的检测和定位,并减小能量消耗(Cooper & Pérez-Mellado,2002)。通常犁鼻器的响应是通过动物的弹舌去采样大的非挥发性分子(Halpern,1992)。利氏壁蜥 Podarcis lilfordi 可以通过犁鼻器识别与食物相关的几种类型的化合物(Cooper et al., 2002)。荒漠鬣蜥 Dipsosaurus dorsalis 可以利用犁鼻器识别环境中隐藏在食物中的化学线索和化学因子(Cooper & Alberts,1991)。在进化过程中,杂食性蜥蜴能够使用化学感觉来辨别不移动的植物性食物(Cooper & Pérez-Mellado,2002)。加那利群岛的杂食性波氏蜥蜴 Gallotia caesaris 对纯猪肉脂肪和蔗糖响应强烈(Cooper & Pérez-Mellado,2001)。楔齿蜥、利氏壁蜥和带斑壁虎 Coleonyx variegatus 对蒸馏水的TFAS(R)均小于吐鲁番沙虎(Cooper & Whiting,1999;Cooper et al., 2001, 2002),可能是因为这些物种生活的环境湿度较大。
由此可见,吐鲁番沙虎对不同食物化合物的TFR和TFAS(R)差异有统计学意义,表明吐鲁番沙虎能够使用犁鼻器检测和识别食物化合物信息,可以在识别和定位猎物中发挥重要作用。
| 陈海峰. 2017. 红脂大小蠹基于近交避免行为的雄性配偶选择研究[J]. 四川动物, 36(3): 271–276. DOI:10.11984/j.issn.1000-7083.20160364 |
| 蒋洁, 武正军, 于海, 等. 2009. 鳄蜥的食物识别机制[J]. 动物学研究, 30(5): 553–558. |
| 李文蓉, 宋玉成, 时磊. 2010. 基于骨龄学方法鉴定吐鲁番沙虎的年龄[J]. 动物学杂志, 45(3): 79–86. |
| 李文蓉, 宋玉成, 时磊. 2013. 性别、季节及体型大小对吐鲁番沙虎巢域的影响[J]. 生态学报, 33(2): 395–401. |
| 林英英, 肖丽蓉, 马晓燕, 等. 2016. 吐鲁番沙虎消化道对刺山柑种子吸水和萌发的影响[J]. 草业科学, 33(9): 1764–1769. DOI:10.11829/j.issn.1001-0629.2015-0753 |
| 刘洋, 宋玉成, 李文蓉, 等. 2010. 吐鲁番沙虎头、体大小的两性异型及其食性的季节性变化[J]. 生态学杂志, 29(2): 333–338. |
| 时磊, 周永恒, 原洪. 2002. 新疆维吾尔自治区爬行动物区系与地理区划[J]. 四川动物, 21(3): 152–157. |
| 宋玉成, 赵蕙, 时磊. 2009. 吐鲁番沙虎的日活动节律及其影响因子分析[J]. 新疆农业大学学报, 32(1): 22–35. |
| 汪波, 黄婷, 韩梦, 等. 2014. 狼蛛的化学感受器在寻觅定位猎物中的作用研究[J]. 四川动物, 33(1): 86–89. DOI:10.3969/j.issn.1000-7083.2014.01.022 |
| Aragon P, Lopez P, Martin J. 2001. Chemosensory discrimination of familiar and unfamiliar conspecifics by lizards:implications of field spatial relationships between males[J]. Behavioral Ecology and Sociobiology, 50(2): 128–133. DOI:10.1007/s002650100344 |
| Auffenberg W. 1984. Notes on the feeding behaviour of Varanus bengalensis (Sauria:Varanidae)[J]. Journal of the Bombay Natural History Society, 80(2): 286–302. |
| Autumn K, Han B. 1989. Mimicry of scorpions by juvenile lizards, Teratoscincus roborowskii (Gekkonidae)[J]. Chinese Herpetological Research, 2(2): 60–64. |
| Baeckens S, Huyghe K, Palme R, et al. 2017. Chemical communication in the lacertid lizard Podarcis muralis:the functional significance of testosterone[J]. Acta Zoologica, 98(1): 94–103. DOI:10.1111/azo.2017.98.issue-1 |
| Besson AA, Thierry A, Boros E, et al. 2009. Evidence of food chemical discrimination in tuatara (O. rhynchocephalia):comparison with a gekkotan lizard (O. squamata)[J]. Journal of Herpetology, 43(1): 124–131. DOI:10.1670/08-164R.1 |
| Cabido C, Gonzalo A, Galan P, et al. 2004. Chemosensory predator recognition induces defensive behavior in the slow-worm (Anguis fragilis)[J]. Canadian Journal of Zoology, 82(3): 510–515. DOI:10.1139/z04-023 |
| Cooper WE, Alberts AC. 1991. Tongue-flicking and biting in response to chemical food stimuli by an iguanid lizard (Dipsosaurus dorsalis) having sealed vomeronasal ducts:vomerolfaction may mediate these behavioral responses[J]. Journal of Chemical Ecology, 17(1): 135–146. DOI:10.1007/BF00994427 |
| Cooper WE, Burghardt G. 1990. A comparative analysis of scoring methods for squamate prey odor discrimination data[J]. Journal of Chemical Ecology, 16(1): 45–65. DOI:10.1007/BF01021267 |
| Cooper WE, Ferguson GW, Habegger JJ. 2001. Responses to animal and plant chemicals by several iguanian insectivores and the tuatara, Sphenodon punctatus[J]. Journal of Herpetology, 35(2): 255–263. DOI:10.2307/1566116 |
| Cooper WE, Pérez-Mellado V, Vitt LJ. 2002. Responses to major categories of food chemicals by the lizard Podarcis lilfordi[J]. Journal of Chemical Ecology, 28(4): 709–720. DOI:10.1023/A:1015280524788 |
| Cooper WE, Pérez-Mellado V. 2001. Chemosensory responses to sugar and fat by the omnivorous lizard Gallotia caesaris with behavioral evidence suggesting a role for gustation[J]. Physiology and Behavior, 73(4): 509–516. DOI:10.1016/S0031-9384(01)00488-7 |
| Cooper WE, Pérez-Mellado V. 2002. Responses by a generalist predator, the Balearic lizard Podarcis lilfordi, to chemical cues from taxonomically diverse prey[J]. Acta Ethologica, 4(1): 119–124. |
| Cooper WE, Whiting MJ. 1999. Foraging modes in lacertid lizard from southern Africa[J]. Amphibia-Reptilia, 20(3): 299–311. DOI:10.1163/156853899X00312 |
| Cooper WE. 1995. Foraging mode, prey chemical discrimination, and phylogeny in lizards[J]. Animal Behavior, 50(4): 973–985. DOI:10.1016/0003-3472(95)80098-0 |
| Cooper WE. 1997. Correlated evolution of prey chemical discrimination with foraging, lingual morphology and vomeronasal chemoreceptor abundance in lizards[J]. Behavioral Ecology and Sociobiology, 41(4): 257–265. DOI:10.1007/s002650050387 |
| Cooper WE. 1998. Prey chemical discrimination indicated by tongue-flicking in the eublepharid gecko Coleonyx variegatus[J]. Journal of Experimental Zoology, 281(1): 21–25. DOI:10.1002/(ISSN)1097-010X |
| Cooper WE. 1999. Prey chemical discrimination in ambush foragers:absence in representatives of two additional iguanian lizard families and probable olfactory mediation in a gekkonine gecko[J]. Chemoecology, 9(4): 155–159. DOI:10.1007/s000490050048 |
| Cooper WE. 2007. Lizard chemical senses, chemosensory behavior, and foraging mode[M]//Reilly S, McBrayer L, Miles D. Lizard ecology. Cambridge: Cambridge University Press: 237-270. |
| Daghfous G, Smargiassi M, Libourel PA, et al. 2012. The function of oscillatory tongue-fflicks in snakes:insights from kinematics of tongue-fflicking in the banded water snake (Nerodia fasciata)[J]. Chemical Senses, 37(9): 883–896. DOI:10.1093/chemse/bjs072 |
| Dial BE, Schwenk K. 1996. Olfaction and predator detection in Coleonyx brevis (Squamata:Eublepharidae), with comments on the functional significance of buccal pulsing in geckos[J]. Journal of Experimental Zoology, 276(6): 415–424. DOI:10.1002/(ISSN)1097-010X |
| Filoramo NI, Schwenk K. 2009. Mechanism of chemical delivery to the vomeronasal organs in squamate reptiles:a comparative morphological approach[J]. Journal of Experimental Zoology Part A:Ecological Genetics and Physiology, 311(1): 20–34. |
| Halpern M, Frumin N. 1979. Roles of the vomeronasal and olfactory systems in prey attack and feeding in adult garter snakes[J]. Physiology & Behavior, 22(6): 1183–1189. |
| Halpern M. 1992. Nasal chemical senses in reptiles: structure and function[M]//Gans C, Crews D. Biology of the Reptilia. Chicago: University of Chicago: 423-523. |
| Labra A, Beltran S, Niemeyer HM. 2001. Chemical exploratory behavior in the lizard Liolaemus bellii[J]. Journal of Herpetology, 35(1): 51–55. DOI:10.2307/1566022 |
| Macey JR, Ananjeva NB, Wang Y, et al. 1997. A taxonomic reevaluation of the gennkonid lizard genus Teratoscincus in China[J]. Russian Journal of Herpetology, 4(1): 8–16. |
| Nevo O, Heymann EW, Schulz S, et al. 2016. Fruit odor as a ripeness signal for seed-dispersing primates? A case study on four Neotropical plant species[J]. Journal of Chemical Ecology, 42(4): 323–328. DOI:10.1007/s10886-016-0687-x |
| Olsson M, Madsen T, Nordby J, et al. 2003. Major histocompatibility complex and mate choice in sand lizards[J]. Proceedings of the Royal Society B:Biological Sciences, 270(2): 254–256. |
| Song YC, Liu Y, Lin YY, et al. 2017. Burrow characteristics and microhabitat use of the Turpan wonder gecko Teratoscincus roborowskii (Squamata, Gekkonidae)[J]. Asian Herpetological Research, 8(1): 61–69. |
| Webb JK, Du WG, Pike DA, et al. 2009. Chemical cues from both dangerous and nondangerous snakes elicit antipredator behaviours from a nocturnal lizard[J]. Animal Behaviour, 77(6): 1471–1478. DOI:10.1016/j.anbehav.2009.02.020 |
| Werner YL, Okada S, Ota H, et al. 1997. Varied and fluctuating foraging modes in nocturnal lizards of the family Gekkonidae[J]. Asiatic Herpetological Research, 7: 153–165. |
 2018, Vol. 37
2018, Vol. 37




