扩展功能
文章信息
- 赵文海, 刘方庆, 文陇英
- ZHAO Wenhai, LIU Fangqing, WEN Longying
- 四川盆地的陆地岛屿效应—基于树麻雀的形态变异
- Continental Island Effect in Sichuan Basin, Based on Morphological Variation of Passer montanus
- 四川动物, 2018, 37(2): 172-178
- Sichuan Journal of Zoology, 2018, 37(2): 172-178
- 10.11984/j.issn.1000-7083.20170311
-
文章历史
- 收稿日期: 2017-10-13
- 接受日期: 2017-12-26
2. 乐山师范学院生命科学学院, 西南山地濒危鸟类保护四川省高等院校重点实验室, 四川乐山 614000
2. Key Laboratory of Sichuan Institute for Protecting Endangered Birds in the Southwest Mountains, College of Life Sciences, Leshan Normal University, Leshan, Sichuan Province 614000, China
四川盆地位于青藏高原东部,形成于始新世时期印度板块和亚欧板块之间的碰撞(郭正吾等,1996),其隆升引起边缘地区鸟类行为和形态特征发生变化(Lei et al ., 2014)。鸟类的遗传结构表明,地理屏障和生境差异对遗传分化起重要作用(Liu et al ., 2012)。四川盆地是中国四大盆地之一,具有特殊的地理结构,周围由大凉山、邛崃山、龙门山、米仓山、大巴山、巫山、武夷山和大娄山环抱。Wu等(2017)通过对中国西南地区752种鸟类分布数据的研究表明,四川盆地在历史气候变化过程中扮演了该地区鸟类物种多样性避难地和地理隔离的2种角色。四川盆地是典型的内陆型盆地,环境空间异质性高,因此形成类似岛屿的陆地岛屿(Cracraft,1988;Servedio,2000)。岛屿具有相对隔离的地理性质,岛屿生态系统为物种分化提供了很多机会,所以是研究物种分化与形成的天然实验室(Emerson,2002)。Mayr(1963)通过对岛屿特有种的研究,发现了隔离机制对物种形态特征差异化及物种形成具有重要影响,例如,大西洋不同海岛上伯氏鹨 Anthus berthelotii 的形态具有显著差异(Spurgin et al ., 2014)。Vuilleumier(1970)通过对安第斯山脉北部高山森林区域鸟类多样性和特异性的研究,有力地支持了岛屿生物地理理论同样适应于大陆上某个相对隔离的生境。Degnan(1993)通过对大陆和岛屿上灰胸绣眼鸟 Zosterops lateralis 微卫星多样性的比较,也从侧面证明了岛屿生态系统是加速鸟类物种分化的天然实验室。
海拔对生物多样性格局具有显著影响(Andrew et al ., 2003),不同海拔地区的气候差异非常大(赵尔宓,杨大同,1997),植被组成也有区别(Yao et al ., 2010),多样的植被类型为鸟类提供了有利的栖息环境,极大地丰富了鸟类多样性。McCormack和Smith(2008)通过对高海拔与低海拔地区灰胸丛鸦 Aphelocoma ultramarina 的食性进行比较研究,发现2种海拔梯度分布的种群在嘴峰、嘴裂等形态特征上存在显著差异;Bears等(2008)发现加拿大落基山脉高海拔地区暗眼灯芯草鹀 Junco hyematis hyemalis 的翅长和尾长大于低海拔地区,并推断由海拔导致的形态差异可能会引起遗传差异。一般认为,恒温动物在寒冷环境中比在温暖环境中的个体更大(Bergmann,1847),因此,海拔梯度是检测生物群体发生形态变异和进化反应比较理想的天然实验室(Körner,2007)。
树麻雀 Passer montanus 隶属雀形目Passeriformes雀科Passeridae麻雀属 Passer ,在中国为留鸟,从东部地区的低海拔地区到西部地区的青藏高原均为常见种(郑光美,2011),分布范围广、数量多、海拔跨度大、环境适应性强,是研究形态特征差异和环境变化关系的良好材料。目前对树麻雀形态学的研究见于羽色特征和飞行能力(Mónus et al ., 2016;Sun et al ., 2016, 2017)。本文通过研究四川盆地及周边地区树麻雀,以期验证:(1)四川盆地的陆地岛屿效应;(2)树麻雀形态特征是否遵循贝格曼定律。
1 材料与方法 1.1 材料收集中国科学院动物研究所、中国科学院昆明动物研究所、华南濒危动物研究所以及野外采集到的成年树麻雀共558只,采样点分布于四川、西藏、青海、甘肃、陕西、湖北、湖南、贵州、云南等,测量体质量、体长、嘴峰、嘴裂、翅长、尾长、跗跖长等形态指标(表 1)。所收集的形态指标数据部分来自于标本馆,部分来自于实地采集。
| 采集时间/年 | 样本量/只 | 采集地点 | 东经/° | 北纬/° | 海拔/m | 采集时间/年 | 样本量/只 | 采集地点 | 东经/° | 北纬/° | 海拔/m | |
| 1956 | 11 | 甘肃兰州 | 103.86 | 36.05 | 1 521.54 | 1961、1982 | 13 | 四川康定 | 101.96 | 30.02 | 2 833.77 | |
| 1963 | 2 | 贵州铜仁 | 108.82 | 27.74 | 389.50 | 1961 | 4 | 四川阿坝若尔盖 | 102.96 | 33.58 | 3 442.00 | |
| 1963 | 13 | 贵州黔西南州 | 105.11 | 25.07 | 1 236.00 | 1961、1962 | 17 | 四川阿坝龙日坝 | 102.37 | 32.44 | 3 556.00 | |
| 1956 | 8 | 贵州贵阳 | 106.63 | 26.65 | 1 277.00 | 1958 | 1 | 四川达县 | 107.54 | 31.20 | 310.00 | |
| 1963 | 4 | 贵州毕节 | 105.44 | 26.95 | 1 525.00 | 1958 | 1 | 四川广安邻水 | 106.93 | 30.33 | 355.00 | |
| 1959 | 2 | 湖北宜昌 | 111.29 | 30.69 | 59.00 | 1960 | 4 | 四川峨眉山 | 103.48 | 29.60 | 443.00 | |
| 1955 | 1 | 湖南株洲黄沙河 | 113.13 | 27.83 | 46.00 | 1956、2014 | 15 | 四川成都 | 104.06 | 30.57 | 485.00 | |
| 1959 | 3 | 湖南常德 | 111.76 | 29.20 | 49.00 | 2013 | 9 | 四川眉山富牛镇 | 103.92 | 30.08 | 493.00 | |
| 1957 | 1 | 湖南长沙 | 112.94 | 28.23 | 63.00 | 1927、1957、1959 | 10 | 四川雅安 | 103.01 | 29.98 | 580.00 | |
| 1955 | 1 | 湖南岳阳平江 | 113.58 | 28.70 | 74.00 | 1960 | 1 | 四川峨边 | 103.26 | 29.23 | 611.00 | |
| 2013 | 5 | 湖南衡阳 | 112.57 | 26.89 | 82.00 | 1958 | 7 | 四川万源 | 108.03 | 32.08 | 656.00 | |
| 1957 | 5 | 湖南浏阳 | 113.64 | 28.16 | 86.00 | 1958 | 3 | 四川万源官渡 | 108.06 | 32.15 | 725.00 | |
| 1957 | 11 | 湖南醴陵 | 113.50 | 27.65 | 90.00 | 2016 | 2 | 四川汉源 | 102.41 | 29.20 | 870.00 | |
| 1956 | 10 | 湖南怀化沅陵 | 110.39 | 28.45 | 116.00 | 2016 | 8 | 四川石棉 | 102.21 | 29.14 | 975.00 | |
| 1955 | 6 | 湖南永州 | 111.31 | 26.39 | 139.00 | — | 1 | 四川雅安大喇嘛河 | 102.42 | 30.06 | 1 317.00 | |
| 1955 | 1 | 湖南资兴四区附近 | 113.23 | 25.98 | 145.00 | 2016 | 4 | 四川汶川 | 103.34 | 31.28 | 1 335.00 | |
| 1955 | 4 | 湖南郴州 | 112.95 | 25.40 | 222.00 | 1973 | 4 | 西藏昌都察雅 | 97.57 | 30.65 | 3 159.00 | |
| 1956 | 7 | 湖南湘西土家族苗族自治州永顺 | 109.85 | 29.00 | 254.00 | 1976 | 3 | 西藏拉萨 | 91.17 | 29.65 | 3 660.00 | |
| 1956 | 1 | 湖南武冈 | 110.63 | 26.73 | 318.00 | 1975 | 1 | 西藏日喀则吉隆 | 85.30 | 28.85 | 4 114.00 | |
| 1955 | 6 | 湖南衡山 | 112.69 | 27.29 | 1 051.00 | 1963 | 1 | 西藏日喀则定日县扎多 | 87.66 | 28.58 | 4 235.00 | |
| — | 2 | 青海循化 | 102.49 | 35.85 | 1 872.00 | 1959 | 1 | 西藏卡达河 | 87.13 | 28.66 | 4 326.00 | |
| — | 8 | 青海民和 | 102.81 | 36.22 | 2 047.00 | 1976 | 5 | 西藏阿里改则 | 84.06 | 32.30 | 4 424.00 | |
| 1960 | 8 | 青海尖扎 | 102.02 | 35.92 | 2 124.00 | 1975 | 1 | 西藏山南浪卡子县 | 90.40 | 28.97 | 4 472.00 | |
| 1958、1959、1960 | 28 | 青海西宁 | 101.73 | 36.64 | 2 287.17 | 1985 | 1 | 云南红河洲河口县南溪 | 103.95 | 22.63 | 123.00 | |
| — | 1 | 青海通海 | 101.74 | 36.89 | 2 399.00 | 1960、1983 | 5 | 云南西双版纳州景洪县 | 100.94 | 21.86 | 543.20 | |
| 1959 | 6 | 青海大通 | 101.69 | 36.93 | 2 443.00 | 1959、1960 | 5 | 云南西双版纳州勐腊县 | 101.31 | 21.85 | 562.00 | |
| — | 2 | 青海同仁 | 102.02 | 35.51 | 2 495.00 | 1962 | 2 | 云南德宏州潞西县遮放 | 98.28 | 24.25 | 807.00 | |
| — | 1 | 青海祁连 | 100.25 | 38.18 | 2 730.00 | 1974 | 4 | 云南怒江州泸水县大兰茂 | 98.86 | 25.82 | 844.00 | |
| 1958 | 1 | 青海门源张檀镇 | 101.62 | 37.38 | 2 867.00 | 1965 | 1 | 云南保山地区保山市坝弯 | 98.84 | 24.95 | 1 026.00 | |
| 1960 | 5 | 青海乌兰 | 98.48 | 36.93 | 2 971.00 | 1960、1983 | 2 | 云南西双版纳州勐海县 | 100.45 | 21.96 | 1 177.00 | |
| 1959 | 10 | 青海贵南 | 100.75 | 35.59 | 3 091.00 | 1960、1964 | 8 | 云南普洱市 | 100.97 | 22.83 | 1 302.00 | |
| 1960 | 1 | 青海斑玛县 | 100.74 | 32.93 | 3 524.00 | 1961 | 5 | 云南文山 | 104.45 | 23.38 | 1 344.20 | |
| 1960 | 1 | 青海河南五哈寺 | 101.62 | 34.73 | 3 527.00 | 1963 | 9 | 云南昭通地区 | 104.52 | 27.47 | 1 485.78 | |
| 1960、1963 | 3 | 青海玉树 | 97.01 | 32.99 | 3 696.00 | 1973 | 3 | 云南怒江州贡山县 | 98.67 | 27.74 | 1 493.00 | |
| 1957 | 9 | 陕西周至 | 108.22 | 34.16 | 433.00 | 1985 | 3 | 云南红河洲蒙自县 | 103.56 | 23.21 | 1 515.33 | |
| 1958 | 10 | 陕西汉中西乡 | 107.87 | 32.99 | 451.30 | 1960 | 1 | 云南大理漾濞 | 99.96 | 25.67 | 1 545.00 | |
| 1957 | 10 | 陕西汉中洋县 | 107.55 | 33.22 | 474.00 | 1960、1964 | 7 | 云南临沧地区 | 99.88 | 23.52 | 1 622.67 | |
| 1958 | 10 | 陕西镇巴渔渡 | 108.00 | 32.31 | 784.00 | — | 8 | 云南怒江州泸水县片马 | 98.63 | 26.00 | 1 895.00 | |
| 1957 | 4 | 陕西汉中留坝 | 106.92 | 33.62 | 978.00 | 1958、1967、1973、1979 | 13 | 云南昆明 | 102.72 | 24.97 | 2 033.77 | |
| 2016 | 6 | 四川攀枝花 | 101.42 | 26.33 | 1 039.00 | 1960 | 4 | 云南大理洱源 | 99.95 | 26.11 | 2 060.00 | |
| 1960 | 1 | 四川攀枝花米易 | 102.11 | 26.89 | 1 099.00 | 1985 | 1 | 云南红河洲屏边县大围山 | 103.68 | 22.92 | 2 291.00 | |
| 1960 | 9 | 四川凉山雷波 | 103.57 | 28.26 | 1 145.00 | 1981 | 1 | 云南迪庆州维西县梨地坪 | 99.28 | 27.18 | 2 300.00 | |
| 1960 | 24 | 四川西昌 | 102.18 | 27.75 | 1 549.08 | 1960、2016 | 15 | 云南丽江 | 100.17 | 26.64 | 2 434.07 | |
| 1960 | 10 | 四川会东 | 102.58 | 26.63 | 1 673.00 | 1958 | 2 | 云南丽江黑龙潭农场 | 100.23 | 26.88 | 2 447.00 | |
| 2016 | 11 | 四川凉山越西 | 102.30 | 28.38 | 1 691.20 | 1981 | 9 | 云南丽江地区宁蒗县泸洁湖 | 100.79 | 27.72 | 2 692.00 | |
| 1960 | 4 | 四川会东堵格 | 102.67 | 26.72 | 2 327.00 | 1981 | 1 | 云南迪庆州中甸县小中甸 | 99.81 | 27.55 | 3 220.00 | |
| 1957、1960 | 5 | 四川盐源 | 101.50 | 27.42 | 2 563.00 | 1960 | 1 | 云南迪庆州中甸县德钦 | 99.70 | 27.83 | 3 282.00 | |
| 1961 | 11 | 四川巴塘 | 99.11 | 30.00 | 2 575.00 | 1960 | 20 | 云南迪庆州德钦县 | 98.91 | 28.49 | 3 352.00 | |
| 1961 | 2 | 四川马尔康 | 102.25 | 31.89 | 2 662.50 | 1960 | 1 | 重庆合川 | 106.28 | 29.97 | 219.00 | |
| 2013 | 7 | 重庆歌乐山 | 106.42 | 29.57 | 589.00 |
使用便携式电子天平(0.10 g)测量体质量(BM),游标卡尺(0.1 mm)测量体长(BL)、嘴峰(CUL)、嘴裂(CLL)、翅长(WL)、尾长(TL)、跗跖长(TML)。采用单因素方差分析(One-Way ANOVA)比较树麻雀不同地理种群:四川盆地( n =59,海拔平均值:484.25 m,海拔范围:219~725 m)、盆地周边山地( n =385,海拔平均值:2 260.42 m,海拔范围:807~4 472 m)和华中平原( n =114,海拔平均值:250.70 m,海拔范围:46~784 m)之间的形态特征差异。同时对海拔、纬度与各形态指标之间的关系进行偏相关性分析。数据结果以平均值±标准差(Mean±SD)表示,数据处理使用SPSS 20.0,P <0.05代表差异有统计学意义,P <0.01代表差异有高度统计学意义。
2 结果 2.1 树麻雀形态指标与海拔、纬度的相关性对树麻雀各个形态指标进行偏相关分析,控制纬度因子不变。结果表明,树麻雀的体质量、尾长、跗跖长与海拔极显著正相关( P <0.01),树麻雀的体长与海拔显著正相关( P <0.05)(图 1)。
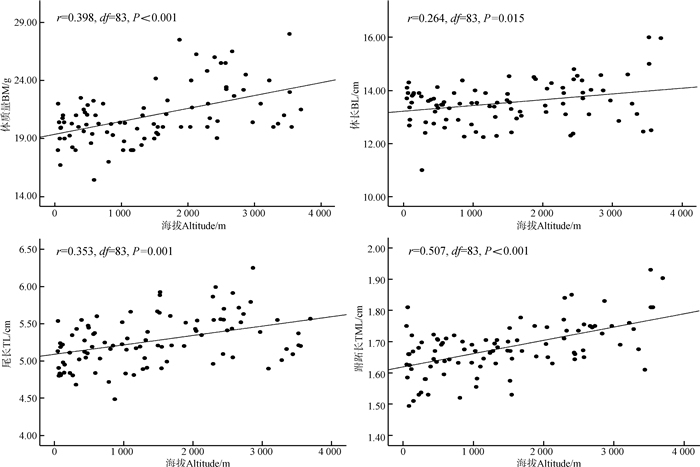
|
| 图 1 树麻雀形态指标与海拔的相关性 Fig. 1 The correlation between morphological indices of Passer montanus and altitude |
| |
控制海拔因子,对树麻雀的形态指标进行偏相关分析表明,树麻雀的体质量、翅长与纬度极显著正相关( P <0.01)(图 2)。
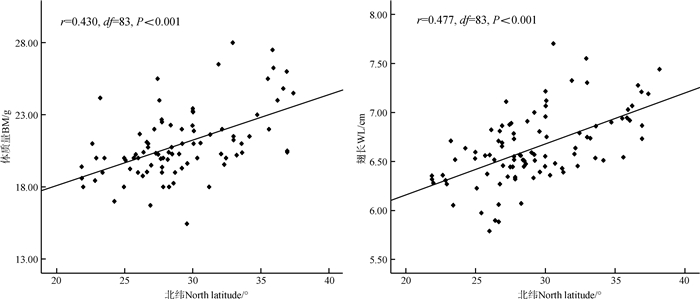
|
| 图 2 树麻雀形态指标与纬度的相关性 Fig. 2 The correlation between morphological indices of Passer montanus and latitude |
| |
单因素方差分析表明:四川盆地、华中平原及盆地周边山地树麻雀的体质量( F =6.70,df =2,P =0.002)、翅长( F =4.91,df =2,P =0.009)、尾长( F =8.40,df =2,P <0.01)、跗跖长( F =6.97,df =2,P =0.001)之间的差异有高度统计学意义(表 2)。
| 地区( n ) | 体质量/g | 体长/cm | 嘴峰/cm | 嘴裂/cm | 翅长/cm | 尾长/cm | 跗跖长/cm |
| 盆地周边山地(385) | 22.01±2.85 | 13.71±0.88 | 1.15±0.11 | 1.28±0.08 | 6.75±0.40 | 5.41±0.38 | 1.71±0.09 |
| 华中平原(114) | 19.95±1.38 | 13.42±0.69 | 1.20±0.11 | 1.29±0.09 | 6.46±0.30 | 5.08±0.25 | 1.64±0.08 |
| 四川盆地(59) | 20.15±2.09 | 13.25±0.57 | 1.16±0.16 | 1.24±0.14 | 6.65±0.38 | 5.19±0.28 | 1.66±0.07 |
| P | 0.002 | 0.134 | 0.201 | 0.314 | 0.009 | <0.01 | 0.001 |
多重比较分析表明:盆地周边山地树麻雀的体质量极显著大于华中平原( P <0.01)、显著大于四川盆地( P <0.05),盆地周边山地的翅长、尾长、跗跖长均极显著大于华中平原( P <0.01)(图 3)。
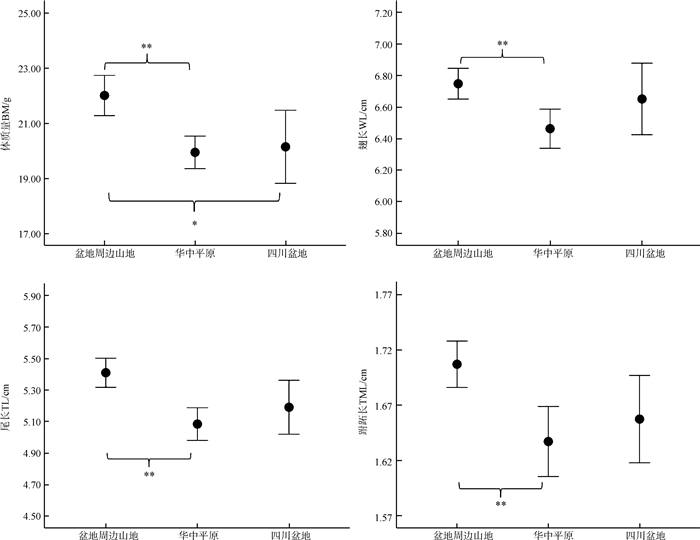
|
| 图 3 盆地周边山地、华中平原及四川盆地树麻雀的形态差异 Fig. 3 Morphological difference of Passer montanus among surrounding mountains outsideSichuan Basin, Central China Plain and Sichuan Basin * P <0.05,** P <0.01 |
| |
四川盆地作为相对封闭的内陆型盆地,最高海拔不超过800 m(Liu et al ., 2012),是一个类似于岛屿的陆地岛屿(Cracraft,1988;Servedio,2000)。本研究结果表明,四川盆地和华中平原的树麻雀种群在体质量、体长、翅长、尾长、跗跖长、嘴峰和嘴裂等形态上的差异无统计学意义,表明四川盆地周边山系没有对盆地内的树麻雀种群形成陆地岛屿效应。然而一些研究则表明,岛屿内外的物种具有显著的形态差异,形成了显著的岛屿隔离机制(Grant,1965;Chen & He,2009;Winger & bates,2015),例如,特立尼达岛屿内同种生物的个体较小、重量较轻(Wright & Steadman,2012)。推断可能有2个原因:1)树麻雀在冰期与间冰期的气候交替变化过程中存在基因交流:在间冰期,树麻雀由四川盆地内向盆地周边山区扩散,而在冰期,树麻雀则由盆地周边山区向温暖湿润的盆地内扩散;2)对树麻雀这类生活于低海拔的鸟类,食性复杂、环境适应力强,常常逐人而居,种群具有较强的扩散能力。
贝格曼定律认为,恒温动物在寒冷环境中比在温暖环境中个体更大(Bergmann,1847)。一般情况下,海拔每升高100 m,气温下降约0.6 ℃(Rundel,1994)。生活在高海拔地区的树麻雀需要克服更低的气温,故高海拔地区的树麻雀比低海拔的需要更多食物用于保持体温。本研究结果表明,树麻雀的体型随海拔和纬度的升高而显著增大,即高海拔、高纬度地区的树麻雀相对于低海拔、低纬度地区的个体更大。因此,树麻雀的体型变化符合贝格曼定律。在大区域内研究时,有关鸟类的556项研究中有60%的研究结果支持贝格曼定律(Teplitsky et al ., 2014),例如,对南美地区湍鸭 Merganetta armata 形态的研究表明,在海拔越高、气温越低的地区,其个体越大(Gutiérrez-Pinto et al ., 2014);加里纳群岛的青山雀 Parus caeruleus 在寒冷气候下会向更大体型和更长翅膀的方向进化(Grant,1979)。这也许是树麻雀作为广布型物种具有较强的适应能力,成为人类伴随物种之一的重要原因。
致谢: 感谢中国科学院动物研究所雷富民研究员、中国科学院昆明动物研究所杨晓君研究员、华南濒危动物研究所邹发生研究员、陇东学院周天林教授、广西大学蒋爱伍博士为样本量度给予的支持和帮助!感谢学生刘丹、叶丽佳、张建男、杨玉凤、谢文菊以及陈灵女士对样本采集所做的工作!| 郭正吾, 邓康龄, 韩永辉, 等. 1996. 四川盆地形成与演化[M]. 北京: 地质出版社. |
| 赵尔宓, 杨大同. 1997. 横断山区的两栖爬行动物[M]. 北京: 科学出版社. |
| 郑光美. 2011. 中国鸟类分类与分布名录(第二版)[M]. 北京: 科学出版社. |
| Andrew NR, Rodgerson L, Dunlop M. 2003. Variation in invertebrate-bryophyte community structure at different spatial scales along altitudinal gradients[J]. Journal of Biogeography, 30(5): 731–746. DOI:10.1046/j.1365-2699.2003.00849.x |
| Bears HC, Drever M, Martin K. 2008. Comparative morphology of dark-eyed juncos Junco hyemalis breeding at two elevations:a common aviary experiment[J]. Journal of Avian Biology, 39(2): 152–162. DOI:10.1111/j.2008.0908-8857.04191.x |
| Bergmann C. 1847. About the relationships between heat conservation and body size of animals[J]. Goett Stud, 1: 595–708. |
| Chen XY, He F. 2009. Speciation and endemism under the model of island biogeography[J]. Ecology, 90(1): 39–45. DOI:10.1890/08-1520.1 |
| Cracraft J. 1988. From Malaysia to New Guinea: evolutionary biogeography within a complex continent-island arc contact zone[C]. Proceedings of the 19th International Ornithological Congress, 2: 2581-2593. |
| Degnan SM. 1993. Genetic variability and population differentiation inferred from DNA fingerprinting in silvereyes (Aves:Zosteropidae)[J]. Evolution, 47(4): 1105–1117. DOI:10.1111/evo.1993.47.issue-4 |
| Emerson BC. 2002. Evolution on oceanic islands:molecular phylogenetic approaches to understanding pattern and process[J]. Molecular Ecology, 11(6): 951–966. DOI:10.1046/j.1365-294X.2002.01507.x |
| Grant PR. 1965. The adaptive significance of some size trends in island birds[J]. Evolution, 19(3): 355–367. DOI:10.1111/evo.1965.19.issue-3 |
| Grant PR. 1979. Ecological and morphological variation of Canary Island blue tits, Parus caeruleus (Aves:Paridae)[J]. Biological Journal of the Linnean Society, 11(2): 103–129. DOI:10.1111/bij.1979.11.issue-2 |
| Gutiérrez-Pinto N, McCracken KG, Alza L, et al. 2014. The validity of ecogeographical rules is context-dependent:testing for Bergmann's and Allen's rules by latitude and elevation in a widespread Andean duck[J]. Biological Journal of the Linnean Society, 111(4): 850–862. DOI:10.1111/bij.2014.111.issue-4 |
| Körner C. 2007. The use of 'altitude' in ecological research[J]. Trends in Ecology & Evolution, 22(11): 569–574. |
| Lei FM, Qu YH, Song G. 2014. Species diversification and phylogeographical patterns of birds in response to the uplift of the Qinghai-Tibet Plateau and Quaternary glaciations[J]. Current Zoology, 60(2): 149–161. DOI:10.1093/czoolo/60.2.149 |
| Liu H, Wang W, Song G, et al. 2012. Interpreting the process behind endemism in China by integrating the phylogeography and ecological niche models of the Stachyridopsis ruficeps[J]. PLoS ONE, 7(10): e46761. DOI:10.1371/jounal.pone.0046761 |
| Liu S, Deng B, Li Z, et al. 2012. Architecture of basin-mountain systems and their influences on gas distribution:a case study from the Sichuan Basin, south China[J]. Journal of Asian Earth Sciences, 47: 204–215. DOI:10.1016/j.jseaes.2011.10.012 |
| Mayr E. 1963. Animal species and evolution[M]. Cambridge: The Belknap Press of Harvard University. |
| McCormack JE, Smith TB. 2008. Niche expansion leads to small-scale adaptive divergence along an elevation gradient in a medium-sized passerine bird[J]. Proceedings of the Royal Society of London B:Biological Sciences, 275(1647): 2155–2164. DOI:10.1098/rspb.2008.0470 |
| Mónus F, Liker A, Pénzes Z, et al. 2017. Status signalling in male but not in female Eurasian tree sparrows Passer montanus[J]. Ibis, 159(1): 180–192. DOI:10.1111/ibi.2017.159.issue-1 |
| Rundel PW. 1994. Tropical alpine climates[M]//Rundel PW, Smith AP, Meinzer FC. Tropical alpine environments: plant form and function. Cambridge: Cambridge University Press. |
| Servedio MR. 2000. Reinforcement and the genetics of nonrandom mating[J]. Evolution, 54: 21–29. DOI:10.1111/evo.2000.54.issue-1 |
| Spurgin LG, Illera JC, Jorgensen TH, et al. 2014. Genetic and phenotypic divergence in an island bird:isolation by distance, by colonization or by adaptation?[J]. Molecular Ecology, 23(5): 1028–1039. DOI:10.1111/mec.12672 |
| Sun Y, Li M, Song G, et al. 2017. The role of climate factors in geographic variation in body mass and wing length in a passerine bird[J]. Avian Research, 8(1): 3–11. DOI:10.1186/s40657-017-0061-x |
| Sun YF, Ren ZP, Wu YF, et al. 2016. Flying high:limits to flight performance by sparrows on the Qinghai-Tibet Plateau[J]. Journal of Experimental Biology, 219(22): 3642–3648. DOI:10.1242/jeb.142216 |
| Teplitsky C, Millien V. 2014. Climate warming and Bergmann's rule through time:is there any evidence?[J]. Evolutionary Applications, 7(1): 156–168. DOI:10.1111/eva.12129 |
| Vuilleumier F. 1970. Insular biogeography in continental regions. Ⅰ. The northern Andes of South America[J]. The American Naturalist, 104(938): 373–388. DOI:10.1086/282671 |
| Winger BM, Bates JM. 2015. The tempo of trait divergence in geographic isolation:avian speciation across the Marañon Valley of Peru[J]. Evolution, 69(3): 772–787. DOI:10.1111/evo.2015.69.issue-3 |
| Wright NA, Steadman DW. 2012. Insular avian adaptations on two Neotropical continental islands[J]. Journal of Biogeography, 39(10): 1891–1899. DOI:10.1111/jbi.2012.39.issue-10 |
| Wu Y, DuBay SG, Colwell RK, et al. 2017. Mobile hotspots and refugia of avian diversity in the mountains of south-west China under past and contemporary global climate change[J]. Journal of Biogeography, 44(3): 615–626. DOI:10.1111/jbi.12862 |
| Yao YH, Zhang BP, Han F, et al. 2010. Diversity and geographical pattern of altitudinal belts in the Hengduan Mountains in China[J]. Journal of Mountain Science, 7: 123–132. DOI:10.1007/s11629-010-1011-9 |
 2018, Vol. 37
2018, Vol. 37




