扩展功能
文章信息
- 陈祎, 宋婷玉, 李金海, 肖永乐, 曾光志, 万小平, 杨璐一, 方鹏飞, 王泽洲, 高荣
- CHEN Yi, SONG Tingyu, LI Jinhai, XIAO Yongle, ZENG Guangzhi, WAN Xiaoping, YANG Luyi, FANG Pengfei, WANG Zezhou, GAO Rong
- 壳聚糖纳米颗粒包裹猪白细胞介素2和融合白细胞介素4/6基因对猪圆环病毒2型疫苗免疫的强化
- Enhancement of Immune Responses to PCV-2 Vaccine by Porcine IL-2 and Fusion IL-4/6 Gene Entrapped in Chitosan Nanoparticles
- 四川动物, 2018, 37(2): 156-163
- Sichuan Journal of Zoology, 2018, 37(2): 156-163
- 10.11984/j.issn.1000-7083.20170102
-
文章历史
- 收稿日期: 2017-03-30
- 接受日期: 2017-09-18
2. 四川省华派生物制药有限公司, 成都 610026;
3. 四川省动物疫病预防控制中心, 成都 610035
2. Sichuan Huapai Biopharmaceutical Company, Chengdu 610026, China;
3. Center for Animal Disease Control of Sichuan Province, Chengdu 610035, China
猪圆环病毒2型(pig circovirus-2,PCV-2)是一种小的无包膜单链DNA病毒,属于圆环病毒科Circoviridae(Gillespie et al., 2009)。PCV-2是猪圆环病毒相关疾病的主要病原菌,其中包括断奶后多系统衰竭综合征、猪皮炎与肾病综合征和猪呼吸道疾病综合征(Allan et al., 2004;Chae,2005;Segalés et al., 2005)等。PCV-2感染存在于大多数养猪国家,给全球养猪业造成了严重的经济损失(Ge et al., 2012)。理想的疫苗是一次接种即可终身免疫。目前许多阻止PCV-2感染的商业疫苗并不能有效地防止PCV-2感染和传播(Beach & Meng,2012)。因此,提高PCV-2疫苗的疗效很重要。
细胞因子因其安全性和高效性而成为一种理想的免疫佐剂,例如γ-干扰素(IFN-γ)(Wang et al., 2013)、白细胞介素2(IL-2)(Yang et al., 2010)、白细胞介素4(IL-4)(Zhang et al., 2007)和白细胞介素6(IL-6)(Li et al., 2011)。IL-2、IL-4和IL-6在细胞和体液免疫反应中起重要作用。IL-2具有多种生物学功能,包括促进T细胞增殖和增强NK细胞的细胞毒性,刺激活化的B淋巴细胞增殖,并诱导免疫球蛋白分泌等(Collins & Oldham,1993)。IL-4可影响体液免疫和细胞免疫应答,如免疫球蛋白的产生、类别转换和分泌(Pasquini et al., 1997)。IL-6具有促进白细胞介素基因表达、B细胞分化、T细胞活化的作用(Kishimoto,2010)。
猪IL-2或IL-6与CpG免疫刺激序列的混合基因能有效提高动物对病原菌的抵抗力(Yang et al., 2010;Huang et al., 2013);此外,猪IL-4/6融合基因与单独的IL-4和IL-6相比,能诱导机体产生更强的免疫应答;猪IL-4/6融合基因能加强大肠杆菌疫苗、猪肺炎支原体疫苗、猪繁殖与呼吸综合征(PRRS)疫苗对机体的体液和细胞免疫,提高接种动物的免疫保护性(Zhang et al., 2007;Zhang et al., 2012;Yang et al., 2013);猪IL-2、IL-4、IL-6的融合基因(IL-4/6-2)相比于IL-4/6和IL-2在小鼠Mus musculus上可产生更强的免疫协同调节作用(杨璐一等,2014)。
因此,本实验在前期研究的基础上,为研制新型高性价比的PCV-2疫苗免疫调节剂,评估共表达IL-2和IL-4/6融合基因纳米颗粒对仔猪生长和PCV-2免疫应答的作用。
1 材料与方法 1.1 材料质粒:真核表达载体VR1020-猪融合白细胞介素4/6-2(VRIL-4/6-2),由本实验室构建并保存;壳聚糖(CS):15 kD,脱乙酰度95%以上,购自Sigma Aldrich;多聚磷酸钠(TPP):购自Sigma(USA);鲎试剂:购自湛江A & C公司;疫苗:PCV-2灭活疫苗(ZJ/C株)(圆环康)和实验动物:健康21日龄长白、约克夏和杜洛克杂交仔猪均由四川省华派生物制药有限公司提供。
1.2 方法 1.2.1 VRIL-4/6-2真核表达质粒的大量制备及内毒素检测参照《分子克隆指南第三版》(Joseph et al., 2002)制备质粒,溶解于TE缓冲液,质粒浓度和纯度使用紫外分光光度计检测;质粒内毒素含量用鲎试剂检测。
1.2.2 VRIL-4/6-2质粒壳聚糖纳米颗粒的制备离子交联法(Bodmeier et al., 1989)制备VRIL-4/6-2质粒壳聚糖纳米颗粒。将壳聚糖溶解于1%的冰醋酸溶液(pH5.5),配制为2.4 mg·mL-1的溶液;ddH2O配制10 mg·mL-1的磷酸三苯酯(TPP)溶液;以上溶液均用0.22 μm微孔滤膜过滤除菌。将VRIL-4/6-2质粒与适量TPP溶液混匀,55 ℃孵育20 min;壳聚糖与质粒质量比为30: 1,在50~55 ℃水浴磁力搅拌下将质粒与TPP的预混液缓慢滴加至壳聚糖溶液中,混合均匀,恒温孵育10 min备用,记作VRIL-4/6-2-CS。用Zetasizer3000HS/IHPL粒度仪检测纳米颗粒粒径和电位。
1.2.3 动物实验10头21日龄长白、约克夏和杜洛克杂交仔猪,经ELISA和荧光定量PCR(qPCR)检测PCV-2、PRRS病毒、猪瘟病毒和支原体均为阴性。随机分成实验组和对照组,每组5头。实验组颈部肌肉注射2.5 mL VRIL-4/6-2-CS(0.5 mg·mL-1),对照组注射相同剂量生理盐水;2组均颈部肌肉注射2.5 mL PCV-2疫苗。猪免疫接种前记为第0天,接种后第7、14、28天定时采集前腔静脉血用于检测免疫反应。接种前及实验结束第28天时分别测量2组仔猪的体质量,用于评价实验质粒对仔猪生长的影响。
1.2.4 PCV-2特异性抗体的测定取500 μL抗凝血低速离心后收集血清,参照ELISA试剂盒说明书操作,在酶标仪上测定OD630值,检测血清中PCV-Ab的含量,试剂盒购自武汉科前生物公司。
1.2.5 IgG1和IgG2a的测定取500 μL抗凝血低速离心后收集血清,参照ELISA试剂盒说明书操作,在酶标仪上测定OD450值,检测血清中IgG1和IgG2a的含量,试剂盒购自成都敏鑫科生物科技公司。
1.2.6 CD4+和CD8+T淋巴细胞的测定取100 μL新鲜抗凝血摇匀,加入2 μL anti-porcine CD3-SPRD、2 μL anti-porcine CD4-FITC、2 μL anti-porcine CD8-PE,震荡混匀避光孵育30 min;加入600 μL红细胞裂解液,避光裂解10 min,500 r·min-1离心5 min,去上清;加入1 mL磷酸缓冲盐溶液(PBS),轻轻悬浮细胞,500 r·min-1离心5 min,去上清;重复洗涤1次,细胞沉淀加入300 μL PBS混匀,悬浮细胞,上机检测。
1.2.7 荧光定量检测基因表达水平100 μL抗凝血加入1 mL的RNAiso pius,充分裂解后提取细胞总RNA,用TransScript All-in-One First-Strand cDNA Synthesis SuperMix for Qpcr (One-Step gDNA Removal)反转录试剂盒合成cDNA。根据GenBank中的猪PPIA、TLR-2、TLR-7、IL-2、IL-4、IL-6、TNF-α、STAT-1、STAT-2、STAT-3基因的cDNA序列,分别设计合成其特异性扩增引物(表 1)。
| 基因 | 引物(5'-3') | 退火温度/℃ |
| PPIA-F | AGACAGCAGAAAACTTCCGTG | 52.0 |
| PPIA-R | ACTTGCCACCAGTGCCATTA | |
| TNF-α-F | CCCACGTTGTAGCCAATGTC | 60.0 |
| TNF-α-R | GAGGTACAGCCCATCTGTCG | |
| IL-2-F | AGCTCTGGAGGGAGTGCTAA | 60.0 |
| IL-2-R | TGTTTCAGATCCCTTTAGTTCCA | |
| IL-4-F | GCTGCCCCAGAGAACACGAC | 60.0 |
| IL-4-R | AGGTTCCTGTCAAGTCCGCTC | |
| IL-6-F | ATAAGGGAAATGTCGAGGCTG | 60.0 |
| IL-6-R | GTGGCTTTGTCTGGATTCTTTC | |
| TLR-2-F | TGCTGCAAGGTCAACTCTCT | 61.0 |
| TLR-2-R | CAGCAGGGTCACAAGACAGA | |
| TLR-7-F | ATAGCGAGCATCACTCCAGCC | 60.0 |
| TLR-7-R | TAATCTGCTGCCTTCTGGTGC | |
| STAT-1-F | TCTGGCACAGTGGCTAGAAAATC | 56.3 |
| STAT-1-R | GAAAACGGATGGTGGCAAAC | |
| STAT-2-F | AACATTCCTGAGAACCCACTG | 54.0 |
| STAT-2-R | CTGTTAGAGACCACGATGAGC | |
| STAT-3-F | AGGACATCAGCGGTAAGA | 60.0 |
| STAT-3-R | GGTAGACCAGCGGAGACA |
以仔猪不同时期血液cDNA为模板,表 1中设计的引物进行扩增。用Bio-Rad IQ5荧光定量PCR仪检测不同基因相对表达的情况,15 μL体系,用SsoAdvanceTM Universal SYBR Green Supermix进行荧光定量分析。扩增参数为:95 ℃预变性30 s;95 ℃变性5 s,最佳退火温度退火30 s,40个循环。熔解曲线参数:65~95 ℃,每6 s上升0.5 ℃。PPIA为内参基因,采用2-ΔΔCT法分析实时荧光PCR数据,比较同一目的基因不同时期的相对表达水平差异。
1.2.8 数据分析以上各数据用GraphPad Prism 6中的双因素方差分析和单因素方差分析进行差异比较,P<0.05表示差异有统计学意义。
2 结果 2.1 仔猪体质量变化实验开始及结束时分别称量每只仔猪的体质量,分别计算每组仔猪体质量的平均值和方差,仔猪体质量变化见表 2。结果显示,实验组仔猪体质量增加显著高于对照组(P<0.05)。
| 组别 | 初始体质量/kg | 终止体质量/kg | 净增长/kg | 日增长/kg |
| 实验组 | 8.10±0.98 | 17.63±2.03 | 9.525±1.135* | 0.340* |
| 对照组 | 7.35±0.25 | 12.60±0.51 | 7.25±0.52 | 0.259 |
| 注Note:*P<0.05 | ||||
在接种第7天后,实验组和对照组中均可以检测到PCV-2抗体,但是2组含量之间的差异无统计学意义(P>0.05)(图 1)。
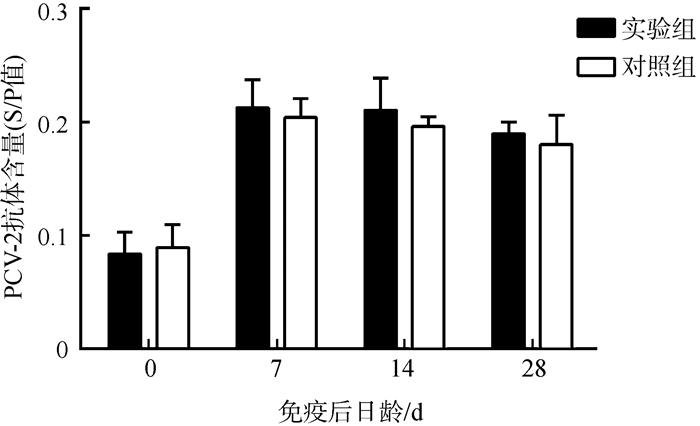
|
| 图 1 仔猪血清中PCV-2抗体含量的变化 Fig. 1 PCV-2 antibody titers in the serum of the experimental piglets S/P=(S-N)/(P-N)=(样品OD值-阴性对照OD值)/(阳性对照OD值-阴性对照OD值),当S/P≥0.16时,认为PCV-2抗体检测为阳性 S/P=(S-N)/(P-N)=(ODsample-ODnegative control)/(ODpositive control-ODnegative control), titer of PCV-2 antibody was considered positive when S/P≥0.16 |
| |
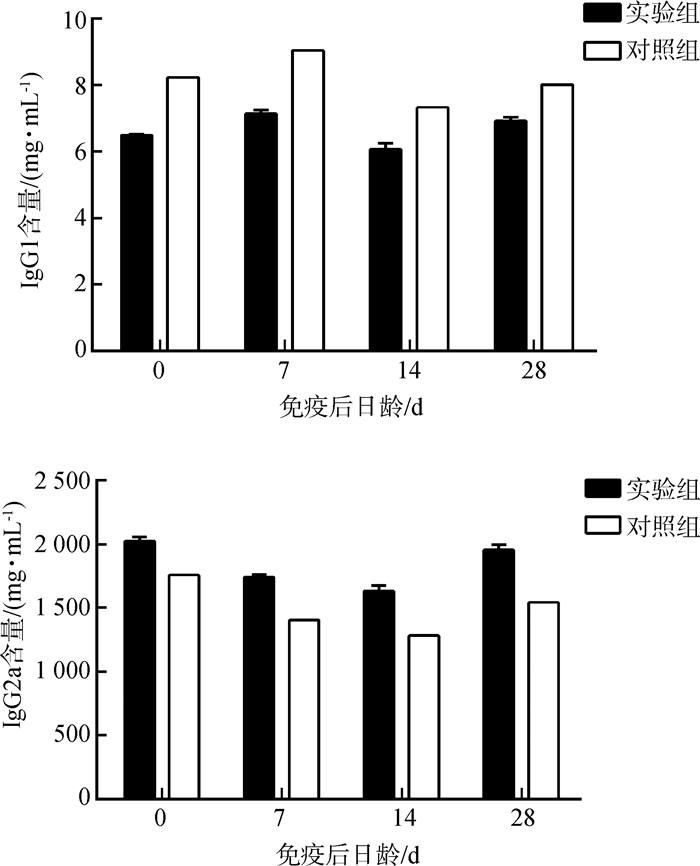
实验组仔猪血清中IgG1的含量显著低于对照组(P<0.05),而IgG2a的含量显著高于对照组(P<0.05)(图 2)。

|
| 图 2 仔猪血清中IgG1和IgG2a含量的变化 Fig. 2 The change of the levels of IgG1 and IgG2a in the serum of piglets |
| |
流式细胞术检测仔猪血液中CD4+和CD8+T淋巴细胞亚群的数量变化,实验组仔猪血液中的CD4+T和CD8+T淋巴细胞的数量与对照组相比均显著增加(P<0.05)(图 3)。
|
| 图 3 仔猪血液中CD4+和CD8+T淋巴细胞数量的变化 Fig. 3 CD4+ and CD8+ T cell numbers in the blood of experimental piglets |
| |
实验组TLR-2基因的表达水平只在免疫后第14天显著高于对照组(P<0.05),而实验组TLR-7基因的表达水平在免疫后第28天显著高于对照组(P<0.05)(图 4)。
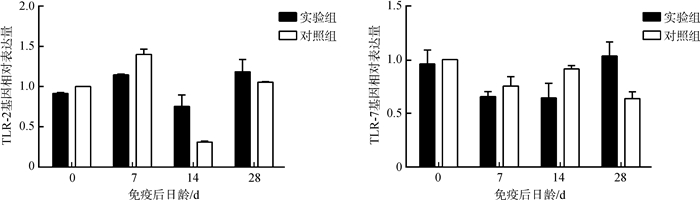
|
| 图 4 仔猪TLR基因表达水平的变化 Fig. 4 The change of expression levels of TLR gene in the blood of experimental piglets |
| |
实验组仔猪血液中IL-2、IL-4、IL-6和TNF-α基因的表达水平在免疫后第28天均显著高于对照组(P<0.05),其中,IL-4和IL-6基因表达水平分别在第7天和第14天显著高于对照组(P<0.05)(图 5)。
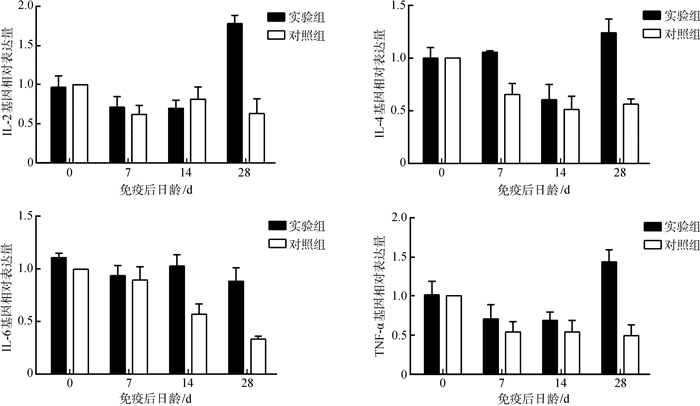
|
| 图 5 仔猪细胞因子基因表达水平的变化 Fig. 5 The change of cytokine gene expression in the blood of experimental piglets |
| |
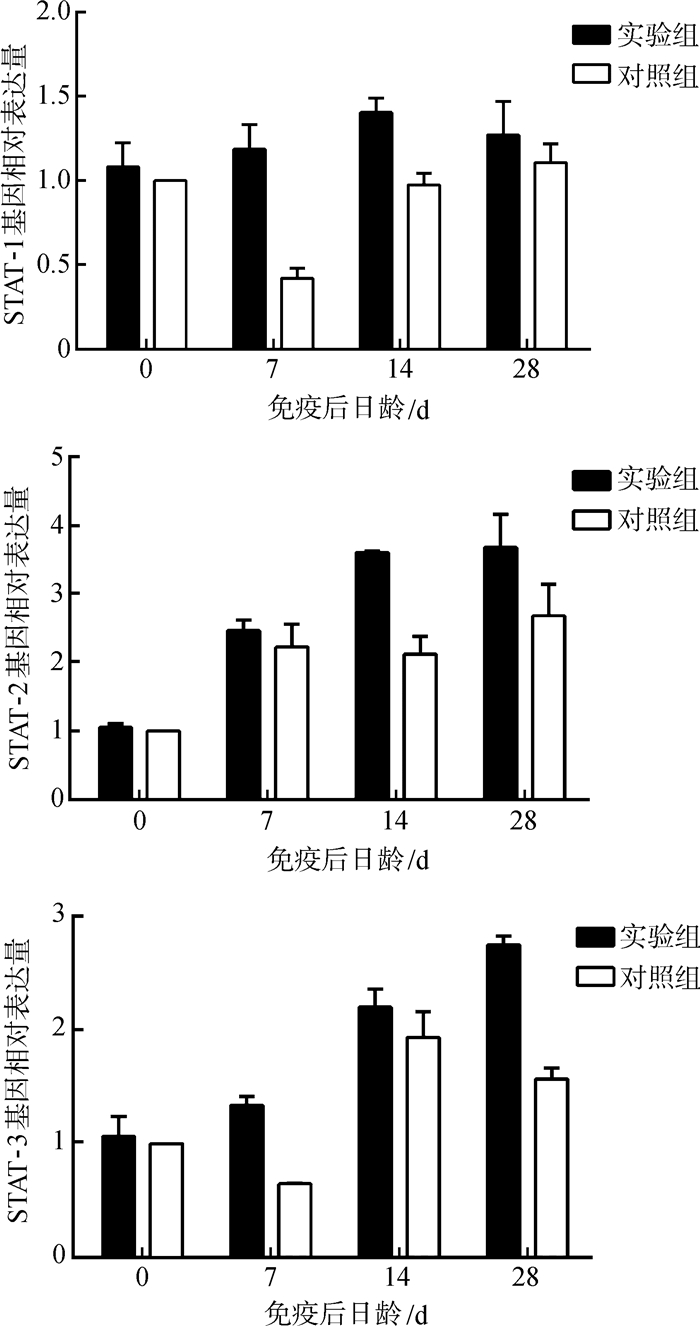
STAT-1基因表达水平在免疫后第7~14天均显著高于对照组(P<0.05),STAT-2基因表达水平在免疫后第14~28天显著高于对照组(P<0.05),STAT-3基因表达水平在免疫后第7、28天显著高于对照组(P<0.05)(图 6)。
|
| 图 6 仔猪免疫信号传导分子基因表达水平的变化 Fig. 6 The change of the immune signal transduction molecules related genes in the blood of experimental piglets |
| |
细胞因子是调节动物免疫功能的关键分子。许多细胞因子被证实作为佐剂对体液或细胞免疫有增强作用(Pasquini et al., 1997;Kayamuro et al., 2010)。IL-2不仅支持T细胞和NK细胞的活化和增殖,还可以刺激和活化B淋巴细胞增殖和诱导免疫球蛋白分泌(Smith,1988;Collins & Oldham,1993)。IL-4可促进体液免疫,增加特异性和非特异性杀伤功能(Erb et al., 1997;Paul,2015)。IL-6可调节B细胞活化、抗体产生和Th1型免疫反应(Paul & Seder,1994;Kishimoto,2006)。有研究表明,猪IL-4/6、IL-2和IL-4/6-2融合基因均可安全增强动物系统和全面的免疫(Yang et al., 2010, 2013;杨璐一等,2014)。基于以前的研究,本研究第一次将猪IL-4/6-2融合基因应用到猪上,来加强对PCV-2疫苗的免疫效果。
本实验用壳聚糖将重组质粒VRIL-4/6-2包裹,制备壳聚糖纳米颗粒,与PCV-2疫苗同时对实验仔猪进行肌肉注射免疫接种。实验所用重组质粒通过2A短肽连接3种白细胞介素基因,构建共表达质粒。2A短肽具有的自剪切机制使连接前后的基因表达量相同(de Felipe & Ryan,2004;Szymczak & Vignali,2005)。裸露的基因不稳定且半衰期短,转染效率低;而壳聚糖包裹质粒可形成小的带正电荷的纳米颗粒,与裸露的质粒相比,它可以更有效地携带目的基因进入细胞,还可以抑制其在生物体内降解,被证实是一种有潜力的缓释材料,并且还具有生物相容性(Chew et al., 2003;Cui & Mumper,2003),因此,壳聚糖作为基因载体的研究发展迅速(Buschmann et al., 2013;Fernández et al., 2016)。Huang等(2005)通过荧光标记研究壳聚糖-DNA复合粒子进入细胞的过程,证实了壳聚糖-DNA复合粒子可以被细胞内吞,继而进行后续基因转染。之前的研究也表明,壳聚糖纳米粒子在动物身上用于基因传递几乎没有毒性和影响(Yang et al., 2010;Zhang et al., 2012),并且空白载体质粒组与空白组没有差异(Yang et al., 2010)。本次实验由于阴性动物难于筛选获得,数量有限,并未进行空白载体质粒组的实验。
在实验期间,实验组和对照组仔猪注射局部均未出现病变、损伤或其他系统性症状。实验开始和结束时分别记录了每只仔猪的体质量,结果显示,实验组仔猪的生长速率显著高于对照组。有研究显示,IL-2、IL-4、IL-6、IL-10、TNF-α等细胞因子可在猪小肠中持续表达,并且细胞因子除了直接的免疫调节作用,还可影响上皮细胞的生长、内环境稳态和免疫细胞的运输(Oswald,2006;Devriendt et al., 2010)。推测VRIL-4/6-2质粒对调节仔猪内分泌、促进物质代谢有积极作用。
PCV-2特异性抗体和PCV-2中和抗体是体液免疫反应的重要检测指标(Meerts et al., 2006;Fort et al., 2007)。研究结果表明,实验组和对照组仔猪血清中PCV-2抗体的含量差异无统计学意义,且实验组仔猪血清中IgG1的含量显著低于对照组,这表明IL-4/6-2可能没有明显增强仔猪对PCV-2疫苗的体液免疫。此外,有研究显示,诱导细胞免疫对于PCV-2的防控很有必要(Fort et al., 2009)。本研究结果表明,实验组的CD4+和CD8+T淋巴细胞数量显著高于对照组,并且实验组的IL-2、TNF-α基因表达水平在第28天显著高于对照组。IL-2、IFN-γ和TNF-α均由Th1细胞产生,Th1细胞可诱导巨噬细胞活化、迟发性超敏反应和IgG2a的产生(Mosmann & Coffman,1989;Abbas et al., 1996)。同时,本次实验发现,接种质粒的实验组比对照组产生了更多的IgG2a抗体,表明实验组仔猪产生了更强的Th1型免疫应答,相比对照组,VRIL-4/6-2-CS提高了仔猪对PCV-2疫苗的细胞免疫应答。
另外,实验组仔猪血液中IL-4、IL-6、TLR-2、TLR-7、STAT-1、STAT-2、STAT-3基因的表达水平在不同时间段内也显著高于对照组。TLRs是先天免疫系统的重要组成部分,Toll-like受体在先天免疫中识别不同病原菌的保守分子模式,并参与对病原体的特异性体液和细胞免疫反应的激活(Kawai & Akira,2010)。STAT-1、STAT-2参与IFNs应答反应,并在干扰素抗病毒应答调节中起重要作用(Mitchell & John,2005;Steen & Gamero,2013);STAT-3可由多种细胞因子激活,例如IL-6、IL-12具有有效的抗炎作用,可调节细胞生长、凋亡、炎性基因的转录等重要细胞过程(Egwuagu,2009);JAK激酶和STAT蛋白参与了许多细胞因子的信号转导,它在细胞因子介导的免疫反应和调控中具有重要作用(Shuai & Liu,2003)。综上,这些基因表达水平的提高表明VRIL-4/6-2-CS诱导了更加全面的免疫应答,增强了仔猪的先天性和适应性免疫应答。
总之,本研究结果首次证实VRIL-4/6-2-CS可有效协同增强仔猪对PCV-2疫苗的免疫应答。VRIL-4/6-2-CS是一种新型高性价比佐剂,可提高猪对抗PCV-2感染的免疫预防能力,具有重要应用前景。
| Joseph S, David W, 黄培堂, 等. 2002. 分子克隆实验指南(第三版)[M]. 北京: 科学出版社: 32-36. |
| 杨璐一, 肖永乐, 万小平, 等. 2014. 猪白细胞介素2与融合白细胞介素4/6基因共表达的免疫效应研究[J]. 四川动物, 33(2): 167–173. |
| Abbas AK, Murphy KM, Sher A. 1996. Functional diversity of helper T lymphocytes[J]. Nature, 383(6603): 787. DOI:10.1038/383787a0 |
| Allan G, McNeilly F, Ellis J, et al. 2004. PMWS:experimental model and co-infections[J]. Veterinary Microbiology, 98(2): 165–168. DOI:10.1016/j.vetmic.2003.10.009 |
| Beach NM, Meng XJ. 2012. Efficacy and future prospects of commercially available and experimental vaccines against porcine circovirus type 2 (PCV2)[J]. Virus Research, 164(1): 33–42. |
| Bodmeier R, Chen H, Paeratakul O. 1989. A novel approach to the oral delivery of micro-or nanoparticles[J]. Pharmaceutical Research, 6(5): 413–417. DOI:10.1023/A:1015987516796 |
| Buschmann MD, Merzouki A, Lavertu M, et al. 2013. Chitosans for delivery of nucleic acids[J]. Advanced Drug Delivery Reviews, 65(9): 1234–1270. DOI:10.1016/j.addr.2013.07.005 |
| Chae C. 2005. A review of porcine circovirus 2-associated syndromes and diseases[J]. The Veterinary Journal, 169(3): 326–336. DOI:10.1016/j.tvjl.2004.01.012 |
| Chew JL, Wolfowicz CB, Mao HQ, et al. 2003. Chitosan nanoparticles containing plasmid DNA encoding house dust mite allergen, Der p 1 for oral vaccination in mice[J]. Vaccine, 21(21): 2720–2729. |
| Collins R, Oldham G. 1993. Recombinant human interleukin 2 induces proliferation and immunoglobulin secretion by bovine B-cells:tissue differences and preferential enhancement of immunoglobulin A[J]. Veterinary Immunology and Immunopathology, 36(1): 31–43. DOI:10.1016/0165-2427(93)90004-N |
| Cui Z, Mumper RJ. 2003. Microparticles and nanoparticles as delivery systems for DNA vaccines[J]. Critical Reviews in Therapeutic Drug Carrier Systems, 20(2-3): 103–137. DOI:10.1615/CritRevTherDrugCarrierSyst.v20.i23 |
| de Felipe P, Ryan MD. 2004. Targeting of proteins derived from self-processing polyproteins containing multiple signal sequences[J]. Traffic, 5(8): 616–626. DOI:10.1111/j.1398-9219.2004.00205.x |
| Devriendt B, Stuyven E, Verdonck F, et al. 2010. Enterotoxigenic Escherichia coli (K88) induce proinflammatory responses in porcine intestinal epithelial cells[J]. Developmental & Comparative Immunology, 34(11): 1175–1182. |
| Egwuagu CE. 2009. STAT3 in CD4+ T helper cell differentiation and inflammatory diseases[J]. Cytokine, 47(3): 149–156. DOI:10.1016/j.cyto.2009.07.003 |
| Erb KJ, Rüger B, Von Brevern M, et al. 1997. Constitutive expression of interleukin (IL)-4 in vivo causes autoimmune-type disorders in mice[J]. Journal of Experimental Medicine, 185(2): 329–340. DOI:10.1084/jem.185.2.329 |
| Fernández EF, Santos-Carballal B, Weber WM, et al. 2016. Chitosan as a non-viral co-transfection system in a cystic fibrosis cell line[J]. International Journal of Pharmaceutics, 502(1): 1–9. |
| Fort M, Fernandes LT, Nofrarias M, et al. 2009. Development of cell-mediated immunity to porcine circovirus type 2 (PCV2) in caesarean-derived, colostrum-deprived piglets[J]. Veterinary Immunology and Immunopathology, 129(1): 101–107. |
| Fort M, Olvera A, Sibila M, et al. 2007. Detection of neutralizing antibodies in postweaning multisystemic wasting syndrome (PMWS)-affected and non-PMWS-affected pigs[J]. Veterinary Microbiology, 125(3): 244–255. |
| Ge X, Wang F, Guo X, et al. 2012. Porcine circovirus type 2 and its associated diseases in China[J]. Virus Research, 164(1): 100–106. |
| Gillespie J, Opriessnig T, Meng X, et al. 2009. Porcine circovirus type 2 and porcine circovirus-associated disease[J]. Journal of Veterinary Internal Medicine, 23(6): 1151–1163. DOI:10.1111/jvim.2009.23.issue-6 |
| Huang J, Chen JL, Wang Y, et al. 2013. Enhancement of the immunity of piglets to pseudorabies vaccine with plasmids containing interleukin-6 gene and CpG motifs encapsulated in chitosan nanoparticles[J]. Procedia in Vaccinology, 7: 8–14. DOI:10.1016/j.provac.2013.06.003 |
| Huang M, Fong CW, Khor E, et al. 2005. Transfection efficiency of chitosan vectors:effect of polymer molecular weight and degree of deacetylation[J]. Journal of Controlled Release, 106(3): 391–406. DOI:10.1016/j.jconrel.2005.05.004 |
| Kawai T, Akira S. 2010. The role of pattern-recognition receptors in innate immunity:update on toll-like receptors[J]. Nature Immunology, 11(5): 373–384. DOI:10.1038/ni.1863 |
| Kayamuro H, Yoshioka Y, Abe Y, et al. 2010. Interleukin-1 family cytokines as mucosal vaccine adjuvants for induction of protective immunity against influenza virus[J]. Journal of Virology, 84(24): 12703–12712. DOI:10.1128/JVI.01182-10 |
| Kishimoto T. 2006. Interleukin-6:discovery of a pleiotropic cytokine[J]. Arthritis Research & Therapy, 8(2): S2. |
| Kishimoto T. 2010. IL-6:from its discovery to clinical applications[J]. International Immunology, 22(5): 347–352. DOI:10.1093/intimm/dxq030 |
| Li D, Chen JL, Zhang H, et al. 2011. Improvement of the immunity of pig to hog cholera vaccine by recombinant plasmid with porcine interleukin-6 gene and CpG motifs[J]. Vaccine, 29(22): 3888–3894. DOI:10.1016/j.vaccine.2011.03.036 |
| Meerts P, Misinzo G, Lefebvre D, et al. 2006. Correlation between the presence of neutralizing antibodies against porcine circovirus 2 (PCV2) and protection against replication of the virus and development of PCV2-associated disease[J]. BMC Veterinary Research, 2(1): 6. DOI:10.1186/1746-6148-2-6 |
| Mitchell TJ, John S. 2005. Signal transducer and activator of transcription (STAT) signalling and T-cell lymphomas[J]. Immunology, 114(3): 301–312. DOI:10.1111/imm.2005.114.issue-3 |
| Mosmann TR, Coffman RL. 1989. Heterogeneity of cytokine secretion patterns and functions of helper T cells[J]. Advances in Immunology, 46: 111–147. DOI:10.1016/S0065-2776(08)60652-5 |
| Oswald IP. 2006. Role of intestinal epithelial cells in the innate immune defence of the pig intestine[J]. Veterinary Research, 37(3): 359–368. DOI:10.1051/vetres:2006006 |
| Pasquini S, Xiang Z, Wang Y, et al. 1997. Cytokines and costimulatory molecules as genetic adjuvants[J]. Immunology & Cell Biology, 75(4): 397–401. |
| Paul WE, Seder RA. 1994. Lymphocyte responses and cytokines[J]. Cell, 76(2): 241–251. DOI:10.1016/0092-8674(94)90332-8 |
| Paul WE. 2015. History of interleukin-4[J]. Cytokine, 75(1): 3–7. DOI:10.1016/j.cyto.2015.01.038 |
| Segalés J, Allan GM, Domingo M. 2005. Porcine circovirus diseases[J]. Animal Health Research Reviews, 6(2): 119–142. DOI:10.1079/AHR2005106 |
| Shuai K, Liu B. 2003. Regulation of JAK-STAT signalling in the immune system[J]. Nature Reviews Immunology, 3(11): 900–911. DOI:10.1038/nri1226 |
| Smith KA. 1988. Interleukin-2:inception, impact, and implications[J]. Science, 240(4856): 1169. DOI:10.1126/science.3131876 |
| Steen HC, Gamero AM. 2013. STAT2 phosphorylation and signaling[J]. Jak-Stat, 2(4): e25790. DOI:10.4161/jkst.25790 |
| Szymczak AL, Vignali DA. 2005. Development of 2A peptide-based strategies in the design of multicistronic vectors[J]. Expert Opinion on Biological Therapy, 5(5): 627–638. DOI:10.1517/14712598.5.5.627 |
| Wang YP, Liu D, Guo LJ, et al. 2013. Enhanced protective immune response to PCV2 subunit vaccine by co-administration of recombinant porcine IFN-γ in mice[J]. Vaccine, 31(5): 833–838. DOI:10.1016/j.vaccine.2012.11.062 |
| Yang X, Sun WK, Chen WL, et al. 2010. Promotion of the immunity of piglets to hog cholera vaccine induced by shuffled pig interleukin-2 gene and CpG immunostimulatory sequences encapsulated in chitosan nanoparticles[J]. Procedia in Vaccinology, 2(1): 51–59. DOI:10.1016/j.provac.2010.03.010 |
| Yang X, Xiao YL, Chen JL, et al. 2013. Potentiation of immunity of piglets to mycoplasma hyopneumoniae vaccine with fused gene for pig IL-4 and IL-6 embodied in chitosan nanoparticles[J]. Procedia in Vaccinology, 7: 15–22. DOI:10.1016/j.provac.2013.06.004 |
| Zhang H, Cheng C, Zheng M, et al. 2007. Enhancement of immunity to an Escherichia coli vaccine in mice orally inoculated with a fusion gene encoding porcine interleukin 4 and 6[J]. Vaccine, 25(41): 7094–7101. DOI:10.1016/j.vaccine.2007.07.050 |
| Zhang HB, Wan XP, Bai GM, et al. 2012. Improvement of the immunity of piglets to PRRS vaccine by a porcine IL-4 and IL-6 fusion gene encapsulated in chitosan nanoparticles[J]. Procedia in Vaccinology, 6: 113–124. DOI:10.1016/j.provac.2012.04.016 |
 2018, Vol. 37
2018, Vol. 37




