扩展功能
文章信息
- 万丽霞, 张海军, 李海娇
- WAN Lixia, ZHANG Haijun, LI Haijiao
- 甘肃密点麻蜥三个地理种群的两性异形研究
- Sexual Dimorphism of Eremias multiocellata from Three Populations in Gansu Region
- 四川动物, 2018, 37(2): 139-148
- Sichuan Journal of Zoology, 2018, 37(2): 139-148
- 10.11984/j.issn.1000-7083.20170231
-
文章历史
- 收稿日期: 2017-07-25
- 接受日期: 2018-02-02
麻蜥亚属Eremias是Fitzinger于1834年为区分蜥蜴亚属Lacerta而建立的(Fitzinger,1834),并于1843年指定敏麻蜥Eremias arguta为麻蜥属Eremias的模式种,将亚属提升为属,并入Eremiae科(Fitzinger,1843)。麻蜥属物种广泛分布于亚洲、欧洲、非洲的温带和暖温带。赵肯堂(1983)认为麻蜥属全世界有50余种,而Fu(1999)认为有29种;赵尔宓等(2000)对中国两栖纲Amphibian和爬行纲Reptilia动物名录进行校正后,认为国内该属有9种,主要分布于东北、西北和华北,是草原和荒漠的典型动物(戴鑫等,2001;蔡波等,2015),甘肃地区分布有6种(姚崇勇,龚大洁,2012)。密点麻蜥Eremias multiocellata在甘肃地区分布较广,栖息于海拔1 500~2 200 m的干旱荒漠、山地阴坡、田边及路旁等生境中,主要以鞘翅目Coleoptera、膜翅目Hymenoptera和半翅目Hemiptera等昆虫为食(吾玛尔·阿布力孜,古丽波斯坦·艾则孜,1999),其次以蛛形类和植物种子为食(刘睿等,2015)。
两性异形是普遍存在于动物中的一种生物学现象,不仅表现为两性体型间的差异(Darwin,1871;Andersson,1994),且表现在外部形态特征、生理行为、生活习性及适合度等方面的显著差异(Fairbairn & Roff,2006)。两栖爬行动物中普遍存在两性异形现象,付晓宇等(2013)和廖灏泓等(2013)的研究发现,中国已知的156种蜥蜴中有6科28种存在不同程度的两性异形,其中,蜥蜴科Lacertidae有9种,占该科种类的42.9%。关于麻蜥属两性异形的研究主要有山地麻蜥E. brenchleyi(许雪峰,计翔,2003)、快步麻蜥E. velox(汪洋,2012)、丽斑麻蜥E. argus(陈绍勇等,2015)。有关密点麻蜥两性异形的研究仅见于李宏等(2006),其研究认为,内蒙古乌拉特后旗的密点麻蜥体型无显著的两性差异,雄性成体的头长和头宽均大于体长相同的雌性成体,但是缺乏有关雌雄两性在其他形态指标上的研究。本文通过对甘肃省3个地区密点麻蜥雌雄两性的形态特征研究,旨在为密点麻蜥的性选择理论提供更多的基础资料,为研究密点麻蜥种群生活史的进化提供参考。
1 材料与方法 1.1 研究材料2005—2011年,于甘肃省兰州市、张掖市、民勤县3个地区采集密点麻蜥样本(保存于95%无水乙醇溶液中)。根据传统形态度量标准和研究需要,用游标卡尺(精确度为0.02 mm)对选取的8个形态可量性状进行测量,包括:体长(snout-vent length,SVL;吻端至泄殖腔孔前缘距离)、头长(head length,HL;吻端到颌角的距离)、头宽(head width,HW;左右颌关节距离)、头高(head height,HH;头部最高处到下颌平面的垂线距离)、前肢长(fore-limb length,FLL;肱与前臂的长度)、后肢长(hind-limb length,HLL;股与胫的长度)、最大腹宽(belly width,BW;腹部最宽的距离)、尾长(tail length,TL;泄殖孔至尾端部的距离)。对浸制的密点麻蜥样本进行解剖以鉴定性别和性成熟情况,具有精巢的判定为雄性,具卵泡或者怀卵的判定为雌性;参考《中国动物志爬行纲第二卷有鳞目蜥蜴亚目蜥蜴科》(赵尔宓等,1999)并结合形态测量结果,记录样本中最小怀卵雌体的体长,将大于此体长的个体判定为成体。
1.2 数据处理用Excel和SPSS 20.0对所有数据进行统计分析。先用Kolmogorov-Smirnov检验正态性,用Levene检验方差同质性。符合正态性和方差齐性的数据,采用Pearson相关性检验分析雌、雄个体体长与其他形态特征的相关性;反之,采用非参数Spearman相关性检验。符合正态性和方差齐性的数据,采用单因素方差分析(One-Way ANOVA)比较两性个体体长的差异;对与体长有显著相关性的形态特征,以体长为协变量、性别为因变量做单因素协方差分析(One-Way ANCOVA)比较各形态特征的两性差异;利用线性回归进一步分析各形态特征和体长的关系,检验有无明显的线性关系来分析雌雄个体间的异速生长。不符合正态性和方差齐性的数据,先采用Mann-Whitney U检验分析两性差异,再进行对数处理,然后进行线性回归分析。
两性异性指数(sexual dimorphism index,SDI)反映某种群或物种中雌雄个体间形态特征差异的不同程度(Lovich & Gibbons,1992;Watkins,1996;汪洋,2012;陈旭等,2013),SDI=雄性某性状的均值/雌性某性状的均值-1(Lovich & Gibbons,1992)。雌性较大时,SDI为正值,而雄性较大时,SDI为负值。通过计算各形态特征的SDI绝对值之和反映3个种群间两性异形的差异程度。
描述统计值均用平均值±标准误(Mean±SE)表示,显著性水平设置为α=0.05。
2 结果 2.1 两性异形兰州地区密点麻蜥体长、前肢长、后肢长、头长、头宽、头高、尾长及最大腹宽数据见表 1。分析显示,雌雄间体长的差异无统计学意义(P=0.700),但雄性的头长(P=0.043)、前肢长(P=0.048)、后肢长(P=0.046)、头高(P<0.001)和尾长(P<0.001)显著或极显著大于雌性,雌性的最大腹宽极显著大于雄性(P=0.001),而头宽间的差异无统计学意义(P=0.057)。除雄性的前肢长及后肢长,雌性的前肢长、尾长及最大腹宽外,其余雌雄两性的各形态学特征均与体长显著或极显著正相关(表 2)。
| 形态特征 | 雄性(n=29)/mm | 雌性(n=21)/mm | 单因素方差分析 | 单因素协方差分析 | Mann-Whitney U检验 |
| 体长 | 55.74±1.10(43.68~67.00) | 55.04±1.48(41.84~68.98) | F1,48=0.150,P=0.700 | ||
| 前肢长 | 14.10±0.52(10.44~19.62) | 13.67±0.67(9.90~18.52) | F1,47=3.310,P=0.048 | ||
| 后肢长 | 18.62±0.61(14.10~24.82) | 17.73±0.58(14.14~22.08) | F1,47=4.043,P=0.046 | ||
| 头长 | 13.57±0.32(10.36~16.50) | 12.51±0.26(9.52~14.52) | U=-2.025,P=0.043 | ||
| 头宽 | 9.30±0.23(7.14~11.58) | 8.70±0.16(7.46~10.28) | U=-1.907,P=0.057 | ||
| 头高 | 7.60±0.19(5.48~9.78) | 7.18±0.20(5.68~9.36) | F1,47=55.142,P<0.001 | ||
| 尾长 | 77.64±2.10(58.38~99.82) | 71.81±1.84(56.58~86.24) | F1,47=17.024,P<0.001 | ||
| 最大腹宽 | 9.90±0.30(7.22~13.34) | 10.64±0.31(7.14~13.46) | F1,47=12.954,P=0.001 |
| 性别 | Pearson 相关性系数 | Spearman 相关性系数 | ||||||
| 前肢长 | 后肢长 | 头高 | 尾长 | 最大腹宽 | 头长 | 头宽 | ||
| 雄性 | 0.171ns | 0.165ns | 0.723** | 0.600** | 0.658** | 0.674** | 0.762** | |
| 雌性 | 0.352ns | 0.469* | 0.760** | 0.407ns | 0.205ns | 0.889** | 0.775** | |
| 注Notes:*P<0.05,**P<0.01;ns P>0.05;下同the same below | ||||||||
张掖地区密点麻蜥体长、前肢长、后肢长、头长、头宽、头高、尾长及最大腹宽数据见表 3。分析显示,雌雄间体长的差异无统计学意义(P=0.686),但雄性的头高(P=0.049)和前肢长(P<0.001)、后肢长(P<0.001)、头长(P<0.001)显著或极显著大于雌性,雌性的最大腹宽极显著大于雄性(P=0.006),而尾长、头宽间的差异无统计学意义。除雄性的尾长,雌性的头长、尾长及最大腹宽外,其余雌雄两性的各形态学特征均与体长具有极显著正相关性(表 4)。
| 形态特征 | 雄性(n=21)/mm | 雌性(n=19)/mm | 单因素方差分析 | 单因素协方差分析 | Mann-Whitney U检验 |
| 体长 | 55.18±1.21(46.82~63.28) | 55.85±1.07(48.26~65.20) | F1,38=0.166,P=0.686 | ||
| 前肢长 | 14.18±0.61(9.80~17.92) | 13.15±0.58(9.62~19.80) | F1,37=19.192,P<0.001 | ||
| 后肢长 | 19.39±0.83(12.04~24.90) | 17.97±0.71(12.18~25.00) | F1,37=20.367,P<0.001 | ||
| 头长 | 13.48±0.46(7.14~16.06) | 13.22±0.30(11.26~15.50) | F1,37=20.223,P<0.001 | ||
| 头宽 | 9.55±0.27(7.52~11.12) | 9.02±0.19(7.14~10.20) | U=-1.747,P=0.081 | ||
| 头高 | 7.82±0.24(6.08~9.72) | 7.15±0.18(4.88~8.30) | U=-1.965,P=0.049 | ||
| 尾长 | 74.20±1.93(59.92~93.08) | 72.08±2.10(53.82~89.28) | F1,37=3.676,P=0.063 | ||
| 最大腹宽 | 9.68±0.22(7.22~11.38) | 10.28±0.34(7.14~13.46) | F1, 37=8.439,P=0.006 |
| 性别 | Pearson相关性系数 | Spearman相关性系数 | ||||||
| 前肢长 | 后肢长 | 头长 | 尾长 | 最大腹宽 | 头宽 | 头高 | ||
| 雄性 | 0.473** | 0.495* | 0.715** | 0.193ns | 0.442* | 0.722** | 0.685** | |
| 雌性 | 0.748** | 0.759** | 0.358ns | 0.441ns | 0.452ns | 0.607** | 0.671** | |
民勤地区密点麻蜥体长、前肢长、后肢长、头长、头宽、头高、尾长及最大腹宽数据见表 5。分析显示,雄性体长显著大于雌性(P=0.028),且雄性的前肢长、后肢长、头长、头宽、头高、尾长和最大腹宽均极显著大于雌性(P<0.001)。雌雄两性的各形态学特征均与体长显著或极显著正相关(表 6)。
| 形态特征 | 雄性(n=22)/mm | 雌性(n=21)/mm | 单因素方差分析 | 单因素协方差分析 |
| 体长 | 61.53±1.25(48.48~69.70) | 56.64±1.76(41.64~71.24) | F1,41=5.224,P=0.028 | |
| 前肢长 | 16.96±0.47(13.04~20.52) | 15.88±0.49(12.40~21.02) | F1,40=29.672,P<0.001 | |
| 后肢长 | 22.19±0.59(18.52~28.30) | 20.72±0.70(14.80~28.08) | F1,40=28.084,P<0.001 | |
| 头长 | 15.22±0.30(12.38~17.66) | 13.68±0.42(10.82~18.12) | F1,40=98.532,P<0.001 | |
| 头宽 | 10.16±0.24(8.08~11.54) | 9.17±0.35(6.64~13.32) | F1,40=89.348,P<0.001 | |
| 头高 | 8.35±0.24(6.62~10.38) | 7.27±0.31(5.70~11.24) | F1,40=82.631,P<0.001 | |
| 尾长 | 93.82±2.73(66.26~112.32) | 81.79±2.22(64.98~102.12) | F1,40=24.833,P<0.001 | |
| 最大腹宽 | 10.86±0.36(8.74~14.02) | 10.73±0.47(7.46~16.70) | F1,40=54.852,P<0.001 |
| 性别 | 前肢长 | 后肢长 | 头长 | 头宽 | 头高 | 尾长 | 最大腹宽 |
| 雄性 | 0.435* | 0.427* | 0.845** | 0.899** | 0.778** | 0.754** | 0.689** |
| 雌性 | 0.827** | 0.790** | 0.843** | 0.796** | 0.848** | 0.535* | 0.804** |
在个体生长发育过程中,雌雄个体的各形态特征都会随着个体大小的增大而呈现出不同的生长速率。分别对雌雄个体的前肢长、后肢长、头长、头宽、头高、尾长和最大腹宽做相对体长的线性回归分析,结果发现,各形态特征与体长均符合线性关系。因此,采用线性回归分析各形态特征的异速生长,其斜率反映随体长增加,各形态特征的相对增长率,即不同性别间生长速率的差别。
兰州种群除前肢长(R雄性2=0.029 1,R雌性2=0.124 2)、后肢长(R雄性2= 0.027 1,R雌性2=0.220 1)和最大腹宽(R雄性2=0.432 7,R雌性2=0.042 1)外,其余4个形态特征均与体长有显著的线性关系(图 1)。从斜率来看,雄性前肢长和后肢长斜率小于雌性,而头长、头宽、头高、尾长和最大腹宽斜率均大于雌性,其中尾长的差异最大(斜率差=0.634 9),表明兰州种群雄性的头长、头宽、头高、尾长和最大腹宽随体长的生长速率明显大于雌性,尤其是尾长生长速率的两性差异最大。
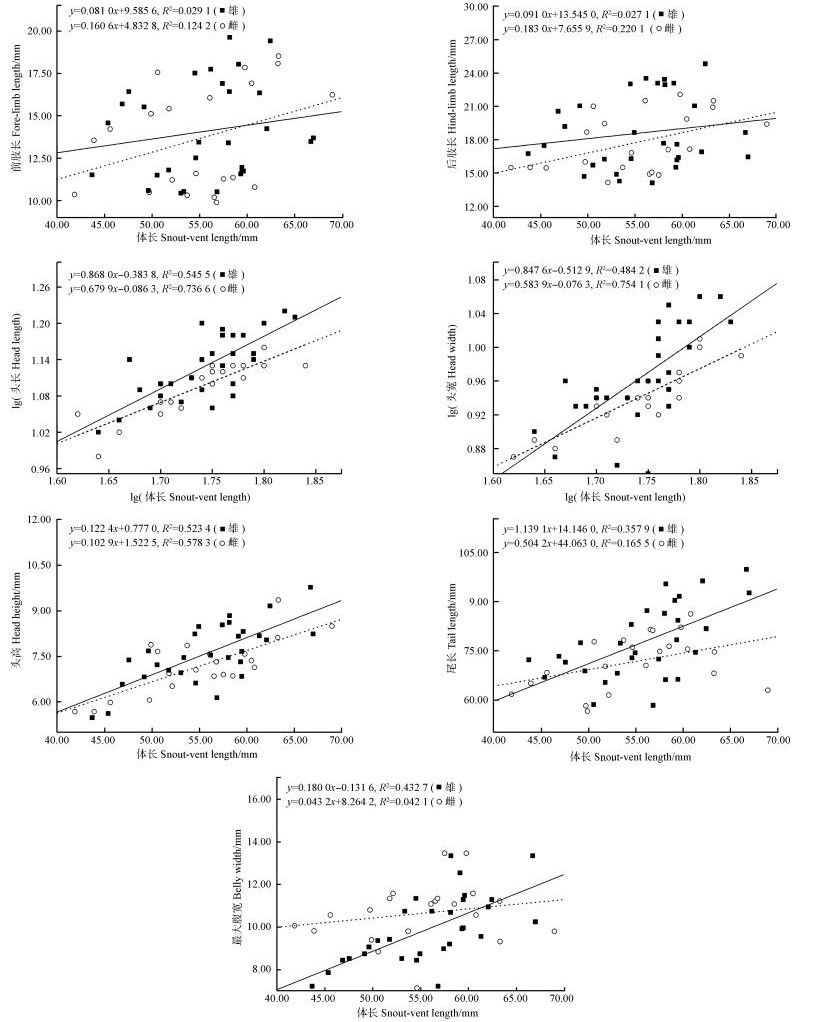
|
| 图 1 兰州地区密点麻蜥形态特征的异速生长与前肢长、后肢长、头长、头宽、头高、尾长和最大腹宽相对体长的线性回归 Fig. 1 Allometries of morphological characters of Eremias multiocellata in Lanzhou, and regressions of fore-limb length, hind-limb length, head length, head width, head height, tail length and belly width performed against snout-vent length |
| |
张掖种群除尾长(R雄性2=0.037 3,R雌性2=0.194 8)和最大腹宽(R雄性2=0.195 2,R雌性2=0.204 3)外,其余5个形态特征均与体长有显著的线性关系(图 2)。从斜率来看,雌性前肢长、后肢长、尾长和最大腹宽斜率均大于雄性,其中尾长的差异最大(斜率差=0.556 4),表明张掖种群雌性的前肢长、尾长和最大腹宽随体长的生长速率明显大于雄性,尤其是尾长生长速率的两性差异最大;而雌性头长、头宽及头高斜率均小于雄性,表明雄性的头长、头宽及头高随体长的生长速率明显大于雌性。
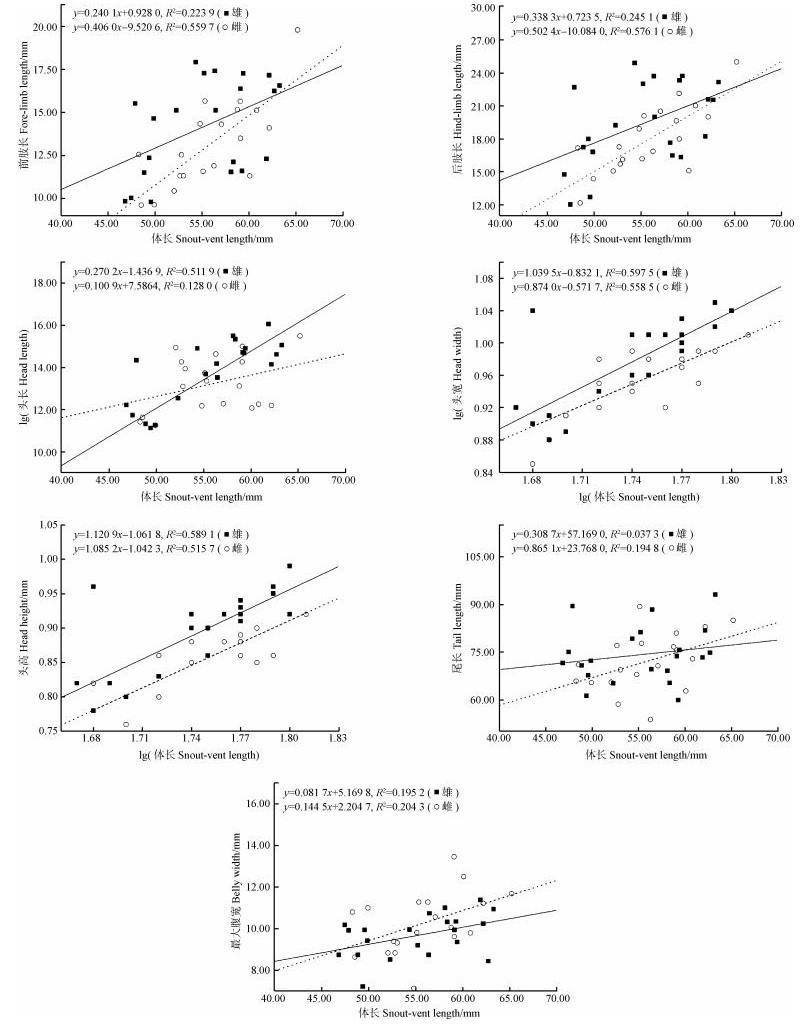
|
| 图 2 张掖地区密点麻蜥形态特征的异速生长与前肢长、后肢长、头长、头宽、头高、尾长和最大腹宽相对体长的线性回归 Fig. 2 Allometries of morphological characters of Eremias multiocellata in Zhangye, and regressions of fore-limb length, hind-limb length, head length, head width, head height, tail length and belly width performed against snout-vent length |
| |
民勤种群的7个形态特征均与体长呈显著的线性关系(图 3)。从斜率来看,雌性前肢长、后肢长和最大腹宽斜率均大于雄性,表明民勤种群雌性的前肢长、后肢长和最大腹宽随体长的生长速率明显大于雄性;而雄性头长、头宽、头高和尾长斜率均大于雌性,其中尾长差异最大(斜率差=0.975 5),表明雄性的头长、头宽、头高和尾长随体长的生长速率明显大于雌性,尤其是尾长生长速率的两性差异最大。
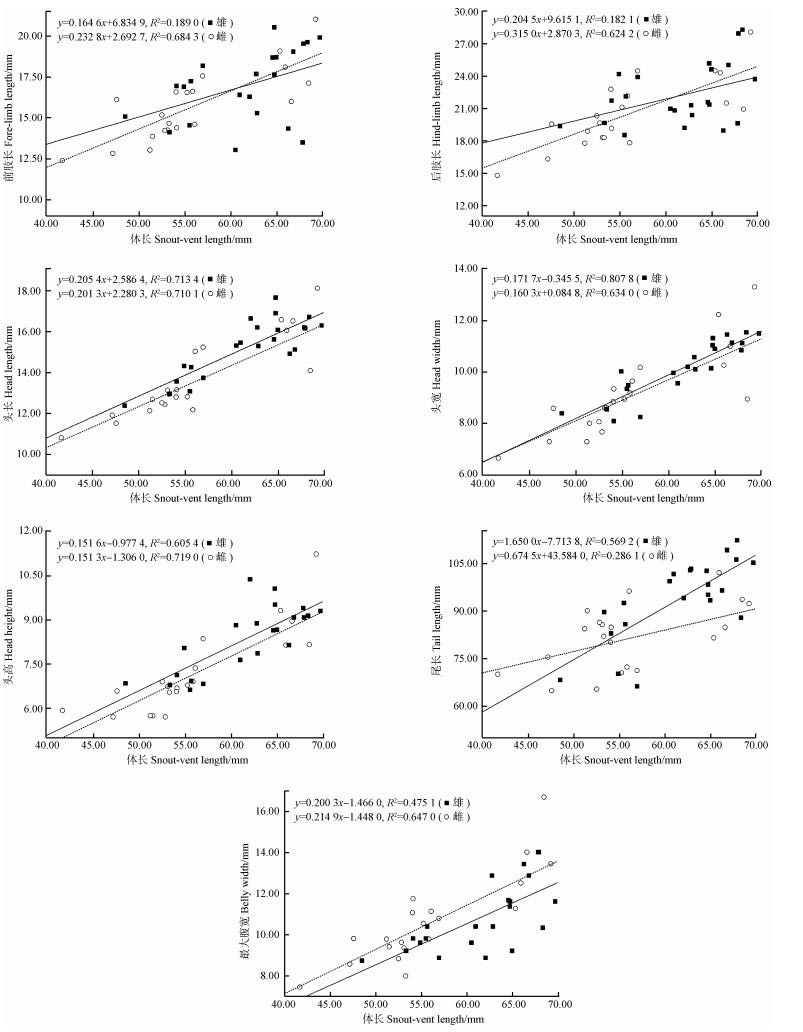
|
| 图 3 民勤地区密点麻蜥形态特征的异速生长与前肢长、后肢长、头长、头宽、头高、尾长和最大腹宽相对体长的线性回归 Fig. 3 Allometries of morphological characters of Eremias multiocellata in Minqin, and regressions of fore-limb length, hind-limb length, head length, head width, head height, tail length and belly width performed against snout-vent length |
| |
结合兰州、张掖、民勤3个地区密点麻蜥各形态特征的描述值计算出3个种群的两性异形指数(表 7),兰州种群雌雄间除最大腹宽(SDIBW=-0.069 5)外,其余7个形态特征的SDI均为正值,表明兰州种群雄性性状除最大腹宽外均大于雌性,雌雄间两性异形程度较大(SDI兰州=0.457 3)。张掖种群雌雄间除体长(SDISVL=0.012 0)、最大腹宽(SDIBW=0.058 4)外,其余6个形态特征的SDI均为正值,表明张掖种群雄性性状除体长、最大腹宽外均大于雌性,雌雄间两性异形程度较小(SDI张掖=0.429 3)。民勤种群雌雄间各形态特征的SDI均为正值,表明民勤种群雄性各形态特征大于雌性,雌雄间两性异形程度最大(SDI民勤=0.753 6)。
| 种群 | 两性异形指数SDI | 形态特征的SDI绝对值之和 | |||||||
| 体长 | 前肢长 | 后肢长 | 头长 | 头宽 | 头高 | 尾长 | 最大腹宽 | ||
| 兰州 | 0.012 7 | 0.031 5 | 0.050 2 | 0.084 7 | 0.069 0 | 0.058 5 | 0.081 2 | -0.069 5 | 0.457 3 |
| 张掖 | -0.012 0 | 0.078 3 | 0.079 0 | 0.019 7 | 0.058 8 | 0.093 7 | 0.029 4 | -0.058 4 | 0.429 3 |
| 民勤 | 0.086 3 | 0.068 0 | 0.070 9 | 0.112 6 | 0.108 0 | 0.148 6 | 0.147 1 | 0.012 1 | 0.753 6 |
两性异形模式分为3种:成体雌性大于成体雄性、成体雄性大于成体雌性、成体雌雄大小同形(Powell & Russell,1985)。本研究结果显示,兰州种群和张掖种群雌雄体长的两性异形不显著,与李宏等(2006)的研究结果一致,但民勤种群雄性体长显著大于雌性。两性体型间的差异主要是性选择作用的结果(Darwin,1871;Hedrick & Temeles,1989;Shine,1989),种群的两性异形表现为雌雄同形,则性选择作用于雌雄两性程度同等。民勤种群雄性体长显著大于雌性,说明性选择对雄性作用更为强烈。民勤位于腾格里沙漠和巴丹吉林沙漠交汇处,气候干燥,而适宜麻蜥生活的区域位于绿洲与沙漠交汇地带,植被稀疏,生境条件明显不同于另外2个种群。此外,民勤地区重叠分布有密点麻蜥的同属近缘种荒漠麻蜥E. przewalskii,资源利用重叠度高,资源的相对匮乏和强烈的种间竞争使民勤密点麻蜥种群密度较低。体型较大的雄性不仅更易获取生存资源(Shine,1989;廖灏泓等,2013a),还能够吸引更多雌性,获得更多交配机会,提高繁殖成功率(杜卫国,计翔,2001;林炽贤等,2004;Xu & Ji,2007;Kuo et al., 2009)。
头部大小的两性异形在蜥蜴类中较为常见,几乎所有的雄性头部都大于雌性。在一定程度上,头部大小与资源的占有能力呈正相关,通常头部较大的雄性会在竞争中获胜,能够占有包括配偶在内的所有资源(计翔等,2002;廖灏泓等,2013;赵雪,毕俊怀,201 4)。同时,头部大小的两性异形也是性选择作用的结果,两性个体的繁殖成功率与成体头部大小相关(张永普,计翔,2000;李宏等,2006)。头部较大,张口和咬合力会更强,更容易击退竞争者,占据更大的领域空间、食物等资源,从而吸引并保护雌性配偶,有效提高密点麻蜥繁殖适合度,提高种群的竞争力,维持种群数量(寿鹿等,2005;周伟等,2006;刘鹏等,2013)。本研究结果表明,3个地理种群的雄性头长、头宽、头高均显著大于雌性,雌雄个体间差异程度大,且头长、头宽、头高生长率明显大于雌性,这与李宏等(2006)的研究结果一致。
附肢长、尾长不仅与蜥蜴类的运动能力有关(Arnold & Bennett,1988),前肢还可作为攻击自保的武器。前后肢越长,运动速度越快,能获得更多资源。这不排除是性选择作用的结果(廖灏泓等,2013)。具有较大尾部的雄性更易获得雌性的青睐,可以提高交配率以及繁殖成功率(赵雪等,2014)。因此,雄性在生长过程中会减缓体型增长而加大尾部生长(梁涛等,2015)。本研究结果显示,3个地理种群中雄性个体的前肢长、后肢长、尾长均大于雌性个体,符合性选择压力假说,说明密点麻蜥雄性个体具有较大的前肢长、后肢长、尾长可能是在性选择压力和生存压力下不断得到强化的结果。
雌性个体可以通过增加腹腔容积来提高其窝卵数和繁殖频率,获得选择优势(林植华等,2007;徐峰等,2015)。本研究中,民勤种群雄性的腹宽显著大于雌性,而兰州种群和张掖种群雌性的腹宽显著大于雄性。民勤地区的生活环境更苛刻、多变,雄性需要较强的体力竞争资源、寻找配偶和成功交配,因而体型壮硕的个体能获得更高的繁殖适合度,提高后代存活率。兰州和张掖地区生境较为稳定,地处盆地,气候波动小,地表多以细小的沙质黄土、砂砾为主,而作为卵胎生物种,密点麻蜥具有较长的孕期,因此,具有较大腹宽的雌性个体能有效地觅食、躲避天敌和抵抗雨水冲击,提高后代的存活率。在性选择中,能够孕育出更多后代的雌性个体会获得雄性的青睐,因此在生育力选择压力的作用下进化出腹宽显著大于雄性的雌性。Berry和Shine(1980)与Zamudio(1998)认为雄性为适应雌性的生育力选择压力,逐渐向体型较小的方向进化,形成雌性大于雄性的两性异形模式。兰州种群和张掖种群两性个体体型大小无明显差异,因而兰州种群和张掖种群不支持此假说。
两性个体各形态指标的绝对值之和可以反映两性之间的差异程度,民勤种群两性异形差异最大,张掖种群两性异形差异较小。张掖种群的雌雄之间是否出现生态位分离,或者在特定环境下隐藏自身性别特征以避免冲突,使其出现了共性选择(Myhre et al., 2012),需要进一步研究。
综上所述,在体长方面,民勤种群存在两性差异,兰州种群和张掖种群均无明显的两性异形;而头部大小、附肢长及尾长等形态特征在3个种群中均表现出明显的两性异形。密点麻蜥雄性个体具有较大的头部、附肢长与尾长可能是雄性承受更大的性选择压力;而雌性个体具有较大的腹宽可能受更大的生育力选择压力。
| 蔡波, 王跃招, 陈跃英, 等. 2015. 中国爬行纲动物分类厘定[J]. 生物多样性, 22(3): 365–382. DOI:10.17520/biods.2015037 |
| 陈绍勇, 毕俊怀, 何志超, 等. 2015. 鄂尔多斯丽斑麻蜥两性异形及繁殖输出[J]. 动物学杂志, 50(2): 214–220. |
| 陈旭, 张方, 陈潘, 等. 2013. 凹耳蛙的两性异形[J]. 四川动物, 32(1): 73–77. |
| 戴鑫, 王跃招, 曾晓茂. 2001. 中国麻蜥属的分类历史简述[J]. 四川动物, 20(3): 135–138. |
| 杜卫国, 计翔. 2001. 蓝尾石龙子的生长、两性异形及雌性繁殖[J]. 动物学研究, 22(4): 279–286. |
| 付晓宇, 赵文阁, 刘鹏. 2013. 蜥蜴体色两性异形的研究进展[J]. 中国农学通报, 29(8): 55–58. DOI:10.11924/j.issn.1000-6850.2012-2470 |
| 计翔, 黄红英, 胡晓忠, 等. 2002. 中国石龙子雌体繁殖特征和卵孵化的地理变异[J]. 应用生态学报, 13(6): 680–684. |
| 李宏, 计翔, 屈彦福, 等. 2006. 密点麻蜥的两性异形和雌性繁殖[J]. 动物学报, 52(2): 250–255. |
| 梁涛, 吕士鹏, 武开乐, 等. 2015. 旱地沙蜥的两性异形和雌性繁殖投入[J]. 生态学杂志, 34(6): 1602–1606. |
| 廖灏泓, 徐峰, 杨维康. 2013. 两栖爬行动物两性大小异形研究进展[J]. 生态学杂志, 32(11): 3082–3093. |
| 林炽贤, 邱清波, 林隆慧, 等. 2004. 蜡皮蜥的两性异形和繁殖输出[J]. 动物学研究, 25(6): 477–483. |
| 林植华, 雷焕宗, 陈利丽, 等. 2015. 棒花鱼形态特征的两性异形和雌性个体生育力[J]. 四川动物, 26(4): 910–913. |
| 刘鹏, 刘恒, 张德成, 等. 2013. 东北林蛙的两性异形和抱对个体的形态相关性[J]. 动物学杂志, 48(2): 188–192. |
| 刘睿, 毕俊怀, 付明霞, 等. 2015. 鄂尔多斯地区密点麻蜥的食性分析[J]. 四川动物, 32(2): 193–199. |
| 寿鹿, 杜卫国, 舒霖. 2005. 金线侧褶蛙和泽陆蛙的两性异形与生育力[J]. 生态学报, 25(4): 664–668. |
| 汪洋. 2012. 新疆快步麻蜥5个地理种群两性异形和地理变异研究[D]. 乌鲁木齐: 新疆农业大学. |
| 吾玛尔·阿布力孜, 古丽波斯坦·艾则孜. 1999. 东疆沙蜥和密点麻蜥的食性研究[J]. 干旱区研究, 16(4): 10–13. |
| 徐峰, 廖灏泓, 杨维康. 2015. 旱地沙蜥的两性异形[J]. 四川动物, 34(6): 859–862. |
| 许雪峰, 计翔. 2003. 山地麻蜥个体发育过程中头部两性异形和食性的变化[J]. 应用生态学报, 14(4): 557–561. |
| 姚崇勇, 龚大洁. 2012. 甘肃两栖爬行动物[M]. 兰州: 甘肃科学技术出版社. |
| 张永普, 计翔. 2000. 北草蜥个体发育过程中头部两性异形及食性的变化[J]. 动物学研究, 21(3): 181–186. |
| 赵尔宓, 张学文, 赵蕙, 等. 2000. 中国两栖纲和爬行纲动物校正名录[J]. 四川动物, 19(3): 196–207. |
| 赵尔宓, 赵肯堂, 周开亚, 等. 1999. 中国动物志爬行纲第二卷有鳞目蜥蜴亚目[M]. 北京: 科学出版社: 220-243. |
| 赵肯堂. 1983. 中国麻蜥属的初步整理[J]. 动物学杂志, 21(1): 2–5. |
| 赵雪, 毕俊怀. 2014. 草原沙蜥幼体的形态两性异形[J]. 动物学杂志, 49(2): 274–279. |
| 周伟, 贺佳飞, 李明会, 等. 2006. 多疣狭口蛙昆明种群雌雄配对行为及形态适应选择[J]. 动物学研究, 27(2): 169–174. |
| Andersson M. 1994. Sexual selection[M]. rinceton: Princeton University Press. |
| Arnold SJ, Bennett AF. 1988. Behavioural variation in natural populations.V. Morphological correlates of locomotion in the garter snake (Thamnophis radix)[J]. Biological Journal of the Linnean Society, 34: 175–190. DOI:10.1111/bij.1988.34.issue-2 |
| Berry JF, Shine R. 1980. Sexual dimorphism and sexual selection in turtles (order Testudines)[J]. Oecologia, 44(2): 185–191. DOI:10.1007/BF00572678 |
| Darwin C. 1871. The descent of man, and selection in relation to sex[M]. London: John Murray. |
| Fairbairn DJC. 2006. The quantitative genetics of sexual dimorphism:assessing the importance of sex-linkage[J]. Heredity, 97(5): 319–328. DOI:10.1038/sj.hdy.6800895 |
| Fitzinger L. 1834. Eremias[M]//Wiegmann AFA. Herpetologica Mexicana, seu descriptio amphibiorum Novae Hispaniae, Pars prima. Saurorum species. Berolini: Lüderitz: 9. |
| Fu JZ. 1999. Phylogeny of lacertid lizard (Squamata: Lacertidae) and the evolution of unisexuality[D]. Ottawa: University of Toronto. |
| Hedrick AV, Temeles EJ. 1989. The evolution of sexual dimorphism in animals:hypotheses and tests[J]. Trends in Ecology & Evolution, 4(5): 136–138. |
| Kuo CY, Lin YT, Lin YS. 2009. Sexual size and shape dimorphism in an agamid lizard, Japalura swinhonis (Squamata:Lacertilia:Agamidae)[J]. Zoological Studies, 48(3): 351–361. |
| Lovich JE, Gibbons JW. 1992. A review of techniques for quantifying sexual size dimorphism[J]. Growth Development & Aging Gda, 56(4): 269–281. |
| Myhre LC, De JK, Forsgren E, et al. 2012. Sex roles and mutual mate choice matter during mate sampling[J]. American Naturalist, 179(6): 741–755. DOI:10.1086/665651 |
| Powell GL, Russell AP. 1985. Growth and sexual size dimorphism in Alberta populations of the eastern short-horned lizard, Phrynosoma douglassi brevirostre[J]. Canadian Journal of Zoology, 63(1): 139–154. DOI:10.1139/z85-023 |
| Shine R. 1989. Ecological causes for the evolution of sexual dimorphism:a review of the evidence[J]. Quarterly Review of Biology, 64: 419–461. DOI:10.1086/416458 |
| Watkins GG. 1996. Proximal causes of sexual size dimorphism in the iguanian lizard Microlophus occipitalis[J]. Ecology, 77(5): 1473–1482. DOI:10.2307/2265544 |
| Xu DD, Ji X. 2007. Sexual dimorphism, female reproduction and egg incubation in the oriental leaf-toed gecko (Hemidactylus bowringii) from southern China[J]. Zoology, 110: 20–27. DOI:10.1016/j.zool.2006.08.001 |
| Zamudio KR. 1998. The evolution of sexual size dimorphism:a population-level comparative study in horned lizards (Phrynosoma)[J]. Evolution, 52(6): 1821–1833. |
 2018, Vol. 37
2018, Vol. 37



