扩展功能
文章信息
- 邓秋洋, 张剑南, 王亚军, 李娟
- DENG Qiuyang, ZHANG Jiannan, WANG Yajun, LI Juan
- 家鸡似G蛋白偶联受体119基因的克隆与组织表达分析
- Molecular Cloning and Tissue Expression of Chicken GPR119-like Gene
- 四川动物, 2018, 37(1): 45-50
- Sichuan Journal of Zoology, 2018, 37(1): 45-50
- 10.11984/j.issn.1000-7083.20170142
-
文章历史
- 收稿日期: 2017-05-02
- 接受日期: 2017-09-22
G蛋白偶联受体(G protein-coupled receptor,GPCR)在真核生物中是最大、种类最多的细胞表面受体家族。人类基因组中参与编码GPCR的基因超过1 000个,广泛参与机体稳态、胚胎发育以及学习、记忆、视觉、嗅觉和味觉调控等过程,其胞外配体包括离子和小分子等,如脂肪酸、氨基酸、多肽和类固醇等(Takeda et al., 2002;Perez,2003;Vassilatis et al., 2003;Fredriksson & Schiöth,2005)。鉴于GPCRs在机体内介导的广泛生理效应,在制药工业中,50%的药物靶标设计针对GPCRs研发(Klabunde & Hessler,2002;Civelli,2005;Winzell & Ahrén,2007)。
G蛋白偶联受体119(GPR119)是一类A型视紫红质G蛋白偶联受体(rhodopsin-like GPCR),具典型7次跨膜结构,与胞内G蛋白偶联,介导下游效应(Hansen et al., 2012)。目前,在大鼠Rattus norvegicus、小鼠Mus musculus、仓鼠Mesocricetus auratus、黑猩猩Pan troglodytes、恒河猴Macaca mulatta、牛Bos taurus和狗Canis lupus familiaris等哺乳动物中,GPR119基因已获得鉴定(Overton et al., 2008)。在人Homo sapiens、小鼠中,GPR119基因cDNA全长1 008 bp,编码335个氨基酸的前体蛋白,具典型7次跨膜结构,并由单一外显子编码(Bonini et al., 2001;Ohishi et al., 2001)。GPR119一直以来被视为孤儿受体,但有文献报道其可以被内源性配体溶血卵磷脂和油酰乙醇胺激活(Soga et al., 2005;Overton et al., 2006)。GPR119可与Gαs蛋白偶联,结合配体后,可刺激下游cAMP水平上升(Holst et al., 2011),进而刺激β细胞胰岛素以及肠道K细胞的葡萄糖依赖性,促胰岛素肽(GIP)和L细胞的胰高血糖素样肽1(GLP-1)的释放(Chu et al., 2008)。GIP与GLP-1是最重要的促胰岛素释放因子,由此,GPR119激动剂成为治疗糖尿病药物研发的重要候选对象,解析GPR119基因序列及其编码蛋白结构备受关注(Kang,2013)。
尽管在哺乳动物中,GPR119的功能已逐步明确,但在包括鸟类在内的低等脊椎动物类群中,关于GPR119的研究几属空白。本研究以家鸡Gallus gallus为研究对象,从其小肠组织中克隆得到1个似GPR119(GPR119-like)新基因,并确定其氨基酸序列。因该基因与鸡和人的GPR119基因具较高序列同源性,因此将其命为cGPR119b。在此基础上,本研究采用实时荧光定量PCR技术首次探究了cGPR119b在家鸡组织中的表达情况。这些结果为探究家鸡GPR119b的内源性配体、胞内信号通路,以及其在家鸡组织中的生理效应奠定基础。
1 材料与方法 1.1 实验材料本实验中成体家鸡全部购自成都活禽市场。家鸡各组织放入液氮速冻后保存于-80 ℃备用。
1.2 实验试剂本实验中用于序列克隆的高保真DNA聚合酶(KOD-FX)体系、各种限制性内切酶、T4 DNA连接酶、Easy-Taq DNA聚合酶、dNTP、反转录酶购自TaKaRa;引物合成及测序由北京华大六和股份有限公司完成;RACE试剂盒购自Clontech;RNAzol购自Molecular Research Center;大肠杆菌Eschericha coli DH5α由本实验室制备保存;DNA纯化胶回收试剂盒购自上海生工生物有限公司。
1.3 方法 1.3.1 总RNA提取取家鸡心脏、肝脏、脾脏、肺、肾脏、肌肉、胰腺、精巢、卵巢、垂体,以及脑部各区域(大脑、下丘脑)和肠道分区(十二指肠、空肠、回肠、盲肠、直肠),放入液氮中速冻,并于液氮中充分研磨,将组织粉末与RNAzol混合均匀,加入240 μL DEPC-H2O混匀,4 ℃、12 000 r·min-1离心15 min;取上清,加入3 μL阿司咪唑,漩涡后于4 ℃、12 000 r·min-1离心10 min;取上清,加入等体积异丙醇,4 ℃、12 000 r·min-1离心15 min;弃上清,加入70%的乙醇漂洗2次,4 ℃、12 000 r·min-1离心3 min;弃上清,用DEPC-H2O溶解沉淀,-80 ℃保存。
1.3.2 RNA反转录以各组织RNA为模板,反转录获得cDNA。反转录反应体系为:RNA 2 μg,Oligo-dT 1 μL,加DEPC-H2O补足至5 μL,70 ℃加热10 min,取出后冰浴2 min;再加入2 μL 5×Buffer,dNTPs 0.5 μL(终浓度2 mmol·L-1),MMLV逆转录酶0.5 μL,2 μL DEPC-H2O,42 ℃孵育1.5 h,70 ℃加热10 min。反应产物用DEPC-H2O稀释至50 μL,MiliQ-H2O作cDNA模板,-20 ℃贮存。
1.3.3 引物设计根据NCBI数据库中的预测序列(LOC101750121)设计引物(表 1),扩增cDNA获得GPR119b基因全长,根据测序序列,设计检测cGPR119b组织表达的特异性引物。
| 基因 | 引物序列5'-3' | 片段长度/bp |
| GPR119b | rU1:CGGTGCAGTGGCCAGACATGGCT rL1:CCGACAGTTCAGGTGAAGGAGA |
1 276 |
| GPR119b | qU1:GACAGGTATCTGGCAGTGAG qL1:AAGCAGAGGGTGTAGAGGTA |
209 |
| GPR119b | GSP1:TGCCACTCTCCTACCGCACGCTTC nGSP1:GAAGCGTGCGGTAGGAGAGTGGCA |
|
| β-actin | U1:TGTGCTACGTCGCACTGGAT L1:GCTGATCCACATCTGCTGGA |
401 |
以小肠cDNA为模板,采用PCR对cGPR119b基因进行扩增。PCR反应体系:5 μL 2×KOD Buffer,2 μL cDNA模板,2 μL 2 mmol·L-1 dNTPs,0.1 μL rU1引物,0.1 μL rL1引物,0.2 μL KOD-Fx,加水补足至10 μL。反应条件为:94 ℃预变性2 min;94 ℃变性10 s,62 ℃退火30 s,68 ℃延伸60 s,34个循环;最后72 ℃延伸20 min。取3 μL产物用1.5%琼脂糖凝胶电泳检测。
1.3.5 利用5'-RACE获取cGPR119b基因5'-UTR序列根据SMART RACE cDNA Amplification Kit试剂盒制备cDNA模板。在此基础上,利用基因特异性引物PCR扩增cGPR119b基因的5'-UTR。PCR反应体系为:5 μL 2×KOD Buffer,2 μL cDNA模板,2 μL 2 mmol·L-1 dNTPs,0.1 μL UPM引物,0.1 μL GSP引物,0.2 μL KOD-Fx,加水补足至10 μL。反应条件:94 ℃预变性2 min;94 ℃变性10 s,72 ℃退火3 min,共5个循环;94 ℃变性10 s,70 ℃退火3 min,共5个循环;94 ℃变性10 s,68 ℃延伸3 min,25个循环;最后68 ℃延伸10 min。反应结束后,取3 μL产物用1.5%琼脂糖凝胶电泳检测。取上述产物稀释1 000倍作为模板,进行第二轮巢氏PCR反应。PCR反应体系及条件同上。
对获得的PCR产物进行加A反应。反应体系为:PCR产物4.5 μL,10×A-attachment Mix 0.5 μL,反应条件为60 ℃加热1 h。将加A后的PCR产物进行TA连接,反应体系为:加A后反应液1.5 μL,2×Ligation Buffer 2.5 μL,pTA2载体0.5 μL,T4 DNA连接酶0.5 μL,总体积5 μL。将TA连接产物转化DH5α进行菌落PCR筛选,将筛选到的阳性克隆进行质粒提取、双向序列测定。
1.3.6 cGPR119b基因的组织表达分析采用实时荧光定量PCR检测cGPR119b基因在成体家鸡各组织中的表达情况。PCR反应体系为:2 μL组织cDNA模板,1 μL 10×Easy-Taq Buffer,0.2 μL EvaGreen,0.2 μL dNTPs,0.15 μL qU1,0.15 μL qL1,0.15 μL Easy-Taq。PCR反应条件为:94 ℃预变性2 min;94 ℃变性20 s,62 ℃退火15 s,72 ℃延伸15 s,34个循环;最后72 ℃延伸5 min。实时荧光定量PCR的结果按照2-ΔΔCT法进行数据分析(Schmittgen & Livak,2008),步骤如下:首先将各组织样品cGPR119b基因的CT值减去对应组织内参基因β-actin的CT值,得到各组织的ΔCT值;然后将cGPR119b基因在回肠中的表达量选作参考,并将上一步分别所得的各组织的ΔCT值减去回肠组织的平均ΔCT值,得到ΔΔCT值;最后计算2-ΔΔCT值,得到各组织相对回肠中cGPR119b基因的表达量倍数,即cGPR119b基因在各组织间的相对表达量。
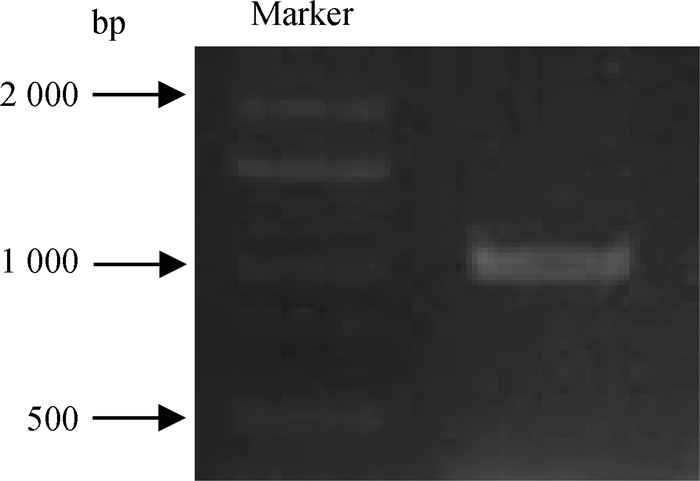
2 结果 2.1 cGPR119b基因编码区序列克隆以小肠cDNA为模板,根据表 1引物rU1+rL1,进行PCR扩增,得到cGPR119b基因编码区的全长cDNA序列。扩增片段约为1 kb,与预测基因片段大小一致(图 1)。将该片段进行胶回收,并克隆到pTA2载体上,经阳性克隆筛选与酶切验证后,选3个克隆进行测序分析。序列比对显示,成功克隆到cGPR119b基因的编码区序列。
|
| 图 1 cGPR119b基因开放阅读框区域扩增 Fig. 1 Amplification of the open reading frame of chicken GPR119b-like gene |
| |
cGPR119b基因开放阅读框长954 bp,由单一外显子编码,编码317个氨基酸的前体蛋白。与其他GPCRs一致,cGPR119b同样含典型7次跨膜结构域,在第二胞内区前端有1个D-R-Y基序(图 2)。通过与家鸡基因组序列进行比对分析,发现cGPR119b基因位于家鸡9号染色体上。cGPR119b的氨基酸序列与家鸡及人GPR119序列相似度相对较低(35%~36%),但与绿头鸭Anas platyrhynchos(XM_013100626)、绿海龟Chelonia mydas(XM_007072744)、西部锦龟Chrysemys picta bellii(XM_005310936)和火鸡Meleagris gallopavo(XM_010715066)的GPR119b具有很高的一致性,分别为79.9%、61.0%、62.3%和95.5%(图 2)。

|
| 图 2 家鸡(Gg)GPR119b的氨基酸序列与绿头鸭(Ap)、绿海龟(Cm)、西部锦龟(Cb)、火鸡(Mg)的比对分析 Fig. 2 Amino acid sequence alignment of chicken (Gg) GPR119b with that of Anas platyrhynchos (Ap), Chelonia mydas (Cm), Chrysemys picta bellii (Cb), Meleagris gallopavo (Mg) 阴影部分显示7次跨膜区,方框显示视紫红质亚家族的典型“D-R-Y”基序,圆点表示与家鸡GPR119b相同的氨基酸残基,破折号表示氨基酸残基的缺失 The putative seventransmembrane domains (TM1-7) were shaded, the"D-R-Y"motif was boxed, dots indicate the amino acids identical to chicken GPR119b and dashes indicate the gaps in the sequence |
| |
为探究cGPR119b基因的结构,以小肠cDNA为模板,采用5'-RACE方法扩增cGPR119b基因的5'-UTR区域,成功获得5'-UTR序列。结果显示,cGPR119b基因的5'-UTR大小为678 bp。通过与家鸡基因组序列比对,发现该区域不含新的外显子。由此可知,与GPR119基因一致,cGPR119b基因也由单一外显子组成(图 3)。

|
| 图 3 cGPR119b的基因组成(5'-UTR+编码区)(A)及其5'-UTR区域核苷酸序列(B) Fig. 3 Composition of chicken GPR119-like gene (cGPR119b) (A) and its 5'-UTR region nucleotide sequence (B) |
| |
实时荧光定量PCR结果显示,cGPR119b基因在大脑、肝脏、肾脏、卵巢、精巢、垂体、胰腺、皮肤、脂肪、肺、十二指肠、空肠、回肠、盲肠、直肠等组织有表达。其中,cGPR119b基因在肝脏、肾脏、盲肠和精巢的表达量较高;在胰腺、皮肤、脂肪和肺等组织中仅有微量表达,而在下丘脑和脾脏不表达(图 4)。

|
| 图 4 cGPR119b基因在家鸡组织中的表达 Fig. 4 Chicken GPR119b-like gene expression in chicken tissues IL.回肠,Br.大脑,Sp.脾脏,Ki.肾脏,Ov.卵巢,Te.精巢,Pi.垂体,Pa.胰腺,Fat.脂肪,Du.十二指肠,Je.空肠,Lu.肺,Ce.盲肠,Li.肝脏,Re.直肠,Hy.下丘脑,Sk.皮肤 IL. ileum, Br. brain, Sp. spleen, Ki. kidney, Ov. ovary, Te. testis, Pi. pituitary, Pa. pancreas, Fat. fat, Du. duodenum, Je. jejunum, Lu. lung, Ce. cecum, Li. liver, Re. rectum, Hy. hypothalamus, Sk. skin |
| |
GPR119是A型视紫红质G蛋白偶联受体家族成员。在哺乳类动物中,该基因高表达于胰腺β细胞和PP细胞以及小肠组织的内分泌L细胞,参与胰岛素的释放调节,成为制药公司研发糖尿病治疗用药的靶标,备受关注(Moran et al., 2016)。本文首次报道了cGPR119b基因序列及其组织表达图谱,研究结果为探究cGPR119b基因在家鸡中的生理效应奠定基础。
利用RT-PCR技术成功从家鸡小肠中克隆得到cGPR119b基因的完整编码区序列。序列分析显示,cGPR119b基因的cDNA全长954 bp,编码具317个氨基酸的前体蛋白,该蛋白由单一外显子编码,具典型7次跨膜结构域,第二胞内区域前端含D-R-Y基序。氨基酸序列对比发现,家鸡GPR119b分别与绿头鸭、绿海龟、西部锦龟和火鸡中预测的GPR119b有79.9%、61.0%、62.3%、95.5%的序列相似度,但与人、小鼠和家鸡GPR119(JQ768805,本实验室已克隆)的序列相似度则较低,因此,本研究将该似GPR119基因命名为cGPR119b。有趣的是,GPR119b基因在哺乳动物中已消失。
采用5'-RACE技术成功获得cGPR119b基因的5'-UTR。测序结果显示,该5'-UTR长度为678 bp,暗示该5'-UTR区或含未知调控序列,或参与控制cGPR119b基因翻译效率。利用实时荧光定量PCR方法解析cGPR119b基因在家鸡组织中的表达图谱,发现cGPR119b基因在肝脏、精巢、肾脏和盲肠等组织表达量较高,而在胰腺和肠分区组织中的表达量较低。该结果与哺乳动物GPR119基因的组织表达存在较大差异(Chu et al., 2007;Odori et al., 2013)。在大鼠中,GPR119基因主要在胰腺组织表达(Sakamoto et al., 2006);在人中,GPR119基因在胰腺和肠内分泌细胞高表达(Chu et al., 2008)。GPR119基因在家鸡中存在2个拷贝(cGPR119与cGPR119b)。家鸡GPR119b基因组织表达图谱区别于其在人、大鼠中的表达图谱,这一结果暗示:cGPR119b基因或与哺乳动物及家鸡GPR119基因的功能显著不同,值得深入探究。
| Bonini JA, Borowsky BE, Adham N, et al. 2001. DNA encoding SNORF25 receptor: U. S. Patent 6, 221, 660[P]. (2001-4-24)[2017-5-1]. https://www.google.com/patents/US6221660660. |
| Chu ZL, Carroll C, Alfonso J, et al. 2008. A role for intestinal endocrine cell-expressed G protein-coupled receptor 119 in glycemic control by enhancing glucagon-like peptide-1 and glucose-dependent insulinotropic peptide release[J]. Endocrinology, 149(5): 2038–2047. DOI:10.1210/en.2007-0966 |
| Chu ZL, Jones RM, He H, et al. 2007. A role for β-cell-expressed G protein-coupled receptor 119 in glycemic control by enhancing glucose-dependent insulin release[J]. Endocrinology, 148(6): 2601–2609. DOI:10.1210/en.2006-1608 |
| Civelli O. 2005. GPCR deorphanizations:the novel, the known and the unexpected transmitters[J]. Trends in Pharmacological Sciences, 26(1): 15–19. DOI:10.1016/j.tips.2004.11.005 |
| Fredriksson R, Schiöth HB. 2005. The repertoire of G-protein-coupled receptors in fully sequenced genomes[J]. Molecular Pharmacology, 67(5): 1414–1425. DOI:10.1124/mol.104.009001 |
| Hansen HS, Rosenkilde MM, Holst JJ, et al. 2012. GPR119 as a fat sensor[J]. Trends in Pharmacological Sciences, 33(7): 374–381. DOI:10.1016/j.tips.2012.03.014 |
| Holst JJ, Knop FK, Vilsbøll T, et al. 2011. Loss of incretin effect is a specific, important, and early characteristic of type 2 diabetes[J]. Diabetes Care, 34(Supplement 2): S251–S257. |
| Kang SU. 2013. GPR119 agonists:a promising approach for T2DM treatment? A SWOT analysis of GPR119[J]. Drug Discovery Today, 18(23): 1309–1315. |
| Klabunde T, Hessler G. 2002. Drug design strategies for targeting G-protein-coupled receptors[J]. Chembiochem, 3(10): 928–944. DOI:10.1002/1439-7633(20021004)3:10<928::AID-CBIC928>3.0.CO;2-5 |
| Moran BM, McKillop AM, O'Harte FP. 2016. Development of novel ligands for peptide GPCRs[J]. Current Opinion in Pharmacology, 31: 57–62. DOI:10.1016/j.coph.2016.08.009 |
| Odori S, Hosoda K, Tomita T, et al. 2013. GPR119 expression in normal human tissues and islet cell tumors:evidence for its islet-gastrointestinal distribution, expression in pancreatic beta and alpha cells, and involvement in islet function[J]. Metabolism, 62(1): 70–78. DOI:10.1016/j.metabol.2012.06.010 |
| Ohishi T, Takasaki J, Matsumoto M, et al. 2001. Method of screening remedy for diabetes: U. S. Patent 10/240, 540[P]. (2001-11-30)[2017-5-1]. https://www.google.com/patents/US20030180813. |
| Overton H, Fyfe M, Reynet C. 2008. GPR119, a novel G protein-coupled receptor target for the treatment of type 2 diabetes and obesity[J]. British Journal of Pharmacology, 153(S1): S76–S81. |
| Overton HA, Babbs AJ, Doel SM, et al. 2006. Deorphanization of a G protein-coupled receptor for oleoylethanolamide and its use in the discovery of small-molecule hypophagic agents[J]. Cell Metabolism, 3(3): 167–175. DOI:10.1016/j.cmet.2006.02.004 |
| Perez DM. 2003. The evolutionarily triumphant G-protein-coupled receptor[J]. Molecular Pharmacology, 63(6): 1202–1205. DOI:10.1124/mol.63.6.1202 |
| Sakamoto Y, Inoue H, Kawakami S, et al. 2006. Expression and distribution of Gpr119 in the pancreatic islets of mice and rats:predominant localization in pancreatic polypeptide-secreting PP-cells[J]. Biochemical and Biophysical Research Communications, 351(2): 474–480. DOI:10.1016/j.bbrc.2006.10.076 |
| Schmittgen TD, Livak KJ. 2008. Analyzing real-time PCR data by the comparative CT method[J]. Nature Protocols, 3(6): 1101–1108. DOI:10.1038/nprot.2008.73 |
| Soga T, Ohishi T, Matsui T, et al. 2005. Lysophosphatidylcholine enhances glucose-dependent insulin secretion via an orphan G-protein-coupled receptor[J]. Biochemical and Biophysical Research Communications, 326(4): 744–751. DOI:10.1016/j.bbrc.2004.11.120 |
| Takeda S, Kadowaki S, Haga T, et al. 2002. Identification of G protein-coupled receptor genes from the human genome sequence[J]. FEBS Letters, 520(1-3): 97–101. DOI:10.1016/S0014-5793(02)02775-8 |
| Vassilatis DK, Hohmann JG, Zeng H, et al. 2003. The G protein-coupled receptor repertoires of human and mouse[J]. Proceedings of the National Academy of Sciences, 100(8): 4903–4908. DOI:10.1073/pnas.0230374100 |
| Winzell MS, Ahrén B. 2007. G-protein-coupled receptors and islet function-Implications for treatment of type 2 diabetes[J]. Pharmacology & Therapeutics, 116(3): 437–448. |
 2018, Vol. 37
2018, Vol. 37