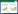扩展功能
文章信息
- 税典章, 陈胜峰, 吴萍, 叶元土, 陈佳, 张晶晶
- SHUI Dianzhang, CHEN Shengfeng, WU Ping, YE Yuantu, CHEN Jia, ZHANG Jingjing
- 异育银鲫过氧化物还原酶基因的克隆及其表达分析
- cDNA Cloning, Characterization and Expression Analysis of Peroxiredoxin Gene in Carassius auratus gibelio
- 四川动物, 2018, 37(1): 35-44
- Sichuan Journal of Zoology, 2018, 37(1): 35-44
- 10.11984/j.issn.1000-7083.20170233
-
文章历史
- 收稿日期: 2017-07-27
- 接受日期: 2017-09-29
过氧化物还原酶(peroxiredoxin,Prx)属于抗氧化蛋白超家族,是机体中一种重要的抗氧化酶,广泛存在于各种生物体内(章波等,2004)。Prx可有效调节体内活性氧(reactive oxygen species,ROS)水平,起抗氧化作用(Lee et al., 2003;Nonn et al., 2003)。此外,它还能刺激细胞的增殖与分化(Dierick et al., 2003),参与细胞信号转导和保护其他蛋白,是抵抗外界不良环境影响的重要免疫因子(章波等,2004)。目前,已经克隆和表达了多种生物的Prx基因cDNA序列,如牛Bos taurus(Singh & Shichi,1998)、人Homo sapiens(Fatma et al., 2001)、褐家鼠Rattus norvegicus(Fujii & Ikeda,2001)、斑点叉尾Ictalurus punctatus(Yeh & Klesius,2007)、鱼Miichthys miiuy(Ren et al., 2013)、斑马鱼Danio rerio(孙晶,薛壮,2015)和青鱼Mylopharyngodon piceus(Wu et al., 2016)等,但在异育银鲫Carassius auratus gibelio中尚未见报道。
异育银鲫是以天然雌核发育的方正银鲫Carassius auratus gibelio (Bloch)为母本、兴国红鲤Cyprinus carpio var. singuonensis为父本,经异精雌核发育得到的子代(徐文斌,孙晓波,1993)。它具有生长迅速、食性广泛、捕捞容易、耐低氧、繁殖方便和经济价值高等优点,在养殖生产中显示出良好的经济性状(潘庭双等,2001),其养殖业在淡水渔业中占据十分重要的地位(陈静等,2014)。然而近年来,因感染鲤疱疹病毒Ⅱ型(cyprinid herpesvirusⅡ,CyHV-2)导致的鳃出血病,严重威胁着异育银鲫的养殖产业,某些染病塘口的死亡率甚至高达100%(张晗,2014)。了解异育银鲫的非特异性免疫及免疫防御机制,是提高异育银鲫抗病能力的基础。进行异育银鲫Prx基因的研究,不仅可为研究其先天免疫反应机制提供基础资料,也可为研究其他鱼类的抗病机制提供借鉴。
本研究从异育银鲫转录组测序的结果中鉴定了Prx基因的部分序列,利用反转录PCR(RT-PCR)和cDNA末端快速扩增技术(rapid amplification of cDNA ends,RACE)克隆了其cDNA全长,预测了蛋白质序列、进行了系统进化分析;研究了异育银鲫过氧化物还原酶(CaPrx)基因的组织表达特征,并比较了它在健康和感染CyHV-2的异育银鲫体内的表达差异,以期为异育银鲫的健康养殖提供理论依据和参考。
1 材料与方法 1.1 材料 1.1.1 实验鱼健康的异育银鲫由江苏省东台市林华水产养殖有限公司提供,二夏龄,体质量为98~188 g,共120尾,其中雌鱼70尾。自然发病的鱼体由江苏省大丰市华辰水产实业有限公司提供,二夏龄,体质量89~141 g,共36尾,其中雌鱼22尾。病鱼全身发黑,背鳍和尾鳍末端发白,眼球充血突出,肌肉充血,鳃呈鲜红色,鳃丝出血,在鳃丝末端有红色斑块。抽取健康鱼血液,解剖取出鳃、肠道、肝脏、脾脏、头肾、中肾、表皮和肌肉等组织;解剖病鱼并取出肝脏和脾脏。上述组织在DEPC水配制的磷酸缓冲盐溶液(PBS)中漂洗后,经液氮冷冻,于-80 ℃保存,用于总RNA提取。
1.1.2 试剂大肠杆菌Escherichia coli DH5α感受态细胞、琼脂糖购自Invitrogen;DEPC购自上海生工生物公司;PrimeScriptTM RTase逆转录酶、RNA酶抑制剂、pMD19-T载体、Trizol、DNA聚合酶Ⅰ、SYBR Premix Ex Taq、dNTP、rTaq酶、DNA Marker购自TaKaRa;SMARTTMRACE cDNA扩增试剂盒购自Clontech。
1.2 患病鱼体的鉴定根据CyHV-2病毒序列(KM200722.1)设计引物CyHV-2-F、CyHV-2-R(表 1),以病鱼各组织DNA为模板进行PCR扩增,25 μL反应体系如下:灭菌蒸馏水16.2 μL、rTaq酶0.3 μL、10×PCR Buffer(Mg2+ Plus)2.5 μL、2.5 mM dNTP Mixture2 μL、模板DNA 2 μL、上下游引物(10 μM)各1 μL。PCR反应程序为:94 ℃预变性4 min;94 ℃40 s、60 ℃ 30 s、72 ℃ 40 s,共25个循环;72 ℃延伸10 min。所得PCR产物送苏州金唯智科技有限公司测序,序列结果在NCBI上进行BlastX比对分析。
| 引物 Primer |
引物序列(5'-3') Primer sequence (5'-3') |
| CyHV-2-F | TGGAATCAGTTCAACGCGTCAT |
| CyHV-2-R | CGTCAGTGCCTGGCAGTAATA |
| actin-F | AGGAGGAAGCAGCAGTGC |
| actin-R | GGTTGGTATGGGACAGAA |
| actin-q-F | TGTCCCTGTATGCCTCTGGT |
| actin-q-R | TGTAGCCTCTCTCGGTCAGG |
| Prx-F | AGCCTGCTCCTCAGTTCA |
| Prx-R | TTCTCCATATTTGTCGGTGT |
| Prx-q-F | TCTGGCATGGATCAACACAC |
| Prx-q-R | CTGCACCAGTCTCAGGGTCT |
| 3-Prx-inner | ATCCCACTGGTGGCTGACCTGACTC |
| 3-Prx-outer | GTTTCGTAAAATCGGCTGCGAGGTC |
| 5-Prx-inner | CGATGACCTCGCAGCCGATTTTACG |
| 5-Prx-outer | CAGGTCAGCCACCAGTGGGATGTTC |
| UPM Long | CTAATACGACTCACTATAGGGCA-AGCAGTGGTATCAACGCAGAGT |
| UPM Short | CTAATACGACTCACTATAGGGC |
| NUP(Nest Universal Primer A) | AAGCAGTGGTATCAACGCAGAGT |
取-80 ℃保存的各组织样品于液氮中研磨,参照Trizol使用说明书进行总RNA提取。用DNase Ⅰ对RNA进行消化处理,所得RNA经紫外分光光度计检测浓度,1%琼脂糖凝胶电泳检测后,按照PrimeScriptTM RT 1st strand cDNA Synthesis Kit试剂盒说明书合成cDNA的第一链,-20 ℃保存备用。
1.4 CaPrx基因、β-actin基因核心序列的克隆根据本实验室异育银鲫转录组测序结果所鉴定的Prx基因、β-actin基因cDNA序列设计引物Prx-F、Prx-R、actin-F和actin-R(表 1)。以异育银鲫肝脏cDNA为模板,采用RT-PCR技术扩增CaPrx、β-actin基因。25 μL反应体系如下:灭菌蒸馏水16.2 μL、rTaq酶0.3 μL、10×PCR Buffer(Mg2+ Plus)2.5 μL、2.5 mM dNTP Mixture 2 μL、模板cDNA 2 μL、上下游引物(10 μM)各1 μL。PCR反应程序为:94 ℃预变性4 min;94 ℃ 40 s、57 ℃40 s、72 ℃ 40 s,共30个循环;72 ℃延伸10 min。PCR产物经电泳、回收、连接、转化后,挑选单克隆送苏州金唯智科技有限公司测序,所得cDNA片段与GenBank数据库中的已知序列进行BlastX同源性分析。
1.5 CaPrx基因全长cDNA序列的获得根据上述克隆测序获得的CaPrx基因cDNA片段序列,设计3'RACE引物3-Prx-inner、3-Prx-outer和5'RACE引物5-Prx-inner、5-Prx-outer(表 1)。以异育银鲫肝脏总RNA为模板,根据SMARTTMRACE cDNA扩增试剂盒说明书分别合成3'-RACE-Ready cDNA和5'-RACE-Ready cDNA。分别以3'-RACE-Ready cDNA和5'-RACE-Ready cDNA为模板,以引物UPM和基因特异outer引物进行首轮PCR扩增,电泳检测并将PCR产物稀释50倍后,以引物NUP和基因特异inner引物进行巢式PCR反应。PCR产物纯化、克隆和测序方法同1.4。
1.6 CaPrx基因的同源性对比、全长cDNA序列特征分析及进化树构建用Vector NTI Suite对获得的cDNA序列进行拼接。使用NCBI的ORF Finder对获得的序列作开放阅读框(ORF)分析(www.ncbi.nlm.nih.gov/orffinder/),预测编码氨基酸序列。通过NCBI BlastP(http://blast.ncbi.nlm.nih.gov/)进行同源性分析。异育银鲫Prx蛋白与其他物种氨基酸序列的比较使用Clustal W多序列对比和BioEdit分析。用MEGA 6.0以邻接法构建系统进化树,分子节点支持率采用1 000次重复抽样检测。利用PROTPARAM(http://expasy.org/tools/protparam.html)分析蛋白质的理化性质,信号肽的预测使用Signal P(http://www.cbs.dtu.dk/services/SignalP)。
1.7 异育银鲫不同组织中CaPrx基因的mRNA表达以1.3中获得的不同组织的cDNA稀释10倍为模板,以获得的CaPrx基因设计特异引物Prx-q-F和Prx-q-R,以本研究获得的异育银鲫β-actin基因序列(NCBI登录号:MF463002)设计内参引物actin-q-F和actin-q-R(表 1)。以无菌水作为阴性对照。20 μL反应体系为:灭菌蒸馏水6 μL,SYBR Premix Ex Taq 10 μL,稀释的cDNA样本2 μL,8 μM的上、下游引物各1 μL。实验仪器为LineGene9600荧光定量PCR仪。反应程序为:95 ℃预变性20 s;95 ℃ 15 s,60 ℃ 2 s,共40个循环;熔解段95 ℃ 15 s、60 ℃ 60 s、95 ℃ 15 s。每次反应都通过从95 ℃降至60 ℃(4 ℃/s)绘出熔解曲线。反应结果用2-ΔΔCt方法分析(Livak & Schmittgen,2001)。用SPSS处理数据。
1.8 CyHV-2人工感染异育银鲫及CaPrx基因的mRNA表达实验前取患病异育银鲫的内脏组织按1: 6(w/v) 0.75%灭菌生理盐水制作组织匀浆,-80 ℃至室温反复冻融3次,5 000 r·min-1离心10 min,所得上清液过0.45 μm滤膜除菌后,收集滤液置于4 ℃备用(刘文枝等,2013)。每尾鱼腹腔注射0.3 mL病毒液,对照组每尾注射0.3 mL生理盐水,每组设3个平行处理。攻毒实验完成后12 h、24 h和48 h采样,取肝脏和脾脏组织,在DEPC水配制的PBS中漂洗后,经过液氮冷冻,于-80 ℃保存。提取RNA后,经过DNaseⅠ消化,电泳,用于cDNA的合成。具体参见1.3。得到的cDNA用实时荧光定量PCR技术检测抗氧化还原酶基因的表达,方法同1.7。
2 结果 2.1 异育银鲫感染CyHV-2的鉴定患病异育银鲫组织样本以CyHV-2-F、CyHV-2-R为引物,PCR结果呈阳性,获得了239 bp的特异性条带(图 1),测序结果经BlastX比对,确定其与CyHV-2 DNA解旋酶序列完全一致,表明病鱼感染了CyHV-2。
|
| 图 1 感染CyHV-2异育银鲫的PCR检测 Fig. 1 PCR assay of Carassius auratus gibelio infected with CyHV-2 M. DL2000 Marker,1~4.病鱼样品the diseased fish,5~8.健康鱼样品the healthy fish |
| |
以异育银鲫肝脏cDNA为模板,以Prx-F和Prx-R为引物进行PCR扩增,获得591 bp的PCR产物,克隆测序后,结果经BlastX分析确定为CaPrx基因目的片段。5'端和3'端经巢式PCR扩增得到特异性条带,条带分别长328 bp和700 bp(图 2)。对其进行克隆、测序,测序结果经分析拼接后,获得CaPrx基因的全长cDNA序列(GenBank登录号:MF346707)。

|
| 图 2 异育银鲫Prx基因RACE电泳图 Fig. 2 RACE of Prx gene from Carassius auratus gibelio A. 5'-RACE of Prx gene, B. 3'-RACE of Prx gene, M. DL2000 Marker, 1. 5'-Prx-inner, 2. 3'-Prx-inner |
| |
CaPrx基因cDNA序列全长1 035 bp,ORF长594 bp,位于76~669 bp处;5'非编码区长75 bp,3'非编码区长366 bp,共编码197个氨基酸;预测蛋白质的分子量为21.83 kD,理论等电点为5.93。3'非编码区中具有典型的加尾信号AATAAA(图 3)。通过NCBI Conserved Domain Search搜索分析,CaPrx蛋白氨基酸有一个保守结构域PRX_Typ2cys(8~179),属于Thioredoxin_like superfamily超蛋白家族。CaPrx基因翻译的蛋白无信号肽,在氨基酸序列的N端和C端各有1个保守的半胱氨酸(Cys)残基,位于保守的“FYPLDFTFVCPTEI”和“GEVCPA”序列中。

|
| 图 3 CaPrx基因cDNA全长以及推导的氨基酸序列 Fig. 3 Nucleotide (upper row) and deduced amino-acid (lower row) sequences of CaPrx full-length cDNA 起始密码子、终止密码子和加尾信号用下划线标出,保守序列用方框标出,保守Cys用阴影显示 The predicted start codon (ATG), stop codon and the polyadenylation signal sequence (AATAAA) are indicated with underline, conserved sequences are indicated with shadows, the conserved Cys in the sequence is indicated with shadows |
| |
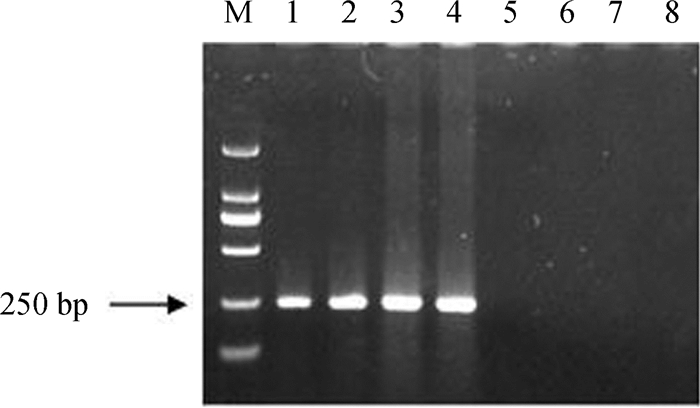
将CaPrx基因编码的氨基酸序列与NCBI数据库中的已知序列作BlastP分析,发现其与鲫Carassius auratus、青鱼、犀角金线鲃Sinocyclocheilus rhinocerous、朝鲜鳑鲏Rhodeus uyekii等的同源性很高,相似性为98%;与斑马鱼和斑点叉尾的相似性也分别达到了97%和94%,与人类、褐家鼠、绒啄木鸟Picoides pubescens、黑腹果蝇Drosophila melanogaster以及狮鬃水母Cyanea capillata的相似性分别为78%、81%、82%、75%和71%。BioEdit程序输出的ClustalW程序多序列比对结果显示,异育银鲫Prx蛋白和其他物种间具有高度保守性(图 4)。并且,随着物种的进化,异育银鲫Prx蛋白的结构域表现出与物种系统发育地位相吻合的同源性高低变化,即亲缘关系近的物种同源性相应较高。

|
| 图 4 Prx蛋白的氨基酸多序列对比 Fig. 4 Alignment of the deduced amino acid sequences of Prx 阴影表示序列中绝对保守或高度保守的氨基酸the shadows represent conserved amino acids in the proteins,Prx的保守序列用方框显示conserved sequences of Prx are indicated with boxes,本实验所得异育银鲫Prx用下划线标出Prx of Carassius auratus gibelio in this study is indicated with underline;登录号GenBank accession numbers:鲫Carassius auratus (AGO58900.1),印度明对虾Fenneropenaeus indicus (ACS91344.1),三疣梭子蟹Portunus trituberculatus (ACI46625.1),黑腹果蝇Drosophila melanogaster (NP_477510.1),绒啄木鸟Picoides pubescens (KFV68516.1),狮鬃水母Cyanea capillata (AHL38196.1),褐家鼠Rattus norvegicus (NP_476455.1),异育银鲫Carassius auratus gibelio (MF346707) |
| |
基于本实验得到的Prx蛋白氨基酸序列,采用MEGA 6.0以邻接法构建系统进化树(图 5)。异育银鲫Prx蛋白先与斑马鱼Prx2聚为一支,然后依次和青鱼以及斑点叉尾的Prx2聚类,之后分别与热带爪蟾Xenopus tropicalis、牛、人的Prx2聚为一支,最后与美国短吻鳄Alligator mississippiensis、地中海实蝇Ceratitis capitata和蜂巢小甲虫Aethina tumida聚类。因此,各物种基于Prx基因体现的分子进化关系与形态学分类地位相吻合。
|
| 图 5 基于Prx氨基酸序列构建的邻接系统进化树 Fig. 5 Neighbor-joining phylogenetic tree constructed from the amino acid sequences of Prx |
| |
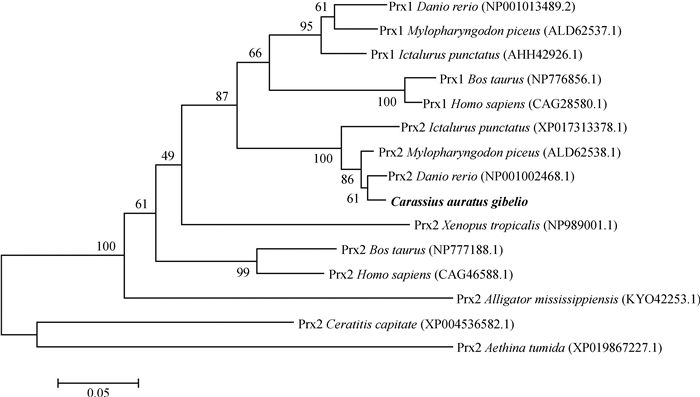
以β-actin基因为内参,以肝脏的基因表达量为标准,实时荧光定量PCR结果显示,CaPrx mRNA在肝脏、血细胞、脾脏、肌肉、心脏和中肾等组织中均有表达(图 6),是一种广泛表达的基因。其中,在血细胞中表达量最高,约为肝脏表达量的1.1倍,其次是肝脏。在肠道和肌肉中也有较高表达,分别为肝脏表达量的80%和65%。而在其他组织中的表达量明显低于肝脏和血细胞。其中,在鳃和头肾中的表达量最少,约为肝脏表达量的10%。此外,在脾脏、心脏、脑、中肾和表皮中也有表达。
|
| 图 6 CaPrx基因在各组织中的表达情况 Fig. 6 The expression of CaPrx mRNA in different tissues HK.头肾head kidney,G.鳃gill,E.表皮epidermis,MK.中肾middle kidney,B.脑brain,H.心脏heart,S.脾脏spleen,M.肌肉muscle,I.肠道intestines,He.血细胞hemocyte,L.肝脏liver |
| |
健康的异育银鲫在人工感染CyHV-2后,CaPrx mRNA在肝脏和脾脏中均出现了差异性表达。在感染12 h后,肝脏中CaPrx mRNA的表达量显著上升,约为健康鱼的3倍(P<0.05),24 h时急剧下降至略低于健康时的水平,48 h时降至更低点,与自然发病鱼体内的CaPrx mRNA表达量持平。与健康异育银鲫相比,自然患病的CaPrx mRNA的表达量几乎下降了80%。与CaPrx mRNA在肝脏中的表达情况不同,异育银鲫在人工感染病毒后,脾脏中CaPrx mRNA的表达量在12 h、24 h、48 h均显著下降。相较于病毒感染后2 d内脾脏中CaPrx mRNA的表达量,自然发病的异育银鲫脾脏中CaPrx mRNA的表达量有所上升(图 7)。
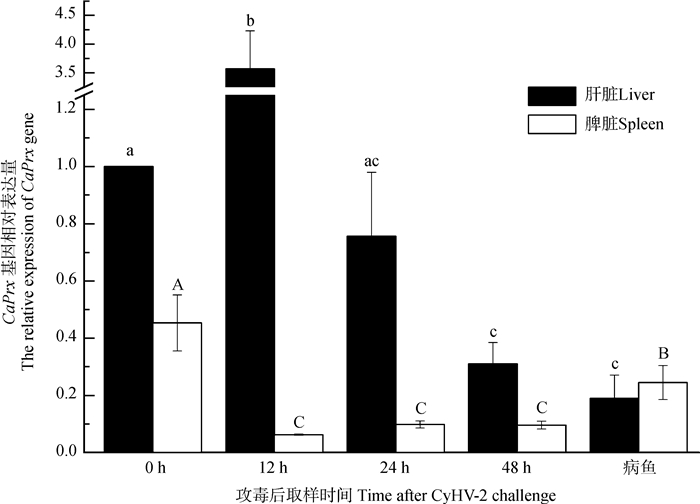
|
| 图 7 健康异育银鲫和感染CyHV-2病鱼的Prx基因的差异表达 Fig. 7 The significance expression of CaPrx mRNA between healthy and diseased Carassius auratus gibelio 柱状图上方不同字母表示差异有统计学意义(P<0.05,n=3),肝脏组用abc表示,脾脏组用ABC表示 Significant differences (P < 0.05, n=3) are shown in different letters above the histogram, with the liver group indicated by abc and the spleen group indicated by ABC |
| |
Prx属于抗氧化蛋白超家族,广泛存在于原核生物和真核生物中。该家族所有蛋白均在N端具有保守的Cys残基,有的成员在C端还具有保守的Cys。根据其保守Cys的数目,可以分为2个亚家族,即1-Cys Prx和2-Cys Prx家族(Hofman et al., 2002;Mu et al., 2009)。CaPrx氨基酸序列的N-端和C-端各有1个保守的Cys残基,这是2-Cys Prx家族中Prx所特有的结构,这2个Cys残基在Prx的催化功能中具有关键作用。以上特征说明CaPrx基因属于2-Cys Prx家族。2-Cys Prx家族基因已被证明参与过氧化氢在真核生物的细胞信号传导途径(Kang et al., 2005;Hall et al., 2009)。2-Cys Prx以同源二聚体形式存在,在发挥抗氧化作用时,一条肽链上的Cys51巯基与另一肽链上的Cys172巯基之间脱氢形成分子间二硫键,即Cys51SSCys172,以供氢而还原氧化(Woo et al., 2003;章波等,2004)。同时,CaPrx基因序列存在2个特征肽段:“FYPLDFTFVCPTEI”和“FYPLDFT”,是典型2-Cys Prx的2个Cys的催化中心。另外,基于Prx的氨基酸序列构建的系统进化树也反映出,本实验克隆的CaPrx基因属于Prx2 类,是2-Cys Prx家族的一员。因此,推测CaPrx基因可能参与异育银鲫体内的抗氧化作用。现已证实,除Prx4基因,Prx基因家族的其他5种均没有信号肽(章波等,2004)。CaPrx基因翻译的蛋白预测无信号肽,说明它并不是一种分泌蛋白,因为信号肽可引导新合成的蛋白向分泌通路转移,而CaPrx基因可能只是由游离的核糖体合成,主要定位于胞浆或核内(Von,1990)。这与斑马鱼Prx2基因的研究结果一致(孙晶,薛壮,2015)。
3.2 CaPrx的组织表达分析根据实时荧光定量PCR的结果,CaPrx基因在肝脏、血细胞、肠道、鳃和肌肉等组织中均有表达,说明CaPrx基因可能参与了异育银鲫体内的多项生理活动,这个结果与日本囊对虾Marsupenaeus japonicus的研究结果相近(Maningas et al., 2008)。鉴于CaPrx基因的结构,推测其参与了清除自由基ROS、免疫应答和细胞凋亡等,具有广泛的抗氧化作用。研究结果显示,CaPrx基因在血液、肝脏和肠道中的表达量较高。血液是运输氧的组织,也是新陈代谢的重要场所;同时,血细胞中的单核细胞、巨噬细胞、粒细胞等都参与了鱼体的免疫防御。因此,CaPrx基因在血液中的高表达一方面说明了鱼体的生理代谢需要有足够的Prx来清除ROS,另一方面揭示了CaPrx基因与异育银鲫的免疫功能有关。已有研究报道,动物肝中的线粒体是产生ROS的主要场所(Taylor et al., 1995),大量ROS能够导致日本沼虾Macrobrachium nipponense肝胰腺中Prx基因表达量显著升高(孙盛明等,2014)。异育银鲫肝脏Prx基因的高表达在一定程度上也说明了肝脏是异育银鲫重要的抗氧化器官。此外,CaPrx基因在肠道中的表达也相对较高。由于肠道是能量与代谢十分旺盛的系统(陈群,2007),在营养物质的消化和吸收过程中起重要作用,同时,肠道时刻面临由食物氧化、重金属、细菌代谢等产生的高含量ROS而带来的危害,肠黏膜产生Prx有利于对抗ROS对机体的伤害(Dong et al., 2007)。组织表达显示,CaPrx基因在异育银鲫心脏中的表达量并不高。Schröder等(2008)认为Prx基因在心脏中的表达量较高,是心脏面对氧化应激的重要因子。同时,Kumar等(2009)发现,在面对外界刺激如缺血和再灌注时,存在于线粒体中的Prx3会快速氧化成二硫化二聚体,含量发生显著变化,而存在于胞质中的Prx1和Prx2则没有变化,因此,心脏中的Prx3被认为是维持心脏功能的主要贡献者。
3.3 CaPrx与免疫应答CaPrx基因在肝脏中的高表达,一定程度上说明肝脏是异育银鲫重要的抗氧化器官。脾脏是鱼类红细胞和各种粒细胞产生、贮存和成熟的主要场所,不仅具有造血功能,还与鱼体的免疫应答有密切联系(王俊相等,2010)。因此,本实验选择肝脏和脾脏来研究Prx在病毒感染后表达量发生的变化。感染CyHV-2的异育银鲫机体会产生氧化应激反应,免疫系统产生了强大的应激(袁军法等,2013;张晗,2014)。本研究表明,自然状态下,异育银鲫在感染CyHV-2患病后,Prx基因在肝脏和脾脏中的表达量均显著下降,表明Prx基因对病毒感染具有较强的应答水平,鱼体本身的抗氧化系统因病毒入侵遭到了一定程度的破坏。在感染CyHV-2病毒后,Prx基因在肝脏和脾脏中的反应存在较大差异。异育银鲫在人工感染CyHV-2后,Prx基因在肝脏中的表达量显著上升,随后开始下降,这与鱼感染鳗弧菌后,Prx2基因在体内的表达模式相似(任丽平,2014)。动物肝脏中的线粒体是产生ROS的主要场所(Taylor et al., 1995),因此,推测异育银鲫在感染CyHV-2的初期,肝脏中Prx基因的表达量上升,用以清除免疫反应产生的过量ROS;但随着感染时间的延长,由于呼吸爆发产生的大量ROS在细胞内的积累、因鱼体免疫反应消耗了大量的能量,以及与产能的呼吸链相耦联的ROS的产生途径产生的大量ROS(Nordberg & Arnér,2001)都对鱼体造成了巨大的伤害,导致鱼体的免疫系统失去功能,从而使Prx基因在肝脏的表达量显著降低。异育银鲫脾脏中Prx基因的表达量在感染CyHV-2后显著下降,与鱼感染鳗弧菌后Prx2基因在脾脏的表达模式相似(任丽平,2014),说明脾脏中的抗氧化系统也遭到了破坏。林秀秀等(2016)对病鱼的超微病理学研究发现,异育银鲫感染CyHV-2后,脾脏中的病毒粒子数量远多于肝脏,由此可见,病毒入侵后,脾脏细胞溶解、免疫和造血系统严重被破坏,从而破坏了脾脏的免疫应答,导致CaPrx mRNA的表达量显著下降。因此,研究结果提示,CaPrx基因在异育银鲫应答病毒入侵过程中具有一定的作用。
| 陈静, 李婧慧, 刘训猛, 等. 2014. 江苏鲫鱼养殖产业发展现状与产业亟待解决问题[J]. 科学养鱼, 12: 1–2. |
| 陈群. 2007. 氧化应激对动物消化道结构与功能影响的研究[D]. 江苏无锡: 江南大学: 83-87. |
| 林秀秀, 叶元土, 吴萍, 等. 2016. 鲤疱疹Ⅱ型病毒(CyHV-2)感染对异育银鲫(Carassius auratus gibelio)组织器官的损伤作用[J]. 基因组学与应用生物学, 35(3): 587–594. |
| 刘文枝, 曾令兵, 张辉, 等. 2013. 异育银鲫感染鲤疱疹病毒Ⅱ型(CyHV-2)后血液生理生化指标变化的研究[J]. 上海海洋大学学报, 22(6): 928–935. |
| 潘庭双, 胡贤江, 蒋业林. 2001. 异育银鲫的人工繁殖及苗种培育技术[J]. 渔业现代化, 4: 10–11. |
| 任丽平. 2014. 鱼过氧化物还原酶peroxiredoxin基因的分子克隆与表达分析[D]. 浙江舟山: 浙江海洋学院: 47-49. |
| 孙晶, 薛壮. 2015. 斑马鱼过氧化物还原酶的生物信息学分析[J]. 生物技术, 25(1): 36–41. |
| 孙盛明, 戈贤平, 傅洪拓, 等. 2014. 日本沼虾过氧化物还原酶基因的克隆及其表达分析[J]. 中国水产科学, 21(3): 474–483. |
| 王俊相, 李玉萍, 孔令富, 等. 2010. 鱼类免疫系统的研究进展[J]. 四川畜牧兽医, 7: 29–31. |
| 徐文斌, 孙晓波. 1993. 异育银鲫的生物学特性及其在我省的增养殖前景[J]. 黑龙江水产, 2: 38–39. |
| 袁军法, 李莉娟, 黄建. 2013. Ⅱ型鲤疱疹病毒感染异育银鲫对鱼体血液中氧化应激指标的影响[C]. 海口: 中国水产学会鱼病专业委员会2013年学术研讨会论文摘要汇编. |
| 张晗. 2014. 苏北:异育银鲫鳃出血病爆发[J]. 海洋与渔业, 8(8): 28–29. |
| 章波, 向渝梅, 白云. 2004. 抗氧化蛋白Peroxiredoxin家族研究进展[J]. 生理科学进展, 35(4): 352–355. |
| Dierick JF, Wenders F, Chainiaux F, et al. 2003. Retrovirally mediated overexpression of peroxiredoxin Ⅵ increases the survival of WI-38 human diploid fibroblasts exposed to cytotoxic doses of tert-butylhydroperoxide and UVB[J]. Biogerontology, 4: 125–131. DOI:10.1023/A:1024154024602 |
| Dong WR, Xiang LX, Shao JZ. 2007. Cloning and characterisation of two natural killer enhancing factor genes (NKEF-A and NKEF-B) in pufferfish, Tetraodon nigroviridis[J]. Fish & Shellfish Immunology, 22: 1–15. |
| Fatma N, Singh DP, Shinohara T, et al. 2001. Transcriptional regulation of the antioxidant protein 2 gene, a thiol-specific antioxidant, by lens epithelium-derived growth factor to protect cells from oxidative stress[J]. Journal of Biological Chemistry, 276(52): 48899–48907. DOI:10.1074/jbc.M100733200 |
| Fujii J, Ikeda Y. 2002. Advances in our understanding of peroxiredoxin, amultifunctional, mammalian redox protein[J]. Redox Report Communications in Free Radical Research, 7(3): 123–130. DOI:10.1179/135100002125000352 |
| Hall A, Karplus A, Pool LB. 2009. Typical 2-Cys peroxiredoxins:structure, mechanisms and functions[J]. The FEBS Journal, 276(9): 2469–2477. DOI:10.1111/ejb.2009.276.issue-9 |
| Hofman B, Hecht HJ, Flohé L. 2002. Peroxiredoxins[J]. Biological Chemistry, 383: 347–364. |
| Kang SW, Rhee SG, Chang TS, et al. 2005. 2-Cys peroxiredoxin function in intracellular signal transduction:therapeutic implications[J]. Trends in Molecular Medicine, 11(12): 571–578. DOI:10.1016/j.molmed.2005.10.006 |
| Kumar V, Kitaeff N, Hampton MB, et al. 2009. Reversible oxidation of mitochondrial peroxiredoxin 3 in mouse heart subjected to ischemia and reperfusion[J]. FEBS Letters, 583(6): 997–1000. DOI:10.1016/j.febslet.2009.02.018 |
| Lee TH, Kim SU, Yu SL, et al. 2003. Peroxiredoxin Ⅱ is essential for sustaining life span of erythrocytes in mice[J]. Blood, 101: 5033–5038. DOI:10.1182/blood-2002-08-2548 |
| Livak KJ, Schmittgen TD. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2 (delta delta C(T)) method[J]. Methods, 25: 402–408. DOI:10.1006/meth.2001.1262 |
| Maningas MBB, Koyama T, Kondo H, et al. 2008. A peroxiredoxin from kuruma shrimp, Marsupenaeus japonicus, inhibited by peptidoglycan[J]. Developmental & Comparative Immunology, 32: 198–203. |
| Mu CK, Zhao JM, Wang LL, et al. 2009. Molecular cloning and characterization of peroxiredoxin 6 from Chinese mitten crab Eriocheir sinensis[J]. Fish & Shellfish Immunology, 26: 821–827. |
| Nonn L, Berggren M, Powis G. 2003. Increased expression of mitochondrial peroxiredoxin-3 (thioredoxin peroxidase-2) protects cancer cells against hypoxia and drug-induced hydrogen peroxide-dependent apoptosis[J]. Molecular Cancer Research, 1(9): 682–689. |
| Nordberg J, Arnér ES. 2001. Reactive oxygen species, antioxidants, and the mammalian thioredoxin system[J]. Free Radical Biology & Medicine, 31(11): 1287–1312. |
| Ren L, Xu T, Wang R, et al. 2013. Miiuy croaker (Miichthys miiuy) Peroxiredoxin 2:molecular characterization, genomic structure and immune response against bacterial infection[J]. Fish & Shellfish Immunology, 34(2): 556–563. |
| Schröder E, Brennan JP, Eaton P, et al. 2008. Cardiac peroxiredoxins undergo complex modifications during cardiac oxidant stress[J]. American Journal of Physiology-Heart and Circulatory Physiology, 295: H425–H433. DOI:10.1152/ajpheart.00017.2008 |
| Singh AK, Shichi H. 1998. A novel glutathione peroxidase in bovine eye. Sequence analysis, mRNA level, and translation[J]. Journal of Biological Chemistry, 273(40): 26171–26178. DOI:10.1074/jbc.273.40.26171 |
| Taylor DE, Ghio AJ, Piantadosi CA. 1995. Reactive oxygen species produced by liver mitochondria of rats in sepsis[J]. Archives of Biochemistry & Biophysics, 316(1): 70–76. |
| Von HG. 1990. The signal peptide[J]. Journal of Membrane Biology, 115(3): 195–201. DOI:10.1007/BF01868635 |
| Woo HA, Chae HZ, Hwang SC, et al. 2003. Reversing the inactivation of peroxiredoxins caused by cysteine sulfinic acid formation[J]. Science, 300(5619): 653–656. DOI:10.1126/science.1080273 |
| Wu C, Cao J, Cao F, et al. 2016. Molecular cloning, characterization and mRNA expression of six peroxiredoxins from black carp Mylopharyngodon piceus in response to lipopolysaccharide challenge or dietary carbohydrate[J]. Fish & Shellfish Immunology, 50: 210–222. |
| Yeh HY, Klesius PH. 2007. cDNA cloning, characterization, and expression analysis of channel catfish (Ictalurus punctatus Rafinesque, 1818) peroxiredoxin 6 gene[J]. Fish Physiology & Biochemistry, 33(3): 233–239. |
 2018, Vol. 37
2018, Vol. 37