扩展功能
文章信息
- 吉晟男, 肖能文, 邓怀庆, 胡德夫
- JI Shengnan, XIAO Nengwen, DENG Huaiqing, HU Defu
- 圈养普氏野马对夏季高温生理应答的非损伤性研究
- Non-invasive Study on Physiological Responses of Equus przewalskii in High Temperature Period of Summer
- 四川动物, 2018, 37(1): 8-14
- Sichuan Journal of Zoology, 2018, 37(1): 8-14
- 10.11984/j.issn.1000-7083.20170211
-
文章历史
- 收稿日期: 2017-07-01
- 接受日期: 2017-11-29
2. 贵州师范大学生命科学学院, 贵阳 550001;
3. 北京林业大学自然保护区学院, 北京 100083
2. School of Life Sciences, Guizhou Normal University, Guiyang 550001, China;
3. School of Nature Conservation, Beijing Forestry University, Beijing 100083, China
高温通常被认为是一种不利的胁迫因子,会影响动物的生存活动(Farooq et al., 2010)。高温应激会影响反刍动物的生长和繁殖(La Salles et al., 2017)。温度变化在动物的耐受范围内时,动物可通过自身生理或行为的改变进行体温调节,以适应不良的生活环境(Bernabucci et al., 2010);当温度变化超过了动物的耐受范围,动物生理或免疫系统调节失常,严重的或死亡(Serbester et al., 2005;Bohmanova,2006)。已有的高温应激研究主要在经济动物中,如绵羊Ovis aries、奶牛Bos taurus等(何世山,金小军,2003;Renaudeau et al., 2008;Serbester et al., 2012);对野生动物的研究,仅见夏季高温条件下生理状况的简单描述(Huber et al., 2003;Gesquiere et al., 2008)。
激素调节在动物应对高温时起着非常重要的作用,尤其是糖皮质激素和三碘甲腺原氨酸(T3) (Marai et al., 2007;Renaudeau et al., 2008)。短期应激对动物有利,但长期的激素应激可能会损害动物的健康(Sapolsky,1998)。目前可以通过测定糖皮质激素和T3各自的代谢产物在血液、唾液和身体排泄物(如粪便)中的含量来判断动物的应激状况(Renaudeau et al., 2008)。在血液和唾液的采集过程中,对动物重复的捕捉和保定不可避免(Millspaugh & Washburn,2004), 对大型哺乳动物和濒危物种而言难度较大。粪便相对容易采集且不会过度干预动物的行为,研究者可在远处观察目标动物,待其排便离开后再采集。这种非损伤性取样方法在野生动物研究中已得到了广泛应用(Creel et al., 2002;Keech et al., 2010;Deng et al., 2014)。
普氏野马Equus prezwalskii是世界上仅存的野生马种类,其野生种群在20世纪中期于中国和蒙古野外灭绝(Mohr,1971), 但其圈养种群使得这一物种得到保存(Ryder,1994)。在国际保护组织的努力下,普氏野马圈养种群获得了充足的发展,并尝试放归实验以恢复野生种群(Ryder & Wedermeyer,1982)。中国于1985年在新疆维吾尔自治区筹建了第一个普氏野马繁育中心,分别在德国和英国进行引种培育,由于该地历史上曾经有野生种群分布,环境条件适宜,新疆普氏野马繁育中心在社会和政府的共同努力下,圈养种群繁育状况良好,种群数量不断扩大,并成功放归。新疆普氏野马繁育中心位于中国西北部,冬寒夏热,四季分明,最热月(7月)气温可达50 ℃(陈金良,2008)。普氏野马不可避免受到夏季高温的影响,在此极端条件下,普氏野马会产生怎样的生理应答未见报道。高温对圈养普氏野马生理和行为产生的应激反应可能会影响其管护工作。鉴于此,本研究利用非损伤性取样法对普氏野马夏季高温刺激的生理应答进行了监测,以期为科学的保护管理提供基础资料。
1 研究方法 1.1 研究对象选择新疆普氏野马繁育中心(89°14′~89°36′E,45°49′~46°04′N)5个家族群中的15匹成年个体,分为雄马、雌马和带驹雌马3组,每组5匹(表 1)。研究时间为2011年7月4日—8月3日。采用隔日取样法收集目标个体的粪便样品,如果遇到极端高温,则每天持续采样,待高温天气结束后3~4 d,恢复隔日取样法。为排除激素代谢产物水平的时间差异,所有待测样品均于同一时间段(08: 00—10: 00)采集。在整个取样期间,不改变普氏野马的饲喂方式。
| 组别Type | 个体编号ID | 年龄Age (范围Range)/岁 |
| 雄马 | Z132、Z226、Z3311、Z3877、Z188 | 8.8±0.9(6~12) |
| 雌马 | Z245、Z257、Z264、Z265、Z266 | 4.2±0.2(4~5) |
| 带驹雌马 | Z162、Z167、Z97、Z125、Z57 | 11.2±1.0(9~15) |
在饲养场中1.5 m处悬挂干湿温度计,从08: 00开始,每隔1 h记录一次温湿度。利用每天最高温度和最低相对湿度计算温湿度指数(temperature-humidity index,THI):
THI=db-[(0.31-0.31RH)(db-14.4)]
其中,db为温度(℃),RH为相对湿度(%)。当THI>28.9时,动物为高温应激状态(LPHSI,1990;Marai et al., 2001)。
1.3 样品采集及检测跟踪观察目标个体,待其排便离开后,用一次性塑料手套收集粪样上层新鲜部分,混合后用塑料自封袋保存,在袋上标记采集时间及个体,带回基地后放于-20 ℃的冰箱内保存待测(Cavigelli,1999;Curtis et al., 2000)。
样品激素测定参照Möstl等(1999)和Galama等(2004)的方法并略作改进。首先解冻样品,然后取湿粪10 g进行冷冻干燥,取0.5 g干燥样品粉碎后放于10 mL 80%甲醇中萃取,离心后取上清液,同时对剩余沉淀物进行二次萃取,离心后取上清液。合并2次收集的上清液进行水浴蒸干,用1 mL 80%甲醇溶解剩余固体并于-20 ℃保存。
采用放射性免疫法测定激素代谢产物水平。皮质醇及T3试剂盒(北京北方生物所)主要技术参数见表 2。N-682型放射性免疫γ光子计数器(上海核福光电仪器有限公司)测定激素代谢产物水平,测定结果换算成单位干粪的激素水平(ng·g-1)。普氏野马粪便激素水平平均具有24 h的延迟(曹婷婷,2008), 数据分析时,当日粪便激素水平对应为前日采集日期。
| 试剂盒种类 | 测定范围/ (ng·mL-1) | 灵敏度/ (ng·mL-1) | 精密度/% | 平均回收率/% | |
| 批内 | 批间 | ||||
| 皮质醇试剂盒 | 10~500 | 2.0 | < 10 | < 15 | 98 |
| T3试剂盒 | 0.5~0.8 | 0.2 | < 10 | < 15 | 98 |
运用SPSS 23.0(SPSS Inc., Chicago,USA)对数据进行统计分析。THI作为分类变量(THI>28.9为高温应激;THI≤28.9为非高温应激),整合不同类群普氏野马的糖皮质激素代谢产物(fecal glucocorticoid metabolites,FGM)水平与T3代谢产物水平,同一类群当日粪便激素取均值对应前一天的THI。对比同一类群高温与非高温应激状态下的激素差异,以及不同类群间激素水平差异。使用One Sample Kolmogorov-Smirnov Test对数据进行正态分布检验,多因变量一般线性模型(Multivariate tests of general linear model)做多因素方差分析,组别和应激程度作为固定因子,组间多重比较采用LSD,对比前检验数据方差齐性。数据结果以Mean±SE表示,P < 0.05表示差异有统计学意义。
2 结果 2.1 夏季普氏野马总体激素水平繁育中心夏季炎热干旱,夏季每日最高温度和最低相对湿度几乎同时出现,一般出现在每日的13: 00—18: 00,持续时间相对较长(图 1)。在整个夏季高温期,普氏野马都维持在一个较高的激素水平,FGM水平为161.30~237.19 ng·g-1,T3代谢产物水平为11.64~17.65 ng·g-1。
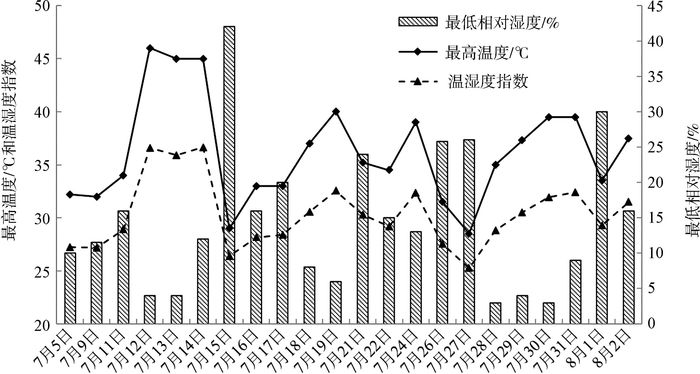
|
| 图 1 夏季高温期日最高温度、最低相对湿度及温湿度指数 Fig. 1 Daily maximum temperature, minimal relative humidity and temperature-humidity index during high temperature periods in summer |
| |
圈养普氏野马在夏季高温期不同类群的FGM水平具有明显差异(图 2), 雄马组水平最高,为237.19 ng·g-1± 10.24 ng·g-1;雌马组水平居中,为208.34 ng·g-1± 6.39 ng·g-1;带驹雌马组水平最低,仅为161.30 ng·g-1± 5.01 ng·g-1。对3个不同类群的FGM水平进行多因素方差分析,结果表明,3组间的差异均有统计学意义(F2,60=22.885,P < 0.001), 具体为:雄马vs.雌马(MD=28.855,SE=11.163,P=0.012)、雄马vs.带驹雌马(MD=75.899,SE=11.163,P < 0.001)、雌马vs.带驹雌马(MD=47.045,SE=11.163,P < 0.001)。此外,以THI=28.9为界,将普氏野马各组组内高温应激与非高温应激的FGM水平进行对比,多因素方差分析结果显示,3组组内不同应激程度的FGM水平差异无统计学意义(F1,60=0.233,P=0.631), 且组别与应激程度不存在交互作用(F2,60=0.024,P=0.976)。
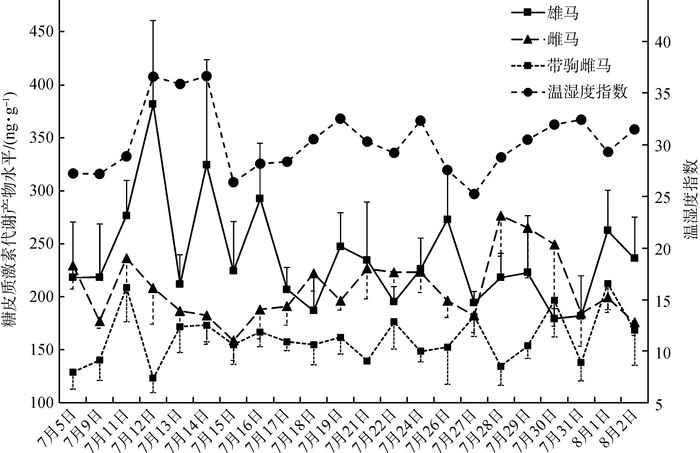
|
| 图 2 圈养普氏野马不同类群夏季高温期粪便糖皮质激素代谢产物水平 Fig. 2 Fecal glucocorticoid metabolites of Equus przewalskii in different groups during high temperature periods in summer |
| |
圈养普氏野马不同类群在夏季高温期间T3代谢产物水平具有明显差异(图 3), 雌马组水平最高,为17.65 ng·g-1±0.59 ng·g-1,雄马组居中,为14.76 ng·g-1±0.43 ng·g-1,带驹雌马组最低,仅为11.64 ng·g-1±0.33 ng·g-1。对3个不同类群的T3代谢产物水平进行多因素方差分析,结果表明,3组间的差异有统计学意义(F2,60=37.780,P < 0.001), 具体为:雄马vs.雌马(MD=-2.891,SE= 0.662,P < 0.001)、雄马vs.带驹雌马(MD=3.120,SE=0.662,P < 0.001)、雌马vs.带驹雌马(MD=6.011,SE=0.662,P < 0.001)。此外,以THI=28.9为界,将普氏野马各组组内高温应激与非高温应激的T3代谢产物水平进行对比,多因素方差分析结果显示,3组组内不同应激程度的T3代谢产物水平差异无统计学意义(F1,60=0.333,P=0.566), 且组别与应激程度不存在交互作用(F2,60=2.260,P=0.113)。
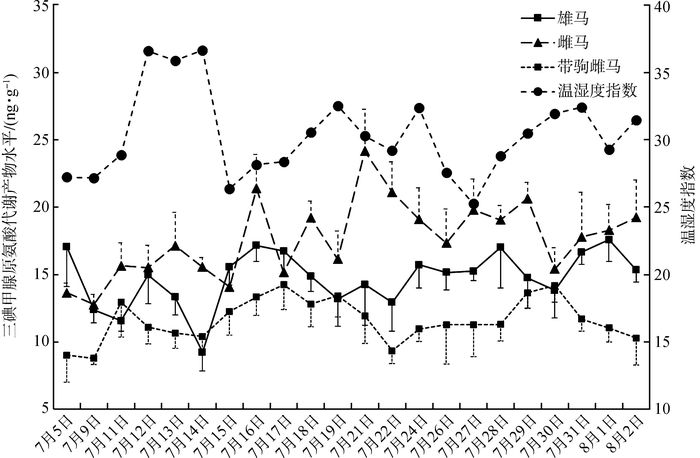
|
| 图 3 圈养普氏野马不同类群夏季高温期三碘甲腺原氨酸代谢产物水平 Fig. 3 Fecal thyroid triiodothyronine metabolites of Equus przewalskii in different groups during high temperature periods in summer |
| |
极端温度会影响动物生理状况,动物亦可通过自身生理调节以适应不良生活环境(Bernabucci et al., 2010)。新疆属于中国西北干旱地区,夏季炎热,7月为当地夏季高温期(陈金良,2008), 在此期间,普氏野马肯定会受到高温胁迫。本研究结果发现,普氏野马在整个高温期一直维持在较高的FGM和T3水平,远高于冬季圈养雄马的FGM水平(34.00 ng·g-1±5.14 ng·g-1)(曹婷婷等,2009)。但是,普氏野马在夏季高温期不同温度下,生理应激程度的激素水平差异并不显著,因此推测,新疆普氏野马在应对夏季高温胁迫时,其生理代谢水平会升高,并维持较高水平,但在其正常调节范围内,没有超过其耐受的阈值。普氏野马生理代谢水平的升高可能是其抵御不利环境的必要保证(于小杰,2011;吉晟男,2013)。此外,LPHSI(1990)仅对畜禽类的高温应激阈值给出统一值,即当THI>28.9时,畜禽类动物处于严重高温应激状态,并未针对动物个体大小进一步细分。Marai等(2001)将THI=28.9作为高温阈值,应用于雌性穴兔Oryctolagus cuniculus的研究中,然而,将THI=28.9作为圈养普氏野马高温与非高温的分界值还有待验证。
动物身体的核心温度超过正常范围时,会导致身体总热负荷(内环境)超过散热能力,动物会通过生理或行为方式降低这种反应(Bernabucci et al., 2010)。已有研究发现,圈养普氏野马在其他季节的休息时间和饮水频次显著低于夏季,且休息和饮水行为发生高峰期与夏季高温时间一致(陈金良,2008;张峰,2010)。吉晟男等(2013)的研究表明,夏季高温期普氏野马偏好选择迎风背阴处站立休息,且饮水和排尿次数增多;同时圈舍面积较小、缺乏足够的庇荫场所,为争夺较好的庇荫环境,普氏野马的攻击行为会增加。
本文研究结果显示,圈养普氏野马的FGM和T3代谢产物在夏季高温期一直维持较高水平,不同类群间差异有统计学意义,总体上成年雄性及雌性的应激水平高于带驹雌马。这一结果也许不仅与性别或带驹有关,3组野马间的年龄差异也可能影响结果,需要后续验证。此外,在干旱地区,高温往往与干旱同时共存,水资源的缺乏对野生动物生存影响更大(Krausman & Etchberger,1995;Marai et al., 2007)。陈金良(2008)研究发现,在新疆普氏野马繁育中心的圈舍内缺乏大面积的地表积水,不利于普氏野马伏水降温。Marai等(2010)研究表明,野生水牛Bubalus arnee arnee只有在树荫下或水中,并有风的情况下,体温才能保持正常。鉴于此,为减少群内个体的争斗,增加其个体生存的适宜度,建议夏季高温期实行分组、分圈管护,优化圈舍环境,增大圈舍内积水面积,具体措施为:(1)分组、分圈管护,将带驹雌马和幼驹分离出家族群,合圈饲养。(2)搭建简易遮阳棚,挖掘小面积水池,增设饮水槽,增加圈舍内积水面积和供水次数;降低水源因子的限制。(3)圈舍间设置障碍物,避免普氏野马之间相互干扰和攻击。
采用非损伤性取样法对普氏野马FGM和T3代谢产物水平进行监测,可定量评估圈养普氏野马夏季高温期的生理状况,及时调整圈养种群的管护模式,降低高温对普氏野马的生理及行为影响,为该物种的管护提供数据资料。
| 曹婷婷. 2008. 圈养和放归普氏野马应激水平的非损伤性研究[D]. 北京: 北京林业大学. http://cdmd.cnki.com.cn/Article/CDMD-10022-2008084767.htm |
| 曹婷婷, 胡德夫, 于小杰, 等. 2009. 冬季圈养和放归普氏野马成年雄性应激状态研究[J]. 干旱区研究, 26(2): 234–237. |
| 陈金良. 2008. 放归普氏野马的食物、水源、空间利用及生存对策的研究[D]. 北京: 北京林业大学. |
| 何世山, 金小军. 2003. 高温对肉鸡血液生化指标的影响[J]. 浙江大学学报(农业与生命科学版), 29(3): 311–314. |
| 吉晟男. 2013. 圈养普氏野马(Equus ferus przewalskii)行为与生理生态及适应性的非损伤性研究[D]. 北京: 北京林业大学. |
| 吉晟男, 杨亮亮, 葛兴芳, 等. 2013. 圈养普氏野马夏季高温期昼间活动时间分配研究[J]. 四川动物, 32(5): 676–683. |
| 于小杰. 2011. 大熊猫和普氏野马类固醇激素及免疫球蛋白水平的非损伤研究[D]. 北京: 北京林业大学. http://cdmd.cnki.com.cn/article/cdmd-10022-1011132728.htm |
| 张峰. 2010. 普氏野马行为节律及其影响因子研究[D]. 北京: 北京林业大学. http://cdmd.cnki.com.cn/Article/CDMD-10022-2010129337.htm |
| Bernabucci U, Lacetera N, Baumgard LH, et al. 2010. Metabolic and hormonal acclimation to heat stress in domesticated ruminants[J]. Animal, 4(7): 1167–1183. DOI:10.1017/S175173111000090X |
| Bohmanova J. 2006. Studies on genetics of heat stress in US Holsteins[D]. Athens, Georgia: The University of Georgia. |
| Cavigelli S. 1999. Behavioural patterns associated with faecal cortisol levels in free-ranging female ring-tailed lemurs (Lemur catta)[J]. Animal Behaviour, 57(4): 935–944. DOI:10.1006/anbe.1998.1054 |
| Creel S, Fox JE, Hardy A, et al. 2002. Snow mobile activity and glucocorticoid stress responses in wolves and elk[J]. Conservation Biology, 16(3): 809–814. DOI:10.1046/j.1523-1739.2002.00554.x |
| Curtis DJ, Zaramody A, Green DI, et al. 2000. Non-invasive monitoring of reproductive status in wild mongoose lemurs (Eulemur mongoz)[J]. Reproduction, Fertility and Development, 12(2): 21–29. DOI:10.1071/RD99091 |
| Deng HQ, Jin XL, Hu DF, et al. 2014. Fecal cortisol content of wild giant pandas (Ailuropoda melanoleuca) to monitor human disturbance level in natural habitats[J]. Animal Biology, 64(1): 75–86. DOI:10.1163/15707563-00002432 |
| Farooq U, Samad HA, Shehzad F, et al. 2010. Physiological responses of cattle to heat stress[J]. World Applied Sciences Journal, 8(special issue): 38–43. |
| Galama WT, Graham LH, Savage A. 2004. Comparison of fecal storage methods for steroid analysis in black rhinoceroses (Diceros bicornis)[J]. Zoo Biology, 23(4): 291–300. DOI:10.1002/(ISSN)1098-2361 |
| Gesquiere LR, Khan M, Shek L, et al. 2008. Coping with a challenging environment:effects of seasonal variability and reproductive status on glucocorticoid concentrations of female baboons (Papio cynocephalus)[J]. Hormones and Behavior, 54(3): 410–416. DOI:10.1016/j.yhbeh.2008.04.007 |
| Huber S, Palme R, Arnold W. 2003. Effects of season, sex, and sample collection on concentrations of fecal cortisol metabolites in red deer (Cervus elaphus)[J]. General and Comparative Endocrinology, 130(1): 48–54. DOI:10.1016/S0016-6480(02)00535-X |
| Keech AL, Rosen DA, Booth RK, et al. 2010. Fecal triiodothyronine and thyroxine concentrations change in response to thyroid stimulation in Steller sea lions (Eumetopias jubatus)[J]. General and Comparative Endocrinology, 166(1): 180–185. DOI:10.1016/j.ygcen.2009.11.014 |
| Krausman PR, Etchberger RC. 1995. Response of desert ungulates to a water project in Arizona[J]. The Journal of Wildlife Management, 59: 292–300. DOI:10.2307/3808942 |
| La Salles AYF, Batista LF, Souza BB, et al. 2017. Growth and reproduction hormones of ruminants subjected to heat stress[J]. Journal of Animal Behaviour & Biometeorology, 5(1): 7–12. |
| Livestock and Poultry Heat Stress Indices (LPHSI). 1990. Agricultural engineering technology guide[S]. Clemson (SC): Clemson University. |
| Marai IFM, Ayyat MS, Abd El-Monem UM. 2001. Growth performance and reproductive traits at first parity of New Zealand white female rabbits as affected by heat stress and its alleviation under Egyptian conditions[J]. Tropical Animal Health and Production, 33(6): 451–462. DOI:10.1023/A:1012772311177 |
| Marai IFM, El-Darawany AA, Fadiel A, et al. 2007. Physiological traits as affected by heat stress in sheep-a review[J]. Small Ruminant Research, 71(1): 1–12. |
| Marai IFM, Haeeb AAM. 2010. Buffalo's biological functions as affected by heat stress-a review[J]. Livestock Science, 127: 89–109. DOI:10.1016/j.livsci.2009.08.001 |
| Millspaugh JJ, Washburn BE. 2004. Use of fecal glucocorticoid metabolite measures in conservation biology research:considerations for application and interpretation[J]. General and Comparative Endocrinology, 138(3): 189–199. DOI:10.1016/j.ygcen.2004.07.002 |
| Mohr E. 1971. The Asiatic wild horse[M]. London: JA Allen & Co. Ltd. |
| Möstl E, Messmann S, Bagu E, et al. 1999. Measurement of glucocorticoid metabolite concentrations in faeces of domestic livestock[J]. Transboundary and Emerging Diseases, 46(10): 621–631. |
| Renaudeau D, Kerdoncuff M, Anais C, et al. 2008. Effect of temperature level on thermal acclimation in large white growing pigs[J]. Animal, 2(11): 1619–1626. DOI:10.1017/S1751731108002814 |
| Ryder OA, Wedermeyer E. 1982. A cooperative breeding programme for the Mongolian wild horse Equus przewalskii in the United States[J]. Biological Conservation, 22(4): 259–271. DOI:10.1016/0006-3207(82)90021-0 |
| Ryder OA. 1994. Genetic studies of Przewalski's horses and their impact on conservation[M]//Boyd L, Houpt KA. Przewalski's horse: the history and biology of an endangered species. New York: Albany: 75-92. |
| Sapolsky RM. 1998. Why zebras don't get ulcers:an updated guide to stress, stress-related diseases, and coping[M]. New York: WH Freeman and Company. |
| Serbester U, Çınar M, Ceyhan A, et al. 2012. Effect of essential oil combination on performance, milk composition, blood parameters and pregnancy rate in early lactating dairy cows during heat exposure[J]. The Journal of Animal and Plant Sciences, 22(3): 556–563. |
| Serbester U, Gorgiilii M, Kutlu HR, et al. 2005. The effects of sprinkler+fan, fish meal or dietary fat on milk yield and milk composition of dairy cows in mid lactation during summer[J]. Journal of Animal and Feed Sciences, 14: 639–653. DOI:10.22358/jafs/67143/2005 |
 2018, Vol. 37
2018, Vol. 37




