扩展功能
文章信息
- 樊宗山, 敬广伟, 赵海鹏
- FAN Zongshan, JING Guangwei, ZHAO Haipeng
- 游泳运动对APP/PS1转基因小鼠学习记忆能力的影响
- Effects of Swimming Exercise on Learning and Memory Ability of APP/PS1 Transgenic Mice
- 四川动物, 2017, 36(6): 663-668
- Sichuan Journal of Zoology, 2017, 36(6): 663-668
- 10.11984/j.issn.1000-7083.20170243
-
文章历史
- 收稿日期: 2017-08-11
- 接受日期: 2017-11-10
2. 河南师范大学体育学院, 河南新乡 453002;
3. 河南鸡公山国家级自然保护区管理局, 河南信阳 464000;
4. 河南大学生命科学学院, 河南开封 475001
2. Physical Education Institute of Henan Normal University, Xinxiang, Henan Province 453002, China;
3. Henan Jigong Mountain National Nature Reserve Management Bureau, Xinyang, Henan Province 464000, China;
4. School of Life Science, Henan University, Kaifeng, Henan Province 475001, China
阿尔茨海默病(Alzheimer's disease,AD)是一种中枢神经退行性疾病,典型的神经病理变化是大脑内存在β样淀粉(amyloid-β,Aβ)沉淀形成的老年斑以及神经元纤维缠结(neurofibrillary tangles),最终导致神经元丢失和神经功能障碍。神经元由于其特殊的功能决定其只能依靠氧化磷酸化提供能量,而线粒体是细胞内产生能量的主要细胞器,因此线粒体的质量体积占神经元的体积超过30%(王来,祝世功,2016)。线粒体结构破坏、活性降低、功能紊乱等所导致的突触降解、神经元凋亡或丢失是AD发生的重要病理机制(Armand-Ugon et al., 2017;Wang et al., 2017;Yu et al., 2017)。研究表明,Aβ可富集到线粒体内,诱导线粒体分裂,促进线粒体片段化和瞬时通透孔(mitochondrial permeability transition)的开放,导致病理症状。抑制线粒体分裂可降低神经元的线粒体功能紊乱、突触降解及动物的认知能力降低,促进线粒体功能则可以缓解AD的病理症状(Ye et al., 2015;Valasani et al., 2016;Baek et al., 2017;Reddy et al., 2017)。过氧化物酶体增殖物激活受体γ辅助活化因子1α(peroxisome proliferator-activated receptor γ coactivator 1α,PGC-1α)能促进线粒体生成,增强线粒体功能(王来,祝世功,2016),因而对维持神经元功能可能发挥重要作用。游泳运动能提高机体的认知能力,抑制疾病或衰老导致的记忆能力降低,促进神经功能恢复(崔建梅等,2013;栾海云等,2016)。本研究观察游泳训练的APP/PS1转基因小鼠的学习记忆能力及其大脑神经元细胞的凋亡情况,探讨游泳运动对APP/PS1转基因小鼠学习记忆能力的影响及影响机制。
1 材料和方法 1.1 动物来源APP/PS1转基因小鼠购自南京大学模式动物研究所并在本实验室繁育,实验动物生产许可证号:J004462,实验动物使用许可证号:SCXK(苏)2010-0001。将雄性APP/PS1转基因小鼠杂合体(+/-)与野生型雌鼠(-/-)合笼繁殖,幼鼠出生后2周,提取小鼠DNA并做PCR鉴定仔鼠基因型。APP基因上游引物为5'-GACTGACCACTCGACCAGGTTCTG-3',下游引物为5'-CTTGTAAGTTGGATTCTCATATCCG-3',PCR产物为350 bp;PS1基因上游引物为5'-AATAGAGAACGGCAGGAGCA-3',下游引物为5'-GCCATGAGGGCACTAATCAT-3',PCR产物为608 bp。PCR反应条件为:95 ℃预变性5 min;94 ℃变性30 s,63 ℃退火45 s,72 ℃延伸1 min,35个循环。APP/PS1转基因阳性小鼠在306 bp和608 bp处有2条条带,野生型小鼠无条带。APP/PS1转基因小鼠在室温22~25 ℃、相对湿度60%~80%的环境下饲养,以出生当天为P0,直至饲养至游泳运动结束,共12个月。
1.2 试剂Tunel细胞凋亡检测试剂盒购自Promega公司;DAPI试剂、刚果红染色试剂盒购自索莱宝生物科技有限公司;小鼠抗PGC-1α抗体、兔抗细胞色素c氧化酶Ⅳ(cytochrome c oxidase Ⅳ,COX Ⅳ)抗体和小鼠抗β-actin抗体购自Santa公司;辣根过氧化物标记的二抗购自北京中杉金桥生物科技有限公司;BCA蛋白定量试剂盒购自美国Life Technologies公司;ECL发光试剂盒购自Millipore公司;RIPA裂解液购自康为世纪生物科技有限公司;其他试剂均为分析纯。
2 方法 2.1 游泳运动训练雄性APP/PS1转基因小鼠20只随机平均分为对照组和游泳组。将游泳组小鼠放入游泳池,游泳池四周光滑且池壁高出水面20 cm,水温30 ℃±1 ℃(等于或稍低于体温时游泳时间最长),每次游泳15 min,每天1次,每周5 d,周二、四休息,共持续4周。如果小鼠漂浮在水中不游,用水温计驱赶其尾部,使其不停游动。
2.2 刚果红染色Aβ斑将对照组和游泳组小鼠用水合氯醛腹腔麻醉,冰上灌流、取脑,置于4%多聚甲醛中室温浸泡后固定24 h。固定后的大脑进行梯度脱水处理:50%酒精,2 h;75%酒精,过夜;90%酒精,1 h;95%酒精Ⅰ,1 h;95%酒精Ⅱ,1 h;无水乙醇Ⅰ,1 h;无水乙醇Ⅱ,1 h;二甲苯Ⅰ,1 h;二甲苯Ⅱ,1 h;最后放入冬青油中过夜。脱水后的大脑用生物组织包埋机(天津天利航空机电有限公司)包埋制成蜡块。石蜡切片机将蜡块切成4 μm的薄片,贴附于涂有多聚赖氨酸的载玻片上,60 ℃烘箱中干燥2 h,脱蜡复水。苏木素染色液浸染5 min,酸性分化液分化5 s,自来水冲洗2 min返蓝,自来水冲洗2 min,刚果红染色液浸染20~30 min,无水乙醇快速冲洗3次,二甲苯透明,中性树胶封片,用荧光显微镜(BX61,Olympus,Japan)观察并拍照。
2.3 Tunel检测皮层神经元的凋亡取对照组和游泳组小鼠大脑石蜡切片,根据Tunel细胞凋亡检测试剂盒说明书依次添加相应试剂。用荧光显微镜(BX61,Olympus,Japan)观察并拍照。
2.4 Western Blot10%水合氯醛腹腔麻醉小鼠,预冷的0.01 mol·L-1磷酸盐缓冲液(PBS)冰上进行心脏灌注,至右心房流出清亮液体,断头取脑,迅速将小鼠大脑置于预冷的PBS中,小心剥离大脑皮质,将其置于添加有苯甲基磺酰氟的RIPA裂解液中,电动匀浆器匀浆,4 ℃、12 000 r·min-1离心10 min,所得上清即为皮层总蛋白。BCA法进行蛋白定量。样品经10%SDS-PAGE分离目的蛋白、转膜、5%的脱脂牛奶室温封闭1 h后加入一抗,4 ℃孵育过夜。次日,用1×TBST漂洗3次,每次15 min,之后加入HRP标记的二抗于室温孵育1 h,用1×TBST漂洗3次,每次15 min。ECL试剂盒显影曝片。Quntity One 4.62进行条带灰度分析。
2.5 Morris水迷宫检测游泳前进行Morris水迷宫实验测试小鼠空间学习记忆能力。实验分为2个部分:(1)定位航行实验:测量小鼠对水迷宫空间学习和记忆的获取能力。实验历时7 d,第1~6天,每只小鼠每天训练3次。在水迷宫的不同象限贴上标识,将小鼠按着标识面向池壁放入水中,记录小鼠寻找并爬上平台时所需时间(即逃避潜伏期)。如果小鼠在60 s内未找到平台,用导引棒将其引至平台,并在平台上停留10 s,这时潜伏期记为60 s。第7天测试;(2)空间搜索实验:在第8天撤除水下平台,在同一入水点将小鼠面向池壁放入水中,记录小鼠进入原先放置平台的象限所花的时间(目标象限搜索时间百分比)和进入该象限的次数(通过目标区域次数),作为空间记忆的检测指标。
2.6 数据分析用GraphPad Prism 6.0进行数据统计分析。实验数据以平均数±标准差(Mean±SD)表示,组间比较采用配对t检验。P<0.05为差异有统计学意义。
3 结果 3.1 APP/PS1转基因小鼠鉴定PCR结果显示,APP/PS1转基因小鼠分别约在350 bp和608 bp处观察到APP和PS1目的带,该位置DNA片段的大小与理论结果一致,而野生型小鼠没有这2条目的带,说明获得APP/PS1转基因小鼠(图 1)。

|
| 图 1 PCR鉴定APP/PS1转基因小鼠 Fig. 1 APP/PS1 transgenic mice identified by PCR M. Marker, 1.APP/PS1转基因小鼠APP/PS1 transgenic mouse,2.野生型小鼠wild type mouse. |
| |
刚果红对Aβ斑的染色结果显示,12月龄的对照组小鼠皮层内形成大量的Aβ斑,然而通过1个月的游泳运动,游泳组小鼠皮层内Aβ斑的数量极显著减少(P<0.01)(图 2)。

|
| 图 2 游泳运动对Aβ斑的影响 Fig. 2 Effects of swimming on Aβ plaques A.刚果红标记的Aβ斑,B. Aβ斑的统计分析;**P<0.01。 Aβ plaques marked by Congo red staining, B. statistical analysis of Aβ plaques; **P < 0.01. |
| |
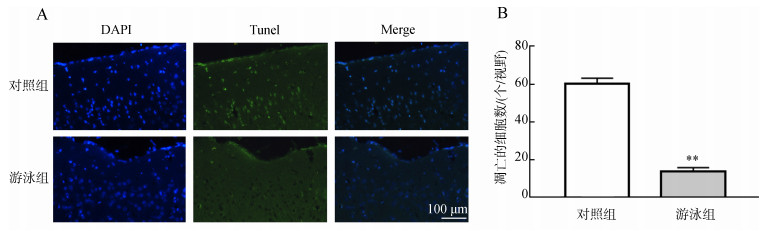
Tunel对神经元凋亡的检测结果显示,12月龄的对照组小鼠皮层内存在大量的神经元凋亡,而经过游泳运动的小鼠,皮层内神经元凋亡的数量极显著减少(P<0.01)(图 3)。
|
| 图 3 游泳运动对皮层神经元的影响 Fig. 3 Effects of swimming on cortical neurons A. Tunel标记的凋亡细胞,B.凋亡细胞的统计分析;**P<0.01;DAPI.染细胞核,Tunel.断裂的DNA,Merge.凋亡细胞。 A. apoptotic cells identified by Tunel, B. statistical analysis of apoptotic cells; **P < 0.01; DAPI. nucleus, Tunel. broken DNA, Merge. apoptotic cells. |
| |
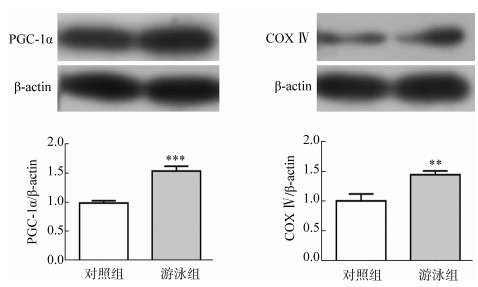
Western Blot检测大脑皮质内PGC-1α和COX Ⅳ的表达。结果显示,游泳运动促进了小鼠皮质内PGC-1α和COX Ⅳ表达的上调,说明游泳运动能够促进线粒体的生成(图 4)。
|
| 图 4 游泳运动对神经元PGC-1α和COX Ⅳ表达的影响 Fig. 4 Effects of swimming on the expression of PGC-1α and COX Ⅳ in neurons **P < 0.01, ***P < 0.001. |
| |
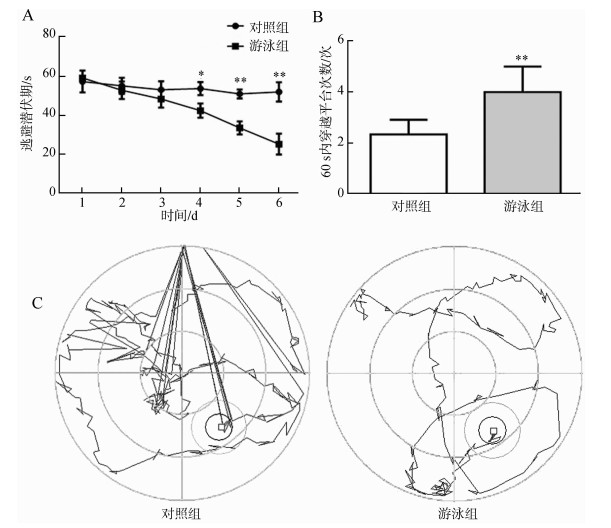
在定位航行实验中,前3 d内对照组和游泳组小鼠的逃避潜伏期都比较长,且差异无统计学意义,从第4天开始,游泳组小鼠所需要的时间比对照组少,且差异具有统计学意义(图 5:A)。在第8天撤出平台,观察小鼠的空间探索能力,发现游泳组小鼠穿过平台所在象限的次数多于对照组小鼠,差异具有统计学意义(图 5:B)。观察水迷宫的轨迹图发现,对照组小鼠的运动轨迹比较复杂、没有规律、耗时较多,而游泳组小鼠运动轨迹的规律比较明显、耗时较少(图 5:C)。
|
| 图 5 游泳运动对APP/PS1转基因小鼠学习记忆能力的影响 Fig. 5 Effects of swimming on learning and memory abilities in APP/PS1 transgenic mice A.逃避潜伏期,B.穿过平台的次数,C.游泳轨迹;*P<0.05,**P<0.01。 A. time of latency, B. passing times across the platform quadrant, C. swim-tracking path; *P < 0.05, **P < 0.01. |
| |
AD作为老年期退行性且不可逆的中枢神经系统性疾病,常导致患者进行性认知功能障碍、记忆力减退以及性格和行为改变等。目前,Aβ沉淀形成老年斑所导致的神经元凋亡或丢失是解释AD发生的重要病理机制。APP/PS1转基因小鼠携带有由小鼠朊病毒蛋白启动子启动表达的突变人类淀粉样前蛋白(APPswe)和人类早老素(DeltaE9)基因,最早在3月龄时即可出现Aβ沉积形成老年斑的病理变化,且随着月龄的增加,出现AD病理症状的表现越加明显,因此该模型小鼠是用来研究AD较理想的动物模型(Jin et al., 2015;Zhao et al., 2016)。本研究发现,12月龄的APP/PS1转基因小鼠大脑皮层内形成大量由Aβ沉积所导致的老年斑,并观察到神经元大量凋亡,与AD出现大量Aβ斑沉积和神经元凋亡或丢失的病理症状相吻合。
最近研究发现,Aβ可富集在线粒体内,导致线粒体氧化损伤、生成能力降低、动力学紊乱、结构破坏和功能降低等,这些是AD发生的早期事件,因此,促进线粒体的功能、抑制神经元凋亡或丢失可能是防治AD的策略之一(Picone et al., 2014;Wu et al., 2014;刘艳萍等,2015)。对缺血再灌注的研究表明,促进线粒体生成可以增强线粒体的功能从而抑制神经元凋亡,发挥神经保护效应(Wang et al., 2014)。孕期的游泳运动可以诱导子代大脑线粒体生成,降低新生鼠缺氧缺血性脑损伤、增加运动能力、促进长时记忆能力,说明游泳运动行为可以通过促进线粒体生成发挥神经保护效应(Marcelino et al., 2013, 2016)。PGC-1α是线粒体生成的重要调控因子,促进PGC-1α的表达可以增强线粒体的体积分数、增加线粒体DNA的拷贝数、上调线粒体自身蛋白的表达,如COX Ⅳ促进线粒体生成,增强线粒体的功能发挥细胞保护效应(Abrahan & Ash,2016;王来,祝世功,2016)。本研究发现,12月龄的APP/PS1转基因小鼠经过游泳运动后,大脑皮层PGC-1α和COX Ⅳ的表达上调,说明游泳运动能促进线粒体的生成。病理学的检测发现,游泳组小鼠大脑皮质内Aβ沉积形成的老年斑数量减少、神经元凋亡数量降低,说明游泳运动可以降低Aβ斑的形成,抑制神经元凋亡或丢失。Morris水迷宫检测APP/PS1转基因小鼠的学习记忆能力表明,游泳组小鼠的逃避潜伏期小于对照组,60 s内穿过平台次数多于对照组,对水迷宫轨迹图的分析表明,对照组小鼠轨迹比较复杂、凌乱,而游泳组轨迹较为简单、有规律,充分说明游泳运动可以抑制APP/PS1转基因小鼠学习记忆能力的降低。
总之,本研究结果表明,游泳运动可以上调APP/PS1转基因小鼠的PGC-1α的表达、促进线粒体的生成、抑制Aβ斑的形成、抑制神经元的凋亡或丢失、增强小鼠的学习记忆能力,该研究结果为探讨AD的运动行为治疗提供了依据。
| 崔建梅, 李小利, 付芳, 等. 2013. 游泳运动对衰老大鼠学习记忆、前额叶皮质氨基酸水平及nNOS表达的影响[J]. 吉林大学学报(医学版), 39(4): 737–742. |
| 刘艳萍, 陆征宇, 董强. 2015. 阿尔茨海默病病理改变的线粒体机制[J]. 神经损伤与功能重建, 10(3): 239–241. |
| 栾海云, 李娜, 王桂华, 等. 2016. 游泳运动对D-半乳糖致衰老小鼠学习记忆和胆碱能神经系统功能的影响[J]. 中国运动医学杂志, 35(1): 36–39. |
| 王来, 祝世功. 2016. 线粒体生成与脑缺血再灌注损伤的研究进展[J]. 中国病理生理杂志, 32(8): 1478–1483. |
| Abrahan C, Ash JD. 2016. The potential use of PGC-1α and PGC-1β to protect the retina by stimulating mitochondrial repair[J]. Advances in Experimental Medicine & Biology, 854: 403–409. |
| Armand-Ugon M, Ansoleaga B, Berjaoui S, et al. 2017. Reduced mitochondrial activity is early and steady in the entorhinal cortex but it is mainly unmodified in the frontal cortex in Alzheimer's disease[J]. Current Alzheimer Research: 4. DOI:10.2174/1567205014666170505095921 |
| Baek SH, Park SJ, Jeong JI, et al. 2017. Inhibition of drp1 ameliorates synaptic depression, Aβ deposition, and cognitive impairment in an Alzheimer's disease model[J]. Journal of Neuroscience the Official Journal of the Society for Neuroscience, 37(20): 5099–5110. DOI:10.1523/JNEUROSCI.2385-16.2017 |
| Jin JL, Liou AK, Shi Y, et al. 2015. CART treatment improves memory and synaptic structure in APP/PS1 mice[J]. Scientific Reports, 5: 10224. DOI:10.1038/srep10224 |
| Marcelino TB, deLemos Rodrigues PI, Klein CP, et al. 2016. Behavioral benefits of maternal swimming are counteracted by neonatal hypoxia-ischemia in the offspring[J]. Behavioural Brain Research, 312: 30–38. DOI:10.1016/j.bbr.2016.06.009 |
| Marcelino TB, Longoni A, Kudo KY, et al. 2013. Evidences that maternal swimming exercise improves antioxidant defenses and induces mitochondrial biogenesis in the brain of young Wistar rats[J]. Neuroscience, 246(5): 28–39. |
| Picone P, Nuzzo D, Caruana L, et al. 2014. Mitochondrial dysfunction:different routes to Alzheimer's disease therapy[J]. Oxidative Medicine & Cellular Longevity, 2014(2): 780179. |
| Reddy PH, Manczak M, Yin X. 2017. Mitochondria-division inhibitor 1 protects against amyloid-β induced mitochondrial fragmentation and synaptic damage in Alzheimer's disease[J]. Journal of Alzheimers Disease Jad, 58(1): 147–162. DOI:10.3233/JAD-170051 |
| Valasani KR, Sun Q, Fang D, et al. 2016. Identification of a small molecule cyclophilin D inhibitor for rescuing Aβ-mediated mitochondrial dysfunction[J]. ACS Medicinal Chemistry Letters, 7(3): 294–299. DOI:10.1021/acsmedchemlett.5b00451 |
| Wang D, Liu X, Liu Y, et al. 2017. The effects of cardiotrophin-1 on early synaptic mitochondrial dysfunction and synaptic pathology in APPswe/PS1dE9 mice[J]. Journal of Alzheimers Disease Jad, 59(4): 1255. DOI:10.3233/JAD-170100 |
| Wang L, Chen M, Yuan L, et al. 2014. 14, 15-EET promotes mitochondrial biogenesis and protects cortical neurons against oxygen/glucose deprivation-induced apoptosis[J]. Biochemical & Biophysical Research Communications, 450(1): 604–609. |
| Wu Z, Zhu Y, Cao X, et al. 2014. Mitochondrial toxic effects of Aβ through mitofusins in the early pathogenesis of Alzheimer's disease[J]. Molecular Neurobiology, 50(3): 986–996. DOI:10.1007/s12035-014-8675-z |
| Ye CY, Lei Y, Tang XC, et al. 2015. Donepezil attenuates Aβ-associated mitochondrial dysfunction and reduces mitochondrial Aβ accumulation in vivo and in vitro[J]. Neuropharmacology, 95: 29–36. DOI:10.1016/j.neuropharm.2015.02.020 |
| Yu Q, Du F, Douglas JT, et al. 2017. Mitochondrial dysfunction triggers synaptic deficits via activation of p38 MAP kinase signaling in differentiated alzheimer's disease trans-mitochondrial cybrid cells[J]. Journal of Alzheimers Disease Jad, 59(1): 223–239. DOI:10.3233/JAD-170283 |
| Zhao FL, Qiao PF, Yan N, et al. 2016. Hydrogen sulfide selectively inhibits γ-secretase activity and decreases mitochondrial aβ production in neurons from APP/PS1 transgenic mice[J]. Neurochemical Research, 41(5): 1145–1159. DOI:10.1007/s11064-015-1807-7 |
 2017, Vol. 36
2017, Vol. 36




