扩展功能
文章信息
- 祝国强, 莫春横, 李正阳, 王亚军, 李娟
- ZHU Guoqiang, MO Chunheng, LI Zhengyang, WANG Yajun, LI Juan
- 家鸡G蛋白偶联受体161的基因克隆、分子进化和组织表达
- Gene Cloning, Molecular Evolution and Tissue Expression of G Protein-coupled Receptor 161 in Chicken
- 四川动物, 2017, 36(6): 632-638
- Sichuan Journal of Zoology, 2017, 36(6): 632-638
- 10.11984/j.issn.1000-7083.20170140
-
文章历史
- 收稿日期: 2017-05-02
- 接受日期: 2017-07-22
G蛋白偶联受体是细胞表面受体中最大并最具多样性的家族,其家族成员均具典型7次跨膜结构,介导视觉、嗅觉、行为等众多生理活动(Morris & Malbon,1999)。在人中已发现并获得鉴定的G蛋白偶联受体超过1 000种,约占人类基因总数的5%(Consortium,2004;Zhang et al., 2006),截至目前,该数量仍在缓慢增加,凸显G蛋白偶联受体在细胞功能实现中的重要作用。
G蛋白偶联受体161(G protein-coupled receptor 161,GPR161)属于G蛋白偶联受体家族孤儿受体家族成员,这一类受体家族成员的内源性配体有待鉴定(Gainetdinov et al., 2004)。尽管缺乏其内源性配体信息,但GPR161被报道在调节晶状体发育和神经胚形成中具有重要作用。空泡化晶状体症小鼠突变体带有先天白内障和神经管畸形,研究发现该表型源于GPR161基因8 bp碱基缺失(Matteson et al., 2008)。原位杂交实验结果进一步显示,GPR161基因的表达伴随着晶状体发育的完整阶段,侧面印证GPR161功能缺失可能是白内障的成因(Matteson et al., 2008)。进一步的研究发现,GPR161的生理功能不仅涉及空泡化晶状体症,还参与调控左右心室形成、乳腺癌细胞的增殖以及垂体柄阻断综合症的发生(Leung et al., 2008;Feigin et al., 2014;Karaca et al., 2014)。
在传统的G蛋白偶联受体信号通路中,胞外配体结合受体激活G蛋白,激活的亚基包括G蛋白α亚基以及β和γ亚基进一步激活下游效应器,包括各种激酶等,促进通路持续(Morris & Malbon,1999)。在信号转导进程中,支架蛋白成为重要的连接器。各种GTP酶、激酶、磷酸化酶等信号蛋白在支架蛋白介导下获得次序激活,掌控多样生理效应。以支架蛋白A类激酶锚定蛋白为例,不同的A类激酶锚定蛋白锚定Ⅰ型或Ⅱ型蛋白激酶A,释放二级信号分子,最终激活环磷酸腺苷感受信号通路(Wong & Scott,2004;Langeberg & Scott,2015)。此外,支架蛋白与G蛋白偶联受体具有物理连接,对G蛋白偶联受体的定位和活性调节有重要意义(Ritter & Hall,2009)。研究表明,GPR161基因除了具G蛋白偶联受体经典的结构特征,其C末端还罕见地包含作为支架蛋白A类激酶锚定蛋白共有的两性分子螺旋,提示该蛋白可以直接锚定、富集Ⅰ型蛋白激酶A,在信号转导进程中发挥更为重要的主导作用,其结构意义及潜在的效应机制备受关注(Mukhopadhyay et al., 2013;Bachmann et al., 2016)。
综上,GPR161基因参与介导机体重要生理效应,其结构特征亦值得进一步探究。至今,针对GPR161基因的研究报道仍然相对匮乏,且GPR161基因序列在鸟类中至今仍未获得鉴定。家鸡Gallus gallus是鸟类模式生物,是脊椎动物进化中最为重要的过渡类群。本研究首次报道家鸡GPR161基因的编码区序列,预测其二级结构,同时也检测其在成体家鸡中的组织表达图谱,研究结果为阐释GPR161基因在脊椎动物中的生理效应提供基础信息。
1 材料与方法 1.1 材料本实验所用动物为罗曼粉成年家鸡,购自四川牧星养鸡场;引物合成、DNA测序工作由成都擎科公司完成;组织保存和RNA提取所用的RNAzol购自Molecular Research Central;MMLV逆转录酶、dNTP、KOD-Fx高保真聚合酶、Easy-Taq酶、pTA-2载体、限制性内切酶、T4 DNA连接酶均购自大连宝生物工程有限公司(TaKaRa);分子克隆宿主大肠杆菌Escherichia coli DH5α由本实验室制备保存;荧光定量PCR仪Bio-Rad CFX96、荧光染料Eva Green、96孔板、塑料封膜购自Bio-Rad。
1.2 方法 1.2.1 总RNA提取取家鸡组织包括脂肪、肾上腺、肾脏、肝脏、肺、肌肉、卵巢、胰腺、皮肤、脾脏、精巢等,迅速放入液氮中速冻,并用研钵研棒保证组织浸泡在液氮中充分研磨成粉末。后续步骤严格按照RNA extraction kits说明书(TaKaRa)提取总RNA:取约60 μg组织粉末,与600 μL RNAzol混合;补充240 μL DEPC灭菌水,用涡旋仪混匀约15 s;在高速冷冻离心机中,于4 ℃、12 000 r·min-1离心15 min;取上清,加入3 μL阿司咪唑,涡旋15 s后于4 ℃、12 000 r·min-1冷冻离心10 min;取上清,加入等体积异丙醇,于4 ℃、12 000 r·min-1冷冻离心10 min;小心吸取上清并弃掉,加入75%乙醇漂洗总RNA沉淀,于4 ℃、8 000 r·min-1冷冻离心3 min;重复上一步,漂洗RNA沉淀;弃上清,用20 μL DEPC灭菌水溶解沉淀,及时构建cDNA文库或于-80 ℃冰箱保存。
1.2.2 cDNA模板制备以各组织总RNA为模板进行逆转录构建cDNA文库,具体步骤如下:取2 μg各组织的总RNA样品,与1 μL Oligo-dT混合;补DEPC灭菌水至总体积5 μL (Oligo-dT终浓度为0.5 μg·μL-1),混匀;于PCR仪中70 ℃加热10 min后,立即取出放置于冰上10 min;加入2 μL 5×RT buffer,0.5 μL MMLV逆转录酶,0.5 μL dNTPs,补充DEPC灭菌水至总体积10 μL,混匀;于PCR仪中42 ℃反应1.5 h,后又70 ℃反应10 min结束;取反应所得产物加入70 μL灭菌水,所得混合溶液即为cDNA模板。
1.2.3 载体构建根据Ensemble数据库提供的家鸡基因组信息,遵循引物设计原理并使用DNAMAN 8.0(Lynnon Biosoft)设计家鸡GPR161基因编码区全长引物(上游引物cGPR161-U1和下游引物cGPR161-L1)和组织表达所需的荧光定量引物(上游引物cGPR161-qU1和下游引物cGPR161-qL1)。以家鸡脂肪组织cDNA为模板,使用编码区全长引物对GPR161基因的开放阅读框(ORF)区域进行扩增。PCR扩增体系如下:5 μL 2×KOD缓冲液,2 μL脂肪组织cDNA模板,2 μL dNTPs,上游引物cGPR161-U1和下游引物cGPR161-L1各0.1 μL,0.5 μL KOD-Fx聚合酶,0.3 μL去离子灭菌水。PCR扩增条件如下:94 ℃预变性2 min;98 ℃变性10 s,60 ℃退火30 s,68 ℃延伸2 min,34个循环;72 ℃最后延伸10 min。然后分别取3 μL反应产物,用1%琼脂糖凝胶电泳检测PCR扩增结果。
取4.5 μL PCR产物与0.5 μL 10×A-attachment Mix混合,置于PCR仪中60 ℃反应30 min,保证KOD-Fx聚合酶扩增的平末端产物的3'末端加上碱基A;反应混合液与pTA-2载体进行4 ℃过夜连接;将连接产物转入DH5α感受态细胞,并均匀涂布在加有抗氨苄的LB固体培养皿中进行蓝白斑筛选;利用pTA-2载体通用引物挑选特异性阳性单克隆,送成都擎科公司进行双向测序。
1.2.4 生物信息分析对获得的家鸡GPR161氨基酸序列与NCBI数据库中其他物种已知或预测序列,使用DNAMAN 8.0(Lynnon Biosoft)和在线网站ESPript(Easy Sequencing in PostScript)进行氨基酸相似度比对(Robert & Gouet,2014),分子进化遗传学分析采用最大似然法(Maximum Likelihood,ML)依托MEGA 6.0完成(Tamura et al., 2013),基因功能预测使用在线BioGRID数据库(Biological General Repository for Interaction Datasets)(Chatr-aryamontri et al., 2016)。
1.2.5 组织表达采用家鸡不同组织的cDNA模板,以荧光定量PCR方法检测各组织的表达情况。荧光定量PCR的扩增体系如下:2%DMSO,9.5 μL去离子灭菌水,2 μL 10×buffer,6 μL cDNA模板,0.4 μL dNTPs,上游引物cGPR161-qU1和下游引物cGPR161-qL1各0.2 μL,1 μL荧光染料Eva Green,1 μL Easy-Taq酶,总体积为20 μL。荧光定量PCR的扩增条件如下:94 ℃预变性2 min;94 ℃变性20 s,60 ℃退火15 s,72 ℃延伸20 s,39个循环,然后按照0.5 ℃/5 s的速度从70 ℃到95 ℃向上升温熔解,生成熔解曲线。荧光定量PCR的结果按照比较CT值法(2-ΔΔCT法)进行数据处理(Schmittgen & Livak,2008),步骤如下:首先将各组织样品结果GPR161的CT值减去对应组织内参基因β-actin的CT值,得到各组织的ΔCT值;然后将GPR161在大脑中的表达量选作参考,并将上一步分别所得的各组织的ΔCT值减去大脑的ΔCT值,得到ΔΔCT值;最后计算2-ΔΔCT值,得到各组织中GPR161相对大脑中GPR161的表达量倍数,即GPR161在各组织间的相对表达量。
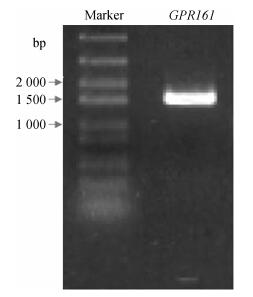
2 结果 2.1 家鸡GPR161基因的克隆参照NCBI数据库中预测的家鸡GPR161基因序列和Ensemble数据库中的家鸡全基因组设计上、下游PCR引物(表 1),采用家鸡脂肪组织cDNA为模板,使用高保真酶KOD扩增家鸡GPR161序列。凝胶电泳显示,扩增条带大小与预期一致,略大于1 500 bp(图 1)。将该片段与pTA-2载体连接后转化到DH5α中,经蓝白斑筛选得到阳性单克隆。提取质粒,酶切检验确保重组质粒的完整性后,选取3个单克隆质粒送公司测序。
| 基因 | 引物名称 | 序列5'-3' | 序列长度/bp |
| GPR161 | cGPR161-U1 | GGTACCTCTGACCATGAGCAGCAATTCT | 1 584 |
| cGPR161-L1 | TCGATGAAGGGAATATTTGACAGTC | ||
| GPR161 (qPCR) |
cGPR161-qU1 | TGCAATTTCTCAGCCCTGCT | 215 |
| cGPR161-qL1 | AACTCCAAAGACGACCAGCC | ||
| β-actin | Actin-qU1 | TGTGCTACGTCGCACTGGAT | 401 |
| Actin-qL1 | GCTGATCCACATCTGCTGGA |
|
| 图 1 家鸡GPR161基因扩增 Fig. 1 PCR amplification of chicken GPR161 gene |
| |
测序结果显示,家鸡GPR161基因编码区ORF长度为1 566 bp,编码521个氨基酸。与家鸡全基因组序列比对后发现,家鸡GPR161基因位于家鸡1号染色体上,编码区没有内含子。将家鸡GPR161基因编码区氨基酸序列与人Homo sapiens、小鼠Mus musculus、斑马鱼Danio rerio的进行比对(图 2),发现其与人、小鼠、斑马鱼的相似度分别为83.0%、82.6%、65.8%。家鸡GPR161基因含有G蛋白偶联受体的7次跨膜区经典结构,同时还含有支架蛋白A类激酶锚定蛋白的两性分子螺旋结构(图 2)。

|
| 图 2 家鸡GPR161与斑马鱼、人、小鼠的基因编码区氨基酸序列比对 Fig. 2 Alignment of the amino acid sequence of GPR161 gene from chicken, zebrafish, human and mouse TM1~7示经典跨膜区域,两性分子螺旋结构在方框中标识。 TM1-7 shows the typical transmembrane domains, the amphipathic helix is indicated. |
| |
尽管GPR161基因序列信息目前只在人、小鼠、斑马鱼和家鸡中得到鉴定,但是随着测序技术的发展和越来越多物种的基因组被破译,不同物种中未经实验数据验证的GPR161基因预测序列或片段也能够从Ensemble数据库获得。为了更加全面地探究GPR161基因在不同物种间的分子遗传学进化,分子系统进化树结果显示,家鸡与火鸡Meleagris gallopavo的同源性最高,且与爬行类中华鳖Pelodiscus sinensis、鸟类斑胸草雀Taeniopygia guttata分子进化关系也较为接近,人和小鼠次之,与斑马鱼进化关系则相对较远(图 3)。

|
| 图 3 GPR161基因的分子系统进化树 Fig. 3 Molecular phylogenetic tree of GPR161 gene |
| |
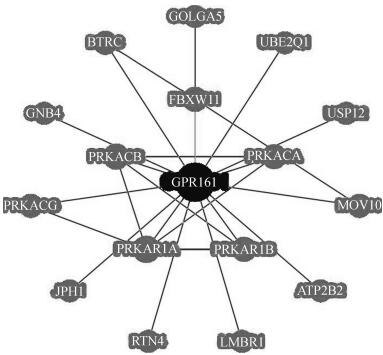
依托于测序产生的大数据,对某个基因或基因家族的生物信息学进行功能注释,目前已逐渐成为分析和预测基因功能的重要技术。在线BioGRID数据库预测了可能与GPR161基因有蛋白相互作用的基因(图 4)。对蛋白互作网络的GO功能注释分析显示,GPR161主要参与G蛋白偶联受体信号通路、腹侧神经管平滑信号通路的负调控、cAMP生物合成的正调控、初级纤毛的生成等生理功能,比如PPKACA、PPKACB、PPKACG是蛋白激酶A的组成亚基,直接介导cAMP信号。
|
| 图 4 GPR161基因蛋白-蛋白间互作网络 Fig. 4 The network of protein-protein interactions with GPR161 gene |
| |
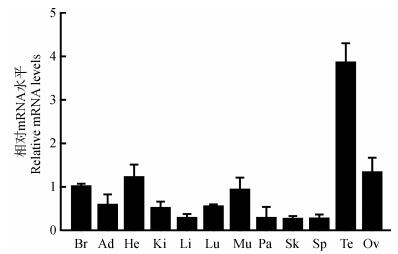
为探究GPR161基因在家鸡各组织中的生理学效应差异,以成体家鸡各组织cDNA为模板,用荧光定量PCR方法检测GPR161基因在家鸡各组织中的mRNA水平表达分布情况。各组织的样本数均大于或等于4。结果显示,GPR161基因mRNA在家鸡的精巢或卵巢、大脑、心脏、肌肉中有较高的表达,但在脂肪、肾脏、肺中表达量相对较低,在肝脏、胰腺、皮肤、脾脏中则检测到更弱的表达信号(图 5)。
|
| 图 5 荧光定量PCR检测GPR161基因mRNA在家鸡各组织中的表达 Fig. 5 qPCR detection of GPR161 gene mRNA expression in chicken tissues Br.大脑,Ad.脂肪,He.心脏,Ki.肾脏,Li.肝脏,Lu.肺,Mu.肌肉,Pa.胰腺,Sk.皮肤,Sp.脾脏,Te.精巢,Ov.卵巢。 Br. brain, Ad. adipose, He. heart, Ki. kidney, Li. liver, Lu. lung, Mu. muscle, Pa. pancreas, Sk. skin, Sp. spleen, Te. testis, Ov. Ovary. |
| |
GPR161基因被报道在晶状体发育、神经胚形成、左右心室形成、乳腺癌细胞增殖、垂体柄阻断综合症的发生等疾病中扮演重要角色(Leung et al., 2008;Matteson et al., 2008;Feigin et al., 2014;Karaca et al., 2014)。该基因在结构上罕见地拥有支架蛋白A类激酶锚定蛋白类似结构,凸显其独特结构特征并暗示其特别的调控机制。本研究首次报道家鸡GPR161基因的序列信息、分子进化关系以及其组织表达图谱。
家鸡GPR161基因编码区ORF长度为1 566 bp,编码521个氨基酸。序列分析显示,家鸡GPR161氨基酸序列与哺乳动物具有较高的序列相似性(人:83.0%;小鼠:82.6%),而与斑马鱼的相似度相对较低(斑马鱼:65.8%)。分子进化遗传分析表明,GPR161基因在家鸡与火鸡的同源性最高,且与爬行类中华鳖、鸟类斑胸草雀分子进化关系也较为接近,人和小鼠次之,而与斑马鱼进化关系相对较远。
本研究也对GPR161的生理功能做了初步预测。通过在线BioGRID数据库预测了GPR161参与G蛋白偶联受体信号通路、cAMP生物合成的正调控等生理功能,这与目前在初级纤毛的发育等研究报道一致(Mukhopadhyay et al., 2013;Bachmann et al., 2016;Pal et al., 2016)。利用荧光定量PCR分析技术解析获得家鸡GPR161基因组织表达图谱,为探究其在各器官的生理学意义提供了参考依据。家鸡GPR161基因主要在精巢或卵巢、大脑、心脏、肌肉组织中高表达,该研究结果与人、小鼠、斑马鱼的报道基本一致。在人和小鼠的大脑、神经管、垂体等神经系统中,GPR161基因mRNA被检测到高水平表达(Mukhopadhyay et al., 2013;Karaca et al., 2014)。在斑马鱼的胚胎发育中,GPR161基因mRNA的高水平表达信号亦在心脏中被检测到(Leung et al., 2008)。GPR161基因在家鸡大脑与心脏组织中的高表达,暗示该基因在家鸡中很可能介导与哺乳动物和鱼类类似的生理效应,即参与促进神经胚的形成及左右心室的发育等(Leung et al., 2008;Matteson et al., 2008;Li et al., 2015)。与之相对的是,家鸡GPR161基因在肾脏、脂肪、肺中的表达量相对较低,在肝脏、胰腺、皮肤、脾脏中表达信号更弱。本研究结果为阐释GPR161基因在脊椎动物中的生理效应提供了基础信息。
| Bachmann VA, Mayrhofer JE, Ilouz R, et al. 2016. Gpr161 anchoring of PKA consolidates GPCR and cAMP signaling[J]. Proceedings of the National Academy of Sciences, 113(28): 7786–7791. DOI:10.1073/pnas.1608061113 |
| Chatr-aryamontri A, Oughtred R, Boucher L, et al. 2016. The BioGRID interaction database:2017 update[J]. Nucleic Acids Research, 45(D1): D369–D379. |
| Consortium IHGS. 2004. Finishing the euchromatic sequence of the human genome[J]. Nature, 431(7011): 931–945. DOI:10.1038/nature03001 |
| Feigin ME, Xue B, Hammell MC, et al. 2014. G-protein-coupled receptor GPR161 is overexpressed in breast cancer and is a promoter of cell proliferation and invasion[J]. Proceedings of the National Academy of Sciences, 111(11): 4191–4196. DOI:10.1073/pnas.1320239111 |
| Gainetdinov RR, Premont RT, Bohn LM, et al. 2004. Desensitization of G protein-coupled receptors and neuronal functions[J]. Annual Review of Neuroscience, 27: 107–144. DOI:10.1146/annurev.neuro.27.070203.144206 |
| Karaca E, Buyukkaya R, Pehlivan D, et al. 2014. Whole-exome sequencing identifies homozygous GPR161 mutation in a family with pituitary stalk interruption syndrome[J]. The Journal of Clinical Endocrinology & Metabolism, 100(1): e140–e147. DOI:10.1210/jc.2014-1984 |
| Langeberg LK, Scott JD. 2015. Signalling scaffolds and local organization of cellular behaviour[J]. Nature Reviews Molecular Cell Biology, 16(4): 232–244. DOI:10.1038/nrm3966 |
| Leung T, Humbert JE, Stauffer AM, et al. 2008. The orphan G protein-coupled receptor 161 is required for left-right patterning[J]. Developmental Biology, 323(1): 31–40. DOI:10.1016/j.ydbio.2008.08.001 |
| Li BI, Matteson PG, Ababon MF, et al. 2015. The orphan GPCR, Gpr161, regulates the retinoic acid and canonical Wnt pathways during neurulation[J]. Developmental Biology, 402(1): 17–31. DOI:10.1016/j.ydbio.2015.02.007 |
| Matteson PG, Desai J, Korstanje R, et al. 2008. The orphan G protein-coupled receptor, Gpr161, encodes the vacuolated lens locus and controls neurulation and lens development[J]. Proceedings of the National Academy of Sciences, 105(6): 2088–2093. DOI:10.1073/pnas.0705657105 |
| Morris AJ, Malbon CC. 1999. Physiological regulation of G protein-linked signaling[J]. Physiological Reviews, 79(4): 1373–1430. |
| Mukhopadhyay S, Wen X, Ratti N, et al. 2013. The ciliary G-protein-coupled receptor Gpr161 negatively regulates the sonic hedgehog pathway via cAMP signaling[J]. Cell, 152(1): 210–223. |
| Pal K, Hwang S, Somatilaka B, et al. 2016. Smoothened determines β-arrestin-mediated removal of the G protein-coupled receptor Gpr161 from the primary cilium[J]. The Journal of Cell Biology, 212(7): 861–875. DOI:10.1083/jcb.201506132 |
| Ritter SL, Hall RA. 2009. Fine-tuning of GPCR activity by receptor-interacting proteins[J]. Nature Reviews Molecular Cell Biology, 10(12): 819–830. DOI:10.1038/nrm2803 |
| Robert X, Gouet P. 2014. Deciphering key features in protein structures with the new ENDscript server[J]. Nucleic Acids Research, 42(W1): W320–W324. DOI:10.1093/nar/gku316 |
| Schmittgen TD, Livak KJ. 2008. Analyzing real-time PCR data by the comparative CT method[J]. Nature Protocols, 3(6): 1101–1108. DOI:10.1038/nprot.2008.73 |
| Tamura K, Stecher G, Peterson D, et al. 2013. MEGA6:molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 30(12): 2725–2729. DOI:10.1093/molbev/mst197 |
| Wong W, Scott JD. 2004. AKAP signalling complexes:focal points in space and time[J]. Nature Reviews Molecular Cell Biology, 5(12): 959–970. DOI:10.1038/nrm1527 |
| Zhang Y, DeVries ME, Skolnick J. 2006. Structure modeling of all identified G protein-coupled receptors in the human genome[J]. PLoS Computational Biology, 2(2): e13–e29. DOI:10.1371/journal.pcbi.0020013 |
 2017, Vol. 36
2017, Vol. 36




