扩展功能
文章信息
- 张方方, 姜昊辰, 金锦锦, 仇玉萍, 陈国柱
- ZHANG Fangfang, JIANG Haochen, JIN Jinjin, QIU Yuping, CHEN Guozhu
- 广东淡水鱼类弓背青鳉分类形态性状再描述
- Characteristic Re-description of Ricefish Oryzias curvinotus from Guangdong, China
- 四川动物, 2017, 36(5): 564-571
- Sichuan Journal of Zoology, 2017, 36(5): 564-571
- 10.11984/j.issn.1000-7083.20170048
-
文章历史
- 收稿日期: 2017-02-21
- 接受日期: 2017-08-11
青鳉是广泛分布于亚洲东部、东南部中南半岛及印度尼西亚群岛的小型鱼类,成熟个体体长多在20~30 mm,因过去在稻田生境中极为常见而被称为稻田鱼,在分类上属鳉形目Cyprinodontiformes大颌鳉科Adrianichthyidae青鳉属Oryzias。迄今为止,被描述过的物种有20多种(Parenti,2008;Herder & Chapuis,2010;Magtoon,2010;Parenti & Hadiaty,2010;Asai et al., 2011;Herder et al., 2012;Parenti et al., 2013;Mokodongan et al., 2014),并可能还存在许多有待鉴定的新物种。我国已记述的有4种,分别为中华青鳉Oryzias sinensis、小青鳉O. minutillus、弓背青鳉O. curvinotus和日本青鳉O. latipes,而日本青鳉很可能是中华青鳉误记(陈银瑞等,1989),因而《中国动物志硬骨鱼纲鳉形目》仅收录了前3种。过去,除陈银瑞等(1989)对云南青鳉鱼类进行过调查外,我国境内究竟存在多少青鳉鱼类物种尚未进行过深入调查,其中对弓背青鳉的记述尤为简略。《中国动物志硬骨鱼纲鳉形目》对弓背青鳉性状的描述摘录于Nichols和Pope(1927)对正模标本所作原始描述,缺乏对实物标本的检视。对研究者早期采集的青鳉样品检视后,Uwa和Parenti(1988)指出Nichols和Pope(1927)对弓背青鳉模式标本臀鳍条数目原始描述出现的问题可能为误记,Parenti(2008)更进一步在对20余种青鳉鱼类分类性状总结中更正弓背青鳉臀鳍条数为17~20,体侧纵列鳞数为27~28。因此,由于Nichols和Pope(1927)对弓背青鳉鳍条数目的描述存在错误,《中国动物志硬骨鱼纲鳉形目》检索表的编制中将弓背青鳉的臀鳍数引述为25,体侧纵列鳞数为35,也是错误的。弓背青鳉模式标本产地原为我国海南岛那大(现儋州那大镇,1957年为那大县,解放前为那恁村和大同村),近代以来由于栖息地的破坏及食蚊鱼Gambusia affinis的广泛入侵,弓背青鳉模式标本产地种群可能已灭绝,多年来弓背青鳉在我国海南岛区域的野外种群已无报道。另一方面,Nichols和Pope(1927)描述所依据的标本仅1尾(未见副模标本表述),弓背青鳉模式标本过去虽产自我国海南岛但保存于美国,距今年代久远,是否尚存不得而知,今人无法对其进行复检。尽管如此,Nichols和Pope(1927)对弓背青鳉关键特征,背鳍起点极为靠后的描述是成立的,因此该物种名被研究者承认(Uwa & Parenti,1988;Parenti,2008)。笔者于2016年8月在广州南沙区南沙街道南沙岛采集了一批青鳉鱼类标本,经鉴定确认为弓背青鳉,其形态性状及关键分类特征与Uwa和Parenti(1988)、Parenti(2008)等诸多研究者的记述接近,而与《中国动物志硬骨鱼纲鳉形目》的记述存在较大差异。鉴于正模标本的描述存在严重错误且难于复检,且地模标本也无法获得,现亟需对其分类性状进行再描述及模式标本重建。
过去一些研究者对产于广东的青鳉鱼类曾作记述,但迄今为止尚未能明确有哪些物种,先后记述过的物种有日本青鳉(潘炯华等,1984;赵俊等,2010)、中华青鳉(贾银涛等,2013;林小涛,张洁,2013)、弓背青鳉(Uwa & Parenti,1988;Wang et al., 2017)。本文通信作者于2006年、2008年、2010年分别在上述文献所记述的韶关曲江地区(潘炯华等,1984)、广州从化地区流溪河流域(赵俊等,2010)、广州增城增江流域(贾银涛等,2013;林小涛,张洁,2013)采集到青鳉鱼类标本,经检定应分属2种不同鱼类,前者应为鳍斑青鳉O.pectoralis,而后两者应为弓背青鳉。而Uwa和Parenti(1988)研究中由于没有具体地点而无法检视,在其所记载区域周边如广州南沙、梧州邻近区域肇庆市怀集县近郊分别采得弓背青鳉。鳍斑青鳉与青鳉属的其他种类关键特征在于其胸鳍基部前有一显著黑斑。目前可以确定,广东区域内至少存在2个青鳉鱼类物种,分别为弓背青鳉和鳍斑青鳉,且均未作详细的分类学描述,亟待补充相关数据。本文将对产自广州南沙岛的弓背青鳉进行分类性状描述,且对其雌雄异形进行统计,以弥补我国对弓背青鳉分类资料的缺失,为进一步整理我国青鳉鱼类分类问题积累基础资料。
1 材料与方法 1.1 样品采集地样品采集地位于广东省广州市南沙区南沙街道南沙岛[该区2005年建区,从原番禹区划出,该地为原广州市番禹县(区)南沙镇所在地],面积约100 km2。采集区域为该地中央黄山鲁森林公园东侧溪流,以所在地名称暂命名为九王庙溪、时代南湾溪、卢湾涌等,共发现3个种群。这3条溪流最终均汇入珠江口北部伶仃洋水域,流程均不超过5 km。
1.2 样品采集与实验室分析2016年8月22—24日及10月2—5日进行采样。利用网孔为2 mm,网口直径30 cm的手抄网进行收集,所得标本用5%福尔马林溶液固定备检。本研究标本共51尾,30雌21雄,均为可辨别的性成熟个体。
在实验室对青鳉样品的可数性状进行计数及对可量性状进行测量,计数及测量性状的选取主要依据《中国动物志硬骨鱼纲鳉形目》所述。涉及的可数性状参数主要有背鳍、臀鳍、胸鳍、腹鳍、尾鳍的鳍条数目以及体侧纵列鳞数目等;可量性状参数主要有体长、体高、背鳍-吻端、臀鳍始点-吻端、肛门-吻端、头长、吻长、眼径、眼间距、口宽、最长背鳍条、最长臀鳍条、胸鳍长、腹鳍长、尾鳍长、尾柄长、尾柄高等(图 1:A)。为进一步对弓背青鳉雌雄异形问题进行分析,采用框架测量方法对其形态进一步测量(图 1:B),数据采用多元统计方法分析。
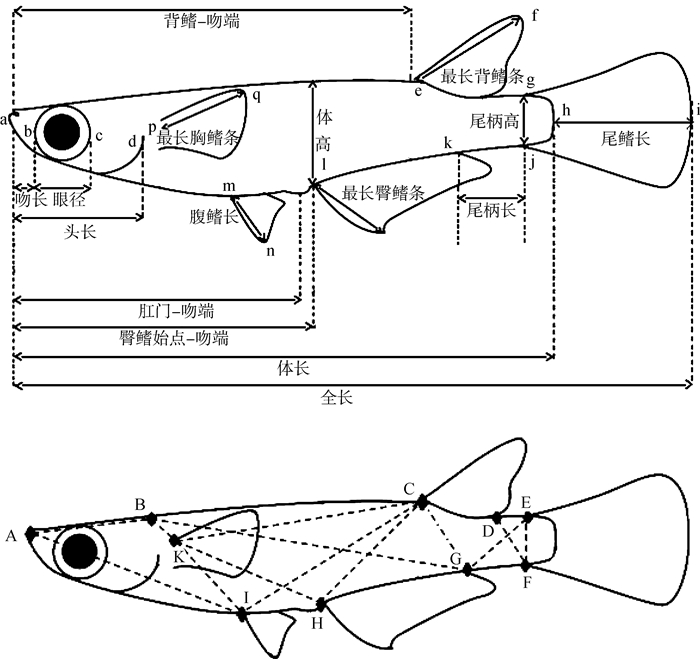
|
| 图 1 弓背青鳉测量性状示意(仿Magtoon,2010) Fig. 1 Measurements of Oryzias curvinotus (redrawing from Magtoon, 2010) |
| |
特别说明,本文采用《中国动物志硬骨鱼纲鳉形目》对青鳉鱼类鳍条数目的处理方法,将不分枝鳍条和分枝鳍条数合并计算鳍条数目而不分开描述。同时,由于弓背青鳉存在雌雄异形现象,本文在性状描述中先合并描述,再将雌鱼、雄鱼分开描述。
1.3 数据分析弓背青鳉可数及可量性状数据均以平均值±标准差表示,利用SPSS 19.0进行统计分析。对雌雄鱼各参数间的差异显著性采用单因素方差分析(ANOVA)。可量性状在分析前与体长或头长作比,以比值进行数据分析,以消除各可量性状参数因体长依赖所引起的系统误差。
另一方面,基于上述传统测量性状及框架测量性状共计57组可量性状比例参数,利用多元统计方法主成分分析、判别分析等对性别间的形态性状差异进行深入分析,以确认雌雄鱼是否存在形态性状差异。
2 结果 2.1 形态与性状描述弓背青鳉体修长,眼大,口上位(图 2)。在野外水体中,从背面观察可见其头顶部至背鳍前端呈狭长“V”字型亮银白色反光,背鳍后至尾柄呈亮蓝色反光。在水族缸中观察时体呈淡青黄色;体透明,可观察到脊柱骨及主要血管分布;腹部呈灰银白色。尾鳍正截形,无分叉。各鳍第一鳍条侧常见较浅的淡黄色,尤其尾鳍上下两侧淡黄色较为明显。8月采样期间正值其繁殖期,雄性间相互争斗并追逐雌鱼,雌雄鱼腹鳍、臀鳍没有中华青鳉所呈现的明显黑灰色。雄鱼臀鳍展开呈平行四边形(图 2:b)。浸制标本体侧有一黑色纵线(图 2),未发现侧线。作为其物种特征之一,背部隆起呈弯弓状这一形态特征只在成年个体(尤其是雄鱼)中表现出来,幼鱼、未性成熟的成体及雌鱼多数个体该特征不明显。背鳍-吻端/体长为(81.6±1.3)%,这是与其他青鳉鱼类区别及种名确定的关键特征。雄鱼臀鳍、背鳍最后鳍条明显短小,鳍条膜呈现显著凹缺(图 2:b,d)。最长臀鳍条出现在臀鳍后部。

|
| 图 2 弓背青鳉 Fig. 2 Oryzias curvinotus (a)活体雌鱼;(b)活体雄鱼;(c) 5%福尔马林固定1周后的雌鱼;(d) 5%福尔马林固定1周后的雄鱼;比例尺=1 cm。 (a) alive female; (b) alive male; (c) preserved by 5% formalin solution one week later, female; (d) preserved by 5% formalin solution one week later, male; scale bar=1 cm. |
| |
可数性状(表 1):背鳍条数目平均6.04±0.20,变动范围6~7;臀鳍条数目19.60±0.80,变动范围19~22,中值19;胸鳍条数目8.69±0.47,变动范围8~9;腹鳍条数目6.00±0.00;尾鳍条数目18.88±1.31,变动范围17~21;体侧纵列鳞数目28.51±0.67,变动范围27~30,中值29。除尾鳍条数目外,雌雄鱼间各测量的可数性状差异无统计学意义。
| 性状Characteristics | 性别Gender | ANOVA | |||
| 雄鱼Male (n=21) | 雌鱼Female (n=30) | 合计Total | |||
| 可 数 性 状 |
背鳍条 | 6.05±0.22(6~7) | 6.03±0.18(6~7) | 6.04±0.20(6~7) | P > 0.05 |
| 臀鳍条 | 19.48±0.81(19~21) | 19.70±0.79(19~22) | 19.60±0.80(19~22) | P > 0.05 | |
| 胸鳍条 | 8.62±0.50(8~9) | 8.73±0.45(8~9) | 8.69±0.47(8~9) | P > 0.05 | |
| 腹鳍条 | 6.00±0.00(6) | 6.00±0.00(6) | 6.00±0.00(6) | P > 0.05 | |
| 尾鳍条 | 18.14±1.15(17~20) | 19.40±1.16(17~21) | 18.88±1.31(17~21) | P < 0.01** | |
| 体侧纵列鳞 | 28.52±0.60(27~29) | 28.50±0.73(27~30) | 28.51±0.67(27~30) | P > 0.05 | |
| 可 量 性 状 |
体长/mm | 20.27±2.20 | 20.28±1.72 | 20.28±1.91 | P > 0.05 |
| 体长/体高 | 4.33±0.17 | 3.95±0.16 | 4.11±0.25 | P < 0.01** | |
| 体长/背鳍-吻端△ | 1.24±0.02 | 1.22±0.01 | 1.23±0.02 | P < 0.01** | |
| 体长/臀鳍始点-吻端 | 1.73±0.05 | 1.64±0.05 | 1.67±0.07 | P < 0.01** | |
| 体长/肛门-吻端 | 1.78±0.05 | 1.70±0.04 | 1.74±0.06 | P < 0.01** | |
| 体长/头长 | 3.89±0.15 | 4.00±0.15 | 3.96±0.16 | P < 0.05* | |
| 头长/吻长 | 4.16±0.21 | 4.14±0.28 | 4.15±0.25 | P > 0.05 | |
| 头长/眼径 | 2.72±0.18 | 2.81±0.16 | 2.77±0.17 | P > 0.05 | |
| 头长/眼间距 | 3.89±0.38 | 3.82±0.30 | 3.85±0.33 | P > 0.05 | |
| 头长/口宽 | 2.68±0.13 | 2.55±0.14 | 2.60±0.15 | P < 0.01** | |
| 头长/最长背鳍条 | 1.19±0.08 | 1.58±0.12 | 1.42±0.22 | P < 0.01** | |
| 头长/最长臀鳍条 | 1.38±0.14 | 1.67±0.10 | 1.57±0.19 | P < 0.01** | |
| 头长/胸鳍长 | 1.24±0.07 | 1.22±0.17 | 1.23±0.10 | P > 0.05 | |
| 头长/腹鳍长 | 2.06±0.10 | 1.79±0.13 | 1.90±0.18 | P < 0.01** | |
| 头长/尾鳍长 | 1.05±0.04 | 1.06±0.05 | 1.05±0.04 | P > 0.05 | |
| 头长/尾柄长 | 2.33±0.20 | 2.39±0.16 | 2.36±0.18 | P > 0.05 | |
| 尾柄长/尾柄高 | 1.04±0.10 | 1.02±0.07 | 1.03±0.08 | P > 0.05 | |
| 注:括号内为数值变动范围;*统计结果在雌雄鱼间差异有统计学意义(P < 0.05),* *统计结果在雌雄鱼间差异有高度统计学意义(P < 0.01);△背鳍-吻端/体长雄鱼为(80.9±1.3)%,雌鱼为(82.2±1.0)%,全部为(81.6±1.3)%。 Notes:the number in brackets is the range of data variation.* there is a significant difference (P < 0.05) and and * * there is an extremely significant difference between genders of Oryzias curvinotus (P < 0.01);△ the ratio of pre-dorsal length/standard length in O. curvinotus is (81.6±1.3)% in total and are (80.9±1.3)% and (82.2±1.0)% in male and female fish respectively. | |||||
可量性状(表 1):体长20.28 mm±1.91 mm,变动范围15.82~24.55 mm,为体高的(4.11±0.25) 倍(3.68~4.56倍),为背鳍-吻端的(1.23±0.02) 倍(1.19~1.26倍),为臀鳍始点-吻端的(1.67 ± 0.07) 倍(1.48~1.82倍),为肛门-吻端的(1.74 ± 0.06) 倍(1.63~1.86倍),为头长的(3.96±0.16) 倍(3.56~4.29倍)。头长为吻长的(4.15±0.25) 倍(3.65~4.70倍),为眼径的(2.77 ± 0.17) 倍(2.42~3.24倍),为眼间距的(3.85±0.33) 倍(2.88~4.55倍),为口宽的(2.60±0.15) 倍(2.27~3.02倍),为最长背鳍条的(1.42±0.22) 倍(1.03~1.92倍),为最长臀鳍条的(1.57 ± 0.19) 倍(1.16~1.95倍),为胸鳍长的(1.23±0.10) 倍(1.02~1.43倍),为腹鳍长的(1.90±0.18) 倍(1.58~2.26倍),为尾鳍长的(1.05±0.04) 倍(0.096~1.14倍),为尾柄长的(2.36±0.18) 倍(2.09~2.99倍)。尾柄长为尾柄高的(1.03±0.08) 倍(0.73~1.22倍)。
雄鱼。体长20.27 mm±2.20 mm,变动范围16.32~24.55 mm,为体高的(4.33±0.17) 倍(4.02~4.56倍),为背鳍-吻端的(1.24±0.02) 倍(1.19~1.26倍),为臀鳍始点-吻端的(1.73 ± 0.05) 倍(1.63~1.82倍),为肛门-吻端的(1.78±0.05) 倍(1.70~1.86倍),为头长的(3.89±0.15) 倍(3.67~4.15倍)。头长为吻长的(4.16 ± 0.21) 倍(3.71~4.52倍),为眼径的(2.72±0.18) 倍(2.42~3.07倍),为眼间距的(3.89±0.38) 倍(2.88~4.54倍),为口宽的(2.68±0.13) 倍(2.40~2.88倍),为最长背鳍条的(1.19±0.08) 倍(1.03~1.34倍),为最长臀鳍条的(1.38±0.14) 倍(1.16~1.65倍),为胸鳍长的(1.24±0.07) 倍(1.15~1.43倍),为腹鳍长的(2.06±0.10) 倍(1.87~2.26倍),为尾鳍长的(1.05±0.04) 倍(0.98~1.14倍),为尾柄长的(2.33±0.20) 倍(2.11~2.99倍)。尾柄长为尾柄高的(1.04±0.10) 倍(0.73~1.22倍)。
雌鱼。体长20.28 mm±1.72 mm,变动范围15.82~22.78 mm,为体高的(3.95±0.16) 倍(3.68~4.25倍),为背鳍-吻端的(1.22±0.01) 倍(1.19~1.26倍),为臀鳍始点-吻端的(1.64±0.05) 倍(1.48~1.72倍),为肛门-吻端的(1.70±0.04) 倍(1.63~1.79倍),为头长的(4.00±0.15) 倍(3.56~4.29倍)。头长为吻长的(4.14±0.28) 倍(3.65~4.70倍),为眼径的(2.81±0.16) 倍(2.53~3.24倍),为眼间距的(3.82±0.30) 倍(3.33~4.55倍),为口宽的(2.55±0.14) 倍(2.27~23.02倍),为最长背鳍条的(1.58±0.12) 倍(1.30~1.92倍),为最长臀鳍条的(1.67±0.10) 倍(1.16~1.95倍),为胸鳍长的(1.22±0.17) 倍(1.02~1.45倍),为腹鳍长的(1.79±0.13) 倍(1.58~2.15倍),为尾鳍长的(1.06±0.05) 倍(0.96~1.14倍),为尾柄长的(2.39±0.16) 倍(2.09~2.75倍)。尾柄长为尾柄高的(1.02±0.07) 倍(0.90~1.15倍)。
2.2 雌雄形态性状差异 2.2.1 单因素方差分析在部分传统分类性状上,雌雄弓背青鳉间差异有统计学意义(表 1)。进一步利用主成分分析也显示了两者间的形态性状分离。
2.2.2 主成分分析分析结果显示,在57组参与分析比例参数中共提取出14个主成分,它们对总变异的累积贡献率为84.455%。其中前4个主成分对种群间形态差异的贡献率分别为:PC1=31.637%、PC2=10.269%、PC3=6.889%、PC4=5.884%,累积贡献率为64.679%。
PC1中体长/EH(0.901,EH为图 1中框架性状测量点E到H的长度;下同)、体长/FH(0.868)、体长/肛门-吻端(0.839)、体长/GH(0.834)、体长/臀鳍始点-吻端(0.830)、体长/DH(0.806)、头长/腹鳍长(0.800)、体长/体高(0.775)、体长/EG(0.729)、体长/CF(0.711) 等10个比例性状参数对PC1有主要贡献(> 0.700);PC2中体长/CI(0.764)、体长/DI(0.734) 比例性状参数对PC2有主要贡献(> 0.700)。弓背青鳉雌雄两者在PC1轴方向明显分离(图 3)。

|
| 图 3 主成分PC1对PC2散点图 Fig. 3 Scatter plot for PC1 vs. PC2 |
| |
本文应用判别分析统计方法的主要目的是分析雌雄弓背青鳉是否存在差异及能否准确区分,故省略了判别函数表达式的表述,只呈现判别结果及判别效果检验。分析结果显示,雌雄鱼间的判别函数组质心分别为12.096和-17.280,距离较远,两者分离显著。所建立的判别函数对原始分组案例中样品正确判别率均为100.0%,交叉验证分组案例的正确率为54.9%。
3 讨论过去对弓背青鳉的分类及相关研究主要是国外,尤其是日本。据Uwa和Parenti(1988)的记述,先后有Oshima(1926)、Nichols和Pope(1927)、Harada (1943)等对其种名确定及形态性状描述的有争论。Nichols和Pope(1927)作为弓背青鳉的定名者,对我国海南岛模式标本产地那大地区个体部分性状如臀鳍条数目的描述存在重要错误,但对该种的定种关键特征的记述是有效的。例如,弓背青鳉区别于其他青鳉鱼类的关键特征之一是背鳍位置明显靠后,导致外观上背部呈隆起状,故称为“弓背”或“曲背”青鳉,背鳍-吻端/体长为80%~82%,而其他青鳉鱼类一般为77%~79%(Uwa & Parenti,1988),该特征在本检测种群为81.6%±1.3%,与之相符;第二特征为雄鱼臀鳍展开为平行四边形,与其他物种的三角形显著区分(Parenti,2008),本文检测种群与之相符。因此,从形态特征上可以确认本文所描述种群为弓背青鳉种群。而对于臀鳍条数目问题,Nichols和Pope(1927)的小失误引起了后来的系列问题。由于早期分类中臀鳍条数目是青鳉鱼类一个重要的分类检索性状,弓背青鳉与日本青鳉臀鳍条的数目十分相似,故Harada(1943)将采自海南的青鳉记述为日本青鳉,后来Uwa和Parenti(1988)检视了日本学者早期在海南岛采集到的青鳉标本后确定为弓背青鳉,并指出Nichols和Pope(1927)将其臀鳍条数目记述为25可能是误记。日本学者很早就在海南岛(那大及嘉积)采集到青鳉,但将之鉴定为日本青鳉,后来Nichols和Pope(1927)根据该地青鳉背鳍位置明显靠后的特点区别于当时已知的数种青鳉鱼类而定出弓背青鳉,且作为青鳉属下一个亚属,种名Aplocheilus curvinotus。弓背青鳉的基本分类性状描述在Uwa和Parenti(1988)后已经得到澄清,并且种的有效性得到细胞生物学(Uwa et al., 1982;Uwa,1991)及基础生物学研究(Hamaguchi & Sakaizumi,1992;Sakaizumi et al., 1992)的支持。近代以来,海南岛淡水鱼类栖息生境由于食蚊鱼广泛入侵及近代急速城镇化而被严重破坏,那大地区仍存有青鳉鱼类种群可能性不大,这也可能是《中国动物志硬骨鱼纲鳉形目》著者未能以实际标本进行描述的关键原因。本文所检视的广州南沙岛区域数个现存弓背青鳉种群,可以作为重建弓背青鳉模式标本、副模标本或者等模式标本候选。
在近代,Uwa和Parenti(1988)对中国广大区域的青鳉鱼类进行过采集,当时是以对东亚区域日本青鳉与弓背青鳉形态与遗传差异为研究目的,发现中国所产“日本青鳉”与日本所产日本青鳉形态上存在许多差别,是确定中华青鳉O. sinensis为青鳉属新种的关键(Uwa et al., 1988;陈银瑞等,1989)。在该文,作者使用了采集自广东广州、东莞太平、广西梧州、香港以及海南岛的标本,明确认定为弓背青鳉,由于该文没有标注采集时间及具体地点,笔者尚无法重新检视上述区域的青鳉鱼类样品。在关键分类指标臀鳍条数目上,本文所采集弓背青鳉样品为19.60±0.80(19~22),与Uwa和Parenti(1988)所记述的采集自广州(平均值19,变化区间19,n=3;下同)、太平(20,18~21,n=9)、梧州(18,16~19,n=32)、香港(20,18~21,n=12)、海南岛(19,18~20,n=29) 以及越南河内(19,18~19,n=3) 等地弓背青鳉样品基本相似(表 2)。同时,本文明确证实了弓背青鳉间存在着雌雄异形现象。目前,弓背青鳉已知分布区域主要为我国华南地区以及国外的越南(Uwa & Parenti,1988;Kottelat,2001;Hayakawa et al., 2015),另有部分人工养殖种群主要存在于日本、泰国(Termvidchakorn & Magtoon,2012)等若干科研机构。日本人工养殖种群种源来自于中国香港,由日本青鳉鱼类学者Uwa Hrioshi在1991年所采集(Uwa,1991),已被广泛用于发育生物学、遗传学、毒理学等方面研究(Hamaguchi & Sakaizumi,1992;Sakaizumi et al., 1992;Shinomiya et al., 2006)。
| 指标 Characteristics |
资料来源Reference | |||||||
| Uwa & Parenti(1988) | Parenti(2008) | 本文This paper | ||||||
| 广州(n=3) | 太平(n=9) | 梧州(n=32) | 香港(n=12) | 海南岛(n=29) | 河内(n=3) | 地点不明 | 南沙岛(n=51) | |
| 体长/mm | 24.7 | 20.8±2.7 | 21.4±2.3 | 24.3±1.7 | 18.0±1.9 | 18.3 | — | 20.28±1.91 |
| 背鳍条 | 6(6) | 6(6) | 6(6~7) | 5(5~7) | 6(5~6) | 6(6) | (5~6) | 6.04±0.20(6~7) |
| 臀鳍条 | 19(19) | 20(18~21) | 18(16~19) | 20(18~21) | 19(18~20) | 19(18~19) | (17~20) | 19.60±0.80(19~22) |
| 胸鳍条 | — | — | — | — | — | — | — | 8.69±0.47(8~9) |
| 腹鳍条 | — | — | — | — | — | — | — | 6.00±0.00(6) |
| 尾鳍条 | — | — | — | — | — | — | — | 18.88±1.31(17~21) |
| 体侧纵列鳞 | — | — | — | — | — | — | (27~28) | 28.51±0.67(27~30) |
特别值得注意的是,和其他青鳉鱼类如中华青鳉等相似(陈银瑞等,1989;陈国柱,2016),弓背青鳉正面临食蚊鱼入侵的严重威胁。笔者在对中华青鳉滇池周边种群的研究中,明确观察到其模式标本产地中最大局部种群在数年内由于食蚊鱼入侵而导致完全灭绝的过程。Dudgeon(1996)指出香港地区的弓背青鳉种群由于食蚊鱼的入侵而严重下降,仅在食蚊鱼尚未入侵区域残存部分种群。本文在采集弓背青鳉的样地中也同时采集到了大量的食蚊鱼个体,并发现食蚊鱼个体数量较多区域的弓背青鳉数量明显较少。近代以来,食蚊鱼在我国已形成广泛入侵,弓背青鳉现存种群仅呈点状分布,当前亟待加强其保护生物学研究并应采取有力的保护措施尽早对现存种群进行有效保护。
| 陈国柱. 2016. 八线腹链蛇食物分析及其对中华青鳉的捕食[J]. 四川动物, 35(4): 588–592. DOI:10.11984/j.issn.1000-7083.20160093 |
| 陈银瑞, 宇和纮, 褚新洛. 1989. 云南青鳉鱼类的分类和分布:鳉形目:青鳉科[J]. 动物分类学报, 14(2): 239–246. |
| 贾银涛, 陈毅峰, 陶捐, 等. 2013. 增江鱼类群落特征及其历史变化[J]. 资源科学, 35(7): 1490–1498. |
| 林小涛, 张洁. 2013. 东江鱼类生态及原色图谱[M]. 北京: 中国环境出版社: 91. |
| 潘炯华, 刘成汉, 郑文彪. 1984. 广东北江鱼类区系研究[J]. 华南师范大学学报(自然科学版), 1: 27–40. |
| 赵俊, 易祖盛, 周先叶, 等. 2010. 广州水生动植物本底资源[M]. 北京: 科学出版社: 190. |
| Asai T, Senou H, Hosoya K. 2011. Oryzias sakaizumii, a new ricefish from northern Japan (Teleostei:Adrianichthyidae)[J]. Ichthyological Exploration of Freshwaters, 22(4): 289–299. |
| Dudgeon D. 1996. Anthropogenic influences on Hong Kong streams[J]. Geojournal, 40(1-2): 53–61. |
| Hamaguchi S, Sakaizumi M. 1992. Sexually differentiated mechanisms of sterility in interspecific hybrids between Oryzias latipes and O. curvinotus[J]. Journal of Experimental Zoology Part A:Ecological Genetics and Physiology, 263(3): 323–329. |
| Hayakawa H, Le QD, Kinoshita M, et al. 2015. Genetic similarity of the Hainan medaka populations collected from hyper-and hypo-osmotic environments in northern Vietnam[J]. Ocean Science Journal, 50(2): 231–235. DOI:10.1007/s12601-015-0020-6 |
| Harada I. 1943. The freshwater fishes of Hainan[J]. Special Service Agency, Hairan Admjnistration, 2: 1–114. |
| Herder F, Chapuis S. 2010. Oryzias hadiatyae, a new species of ricefish (Atherinomorpha:Beloniformes:Adrianichthyidae) endemic to Lake Masapi, central Sulawesi, Indonesia[J]. The Raffles Bulletin of Zoology, 58(2): 269–280. |
| Herder F, Hadiaty RK, Nolte AW. 2012. Pelvic-fin brooding in a new species of riverine ricefish (Atherinomorpha:Beloniformes:Adrianichthyidae) from Tana Toraja, central Sulawesi, Indonesia[J]. The Raffles Bulletin of Zoology, 60(2): 467–476. |
| Kottelat M. 2001. Freshwater fishes of northern Vietnam:a preliminary check-list of the fishes known or expected to occur in northern Vietnam with comments on systematics and nomenclature[C]. Environment and Social Development Unit, East Asia and Pacific Region. The World Bank. Freshwater Fish:56. |
| Magtoon W. 2010. Oryzias songkhramensis, a new species of ricefish (Beloniformes; Adrianichthyidae) from northeast Thailand and central Laos[J]. Tropical Natural History, 10(1): 107–129. |
| Mokodongan DF, Tanaka R, Yamahira K. 2014. A new ricefish of the genus Oryzias (Beloniformes, Adrianichthyidae) from Lake Tiu, central Sulawesi, Indonesia[J]. Copeia, 2014(3): 561–567. DOI:10.1643/CI-13-081 |
| Nichols JT, Pope CH. 1927. The fishes of Hainan[J]. Bulletion of the American Museum of Natural History, 54: 321–394. |
| Oshima M. 1926. Notes on a colletion of fishes from Hainan, obtained by professor S. F. Licht, 1926[J]. Annotationes Zoologicae Japonenses, 11(1): 1–25. |
| Parenti LR. 2008. A phylogenetic analysis and taxonomic revision of ricefishes, Oryzias and relatives (Beloniformes, Adrianichthyidae)[J]. Zoological Journal of the Linnean Society, 154(3): 494–610. DOI:10.1111/zoj.2008.154.issue-3 |
| Parenti LR, Hadiaty RK. 2010. A new, remarkably colorful, small ricefish of the genus Oryzias (Beloniformes, Adrianichthyidae) from Sulawesi, Indonesia[J]. Copeia(2): 268–273. |
| Parenti LR, Hadiaty RK, Lumbantobing D, et al. 2013. Two new ricefishes of the genus Oryzias (Atherinomorpha:Beloniformes:Adrianichthyidae) augment the endemic freshwater fish fauna of southeastern Sulawesi, Indonesia[J]. Copeia(3): 403–414. |
| Sakaizumi M, Shimizu Y, Hamaguchi S. 1992. Electrophoretic studies of meiotic segregation in inter-and intraspecific hybrids among east Asian species of the genus Oryzias (Pisces:Oryziatidae)[J]. Journal of Experimental Zoology Part A:Ecological Genetics and Physiology, 264(1): 85–92. |
| Shinomiya A, Kato M, Yaezawa M, et al. 2006. Interspecific hybridization between Oryzias latipes and Oryzias curvinotus causes XY sex reversal[J]. Journal of Experimental Zoology Part A:Ecological Genetics and Physiology, 305(10): 890–896. |
| Termvidchakorn A, Magtoon W. 2012. Development and identification of three species of Thai ricefish, Oryzias, in the Mekong Basin[J]. Tropical Natural History, 12(1): 75–88. |
| Uwa H. 1991. Cytosystematic study of the Hainan medaka, Oryzias curvinotus, from Hong Kong (Teleostei:Oryziidae)[J]. Ichthyological Exploration of Freshwaters(1): 361–367. |
| Uwa H, Parenti LR. 1988. Morphometric and meristic variation in ricefishes, genus Oryzias:a comparison with cytogenetic data[J]. Japanese Journal of Ichthyology, 35(2): 159–166. |
| Uwa H, Tanaka K, Formacion MJ. 1982. Karyotype and banding analyses of the Hainan medaka, Oryzias curvinotus (Pisces)[J]. Chromosome Inform Service(33): 15–17. |
| Uwa H, Wang RF, Chen YR. 1988. Karyotypes and geographical distribution of ricefishes from Yunnan, southwestern China[J]. Japanese Journal of Ichthyology, 35(3): 332–340. |
| Wang Z, Long S, Liao J, et al. 2017. Complete mitogenome of Hainan medaka Oryzias curvinotus (Teleostei:Beloniformes) and transcriptional differences between male and female liver[J]. Mitochondrial DNA Part B, 2(1): 157–158. DOI:10.1080/23802359.2017.1303340 |
 2017, Vol. 36
2017, Vol. 36




