扩展功能
文章信息
- 王昱
- WANG Yu
- 油橄榄叶提取物对大鼠酒精性脂肪肝的保护作用
- Protective Effects of Olive Leaf Extract on Alcohol Hepatic in Rats
- 四川动物, 2017, 36(5): 557-562
- Sichuan Journal of Zoology, 2017, 36(5): 557-562
- 10.11984/j.issn.1000-7083.20170034
-
文章历史
- 收稿日期: 2017-02-07
- 接受日期: 2017-04-10
脂肪变性是酒精性肝病最早和最常出现的损伤形式,长期酗酒者约90%以上可发展成脂肪肝,若不加重视,可在短期内发展为不可逆的肝损伤。研究表明,发生酒精性脂肪肝后,肝细胞肿大压迫肝血窦造成窦间隙变窄,使肝细胞缺氧,长时间就会导致肝细胞变性和坏死,并促进肝纤维化的发生(祁瑞瑞,2012)。然而,由于酒精性脂肪肝的发病机制尚未完全明确,目前针对酒精性脂肪肝仍缺少有效的靶向治疗方法。
油橄榄叶提取物(olive leaf extract,OLE)是从油橄榄叶中提取,主要成分为黄酮类和萜类内酯化合物,有降血糖、抗高血压及抗微生物作用,还有促进骨骼钙化、防治骨质疏松、预防钙质流失等作用(Goulas et al., 2010;Kontogianni & Gerothanassis,2012;Turkez et al., 2012;王昱,2014)。近年来,药理研究发现其具有很好的抗氧化、降血脂、排铅等作用(Esmaeili-Mahani et al., 2010;Kaeidi et al., 2011;王昱,2013;Wang et al., 2013)。然而,油橄榄叶提取物抑制酒精性肝损伤的作用尚未有报道。因此,本研究拟以乙醇诱导大鼠建立肝损伤模型,从抗氧化能力、炎症反应、脂代谢调控因子变化等方面,探讨油橄榄叶提取物对酒精性肝损伤大鼠的保护作用及作用机制。
1 材料与方法 1.1 材料OLE由陇南田园油橄榄科技开发有限公司提供;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽还原酶(glutathione reductase,GR)和丙二醛(malondialdehyde,MDA)试剂盒(南京建成生物工程研究所);肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1(interleukin-1β,IL-1β)试剂盒(武汉博士德生物工程研究所)。U-1800型UV-VIS全自动分光光度计(日本Tokyo),SpectraMax M5型酶标仪(Molecular Devices,美国),BS-300型全自动生化分析仪(深圳迈瑞);FX-35WA型Olympus显微镜(Japan);TGL-16M型高速台式冷冻离心机(Beckman美国);兔抗鼠固醇调节元件结合蛋白-1c(sterol regulatory element-binding protein 1c,SREBP-1c)多克隆抗体、免疫组织化学试剂盒和DAB(北京中杉金桥生物技术有限公司);50只健康雄性SD大鼠,SPF级,购于兰州大学实验动物中心,许可证号:SCXK(甘)2005-0007,体质量200~250 g。
1.2 方法 1.2.1 动物模型的建立与给药50只大鼠随机分为5组,即正常组、模型组、OLE低剂量组(Ⅰ组)、OLE中剂量组(Ⅱ组)和OLE高剂量组(Ⅲ组),每组10只。参照文献(赵赶等,2015),除正常组外,其他各组采用剂量递增法灌胃乙醇:1~4周5.0 g·kg-1,5~8周7.0 g·kg-1,9~12周9.0 g·kg-1,13~24周9.5 g·kg-1,每日1次。造模同时,Ⅰ、Ⅱ、Ⅲ组分别灌胃250 mg·kg-1、500 mg·kg-1、1 000 mg·kg-1OLE,每日1次,连续24周。
1.2.2 血生化指标测定各组大鼠均乙醚麻醉,摘眼球采血,以3 000 r·min-1离心10 min,分离血清,用全自动生化分析仪测定谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)水平,用甘油三酯试剂盒提供的磷酸甘油氧化酶-PAP酶法测定甘油三酯(triglyceride,TG)活性,用总胆固醇试剂盒提供的胆固醇氧化酶-PAP酶法测定总胆固醇(total cholesterol,TC)活性。
1.2.3 酶活性测定末次给药后,取大鼠肝脏,用预冷的生理盐水洗净血液,滤纸吸干,精确称量、匀浆、3 000 r·min-1离心10 min,按试剂盒的操作要求测定肝脏SOD、CAT、GR的活性及MDA含量。
1.2.4 炎症因子检测末次给药后,迅速取肝,洗净、冰浴匀浆,3 000 r·min-1离心15 min,取上清液,采用放射免疫法中的液相竞争法和平衡法测定肝组织TNF-α、IL-1β含量,按照检测试剂盒说明书操作。
1.2.5 免疫组织化学免疫组化SP法(链霉菌抗生物素蛋白-过氧化物酶连结法)。末次给药后,取大鼠肝脏数块置于4%多聚甲醛固定,经脱水、石蜡包埋后冠状位切片,厚6 μm。脱蜡、抗原修复后,用3%H2O2室温孵育10 min,正常兔血清室温封闭30 min,然后用兔抗鼠SREBP-1c多克隆抗体(1: 200),4 ℃孵育过夜;次日取出切片以PBS冲洗后,再依次滴加生物素化羊抗兔IgG孵育30 min,SABC工作液孵育30 min,最后DAB显色,苏木素复染,空白对照以PBS代替一抗。常规乙醇脱水、二甲苯透明、中性树胶封片,在显微镜下观察并拍照。
1.2.6 组织学观察在肝左叶同部位取小块肝组织,用预冷的生理盐水冲洗干净,迅速投入15%的中性福尔马林溶液固定24 h,常规石蜡包埋切片(6 μm),苏木精-伊红染色,在光学显微镜下观察并拍照。
1.2.7 数据处理所有数据以x±s表示,用SPSS 13.0进行单因素方差分析,P < 0.05表示差异有统计学意义。
2 结果 2.1 OLE对大鼠血清ALT、AST、TG、TC水平的影响与正常组相比,模型组大鼠血清ALT、AST、TG、TC水平升高(P < 0.05,P < 0.01),而OLE治疗后,大鼠血清ALT、AST、TG、TC水平明显降低(P < 0.05,P < 0.01),且呈剂量依赖性,即OLE浓度越高,抑制作用越明显(图 1)。
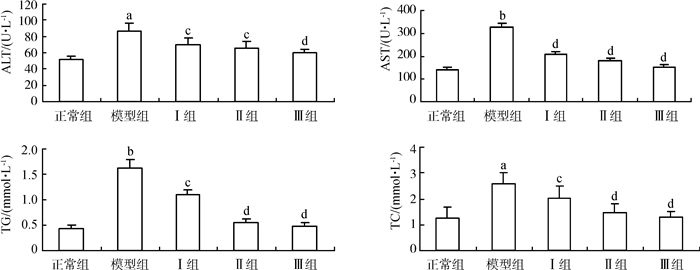
|
| 图 1 OLE对大鼠血清ALT、AST、TG、TC水平的影响 Fig. 1 Effect of OLE on the levels of ALT, AST, TG and TC in the serum of rats 模型组与正常组比较comparison between the model group and control group,a. P < 0.05,b. P < 0.01;治疗组与模型组比较comparison between the OLE treated groups and model group,c. P < 0.05,d. P < 0.01;下同,the same below. |
| |
与正常组相比,模型组大鼠肝TNF-α、IL-1β含量显著升高(P < 0.05),而OLE治疗后大鼠肝TNF-α、IL-1β含量极显著降低(P < 0.01),且呈剂量依赖性(图 2)。

|
| 图 2 OLE对大鼠肝TNF-α、IL-1β含量的影响 Fig. 2 Effect of OLE on the contents of liver TNF-α and IL-1β in rats |
| |
与正常组相比,模型组大鼠肝组织SOD、CAT、GR活性显著降低(P < 0.01),MDA含量极显著增高(P < 0.01),而OLE治疗后肝组织SOD、CAT、GR活性显著升高(P < 0.05,P < 0.01),MDA含量显著降低(P < 0.05,P < 0.01),且呈剂量依赖性(图 3)。
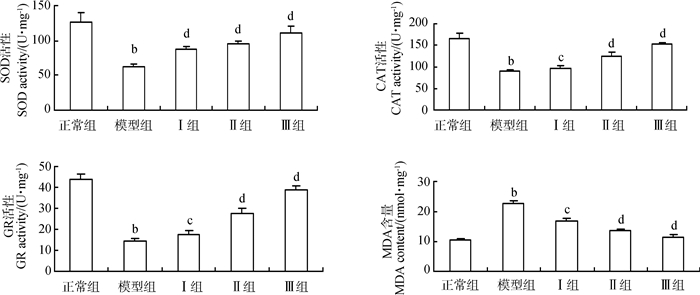
|
| 图 3 OLE对大鼠肝组织SOD、CAT、GR活性及MDA含量的影响 Fig. 3 Effect of OLE on the liver SOD, CAT, GR activities and MDA content in rats |
| |
免疫组织化学显示:SREBP-1c在各实验组大鼠肝脏中都有不同程度的阳性表达,阳性表达部位被染成棕黄色,阴性对照组无SREBP-1c阳性表达(图 4)。与正常组相比,模型组大鼠肝脏SREBP-1c的表达水平增强、阳性细胞数增加(P < 0.01)。各给药组与模型组比较,大鼠肝脏SREBP-1c的表达减弱、阳性细胞数减少(P < 0.05,P < 0.01;图 5)。
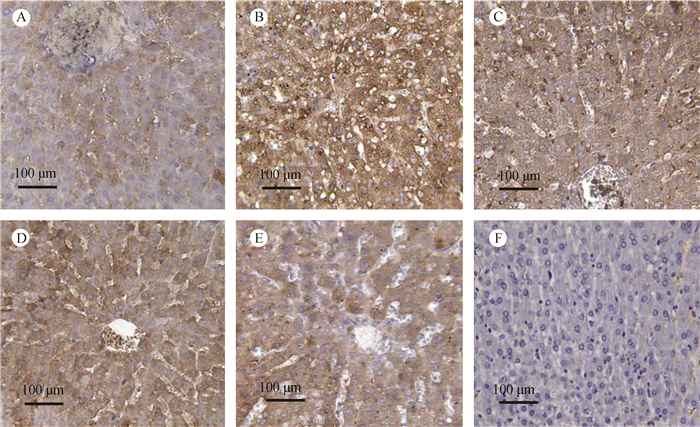
|
| 图 4 SREBP-1c在大鼠肝脏的表达 Fig. 4 SREBP-1c expression in rats liver A.正常组,B.模型组,C. Ⅰ组,D. Ⅱ组,E. Ⅲ组,F.阴性对照。 A. control group, B. model group, C. group Ⅰ, D. group Ⅱ, E. group Ⅲ, F. negative comparison. |
| |
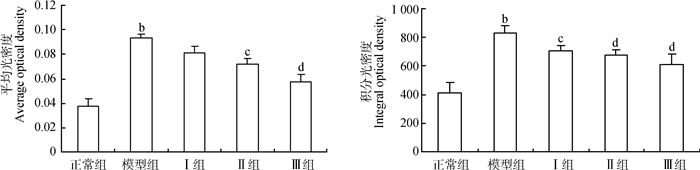
|
| 图 5 各组大鼠肝脏SREBP-1c表达的比较 Fig. 5 Comparison of SREBP-1c expression in rats liver among the groups |
| |
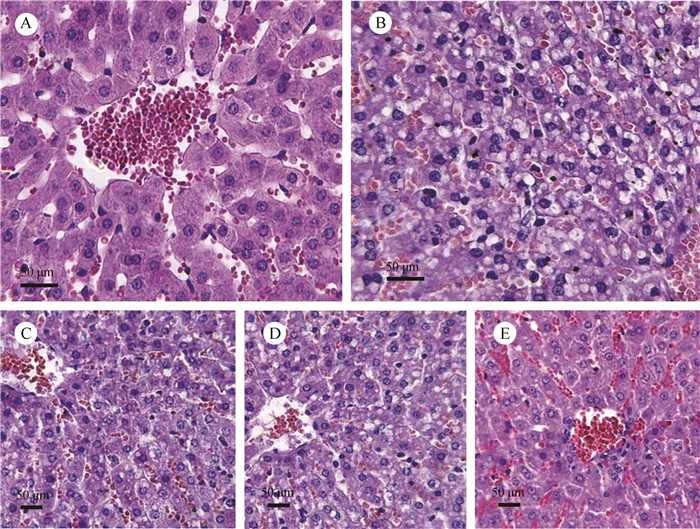
正常组大鼠肝细胞结构正常,无脂质空泡。模型组大鼠肝组织中出现弥漫性的脂质空泡,肝细胞肿大、排列紊乱,胞浆内挤满了小脂泡,肝小叶不清。Ⅰ、Ⅱ、Ⅲ治疗组大鼠肝组织脂变情况均有一定程度的减轻,且呈明显的剂量依赖性(图 6)。
|
| 图 6 OLE对大鼠肝组织病理学影响 Fig. 6 Effect of OLE on the hepatic histopathology in rats A.正常组,B.模型组,C. Ⅰ组,D. Ⅱ组,E. Ⅲ组。 A. control group, B. model group, C. group Ⅰ, D. group Ⅱ, E. group Ⅲ. |
| |
酒精性肝损伤是由于长期过度饮酒,使肝细胞反复发生脂肪变性、坏死和再生所引起的一种疾病(赵赶等,2015),具有可逆性,这为临床及时治疗提供了重要依据。关于酒精性肝损伤的发病机制,近年来的研究表明,细胞因子、自由基损害等在酒精性肝损伤发病机制中起重要作用。目前,在治疗方面以戒酒、营养支持为主,其他试用药物均不理想,且大多有副作用,故本研究采用OLE来探讨其对酒精性肝损伤的保护作用。
脂肪肝最主要的特征是肝细胞脂肪沉积,肝脂含量是观察脂肪性肝病发展的一个重要指标,而临床上脂肪肝患者的血脂异常主要表现为TG、TC水平的升高(Tannapfel & Flott-Rahmel,2011)。长期饮酒会导致肝细胞发生损伤,肝细胞膜通透性增加及线粒体损伤,大量的血清标志物酶ALT和AST释放入血,致使血中ALT和AST水平升高(吕元,2004;彭文锋,钟政永,2011)。研究表明,正常肝内转氨酶含量约为血中的100倍,1%的肝特异性细胞坏死即可使血清酶活性增加1倍(Stranges et al., 2004)。因此,转氨酶是肝细胞受损的敏感标志,对血清酶的检测有助于判断脂肪肝是否已并发脂肪性肝炎(中华医学会肝病学分会脂肪肝和酒精性肝病学组,2010)。SOD广泛存在于机体细胞中,可以使自由基经过歧化而被清除,使机体免受自由基的损伤。CAT存在于红细胞及某些组织细胞的微体中,催化H2O2转化为H2O和O2,H2O2不能在膜外与Fe2+或Cu2+反应生成OH-自由基,使其失去活性氧的作用,保护机体。GR的作用是将氧化型的谷胱甘肽还原成还原型的谷胱甘肽,参与自由基和脂类过氧化物损伤的防护。MDA是超氧化物阴离子自由基作用于生物膜磷脂结构不饱和脂肪酸所形成的终产物之一,机体组织MDA含量可间接反映机体细胞受自由基攻击的严重程度(Rump et al., 2010;Nassir & Ibdah,2014)。酒精等异物打破肝脏氧化与抗氧化平衡,引起氧化应激反应,促使肝细胞中的氧化剂耗尽或失活,最终导致细胞坏死或凋亡。除了氧化损伤,细胞因子的代谢异常也是酒精性肝病的一大特点,如致炎症因子TNF-α、IL-1β等的大量表达(Neri et al., 2010)。
SREBP是一种重要的脂代谢调控因子,该蛋白属于碱性螺旋-环-螺旋-亮氨酸链转录因子,有3种异构体,分别为SREBP-1a、SREBP-1c及SREBP-2,其中SREBP-1c在人和鼠组织表达部位相近,尤其在肝脏中有高水平的表达,在脂肪肝的形成中起重要作用(祁瑞瑞,2012)。研究表明,乙醇可上调SREBP-1c的过度表达,促进脂肪酸的合成,从而加重甘油三酯在肝脏内的蓄积(蒲鹏,2016)。
本实验观察到,模型组大鼠肝组织TNF-α、IL-1β、MDA、SREBP-1c及血清ALT、AST、TG和TC水平显著增加,SOD、CAT、GR水平降低。经OLE治疗后,肝组织TNF-α、IL-1β、MDA、SREBP-1c及血清ALT、AST、TG和TC水平显著降低,SOD、CAT、GR水平显著升高。这提示OLE能改善肝功能,清除肝损伤大鼠体内氧自由基,下调肝组织中的炎症介质TNF-α、IL-1β的表达,抑制SREBP-1c水平,减轻肝组织脂肪变性程度,从而起到保护肝的作用。
综上所述,OLE能有效减轻肝组织的病理损伤,对慢性酒精性肝损伤有显著的保护作用,其机制可能与提高肝组织的抗氧化能力、缓解炎症因子反应及抑制SREBP-1c表达有关。本研究初步证实,OLE作为一种天然产物,可作为预防和治疗肝损伤、肝纤维化的一种有潜在价值的药物,值得更进一步的开发研究。
| 吕元. 2004. 临床实验诊断学[M]. 上海: 上海科学技术出版社: 44-47. |
| 彭文锋, 钟政永. 2011. ADA与ALT、AST、GGT联合检测在肝脏疾病诊断中的意义[J]. 当代医学, 17(9): 4–5. |
| 蒲鹏. 2016. 橙皮苷改善肥胖小鼠糖脂代谢的机制研究[J]. 中国中药杂志, 41(17): 3290–3295. |
| 祁瑞瑞. 2012. 马齿苋提取物对大鼠酒精性脂肪肝的预防作用及机制探讨[D]. 上海: 第二军医大学: 2-3. http://cdmd.cnki.com.cn/Article/CDMD-90024-1012404776.htm |
| 王昱. 2013. 油橄榄叶提取物对铅中毒小鼠视网膜组织结构及抗氧化能力的影响[J]. 四川动物, 32(3): 429–433. |
| 王昱. 2014. 油橄榄叶提取物联合美沙酮对海洛因成瘾大鼠肾功能及活性物质的影响[J]. 四川动物, 33(6): 912–917. |
| 赵赶, 吕淑娟, 韦刚, 等. 2015. 委陵菜积雪草酸对大鼠酒精性肝损伤的保护作用[J]. 中国中药杂志, 40(14): 2866–2870. |
| 中华医学会肝病学分会脂肪肝和酒精性肝病学组. 2010. 酒精性肝病诊疗指南[J]. 中华肝脏病杂志, 18(3): 167–170. |
| Esmaeili-Mahani S, Rezaeezadeh-Roukerd M, Esmaeilpour K, et al. 2010. Olive (Olea europaea L.) leaf extract elicits antinociceptive activity, potentiates morphine analgesia and suppresses morphine hyperalgesia in rats[J]. Journal of Ethnopharmacology, 132(1): 200–205. DOI:10.1016/j.jep.2010.08.013 |
| Goulas V, Papoti VT, Exarchou V, et al. 2010. Contribution of falconoid to the overall radical scavenging activity of olive (Olea europaea L.) leaf polar extracts[J]. Journal of Agricultural & Food Chemistry, 58(6): 3303–3308. |
| Kaeidi A, Esmaeili-Mahani S, Sheibani V, et al. 2011. Olive (Olea europaea L.) leaf extract attenuates early diabetic neuropathic pain through prevention of high glucose-induced apoptosis:in vitro and in vivo studies[J]. Journal of Ethnopharmacology, 136(1): 188–196. DOI:10.1016/j.jep.2011.04.038 |
| Kontogianni VG, Gerothanassis IP. 2012. Phenolic compounds and antioxidant activity of olive leaf extracts[J]. Natural Product Research, 26(2): 186–189. DOI:10.1080/14786419.2011.582842 |
| Nassir F, Ibdah JA. 2014. Role of mitochondria in alcoholic liver disease[J]. World Journal of Gastroenterology, 20(9): 2136–2142. DOI:10.3748/wjg.v20.i9.2136 |
| Neri M, Bello S, Bonsignore A, et al. 2010. Myocardial expression of TNF-α, IL-1β, IL-6, IL-8, IL-10 and MCP-1 after a single MDMA dose administered in a rat model[J]. Current Pharmaceutical Biotechnology, 11(5): 413–420. DOI:10.2174/138920110791591517 |
| Rump TJ, Abdul Muneer PM, Szlachetka AM, et al. 2010. Acetyl-L-carnitine protects neuronal function from alcohol-induced oxidative damage in the brain[J]. Free Radical Biology and Medicine, 49(10): 1494–1504. DOI:10.1016/j.freeradbiomed.2010.08.011 |
| Stranges S, Dorn JM, Muti P, et al. 2004. Body fat distribution, relative weight, and liver enzyme levels:a population-based study[J]. Hepatology, 39(3): 754–763. DOI:10.1002/(ISSN)1527-3350 |
| Tannapfel A, Flott-Rahmel B. 2011. Histopathological diagnosis of non-alcoholic and alcoholic fatty liver disease[J]. Liver Biopsy in Modern Medicine: 13–34. |
| Turkez H, Togar B, Polat E. 2012. Olive leaf extract modulates permethrin induced genetic and oxidative damage in rats[J]. Cytotechnology, 64(4): 459–464. DOI:10.1007/s10616-011-9424-z |
| Wang Y, Wang SQ, Cui WH, et al. 2013. Olive leaf extract inhibits lead poisoning-induced brain injury[J]. Neural Regeneration Research, 8(22): 2021–2029. |
 2017, Vol. 36
2017, Vol. 36



