扩展功能
文章信息
- 刘岚, 陈燕, 李宁, 王大伟, 任飞, 宋英, 郭聪, 刘晓辉
- LIU Lan, CHEN Yan, LI Ning, WANG Dawei, REN Fei, SONG Ying, GUO Cong, LIU Xiaohui
- 布氏田鼠GnRH基因克隆及不同组织和发育阶段的基因表达特征
- Molecular Cloning, Tissue Distribution and Expression of GnRH Gene in Different Developmental Stages of Lasiopodomys brandtii
- 四川动物, 2017, 36(5): 498-506
- Sichuan Journal of Zoology, 2017, 36(5): 498-506
- 10.11984/j.issn.1000-7083.20170076
-
文章历史
- 收稿日期: 2017-03-11
- 接受日期: 2017-05-10
2. 中国农业科学院植物保护研究所, 中国农业科学院杂草鼠害生物学与治理重点开放实验室, 北京 100193
2. Key Laboratory of Weed and Rodent Biology and Management, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China
促性腺激素释放激素(gonadotropin releasing hormone,GnRH),又称促黄体激素释放激素(luteinizing hormone-releasing hormone,LH-RH)、卵泡刺激激素释放激素(follicle-stimulating hormone,FSH-RH),最早由Shally和Guillenmin从猪Sus scrofa domestica的下丘脑中分离出来,是下丘脑弓状核神经内分泌小细胞分泌产生的神经激素(Lincoln,1976;林浩然,2004)。随着对GnRH研究的逐渐深入,目前已经发现超过24种不同类型,每种类型都以其最早鉴别出来的动物命名(Amoss et al., 1971;Baba et al., 1971;叶丹等,2003)。除了章鱼的GnRH(octo GnRH),所有已鉴别的GnRH都是由10个氨基酸组成的相似结构。在已知GnRH的所有哺乳动物中,均具有相同的10个氨基酸的肽链,即COOH-pGlu-His-Tip-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH2,其中pGlu是末端含有1个磷酸基的谷氨酸(Gorbman & Sower,2004;Lethimonier et al., 2004)。
GnRH在下丘脑、垂体和多种组织中均有表达,在不同组织中有不同的生物学作用,比如在消化系统中调节胃壁细胞分泌胃酸,在胎盘中调节绒膜促性腺激素的分泌,但其最主要的生物学作用是参与促性腺激素释放的调控,形成“下丘脑-垂体-性腺”轴(hypothalamic-pituitary-gonad axis,HPG轴)对繁殖活性进行调控(Belchetz et al., 1979;Young et al., 1999;Huang et al., 2001)。当受到高级中枢神经递质的刺激或者性刺激,下丘脑产生的GnRH以脉冲形式通过垂体门脉系统或神经分泌细胞的轴突末梢到达垂体前叶,与脑垂体内促性腺激素分泌细胞的特异性受体结合,刺激促性腺激素的生成和分泌;之后通过血液循环系统作用于靶器官或靶细胞,调节配子的发生和性腺类固醇激素(睾酮、雌二醇等)的产生(Dubois et al., 2002;叶丹等,2003;Lee et al., 2008;Clarke et al., 2009)。
布氏田鼠Lasiopodomys brandtii属于啮齿目Rodentia仓鼠科Cricetidae田鼠亚科Microtinae,是我国内蒙古东部草原区的害鼠之一,主要分布于我国内蒙古、蒙古人民共和国和俄罗斯贝加尔一带的典型草原区。布氏田鼠的种群数量变化具有年间和年内周期性波动的特点,在合适的年份一旦大量暴发会大面积啃食和破坏草原植被,造成草原退化,此外它还是鼠疫的自然宿主(张洁等,1978;张洁,钟文勤,1979;侯建军,尹峰,1996)。因此,对布氏田鼠的防治在草原有害生物研究中受到广泛关注。布氏田鼠具有明显的季节性繁殖特点,繁殖期从3月下旬到8月上旬,其种群呈暴发式增长,在数量高峰年更易形成严重危害(张洁,钟文勤,1981;施大钊等,1999;宛新荣等,2002)。近年来,由于逐渐认识到鼠类在草原生态系统中的重要性,因此对害鼠的防治理念从“一味灭杀”转变为“可持续控制”,繁殖干扰方法作为一种更为合理的有害生物管理方法而得到大量研究(张知彬,1995;Hood et al., 2001;王大伟等,2011;吕江等,2013;陈雅娟等,2014)。因此,阐明布氏田鼠繁殖调控通路对于深入理解其繁殖特征和种群数量生育干扰控制技术的研发具有重要意义。GnRH基因是繁殖调控的中枢物质,然而该基因序列在布氏田鼠内尚未被报道。基于以上研究现状,利用RACE技术获得了布氏田鼠下丘脑中GnRH基因的cDNA序列,检测其在不同组织中及不同发育阶段的表达特征,探究GnRH基因在布氏田鼠繁殖调控中的作用,为后期布氏田鼠繁殖调控的研究提供基础。
1 材料和方法 1.1 实验动物布氏田鼠来自实验室(中国农业科学院植物保护研究所)长期饲养种群,饲养条件为室温20 ℃左右,相对湿度75%,自然光照。
1.2 试剂及仪器RNAprep pure Tissue试剂盒购于ZYMO Research公司(USA);SMARTerTM RACE cDNA Amplification试剂盒购于Clontech公司(USA),包含SMARTer Ⅱ A Oligonucleotide,10×Universal Primer和nested Universal Primer A;LA Taq DNA polymerase购于TaKaRa公司(日本);cDNA Synthesis试剂盒购于TransGen Biotech公司(中国);2×Taqman PreAmp master Mix购于ABI公司(USA);2×SsoFastTM EvaGreen Supermix with low ROX购于Bio-Rad公司(USA);2×Assay Loading Reagent和20×DNA Binding Dye Sample Loading Reagent购于Fluidigm公司(USA);碘[125]睾酮放射免疫分析药盒购于北京北方生物技术研究所(中国);雌二醇放射免疫分析药盒购于北京北方生物技术研究所(中国);实验引物由生工生物工程有限公司合成(上海);DNA序列由华大基因(北京)测序。
1.3 方法 1.3.1 引物设计从NCBI下载多个物种GnRH基因的cDNA序列(橙腹田鼠Microtus ochrogaste,登录号:XP_005355523.1;拉布拉多白足鼠Peromyscus maniculatus bairdii,登录号:XP_015841126.1;小家鼠Mus musculus,登录号:AAI16900.1),分析比对找到较为保守的序列,用Primer Premier 5.0设计用于RACE扩增全长的2对特异性引物(表 1)。RACE获得全长后,利用Primer Premier 5.0设计实时荧光定量PCR引物(表 1)。用于实时荧光定量的GnRH荧光引物标准曲线:R2(相关系数)=0.996,Eff%(循环效率)=104.76,符合荧光定量标准。
| 引物Primer | 序列Sequence (5'-3') | 用途Purpose |
| GnRH-5'-UTR1 | TCTACGCTGCTGGGTATAGAAATGCT | 5'-RACE-primary |
| GnRH-5'-UTR2 | GGGTATAGAAATGCTGAAACCCACAC | 5'-RACE-nest |
| GnRH-3'-UTR1 | GCTGGGCAGAAGAAGATGTAAGTGCACT | 3'-RACE-primary |
| GnRH-3'-UTR2 | GCACTGGCCCTGAAGGATCCACAAC | 3'-RACE-nest |
| GnRH-F | CGATTCTTTCCAAGAGATGGG | q-RCR |
| GnRH-R | CATCAGACTTTCCAGAGCTCCT | q-RCR |
| β-actin-F | GCTCTCTTCCAGCCTTCCTTCCTG | q-RCR |
| β-actin-R | GTGTTGGCGTACAGGTCCTTGCGG | q-RCR |
取1只雄性布氏田鼠的下丘脑组织用于总RNA的提取,操作方法根据RNAprep pure Tissue试剂盒说明。取1 μL RNA于Nanodrop ND-2000分光光度计(Thermo-Fisher,USA)测浓度和OD260/OD280值。RNA的完整性用1%琼脂糖凝胶电泳检测。检测显示OD260/OD280为1.8~2.0,28s RNA是18s RNA的2倍,可用于后续反转录。使用SMARTer Ⅱ A Oligonucleotide(12 μM)和提取的总RNA,根据SMARTerTM RACE cDNA Amplification试剂盒说明书操作,制备cDNA第一条链。使用10× Universal Primer A Mix和GnRH-5'-UTR1(表 1),根据SMARTerTM RACE cDNA Amplification试剂盒说明书操作进行第一轮5'-RACE。使用10×Universal Primer A Mix和GnRH-3'-UTR1(表 1),根据SMARTerTM RACE cDNA Amplification试剂盒说明书操作进行第一轮3'-RACE。第一轮5'-RACE和3'-RACE产物稀释50倍作为巢式PCR模板,分别加上GnRH-5'-UTR2和GnRH-3'-UTR2,按照SMARTerTM RACE cDNA Amplification试剂盒说明书操作,产物送华大基因(北京)测序,使用Vector NTI分析所有测序结果(ABI格式),最后拼接,获得GnRH基因的cDNA序列。使用在线BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)分析核酸和推测的蛋白的同源性。使用ORF Finder在线工具(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)寻找开放阅读框(open reading frame,ORF)。使用DNAMAN分析相应氨基酸序列同源性。
1.3.3 GnRH基因在布氏田鼠各组织中的表达分析为了探究GnRH基因是否在雄性布氏田鼠下丘脑、垂体、性腺等多个水平对繁殖进行调控,并且参与泌尿系统、消化系统功能的调节。选取下丘脑、垂体、肾上腺、睾丸、膀胱和肠组织(n=3~4)。根据RNAprep pure Tissue试剂盒说明书提取总RNA,测浓度和完整性后,符合要求的RNA用作模板,根据cDNA Synthesis试剂盒操作说明合成cDNA第一条链。根据Biomark高通量基因表达实验操作流程进行目的基因预扩增PCR,5 μL体系包含:2.5 μL 2× Taqman PreAmp master Mix,0.5 μL 500 nM(10×) pooled primer mixture,0.75 μL PCR级水,1.25 μL cDNA;反应条件:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火4 min,14个循环。产物加入1.5 μL PCR级水,0.2 μL Exonuclease Ⅰ reaction buffer和Exonuclease Ⅰ (20 units/μL),PCR仪器中37 ℃保持30 min;80 ℃保持15 min。以上产物作为模板用于实时荧光定量PCR,根据Biomark高通量基因表达实验操作流程,以GnRH-F、GnRH-R为引物,β-actin为内参,2× SsoFastTM EvaGreen为荧光染料,使用富鲁达实时荧光PCR仪器进行荧光定量PCR,PCR程序为:95 ℃预变性1 min;96 ℃变性5 s,60 ℃退火20 s,60 s延伸3 s,30个循环;从60 ℃到95 ℃,每3 s增加1 ℃。每个PCR循环延伸阶段收集一次荧光,结果用2-ΔΔCT方法计算拷贝数。
1.3.4 不同发育阶段布氏田鼠下丘脑GnRH基因表达及血液中睾酮和雌二醇水平取不同发育时期(2、4、8、36、80周龄,n=7~8) 的雄性和雌性布氏田鼠的下丘脑组织,共78个个体,在5月和6月进行解剖,并通过上述实验方法(1.3.3) 进行实时荧光定量PCR检测,反应结束使用2-ΔΔCT方法,以β-actin为内参,计算拷贝数。
血液送北京科美生物技术有限公司(中国),用竞争放射免疫分析法,按照碘[125]睾酮放射免疫分析药盒操作说明检测雄性布氏田鼠睾酮激素水平,按照雌二醇放射免疫分析药盒操作说明检测雌性布氏田鼠雌二醇激素水平。睾酮精准度为:批内CV<10%,批间CV<15%;雌二醇精准度为:批内CV<10%,批间CV<15%。2周龄布氏田鼠个体较小,血液不足,未送检测。结果采用lg(绝对值+1) 对数值进行分析(Wang et al., 2012)。
1.3.5 统计分析使用SPSS 21.0对所有数据进行统计分析,实验数据满足正态分布,使用t-test和One-Way ANOVA检验;数据不符合正态分布,使用非参数检验。显著性水平设置为α=0.05。
2 结果 2.1 GnRH基因cDNA序列的克隆布氏田鼠GnRH基因cDNA序列497 bp,包含ORF长度273 bp,编码90个氨基酸和1个终止密码子(TAA),其中第22个到第31个氨基酸是高度保守的序列,与其他物种GnRH基因相似性高(图 1,图 2)。使用NCBI在线BLAST,发现布氏田鼠下丘脑GnRH基因的cDNA序列与橙腹田鼠GnRH1的相似性达95%,与拉布拉多白足鼠GnRH1的相似性为90%,与灰仓鼠Cricetulus griseus GnRH1的相似性为90%,与金色大鼠Mesocricetus auratus GnRH1的相似性为90%,与小家鼠GnRH1的相似性为85%,与褐家鼠Rattus norvegicus GnRH的相似性为85%。将布氏田鼠GnRH基因的序列提交至GenBank,序列号为KY038929。

|
| 图 1 布氏田鼠下丘脑GnRH基因的cDNA核酸序列及其推导的氨基酸序列 Fig. 1 The cDNA sequence and deduced amino acid sequence of GnRH gene from Lasiopodomys brandtii hypothalamus 下划线表示信号肽(M~S)和连接肽(S~M),方框标出十肽区和加工位点,*表示终止密码子。 The underscore indicates the signal peptide (M-S) and the associated peptide (S-M); the sequences in box are the decapeptide region and the processing site; *indicates the stop codon. |
| |

|
| 图 2 布氏田鼠(登录号:KY038929)、灰仓鼠(登录号:AHC06151.1)、小家鼠(登录号:AAI16900.1)、拉布拉多白足鼠(登录号:XP_015841126.1)、金色大鼠(登录号:XP_005075289.2)、橙腹田鼠(登录号:XP_005355523.1)、斑马鱼(登录号:AAL99294.1)、人(登录号:NP_ 001076580.1)、原鸡(登录号:NP_001074346.1) 和热带爪蟾(登录号:NP_001107165.1)GnRH氨基酸序列比较 Fig. 2 Comparison of amino acid sequence of GnRH among Lasiopodomys brandtii (GenBank accession: KY038929), Cricetulus griseus (GenBank accession: AHC06151.1), Mas musculus (GenBank accession: AAI16900.1), Peromyscus maniculatus bairdii (GenBank accession: XP_015841126.1), Mesocricetus auratus (GenBank accession: XP_005075289.2), Microtus ochrogaste (GenBank accession: XP_005355523.1), Danio rerio (GenBank accession: AAL99294.1), Homo sapiens (GenBank accession: NP_001 076580.1), Gallus gallus (GenBank accession: NP_ 001074346.1) and Xenopus tropicalis (GenBank accession: NP_001107165.1) 阴影标出一致区域。 Identical amino acid residues are marked with shade. |
| |
使用DNAMAN将布氏田鼠下丘脑GnRH基因相应氨基酸序列与其他物种序列(灰仓鼠 GnRH1、小家鼠GnRH1、拉布拉多白足鼠GnRH1、金色大鼠GnRH1、橙腹田鼠GnRH1、斑马鱼GnRH、人GnRH1、原鸡GnRH1和热带爪蟾GnRH1)进行比对(图 2),发现不同物种间十肽区较为稳定,布氏田鼠和所比对的哺乳动物有相同的十肽(COOH-pGlu-His-Tip-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH2)(图 2)。
2.2 GnRH基因在布氏田鼠各组织的表达基因组织表达特征的分析结果显示,4周龄雄鼠GnRH在不同组织中的表达量差异有统计学意义(One-Way ANOVA检验:df=5,F=3.719,P<0.05),下丘脑中的表达量最高,其次是肠、肾上腺、睾丸、垂体,在膀胱中表达最低(图 3),并且下丘脑中表达量显著高于肠(LSD检验:P<0.05)、肾上腺(LSD检验:P<0.01)、睾丸(LSD检验:P<0.01)、垂体(LSD检验:P<0.01) 和膀胱(LSD检验:P<0.01);8周龄雄鼠GnRH在不同组织中的表达量差异有统计学意义(ANOVA检验:df=5,F=3.196,P<0.05),下丘脑中的表达量最高,其次是肠、睾丸、肾上腺、垂体,在膀胱中最低,并且下丘脑中表达量显著高于肾上腺(LSD检验:P<0.015)、睾丸(LSD检验:P<0.05)、垂体(LSD检验:P<0.01) 和膀胱(LSD检验:P<0.05)(图 3)。
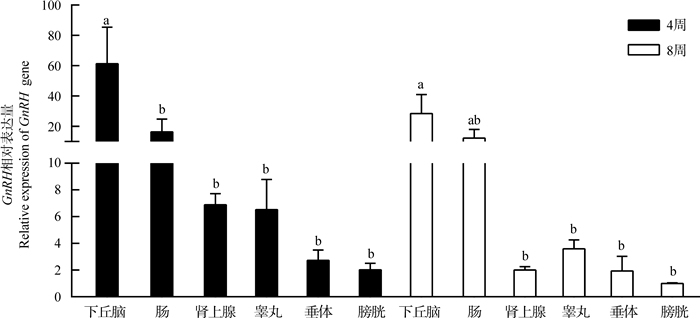
|
| 图 3 4周龄、8周龄雄性布氏田鼠不同组织中GnRH相对表达量(mean±SE,n=3) Fig. 3 Tissue specific expression of GnRH in 4 week-old and 8 week-old male Lasiopodomys brandtii (mean±SE, n=3) 柱形图上方不同字母表示差异有统计学意义。 Bars with different letters indicate there is a significant difference. |
| |
不同发育阶段布氏田鼠下丘脑GnRH表达量结果表明,不同周龄雄鼠之间差异无统计学意义(One-Way ANOVA检验:df=4,F=2.458,P>0.05),但80周龄雄鼠下丘脑GnRH表达量显著高于2周龄(LSD检验:P<0.05) 和8周龄(LSD检验:P<0.01)(图 4:A);不同年龄阶段雌鼠下丘脑GnRH表达量差异有高度统计学意义(One-Way ANOVA检验:df=4,F=7.384,P<0.001),80周龄下丘脑GnRH表达量均极显著高于2周龄(LSD检验:P<0.001)、4周龄(LSD检验:P<0.001)、8周龄(LSD检验:P<0.01) 和36周龄(LSD检验:P<0.001)(图 4:B)。
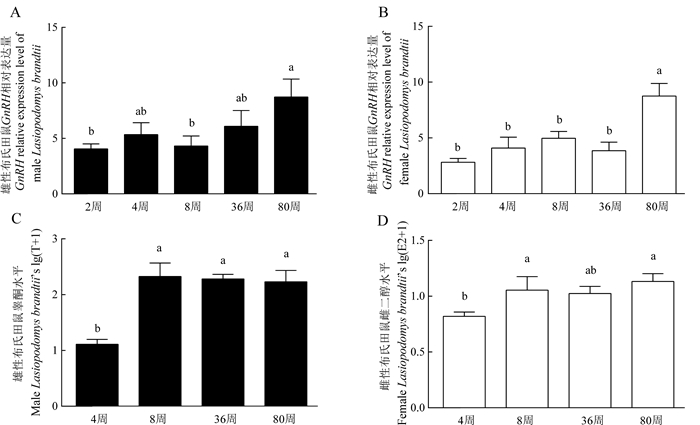
|
| 图 4 不同年龄布氏田鼠下丘脑GnRH表达情况(A.雄鼠,B.雌鼠)及性激素水平(C.雄鼠睾酮,D.雌鼠雌二醇)(mean±SE,n=8) Fig. 4 GnRH expression level in hypothalamus (A. male, B. female) and blood testosterone level of males (C)/estradiol level of females (D) in Lasiopodomys brandtii with different developmental stages (mean±SE, n=8) 柱形图上方不同字母表示差异有统计学意义。 Bars with different letters indicate there is a significant difference. |
| |
雄鼠血液中睾酮水平在不同发育阶段差异有高度统计学意义(One-Way ANOVA检验:df=3,F=12.898,P<0.001),并且4周龄睾酮水平极显著低于8周龄(LSD检验:P<0.001)、36周龄(LSD检验:P<0.001) 和80周龄(LSD检验:P<0.001)(图 4:C);雌鼠血液中雌二醇水平差异无统计学意义(One-Way ANOVA检验:df=3,F=2.757,P>0.05),但4周龄雌二醇水平显著低于8周龄(LSD检验:P<0.05) 和80周龄(LSD检验:P<0.05)(图 4:D)。
3 讨论人们已获得很多脊椎动物GnRH的cDNA序列(Amano et al., 2002;Swapna et al., 2005;丁炜东等,2006)。本研究克隆获得布氏田鼠497 bp的GnRH cDNA序列,编码90个氨基酸。同源性分析表明,布氏田鼠下丘脑GnRH基因属于Ⅰ型,十肽区与其他哺乳动物相同。GnRH在下丘脑中表达量最高,在垂体、睾丸、肾上腺、膀胱和肠中均有表达,GnRH在下丘脑、垂体和性腺的表达主要与繁殖调控有关,外周组织的表达提示GnRH可能参与其他生物学功能。这与前人的研究一致,GnRH除在下丘脑中广泛表达,还在其他组织中表达(叶丹等,2003)。
本研究显示,8周龄、36周龄和80周龄鼠性激素浓度均处于高水平,高于4周龄鼠,这与之前的研究结果一致,8周龄、36周龄和80周龄鼠性器官质量均显著高于4周龄鼠(Chen et al., 2017)。同时实验用8周龄鼠为当年成鼠,36周龄和80周龄鼠分别为2015年和2014年出生的越冬鼠,解剖时间为繁殖季节(5—6月),任飞等(2016)的研究发现,在繁殖季节,越冬鼠和当年成鼠均可以参与繁殖,本结果与此一致。
本研究显示,8周龄鼠性激素水平显著高于4周龄鼠,但下丘脑GnRH没有相应增加,可能是高浓度性激素对下丘脑GnRH负反馈作用造成的。下丘脑可以分泌GnRH,刺激腺垂体释放促性腺激素,如黄体生成素(LH)和卵泡刺激素(FSH),随着血液循环到达性腺,刺激性腺分泌性激素。性激素通过负反馈调节作用影响下丘脑和腺垂体的激素分泌(阮玲娟,2011)。性激素分为雌激素、雄激素和孕激素三大类,前两者为外周最主要性激素,雌性大鼠的卵巢和雄性大鼠的睾丸分别是体内分泌性激素的外周主要器官(Solomon & Herman,2009)。下丘脑的室内侧核、正中隆起、弓状核等区域都有丰富的雄激素受体(母义明,2004);调解HPG轴的雌激素受体,广泛分布于大脑的多个脑区,包括海马、下丘脑、杏仁核和脑干(Freeman et al., 2006)。很多物种中发现了性激素对下丘脑GnRH或者促性腺激素的反馈作用。雄性阉割后,下丘脑GnRH脉冲频率增加;给予睾酮,抑制GnRH的释放。正常男性服用Anan-dron(抗雄激素药),GnRH脉冲频率增加。睾酮替代治疗原发性功能减退的患者,GnRH脉冲频率减慢,峰值降低(母义明,2004)。10例患有卵巢癌的雌恒河猴Macaca mulatta中有7例血清FSH含量升高。阉割少年雌猴,血清FSH值远高于正常青春期水平,8例假手术的青少年控制组与实验组FSH水平没有差异(Winter et al., 1987)。母羊的雌二醇对GnRH有负反馈调节(Glass,王刚牛,1988)。大鼠卵巢切除后,下丘脑雌二醇水平增加,同时雌二醇受体mRNA表达增加(阮玲娟,2011)。本研究结果显示,2周龄和4周龄布氏田鼠性激素水平最低,同时下丘脑GnRH mRNA低水平表达。这可能是因为幼年时期性器官尚未发育成熟,外周性激素水平低,对下丘脑的反馈抑制作用不明显,主要由下丘脑GnRH调节剂的中心抑制调控;青春期后,主要由性激素类固醇调节。这一现象与恒河猴研究的猜想较为符合,幼年促性腺激素分泌的主要调节剂是下丘脑GnRH调节剂的中心抑制,青春期后,促性腺激素分泌的主要调节剂变成性类固醇介导的反馈抑制(Winter et al., 1987)。本实验8周龄鼠外周性激素显著高于4周龄鼠,但8周龄鼠下丘脑GnRH表达水平并未显著升高。猜测4周龄期起主导作用的是下丘脑GnRH调节剂的中心调节,因为如果此阶段性激素反馈抑制为主导,性器官发育会受阻;而8周龄和36周龄鼠性激素水平较高时,其下丘脑GnRH表达水平较低,猜测此时起主导作用的是外周性激素的调节,此时高水平的外周性激素抑制了GnRH的表达。80周龄鼠性激素与下丘脑GnRH表达量均处于高水平,推测随着年龄的增加,到80周龄,布氏田鼠下丘脑GnRH对外周性激素的调节变得不敏感。这与恒河猴中的研究较为相似。切除11岁恒河猴的睾丸,接近青春期时,促性腺激素水平升高到成年范围;接近29岁的恒河猴,LH对睾丸切除术的反应推迟到6个月以后;4月龄的雌性恒河猴卵巢切除后,FSH在2周内升高,1岁的恒河猴,卵巢切除后,FSH的上升延迟了3个月,1~2岁的恒河猴,卵巢切除后2年内,实验组和对照组FSH/LH差异无统计学意义(Winter et al., 1987)。所以猜测,当布氏田鼠到达80周龄时,性激素对下丘脑GnRH的反馈作用减弱,或应答时间延长。
本研究克隆获得了布氏田鼠下丘脑GnRH的cDNA序列,属于Ⅰ型GnRH,其结构和功能比较保守。布氏田鼠在出生后8周达到性成熟(Chen et al., 2017)。4周龄鼠下丘脑GnRH低表达,同时血清性激素呈现低水平;8周龄/36周龄鼠GnRH低表达,血清性激素显著高于4周龄鼠,可能与青春期及繁殖盛期成体中GnRH受性激素反馈抑制有关;80周龄鼠,下丘脑GnRH表达水平升高,同时血清性激素浓度高水平,可能与老年个体反馈抑制现象减弱有关。不同年龄段下丘脑GnRH表达与血清性激素水平的不同步,猜测下丘脑GnRH调节剂的中心抑制和性类固醇介导的反馈抑制调控布氏田鼠的繁殖,但在不同年龄阶段,谁为主导作用有待进一步验证。
| 陈雅娟, 张博, 靳铁治, 等. 2014. 不育控制技术在有害鼠类防控中的研究进展[J]. 陕西农业科学, 60(12): 73–76. DOI:10.3969/j.issn.0488-5368.2014.12.024 |
| 丁炜东, 曹丽萍, 吴婷婷. 2006. 奥利亚罗非鱼促性腺激素释放激素cDNA的原核表达及其免疫原性研究[J]. 生物工程学报, 22(4): 561–566. |
| GlassJD, 王刚牛. 1988. 雌二醇和孕酮对乏情母羊GnRH免疫反应神经元系统的影响[J]. 草食家畜(2): 26–28. |
| 侯建军, 尹峰. 1996. 关于布氏田鼠的生态学研究[J]. 内蒙古师大学报(自然汉文版), 12(4): 54–58. |
| 林浩然. 2004. 促性腺激素释放激素(GnRH)结构与功能及其受体的进化发展[J]. 中山大学学报(自然科学版), 43(6): 1–5. |
| 吕江, 张凤琴, 刘汉武, 等. 2013. 具有竞争性繁殖干扰的不育控制害鼠种群模型[J]. 工程数学学报, 30(2): 263–270. |
| 母义明. 2004. 下丘脑-垂体轴外GnRH系统研究进展[J]. 武警后勤学院学报(医学版), 13(5): 424–425. |
| 任飞, 王大伟, 李宁, 等. 2016. 不同季节出生的布氏田鼠繁殖发育模式分析[J]. 植物保护, 42(2): 31–37. |
| 阮玲娟. 2011. 正常动情周期和性腺摘除大鼠外周性激素对下丘脑的影响[D]. 杭州: 浙江大学. http://cdmd.cnki.com.cn/Article/CDMD-10335-1011057761.htm |
| 施大钊, 海淑珍, 吕东, 等. 1999. 布氏田鼠洞群内社群结构变动与序位的研究[J]. 兽类学报, 19(1): 48–55. |
| 宛新荣, 王梦军, 王广和, 等. 2002. 布氏田鼠标志种群的繁殖参数[J]. 兽类学报, 22(2): 116–122. |
| 王大伟, 刘祺, 刘明, 等. 2011. EP-1包合物制备及其对布氏田鼠繁殖器官的影响[J]. 兽类学报, 31(1): 79–83. |
| 叶丹, 潘建伟, 廖鸣娟., 等. 2003. 促性腺激素释放激素的结构及其生物学功能[J]. 生物化学与生物物理进展, 30(1): 49–53. |
| 张洁, 钟文勤. 1979. 布氏田鼠种群繁殖的研究[J]. 动物学报(3): 63–72. |
| 张洁, 钟文勤. 1981. 布氏田鼠洞群内群体结构的研究[J]. 兽类学报, 1(1): 53–58. |
| 张洁, 周庆强, 钟文勤., 等. 1978. 布氏田鼠种群年龄的研究[J]. 动物学报(4): 41–55. |
| 张知彬. 1995. 鼠类不育控制的生态学基础[J]. 兽类学报, 15(3): 229–234. |
| Amano M, Takahashi A, Yamanome T, et al. 2002. Molecular cloning of three cDNAs encoding different GnRHs in the brain of barfin flounder[J]. General & Comparative Endocrinology, 126(126): 325–333. |
| Amoss M, Burgus R, Blackwell R, et al. 1971. Purification, amino acid composition and N-terminus of the hypothalamic luteinizing hormone releasing factor (LRF) of ovine origin[J]. Biochemical & Biophysical Research Communications, 44(1): 205–210. |
| Baba Y, Matsuo H, Schally AV. 1971. Structure of the porcine LH-and FSH-releasing hormone. Ⅱ. Confirmation of the proposed structure by conventional sequential analyses[J]. Biochemical & Biophysical Research Communications, 44(2): 459–463. |
| Belchetz PE, Plant TM, Nakai Y, et al. 1979. Hypophysial responses to continuous and intermittent delivery of hypopthalamic gonadotropin-releasing hormone[J]. Science, 202(4368): 631–633. |
| Chen Y, Liu L, Li ZG, et al. 2017. Molecular cloning and characterization of kiss1 in Brandt's voles (Lasiopodomys brandtii)[J]. Biochemistry & Molecular Biology. DOI:10.1016/j.cbp.2017.04.006 |
| Clarke IJ, Smith JT, Goodman RL, et al. 2009. Kisspeptin and seasonality in sheep[J]. Peptides, 30(1): 154–163. DOI:10.1016/j.peptides.2008.08.022 |
| Dubois EA, Zandbergen MA, Peute J, et al. 2002. Evolutionary development of three gonadotropin-releasing hormone (GnRH) systems in vertebrates[J]. Brain Research Bulletin, 57(4): 413–418. |
| Freeman EW, Sammel MD, Lin H, et al. 2006. Associations of hormones and menopausal status with depressed mood in women with no history of depression[J]. Arch Gen Psychiatry, 63(4): 375–382. DOI:10.1001/archpsyc.63.4.375 |
| Gorbman A, Sower SA. 2004. Evolution of the role of GnRH in animal (Metazoan) biology[J]. General & Comparative Endocrinology, 134(3): 207–213. |
| Hood GM, Chesson P, Pech RP. 2000. Biological control using sterilizing viruses:host suppression and competition between viruses in non-spatial models[J]. Journal of Applied Ecology, 37(6): 914–925. DOI:10.1046/j.1365-2664.2000.00544.x |
| Huang W, Yao B, Sun L, et al. 2001. Immunohistochemical and in situ hybridization studies of gonadotropin releasing hormone (GnRH) and its receptor in rat digestive tract[J]. Life Sciences, 68(15): 1727–1734. DOI:10.1016/S0024-3205(01)00968-7 |
| Lee VHY, Lee LTO, Chow BKC. 2008. Gonadotropin-releasing hormone:regulation of the GnRH gene[J]. Febs Journal, 275(22): 5458–5478. DOI:10.1111/j.1742-4658.2008.06676.x |
| Lethimonier C, Madigou T, Muñoz-Cueto JA. 2004. Evolutionary aspects of GnRHs, GnRH neuronal systems and GnRH receptors in teleost fish[J]. General & Comparative Endocrinology, 135(1): 1–16. |
| Lincoln GA. 1976. Seasonal variation in the episodic secretion of luteinizing hormone and testosterone in the ram[J]. Journal of Endocrinology, 69(2): 213–226. DOI:10.1677/joe.0.0690213 |
| Solomon MB, Herman JP. 2009. Sex differences in psychopathology:of gonads, adrenals and mental illness[J]. Physiology & Behavior, 97(2): 250–258. |
| Swapna I, Sreenivasulu G, Rasheeda MK, et al. 2005. Seabream GnRH:partial cDNA cloning, localization and stage-dependent expression in the ovary of snake head murrel, Channa striatus[J]. Fish Physiology and Biochemistry, 31(2): 157–161. |
| Wang D, Zhang J, Zhang Z. 2012. Effect of testosterone and metatonin on social dominance and agonistic behavior in male Tscheskia triton[J]. Behavioural Processes, 89(3): 271–277. DOI:10.1016/j.beproc.2011.12.010 |
| Winter JS, Ellsworth L, Fuller G, et al. 1987. The role of gonadal steroids in feedback regulation of gonadotropin secretion at different stages of primate development[J]. Acta Endocrinologica, 114(2): 257–268. |
| Young KG, Chang JP, Goldberg JI. 1999. Gonadotropin-releasing hormone neuronal system of the freshwater snails Helisoma trivolvis and Lymnaea stagnalis:possible involvement in reproduction[J]. Journal of Comparative Neurology, 404(4): 427–437. DOI:10.1002/(ISSN)1096-9861 |
 2017, Vol. 36
2017, Vol. 36




